Сучасні аспекти лікування хворих з фібриляцією передсердь
ІX науково-практична конференція «Дні аритмології в Києві», яка відбулася 16-17 листопада, охоплювала головні аспекти сучасної аритмології: застосування катетерної абляції, особливості антикоагулянтної терапії в пацієнтів з фібриляцією передсердь (ФП) і тромбоемболією легеневої артерії, хірургічні методи лікування гіпертрофічної кардіоміопатії, діагностику та лікарську тактику за умов безсимптомних аритмій тощо.
 Доповідь завідувача кафедри внутрішньої медицини № 3 Вінницького національного медичного університету ім. М. І. Пирогова, доктора медичних наук, професора Валерія Павловича Іванова стосувалася суправентрикулярних порушень ритму серця, а саме ФП, у фокусі нових рекомендацій Європейського товариства кардіологів (2016).
Доповідь завідувача кафедри внутрішньої медицини № 3 Вінницького національного медичного університету ім. М. І. Пирогова, доктора медичних наук, професора Валерія Павловича Іванова стосувалася суправентрикулярних порушень ритму серця, а саме ФП, у фокусі нових рекомендацій Європейського товариства кардіологів (2016).
ФП є вкрай небезпечним явищем, оскільки збільшує частоту інфаркту міокарда, рівні серцево-судинної та загальної смертності удвічі, а ризик інсультів – у 5 разів. Є дані, що за умов ФП зростає ризик геморагічних інсультів і субарахноїдальних крововиливів. Крім того, серед усіх аритмій саме ФП зумовлює найбільшу кількість госпіталізацій і викликів швидкої медичної допомоги. Також ФП підвищує імовірність розвитку хронічної серцевої недостатності (СН) та деменції, істотно погіршує якість життя.
Якість життя пацієнтів з ФП залежить від вираженості основних симптомів аритмії: відчуття перебоїв у роботі серця, серцебиття, «клекотіння» або «тремтіння» в грудях; задишки; загальної слабкості; відчуття страху; болю в грудній клітці; синкопальних станів; запаморочень.
Згідно з класифікацією Європейської асоціації серцевого ритму (EHRA) виокремлюють кілька класів ФП відповідно до наявної симптоматики (табл. 1).
У практичній діяльності класифікація EHRA допомагає здійснити вибір лікарської тактики. Зокрема, за умов ФП класів І-ІІВ можлива відмова від застосування антиаритмічних препаратів (ААП). Таким пацієнтам проводиться тільки контроль частоти серцевих скорочень (ЧСС). Однак за наявності синкопе прогноз хворого радикально погіршується, оскільки ці симптоми свідчать про порушення ауторегуляції мозкового кровообігу. Зазвичай синкопальні стани виникають на тлі тахі- чи брадикардії при ФП.
Що стосується безсимптомної ФП, то, на думку експертів, ризик тромбоемболії у цьому випадку не відрізняється від такого при симптомній аритмії. Першим проявом безсимптомної ФП може бути ішемічний інсульт або транзиторна ішемічна атака, що за цих обставин трактуються як криптогенні. Таким чином, хворим, які перенесли інсульт нез’ясованої етіології, необхідно виконати тривале (3-7 діб) холтерівське моніторування електрокардіограми (ЕКГ), що дозволяє підвищити частоту діагностики ФП.
З ФП також асоційована проблема деменції. Дані нейровізуалізаційних досліджень (комп’ютерної та магнітно-резонансної томографії) свідчать, що в 10-38% хворих з ФП відзначається деменція, а у 8-28% – так звані німі інфаркти мозку (без документованого епізоду гострого неврологічного дефіциту) (Marini C. et al., 2005). Саме ці німі інфаркти поволі прогресують і зумовлюють розвиток деменції в пацієнтів з миготливою аритмією.
Структура ішемічних інсультів, зареєстрованих у м. Вінниці, станом на 2014 та 2016 рік включала практично однакову кількість кардіоемболічних ішемічних інсультів (29 і 28% відповідно), натомість частка криптогенних ішемічних інсультів за 2 роки значно зросла (з 19 до 29%). Професор В. П. Іванов припустив, що серед інсультів, ідентифікованих як криптогенні, значна частка зумовлена безсимптомною ФП. Отже, кількість інсультів, пов’язаних з миготливою аритмією, імовірно, є недооціненою. Європейські дані свідчать, що кожен п’ятий інсульт є прямим чи опосередкованим наслідком ФП. У той же час показники вітчизняної статистики демонструють ще більш вагомий вплив ФП: кожен третій інсульт так чи інакше спричинений миготливою аритмією.
Частота розвитку інсульту не залежить від форми аритмії (вперше виникла, пароксизмальна, персистуюча, постійна). Будь-який епізод ФП тривалістю понад 5 хв, виявлений при холтерівському моніторуванні ЕКГ, може бути фактором збільшення ризику інсульту.
Пріоритети в лікуванні ФП включають профілактику тромбоемболічних інсультів, контроль симптомів і покращення якості життя та прогнозу. Ці чинники є рівнозначними і потребують уваги лікаря.
При з’ясуванні оптимальної лікарської тактики першим питанням постає визначення генезу ФП. Про клапанну ФП йдеться за наявності ревматичного мітрального стенозу, механічного протезу або біопротезу серцевого клапана, пластики мітрального клапана. За умов клапанної ФП препаратами вибору є антагоністи вітаміну К. У разі неклапанної ФП обов’язково проводиться оцінка ризику інсульту за шкалою CHA2DS2-VASc, вибір лікування здійснюється залежно від отриманих балів. Також при визначенні терапевтичної стратегії враховуються оцінка ризику кровотеч за шкалою HAS-BLED та індивідуальні уподобання пацієнта.
У разі високого ризику інсультів за CHA2DS2-VASc орієнтуються на застосування нових пероральних антикоагулянтів. Переваги цих препаратів порівняно з варфарином – спрощений режим дозування, можливість використання фіксованих дозувань, відсутність дієтичних обмежень, передбачуваність і надійність антикоагуляції, відсутність необхідності в рутинному контролі коагуляції, кращий профіль безпеки (менша кількість життєво небезпечних кровотеч, субарахноїдальних крововиливів, геморагічних інсультів тощо). Основними засобами групи нових пероральних антикоагулянтів є дабігатран, ривароксабан й апіксабан. Усі вони мають високу ефективність у профілактиці інсульту. Оскільки досліджень, що безпосередньо порівнюють їх властивості, поки що не проводилося, вибір препарату залежить виключно від лікаря.
Професор В. П. Іванов продемонстрував аудиторії шкалу SAMe-TT2R2, яка дозволяє визначити ймовірність контролю коагуляційних властивостей крові за допомогою варфарину (табл. 2).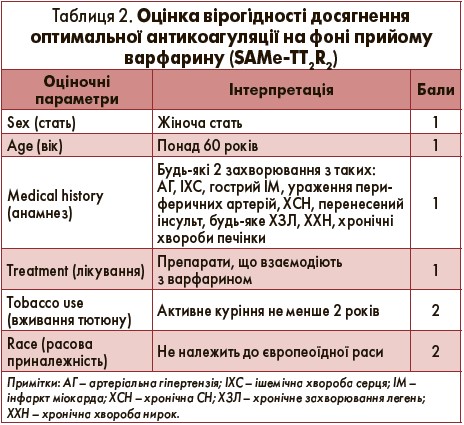
Якщо загальна кількість балів становить 0-2, імовірність контролю міжнародного нормалізованого відношення (МНВ) в інтервалі 65-70% досить висока, тож лікування доцільно розпочинати з варфарину. У разі оцінки >2 балів гарантії надійного контролю МНВ немає, тому на старті лікування слід надати перевагу новим пероральним антикоагулянтам.
Контроль симптомів ФП реалізується двома основними шляхами: відновлення синусового ритму та контроль ЧСС при збереженій ФП. Доповідач зазначив, що стосовно прогнозу перша стратегія не має переваг над другою. Більшою мірою на прогноз пацієнтів впливає основне захворювання, тобто характер структурного ураження міокарда, а не форма аритмії. Наведені факти доводять потребу ретельної етіологічної верифікації аритмії й адекватної корекції основної патології.
У нових рекомендаціях Європейського товариства кардіологів радикально змінилася позиція стосовно контролю ЧСС: пріоритет надається м’якому контролю. Теза, що чим менша ЧСС, тим краще для хворого, втратила актуальність. Середньодобова ЧСС <70 уд./хв супроводжується високим ризиком появи епізодів асистолії вночі, що обумовлює необхідність дотримання вищих цільових показників. Оптимальне значення ЧСС не встановлено, однак переважна більшість експертів вказує на рівень у межах 80-90 уд./хв, іноді – 100 уд./хв. Важливим є також контроль дефіциту пульсу, який має становити <10 уд./хв.
Що стосується вибору препаратів, то дещо похитнулися позиції β-адреноблокаторів (БАБ). Дослідження, що вивчали прогнозмодифікуючу дію БАБ при ФП, показали, що прийом препаратів цього класу не зменшує рівень смертності. У зв’язку із цим фокус фармакотерапії ФП змістився на недигідропіридинові антагоністи кальцію (верапаміл, дилтіазем), які забезпечують м’який контроль ЧСС.
Також відбулися зміни в позиції медично-наукової спільноти стосовно дигоксину. Деякі дослідження, у тому числі TREAT-AF, показали, що дигоксин збільшує показник смертності пацієнтів з ФП на 14-26%. Таким чином, цей препарат слід використовувати тільки для контролю ЧСС при постійній формі ФП у пацієнтів з клінічно маніфестованою ХСН у комбінації з БАБ, оскільки в таких хворих застосування дигоксину демонструє найменше збільшення рівня смертності.
Для тривалого контролю синусового ритму в молодих пацієнтів з мінімальними структурними ураженнями серця та пароксизмальною формою аритмії найкращий ефект забезпечує радіочастотна катетерна абляція. З наростанням вираженості змін серця зменшується кількість препаратів, що можуть бути використані; за умов СН можна застосовувати лише аміодарон.
В алгоритмі вибору методу електричної та медикаментозної кардіоверсії з’явився окремий пункт «вибір пацієнта», тобто хворий може обрати перший чи другий варіант відповідно до особистих переваг. Для фармакологічної кардіоверсії за відсутності значимої структурної патології серця внутрішньовенно застосовуються флекаїнід, ібутилід, пропафенон або вернакалант; у разі помірної СН (ІІ функціональний клас) зі зниженою, помірно зниженою чи збереженою фракцією викиду, ІХС – вернакалант або аміодарон; у випадку тяжкої СН (ІІІ-IV функціональний клас), зниженої фракції викиду (<40%), тяжкого аортального стенозу – тільки аміодарон.
Стандартна рекомендована доза препарату Кордарон® становить 5 мг/кг, яка вводиться шляхом внутрішньовенної інфузії протягом часу від 20 хв до 2 год. Препарат має вводитися у вигляді розчину, розведеного у 250 мл 5% розчину глюкози. Після цього може бути застосована повторна інфузія препарату в дозі до 1200 мг (приблизно 15 мг/кг) у 5% розчині глюкози об’ємом до 500 мл протягом 24 год, при цьому швидкість інфузії необхідно коригувати залежно від клінічної відповіді пацієнта.
У надзвичайно невідкладних клінічних ситуаціях лікарський засіб, на розсуд лікаря, може бути введений у вигляді повільної ін’єкції в дозі 150-300 мг у 10-20 мл 5% розчину глюкози протягом не менше ніж 3 хв. Після цього повторне введення препарату можна здійснювати не раніше ніж через 15 хв після початку інтенсивної терапії.
Перевагами аміодарону (препарату Кордарон®) є надзвичайно висока ефективність у попередженні рецидивів ФП (що перевищує таку пропафенону та соталолу) та універсальна антиаритмічна активність, що зумовлюють стійкі позиції Кордарону в структурі ААП; можливість застосування в пацієнтів із частими рецидивами ФП на тлі використання інших ААП та призначення хворим з тяжкими структурними ураженнями серця (на відміну від інших ААП).
Дослідження CTAF показало, що за умов лікування аміодароном імовірність підтримки синусового ритму впродовж одного року без рецидиву ФП була достовірно вищою, ніж при застосуванні пропафенону чи соталолу. Відносний ризик рецидиву ФП у групі аміодарону був на 57% нижчим, а достовірних відмінностей у частоті побічних ефектів у групах аміодарону та соталолу відзначено не було.
Результати дослідження О. С. Сичова і співавт. (2009) показали, що необґрунтована заміна препарату Кордарон® на інший ААП призводить до розвитку постійної форми ФП у половини хворих, а за відміни усіх ААП постійна форма ФП виникає в 64% пацієнтів. Це додатково підкреслює дієвість препарату Кордарон® у контролі ФП.
Первинна профілактика ФП включає застосування антагоністів альдостерону, інгібіторів ангіотензинперетворювального ферменту чи блокаторів рецепторів до ангіотензину ІІ. Дослідження PREDIMED показало, що потужний профілактичний вплив має дотримання середземноморської дієти в сукупності з підвищеним вживанням оливкової олії. Однак вторинної профілактики ФП (попередження рецидивів) не гарантує жодне із цих втручань, хоча існують деякі дані щодо користі в цьому аспекті антагоністів альдостерону. Збільшують частоту розвитку ФП прийом нестероїдних протизапальних препаратів незалежно від їх селективності, застосування івабрадину, вживання алкоголю та інтенсивне фізичне навантаження.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 22 (419), листопад 2017 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




