Ожирение у женщин в период менопаузы

Ожирение – одна из наиболее важных медико-социальных проблем современного общества. Эта патология относится к наиболее распространенным хроническим заболеваниям в мире.
По данным Всемирной организации здравоохранения (ВОЗ), в 2016 г. 39% взрослых старше 18 лет (39% мужчин и 40% женщин) имели избыточную массу тела и около 13% взрослого населения планеты (11% мужчин и 15% женщин) – ожирение [1]. По общему количеству людей с ожирением лидируют США, Германия и Канада. Так, в США 34% взрослого населения имеют избыточную массу тела и 27% – ожирение [2]. Отмечено, что ежегодно по меньшей мере 2,8 млн человек умирает в результате избыточной массы тела или ожирения (ВОЗ определяет избыточную массу тела при индексе массы тела, ИМТ, ≥25 кг/м2, а ожирение – при ИМТ ≥30 кг/м2; ИМТ рассчитывается путем деления массы тела в килограммах на квадрат роста в метрах, кг/м2 [3]).
С возрастом отмечается тенденция к увеличению массы тела как у мужчин, так и у женщин. Вместе с тем женщины более склонны к развитию ожирения. Так, в США в 2013-2014 гг. распространенность ожирения составляла 35,0% среди мужчин и 40,4% среди женщин [5]. Недавний анализ данных 2-летнего (2013-2014 гг.) исследования National Health and Nutrition Examination Survey (NHANES) [6] и исследования NHANES (2005-2012 гг.) [7] с участием 21 018 человек показал, что распространенность ожирения в США с 2005 по 2014 г. увеличилась у женщин и не изменилась у мужчин.
Развитие женского организма от рождения и созревания до окончания жизни принято разделять на отдельные периоды, которые характеризуются определенными морфологическими и функциональными особенностями. В любом из этих периодов фактор ожирения может оказать неблагоприятное влияние на формирование, становление и функцию репродуктивной системы [8]. Так, в исследовании М.Н. Авксеновой (2011), включавшем 136 женщин в возрасте от 18 до 41 года, страдающих ожирением, нарушение менструальной функции отмечено в 40,4% случаев. Установлено, что у женщин с ожирением и нарушенной менструальной функцией отмечается более высокий уровень лютеинизирующего гормона и лептина, а также отличающаяся от таковой у пациенток с сохраненной менструальной функцией динамика уровней эстрадиола, фолликулостимулирующего гормона и кортизола. При этом степень гиперандрогении и гиперлептинемии у женщин с ожирением и нарушением репродуктивной функции зависит от клинической формы ожирения (абдоминальное или глютеофеморальное).
Активность репродуктивной системы оказывает существенное воздействие на функционирование организма в целом [10]. Особую категорию лиц с высоким риском развития ожирения составляют женщины в период менопаузы. Менопауза представляет собой важный физиологический этап для всего организма женщины, он знаменует прекращение ее репродуктивной функции и ассоциирован с рядом физических и психологических изменений, непосредственно влияющих на качество жизни. Эти изменения обусловлены снижением гормональной активности гипоталамуса, гипофиза, регулирующих менструальный цикл, что ведет к потере функции яичников и, следовательно, к прекращению секреции половых гормонов (эстрогенов и прогестерона) [11]. Со снижением концентрации эстрогенов в организме связывают такие проблемы менопаузы, как вагинальную сухость, урогенитальные расстройства, вазомоторные симптомы, ожирение и эмоционально-психические нарушения, которые отрицательно влияют на качество жизни женщин [12]. К причинам увеличения массы тела после наступления менопаузы относятся снижение физической активности, нагрузок и естественное старение как таковое, которое способствует замедлению процесса «сжигания» калорий. Однако ключевая роль в патогенезе ожирения в период менопаузы отводится дефициту эстрогенов. Доказано, что дефицит эстрогенов обусловливает уменьшение интенсивности липолиза, что ведет к накоплению жировой ткани, в основном в области передней брюшной стенки [13]. Установлено, что степень снижения скорости метаболизма «в покое» после менопаузы соответствует накоплению энергии 60 000-80 000 кДж в год, это эквивалентно увеличению массы тела на 3-4 кг. При длительном наблюдении за женщинами одного возраста показано, что в период постменопаузы скорость метаболизма «в покое» снижается примерно на 420 кДж/день, а при сохраненной функции яичников подобный эффект отсутствует [14].
Абдоминальный тип ожирения в сочетании с артериальной гипертензией, инсулинорезистентностью, нарушением толерантности к глюкозе и дислипидемией представляют состояние, обозначаемое как метаболический синдром [15]. Его развитие является одним из наиболее тревожных последствий менопаузы. Продемонстрировано, что ожирение и метаболический синдром встречаются у женщин в этот период в 3 раза чаще, чем до менопаузы [16]. Так, в США ожирением страдает примерно 65% женщин в возрасте от 40 до 59 лет и 73,8% женщин старше 60 лет [5]. Показано, что менопауза является независимым предиктором развития метаболического синдрома [17]. Установлено, что наступление менопаузы приводит к повышению в 2-3 раза риска смерти женщин в климактерический период по сравнению с мужчинами того же возраста [18, 19]. Принимая во внимание, что средний возраст наступления менопаузы составляет около 50 лет и ожидаемая продолжительность жизни для женщин – около 75 лет, это означает что большинство женщин почти треть своей жизни проводят в состоянии дефицита эстрогенов и часто страдают от его последствий [20].
Хирургическая менопауза занимает особое место среди эстрогендефицитных состояний. Билатеальная овариэктомия с гистерэктомией вызывают одномоментное «выключение» функции яичников.
Изменения, происходящие в организме женщины после такой операции, значительно отличаются от течения естественной менопаузы [21]. В исследовании С.В. Моисеенко (2011) установлено, что хирургическая менопауза в репродуктивном возрасте характеризуется существенным прогрессированием как частоты встречаемости отдельных факторов риска, так и их сочетаний (комбинаций), более выраженных у пациенток, у которых не проводилась заместительная гормональная терапия. Так, при отсутствии заместительной гормональной терапии у пациенток отмечены значимые различия показателей ИМТ (28,7 ± 4,9 против 30,7 ± 6,3 кг/м2) и окружности талии (85,7 ± 11,9 против 94,4 ± 14,9 см) в сравнении с ее наличием. Это свидетельствует о более выраженных проявлениях постменопаузального метаболического синдрома. При этом применение заместительной гормональной терапии не ведет к прибавке массы тела и перераспределению жировой ткани [22].
В период менопаузы в связи с дефицитом эстрогенов меняется распределение жировой ткани с периферического на центральный тип, снижается чувствительность тканей к инсулину [23, 24].
Подсчитано, что раннее прекращение менструаций независимо от причин (естественная или хирургическая менопауза) приводит к 7-кратному повышению риска развития ишемической болезни сердца в возрасте после 60 лет в течение каждых последующих 10 лет [25]. Установлено, что степень тяжести ранних проявлений климактерического синдрома зависит и от величины ИМТ [26]. Также отмечено, что фактором риска развития метаболического синдрома у женщин является депрессия [27].
Патогенетические механизмы ожирения в период менопаузы
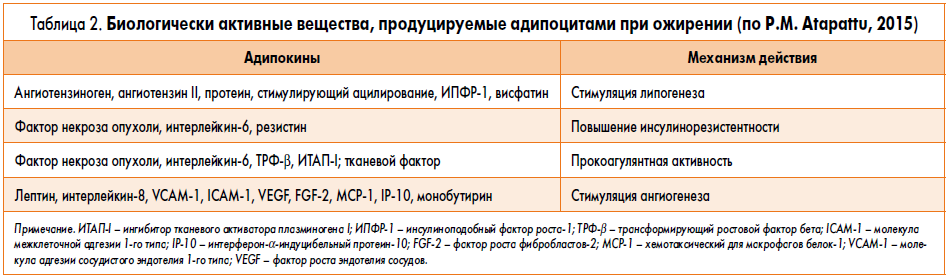
Исследования последних десятилетий позволили установить, что жировая ткань является не только крупнейшим источником энергии в организме, но и эндокринным органом (белая жировая ткань) [28]. Клетки жировой ткани (адипоциты) продуцируют пептидные субстанции – адипоцитокины, или адипокины (известно более 50 адипокинов), участвующие в регуляции энергетического гомеостаза, метаболизма липидов и действии инсулина (табл. 1).
Висцеральный жир, являясь гормонально-активным, осуществляет различные функции в организме (табл. 2) [30]. В результате действия биологически активных веществ, синтезируемых жировыми депо, у пациента с ожирением развиваются сердечно-сосудистые заболевания и нарушения метаболических процессов.
Провоспалительным адипокинам (в частности интерлейкинам‑1 и -6, лептину, резистину, фактору некроза опухоли и др.) отводится центральное место в развитии сердечно-сосудистых заболеваний, инсулинорезистентности, дислипидемии, артериальной гипертензии, атеросклероза, метаболического синдрома, сахарного диабета 2 типа, неалкогольного стеатогепатита и злокачественных новообразований [28]. Кроме того, ожирение ассоциируется и с другими проблемами менопаузы: вазомоторными симптомами, сексуальными нарушениями, остеопорозом, расстройствами мочеиспускания, хронической болезнью почек и др.
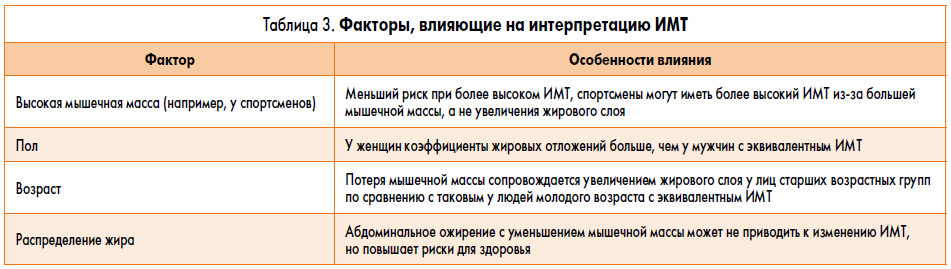
Следует отметить, что на правильную интерпретацию ИМТ оказывают влияние ряд факторов, среди которых – этническая принадлежность, мышечная масса, возраст и характер распределения жира при ожирении (табл. 3).
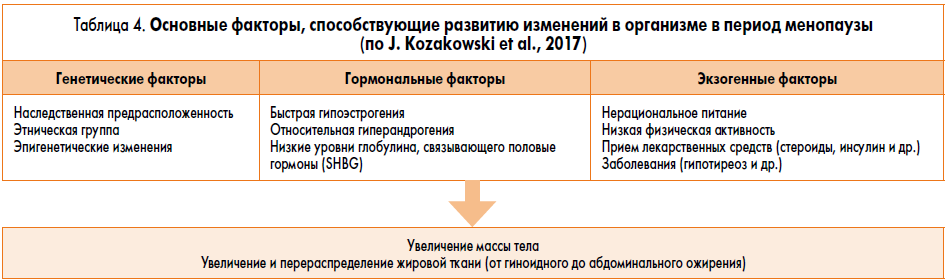
Несомненно, увеличение массы тела во время менопаузы является обычным явлением, что в значительной степени обусловлено гормональными сдвигами, характерными для этого периода. Также следует учитывать генетическую предрасположенность, нерациональное питание, малоподвижный образ жизни, наличие заболеваний (болезнь Кушинга, гипотиреоз и др.), прием лекарственных средств (например, кортикостероидов, глитазонов и др.) и другие факторы (табл. 4).
Эстрогены
Эстрогены у женщин ответственны за накопление жира в подкожной клетчатке, особенно в ягодичной и бедренной областях. Реализация биологического эффекта эстрогенов осуществляется при соединении с рецепторами, принадлежащими к семейству ядерных рецепторов. Исследованиями последних лет установлено существование двух типов эстрогеновых рецепторов (ЭРα, ЭРβ), которые являются факторами транскрипции, регулирующими экспрессию генов-мишеней. Однако считается, что дополнительно к геномному эффекту эстрогены могут также воздействовать за счет негеномных механизмов в зависимости от активации специфических рецепторов, расположенных на клеточной мембране.
Другие половые гормоны – андрогены – способствуют накоплению жира в области передней брюшной стенки. Развитие ожирения с метаболически неблагоприятным перераспределением жировой ткани с периферического на центральный тип в период менопаузы объясняют изменением баланса энергии, регуляции жировых клеток, повышенной кортикостероидной стимуляцией, влиянием факторов роста, относительной гиперандрогенией в условиях дефицита эстрогенов. Другим важным фактором, способствующим развитию центрального ожирения, является снижение секреции глобулина, связывающего половые гормоны (SHBG) в печени, что увеличивает биодоступность андрогенов. Отмечено, что у женщин в период постменопаузы риск развития абдоминального ожирения в 4,88 раза выше, чем у в пременопаузе [33].
«Выключение» яичникового стероидогенеза запускает ряд компенсаторных механизмов внеяичниковой продукции эстрогенов. Установлено, что наряду с синтезом гормонов в яичниках жировая ткань является местом экстрагонадного синтеза половых гормонов из андрогенов. Следовательно, уровень половых гормонов в крови определяет характер распределения жировой ткани, поскольку и в ней происходит накопление, интенсивная ароматизация половых гормонов и их секреция. Повышение продукции постменопаузальных эстрогенов по мере увеличения массы тела связано с участием жировой ткани в процессе ароматизации андрогенов. Следовательно, масса тела положительно коррелирует с уровнем эстрона и эстрадиола в крови. В результате масса висцерального жира увеличивается во время менопаузы на 44%, а масса гиноидного жира – примерно на 32% [34]. Предполагается, что эстрогены, полученные из ароматазы, не обладают протективными свойствами в отношении чувствительности к инсулину и развития сердечно-сосудистых заболеваний, а также повышенного риска сахарного диабета 2 типа, артериальной гипертензии и дислипидемии. Это проявляется более высокой частотой сердечно-сосудистых заболеваний у женщин в период постменопаузы.
Половые гормоны и метаболизм жировой ткани
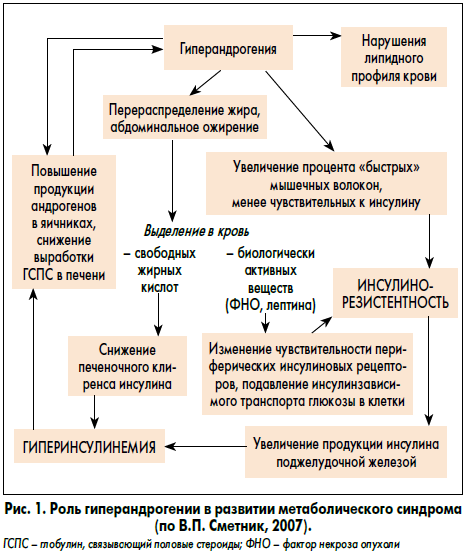
Стимуляция ЭРα в жировой ткани влияет на метаболическую активность адипоцитов. С помощью ЭРα реализуется положительное влияние эстрогенов на распределение жировой ткани, метаболизм глюкозы и воспаление [35]. Вместе с тем метаболизм жировой ткани фактически регулируется преимущественно адренергической системой. При стимуляции β-адренергических рецепторов увеличивается липолиз, тогда как активация α2A-рецепторов оказывает антилиполитическое действие и способствует накоплению жира. Продемонстрировано, что эстрадиол увеличивает экспрессию α2A-рецепторов в подкожной жировой ткани у женщин и не влияет на эти рецепторы в висцеральных жировых отложениях [36]. В другом исследовании отмечено, что активация ЭРα стимулирует β-адренорецепторы в висцеральной ткани и усиливает липолиз, что ведет к уменьшению слоя жировой ткани в области передней брюшной стенки. Установлено, что эстрогены увеличивают окисление жира в скелетных мышцах и ингибируют липогенез в печени и мышцах [32]. Таким образом, дефицит эстрогенов, обусловленный менопаузой, сопровождается увеличением висцеральных жировых отложений. В свою очередь, абдоминальное ожирение является основным фактором патогенеза инсулинорезистентности и метаболического синдрома. Висцеральная жировая ткань рассматривается в качестве потенциального медиатора между статусом менопаузы и степенью инсулинорезистентности. Однако в этом направлении необходимы дальнейшие исследования. Следует отметить, что самые тяжелые метаболические нарушения в период постменопаузы обнаруживаются у женщин с абдоминальным ожирением и инсулинорезистентностью. Взаимосвязь между степенью висцерального ожирения и инсулинорезистентностью зависит не только от содержания эстрогенов, но и других половых гормонов (рис. 1).
Жировая ткань, особенно у пациентов с ожирением, является источником ряда адипокинов (см. выше). Одним из наиболее важных адипокинов является лептин – ключевой регулятор энергетического баланса в организме. Лептин передает информацию об энергетических запасах от жировой ткани к мозгу. Головной мозг, в большей степени гипоталамус, поддерживает энергетический гомеостаз и нормальную массу тела путем регуляции потребления пищи и расходования энергии [37]. Продемонстрировано, что содержание лептина в крови возрастает при увеличении массы жировой ткани, причем его секреция в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Уровень лептина отражает не только количество накопленного жира, но и нарушение энергетического обмена. Установлено, что эстрогены потенцируют действие лептина, увеличивая экспрессию и чувствительность его рецепторов в гипоталамусе [38].
Отмечена обратная корреляционная связь между уровнями эстрогенов и адипонектина – еще одного важного цитокина, обладающего противовоспалительным и антиатерогенным действием [39].
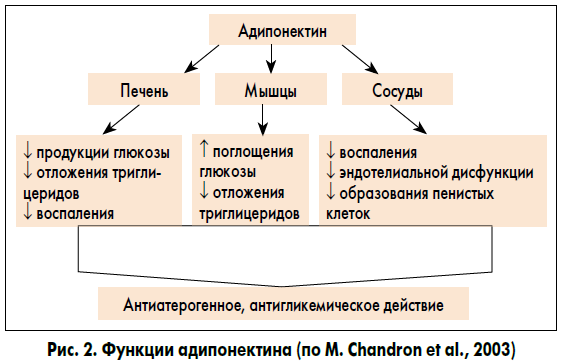
В отличие от других адипокинов, секреция которых увеличивается пропорционально увеличению массы жировой ткани, концентрация адипонектина в крови обратно коррелирует с массой жировой ткани. Адипонектин в мышечной ткани увеличивает окисление жиров, снижает внутриклеточное накопление липидов, улучшает чувствительность мышц к инсулину; в печени – уменьшает поступление жирных кислот и стимулирует их окисление; в сосудах – демонстрирует противовоспалительные и антиатерогенные свойства; в сердце – влияет на ремоделирование миокарда после ишемического повреждения (рис. 2).
Кроме того, эстрогены ингибируют продукцию провоспалительных цитокинов, секретируемых в жировой ткани, таких как интерлейктин‑6 или фактор некроза опухоли [41].
С клинической точки зрения заслуживает внимания воздействие половых гормонов на ме-таболизм жировых отложений и состояние липидного обмена. У женщин в период постменопаузы эстрогены стимулируют поддержание благоприятного профиля липидов, в то время как увеличение уровней андрогенов оказывает атерогенное действие [42].
В период перименопаузы в связи со снижением уровня эстрогенов у женщин часто наблюдается повышение артериального давления. На это влияют такие факторы:
- относительное повышение уровней андрогенов;
- активация ренин-ангиотензиновой системы (более высокие уровни ренина);
- увеличение содержания эндотелина‑1 в плазме крови;
- высокая солечувствительность;
- повышение инсулинорезистентности;
- повышение активности симпатической нервной системы;
- увеличение массы тела.
Установлено, что распространенность артериальной гипертензии у женщин в возрасте старше 55 лет увеличивается по сравнению с таковой у мужчин [43]. Такая закономерность не прослеживается в более молодом возрасте. Патогенез артериальной гипертензии у женщин в перименопаузальный период является достаточно сложным. Однако решающим представляется дефицит эстрогенов, ведущий к доминированию эффектов вазоконстрикции над вазодилатацией. Отмечено, что дефицит эстрогенов сопровождается снижением уровней простациклина и оксида азота в крови [44].
Установлено, что назначение эстрогенсодержащих препаратов в период физиологической менопаузы не сопровождается существенным снижением артериального давления, подтверждая многообразие патогенетических механизмов развития артериальной гипертензии, например, вклад ренин-ангиотензин-альдостероновой системы и др. Следует также учитывать существенный вклад в развитие артериальной гипертензии таких факторов, как ожирение, инсулинорезистентность и воспаление.
Влияют ли эстрогены на аппетит?
Контроль аппетита и энергетического баланса в целом постоянно осуществляется в центральной нервной системе, главным образом, в гипоталамусе. В этой области расположены дугообразные, паравентрикулярные и вентромедиальные ядра. Активация специфических нейронов в этих структурах стимулирует орексигенный (увеличивает потребление пищи) или анорексигенный (уменьшает аппетит) эффект. В этой области экспрессируются оба типа рецепторов эстрогенов, но преимущественно ЭРα. В эксперименте установлено, что посредством активации ЭРα эстрогены регулируют активность проопимеланокортиновых нейронов дугообразного ядра гипоталамуса, которые вызывают ощущение сытости и ведут к анорексии [45]. Продемонстрировано, что в присутствии эстрогенов ингибируется экспрессия нейропептида Y – орексигенного пептида, продуцируемого в гипоталамусе [46]. Следовательно, эстрогены участвуют в центральной регуляции энергетического обмена и на уровне ЦНС снижают аппетит. Предполагается, что быстрое снижение уровней этих гормонов способствует существенному повышению аппетита.
Выводы
Менопауза обычно является причиной многих проблем женщин, одной из которых является увеличение массы тела. Доказано, что ожирение – независимый и самый значимый фактор риска развития ишемической болезни сердца, сахарного диабета 2 типа и др. Кроме того, ожирение и менопауза являются взаимоутяжеляющими факторами в плане развития сердечно-сосудистых и метаболических заболеваний, а также преждевременной смерти. Принимая во внимание растущую частоту избыточной массы тела и ожирения у всего населения, проблемы метаболизма, возникающие у женщин в период менопаузы, следует рассматривать не только как индивидуальные, но и социально-экономические. Лучшее понимание причин и механизмов увеличения массы тела в этот период жизни женщины позволяет считать, что ожирение не является неизбежным и ему можно эффективно противостоять, соблюдая принципы здорового образа жизни, а также при необходимости применяя медикаментозную коррекцию.
Литература
1. Ожирение и избыточный вес / Информационный бюллетень ВОЗ, октябрь 2017.
2. Nicklas T.A., Baranowski T., Cullen K.W., Berenson G. Eating patterns, dietary quality and obesity. J. Am. Coll. Nutr. 2001; 20: 599-608.
3. Ожирение и избыточный вес / Информационный бюллетень ВОЗ, 2013, № 311.
4. International Food Policy Research Institute. Nutrition Country Profile: Ukraine. 2014. http://globalnutritionreport.org/files/2014/11/gnr14_cp_ukraine.pdf (accessed Jan 15, 2015).
5. Flegal K.M., Kruszon-Moran D., Carroll M.D. et al. Trends in Obesity Among Adults in the United States, 2005 to 2014. JAMA. 2016; 315(21): 2284-2291.
6. Centers for Disease Control and Prevention. NHANES Response Rates and Population Totals, 2015; http://www.cdc.gov/nchs/nhanes/response_rates_cps.htm. Accessed April 10, 2016.
7. Ogden C.L., Carroll M.D., Kit B.K., Flegal K.M. Prevalence of childhood and adult obesity in the United States, 2011-2012. JAMA. 2014; 311(8): 806-814.
8. Прилепская В.Н., Гогаева Е.В. Ожирение у женщин в различные возрастные периоды // Гинекология. – 2002. – № 1. – С. 30-32.
9. Авксенова М.Н. Влияние ожирения на развитие менструальной дисфункции, гормональные показатели, липидный обмен у репродуктивно-способных женщин // Автореф… канд. мед. наук. – Санкт-Петербург, 2011.
10. Poretsky, L., Cataldo, N.A., Rosenwaks, Z. and Giudice, L.C. The insulin related ovarian regulatory system in healthy and disease. Endocrine Reviews. 1999; 20: 535-582.
11. Татарчук Т.Ф., Ефименко О.А., Исламова А.О. Менопауза: новый взгляд на старую проблему // Репродуктивная эндокринология. – 2013. – № 1. – С. 7-12.
12. Князькова И.И. Лечение когнитивных нарушений у женщин в постменопаузе // Мед. аспекты здоровья женщины. – 2014. – № 9. –
C. 51-53.
13. Asarian L., Geary N. Sex differences in the physiology of eating. Am J Physiol Regul Integr Comp Physiol 2013. 305(11): R1215-R1267.
14. Poehlman E.T. Menopause, energy expenditure, and body composition. Acta Obstet Gynecol Scand. 2002; 81(7): 603-611.
15. Митченко Е.И. Метаболический синдром: состояние проблемы и лечебные подходы // Практична ангіологія. – 2005. – № 1.
16. Kwasniewska M., Pikala M., Kaczmarczyk-Chaas K. et al. Smoking status, the menopausal transition, and metabolic syndrome in women. Menopause. 2012; 19: 194-200.
17. Eshtiaghi R., Esteghamati A., Nakhjavani M. Menopause is an independent predictor of metabolic syndrome in Iranian women. Maturitas. 2010; 65(3): 262-266.
18. Савочкина Ю.В. Патофизиологические изменения в организме женщины в результате хирургической менопаузы // Охрана материнства и детства. – С. 66-72.
19. Практические рекомендации. Ведение женщин в пери- и постменопаузе / под ред. В.П. Сметник, Л.М. Ильина. – Ярославль: ИПК «Литера», 2010. – 222 с.
20. Беловол А.Н., Князькова И.И., Цыганков А.И. Лечение артериальной гипертензии у женщин в постменопаузе // Вісник морфології. – 2011. – Т. 17, № 3. – С. 646-652.
21. Киселев А.Р., Нейфельд И.В., Балашов С.В. Факторы сердечно-сосудистого риска у женщин в постменопаузе // Клиницист. – 2014. – № 1. – С. 9-14.
22. Моисеенко С.В. Сердечно-сосудистая система у женщин после хирургической менопаузы (результаты десятилетнего наблюдения) // Автореф… канд. мед. наук. – Москва, 2011.
23. Rochlani Y., Pothineni N.V., Mehta J.L.Metabolic Syndrome: Does it Differ Between Women and Men? Cardiovasc Drugs Ther. 2015; 29(4): 329-338.
24. Walton C. The effects of the menopause on insulin sensitivity, secretion and elimination in non-obese, healthy women. Eur J Clin Invest. 1993; 23: 466-473.
25. Чазова И.Е. и др. Консенсус Российских кардиологов и гинекологов: ведение женщин в пери- и постменопаузе с сердечно-сосудистым риском // Consilium medicum. – 2008. – Т. 1, № 6. – С. 5-18.
26. Григорян О.Р., Андреева Е.Н. Состояние углеводного обмена у женщин в период менопаузы // Сахарный диабет. – 2009. – № 4. – С. 15-20.
27. Goldbacher E.M., Bromberger J., Matthews K.A.Lifetime history of major depression predicts the development of the metabolic syndrome in middle-aged women. Psychosom Med. 2009; 71(3): 266-272.
28. Ковалева О.Н., Сорокин Д.И., Ащеулова Т.В. Влияние избыточной массы тела, ожирения и абдоминального типа распределения жировой ткани на формирование гипертрофии миокарда левого желудочка у пациентов с артериальной гипертензией // Український кардіологічний журнал. – 2009. – № 2. – С. 39-44.
29. Кроненберг Г.М., Меллмед Ш., Полонски К.С., Ларсен П.Р. Эндокринология по Вильямсу. Ожирение и нарушения липидного обмена / пер. с англ под ред. акад. РАН и РАМН И.И. Дедова, чл.-корр. РАМН Г.А. Мельниченко. – М.: ГЭОТАР-Медиа, 2010. – С. 80.
30. Fruhbeck G. et al. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation. Am. J. Physiol. Endocrinol. Metab. 2001; 280: 827-847.
31. Atapattu P.M. Obesity at Menopause: An Expanding Problem. J Pat Care. 2015; 1: 103.
32. Kozakowski J., Gietka-Czernel M., Leszczynska D., Majos A. Obesity in menopause – our negligence or an unfortunate inevitability? Prz Menopauzalny. 2017 Jun; 16(2): 61-65.
33. Donato G.B., Fuchs S.C., Oppermann K. et al. Association between menopause status and central adiposity measured at different cutoffs of waist circumference and waist-to-hip ratio. Menopause. 2006; 13: 280-285.
34. Panotopoulos G., Raison J., Ruiz J.C. et al. Weight gain at the time of menopause. Hum Reprod. 1997; 12(suppl 1): 126-133.
35. Сметник В.П. Половые гормоны и жировая ткань // Ожирение и метаболизм. – 2007. – № 3. – С. 17-22.
36. Pedersen S.B., Kristensen K., Hermann P.A. et al. Estrogen controls lipolysis by up-regulating alpha2A-adrenergic receptors directly in human adipose tissue through the estrogen receptor alpha. Implications for the female fat distribution. J Clin Endocrinol Metab. 2004; 89: 1869-1878.
37. Zhou Y., Rui L. Leptin signaling and leptin resistance Front Med. 2013; 7(2): 207-222.
38. Fuente-Martin E., Garcia-Caceres C., Morselli E. et al. Estrogen, astrocytes and the neuroendocrine control of metabolism. Rev Endocr Metab Disord. 2013; 14(4): 331-338.
39. Tworoger S.S., Mantzoros C., Hankinson S.E. Relationship of plasma adiponectin with sex hormone and insulin-like growth factor levels. Obesity (Silver Spring) 2007; 15: 2217-2224.
40. Chandron M. et al. Adiponectin: more than just another fat cell hormone? Diabetes Care. 2003; 26: 2442-2450.
41. Posa A., Szabo R., Csonka A. et al. Endogenous Estrogen-Mediated Heme Oxygenase Regulation in Experimental Menopause. Oxid Med Cell Longev. 2015; 2015: 429713.
42. Shelley J.M., Green A., Smith A.M.A. et al. Relationship of endogenous sex hormones to lipids and blood pressure in mid-aged women. Ann Epidemiol. 1998; 8: 39-45.
43. Staessen J.A., van der Heijden-Spek J.J., Safar M.E., Den Hond E., Gasowski J., Fagard R.H. et al. Menopause and the characteristics of the large arteries in a population study. J Hum Hypertens 2001; 15: 511-8.
44. Малая Л.Т., Корж А.Н., Балковая Л.Б. Эндотелиальная дисфункция при патологии сердечно-сосудистой системы. – Харьков: Форсинг, 2000.
45. Nestor C.C., Kelly M.J., Rnnekleiv O.K. Cross-talk between reproduction and energy homeostasis: central impact of estrogens, leptin and kisspeptin signaling. Horm Mol Biol Clin Investig. 2014; 17: 109-128.
46. Rebouas E.C., Leal S., Sa S.I. Regulation of NPY and α-MSH expression by estradiol in the arcuate nucleus of Wistar female rats: a stereological study. Neurol Res. 2016; 38: 740-747.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 4 (28), грудень 2017 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...
Хронічний тазовий біль (ХТБ) є поширеним патологічним станом, який відзначається у жінок будь-якого віку і супроводжується сексуальною дисфункцією, емоційною лабільністю, аномальними матковими кровотечами, порушенням сечовипускання, розладами з боку кишечника тощо. Пацієнтки, які страждають на ХТБ, часто скаржаться на симптоми тривоги та депресії, що негативно позначається на їхній повсякденній активності, включаючи зниження працездатності та погіршення якості життя [1]. Сьогодні проблема ХТБ є економічним тягарем, пов’язаним із прямими або непрямими медичними витратами, які в середньому в різних країнах світу оцінюються у 4,9 млрд доларів на рік [2]. Раціональна фармакотерапія,спрямована на полегшення та контроль симптомів болю, є ключовою стратегією боротьби із ХТБ...
Дефіцит заліза є найпоширенішим патологічним станом у світі та однією з п’яти основних причин інвалідності. У той час як низький показник феритину у сироватці крові є діагностичною ознакою залізодефіциту, підвищений його рівень визначається як гострофазовий маркер, що може реєструватися при запальних станах уже в І триместрі вагітності. Відповідно до сучасних настанов, проведення рутинного скринінгу на залізодефіцит у невагітних та вагітних жінок за відсутності ознак анемії не рекомендоване. З огляду на останні літературні дані ця рекомендація має бути переглянута...
Наказ Міністерства охорони здоров’я України від 25.08.2023 № 1533 ...