Молекулярне профілювання для прийняття клінічного рішення при лікуванні раку на пізній стадії: клінічна оцінка
Метою персоналізованої медицини в галузі онкології є вчасне призначення кожному пацієнту правильно обраного препарату. Завдяки високим очікуванням та видатним результатам у цій сфері було розроблено низку комерційних діагностичних систем для профілювання пухлин у звичайних клінічних умовах. За останні десять років результатом поглибленого розуміння багатьох молекулярних альтерацій, специфічних для певних типів пухлин, стало безпрецедентне поліпшення результатів лікування пацієнтів. Персоналізований підхід широко застосовується в сучасній клінічній онкології не тільки через медичну й економічну користь підбору оптимального препарату для кожного окремого пацієнта та можливість уникнути вживання лікарських засобів, які, найімовірніше, будуть неефективними, а й завдяки появі великої кількості нових таргетних препаратів.
З початку цього десятиліття персоналізована медицина в галузі онкології розвивалася швидкими темпами. Цей успіх став можливим завдяки технологічним досягненням, оскільки лікарі отримали доступ до нових діагностичних технологій, а також завдяки досягненням у біоінформатиці, які дозволяють використовувати результати аналізів на біомаркери для формулювання дієвих висновків. Проте швидка поява численних комерційних систем для профілювання пухлин, а також поширення молекулярного тестування в місцевих академічних закладах означають, що в цій сфері швидко з’являється багато різних варіантів. Існує ризик, що неналежне регулювання в цій галузі призведе до дезорієнтації та відчуття безпорадності в лікарів і розчарування в онкологічних пацієнтів, які покладали надії на персоналізовану медицину, але виявили, що конкретна система, яку вони застосовували, не допоможе в досягненні мети.
Персоналізований підхід забезпечує раціональне обґрунтування у сфері онкології, отже, важливо ретельно оцінювати комерційні платформи, аби переконатися, що застосовувані системи надають достатні докази якості, цінності й клінічної користі. Лише в разі дотримання всіх вимог мета персоналізованої медицини буде досягнута, а пацієнти будуть захищені від експлуатації або використання в дослідних цілях у рутинній клінічній практиці. У цій статті надається об’єктивна оцінка опублікованих даних щодо трьох комерційних систем для профілювання пухлинних тканин.
Матеріали та методи
Експертна рада мультидисциплінарних спеціалістів-онкологів проаналізувала та порівняла доступні в Іспанії платформи для профілювання пухлин: Caris Molecular Intelligence®, FoundationOne® та OncoDEEP®. Щодо кожної з платформ було здійснено розширений огляд наукової літератури та зібрано інформацію на веб-сайтах. У результаті глибокого аналізу й обговорення на оглядовому засіданні було розроблено проект узгодженого документа, поданий на розгляд двом незалежним експертам. Офіційний систематичний пошук у науковій літературі не здійснювався.
Результати
Порівняння систем для профілювання пухлин
Багато клінік користуються послугами місцевих лабораторій для оцінки індивідуальних біомаркерів або їх вузьких панелей. Застосування комерційних систем може забезпечити низку додаткових переваг перед локальним тестуванням.
- Нові технології можуть бути запроваджені швидше, коли завдяки більшій кількості випадків буде продемонстровано достатню цінність та здійснено валідацію.
- Узгодженість результатів можна контролювати завдяки глобальній стандартизації та контролю якості з боку незалежних організацій.
- Централізація та висока пропускна здатність аналізів забезпечують швидке створення бази даних клінічних доказів із внутрішньою порівнянністю.
Аналітичне порівняння тестів для профілювання пухлин враховує три аспекти.
- які технології застосовуються в кожній системі і яким чином вони були валідовані;
- які докази використовуються для створення прогнозної кореляції між результатами аналізу на біомаркери та варіантами лікування;
- яким документально підтвердженим стандартам якості відповідає кожна система.
Технологія та валідація. Наразі для молекулярного профілювання застосовуються кілька технологій. До них належать імуногістохімічний аналіз (IHC), секвенування за Сенгером, секвенування нового покоління (NGS), флуоресцентна або хромогенна гібридизація in situ (FISH і CISH) та полімеразна ланцюгова реакція. У більшості випадків при локальному тестуванні застосовують метод NGS за допомогою комерційних панелей генів, які дозволяють виявляти гарячі точки приблизно в 50-70 генах, а також імуногістохімію або гібридизацію in situ за допомогою супутніх діагностичних наборів або валідованих моноклональних антитіл, зазначених у протоколах лікування. Панелі гарячих точок допомагають виявити попередньо визначені мутації, які відбуваються на обмежених ділянках досліджуваних генів. Ці тести фокусуються на вузьких підгрупах і, як правило, не аналізують кодувальні ділянки повністю та не виявляють усі відомі альтерації або класи альтерацій. Більш глибокий аналіз із повним охопленням екзонів може доповнити вже проведене тестування з метою визначення подальших можливих варіантів лікування пацієнтів. Часто на місцевих ринках існують інші, більш нові технології, але вони застосовуються тільки в дослідницьких цілях і на сьогоднішній день не можуть бути використані в клінічних умовах через відсутність валідації. Цінність найбільш доступних локальних панелей NGS полягає в тому, що вони допомагають відбирати пацієнтів для поточних клінічних досліджень і виявляти добре вивчені молекулярні аберації для застосування зареєстрованих таргетних препаратів.
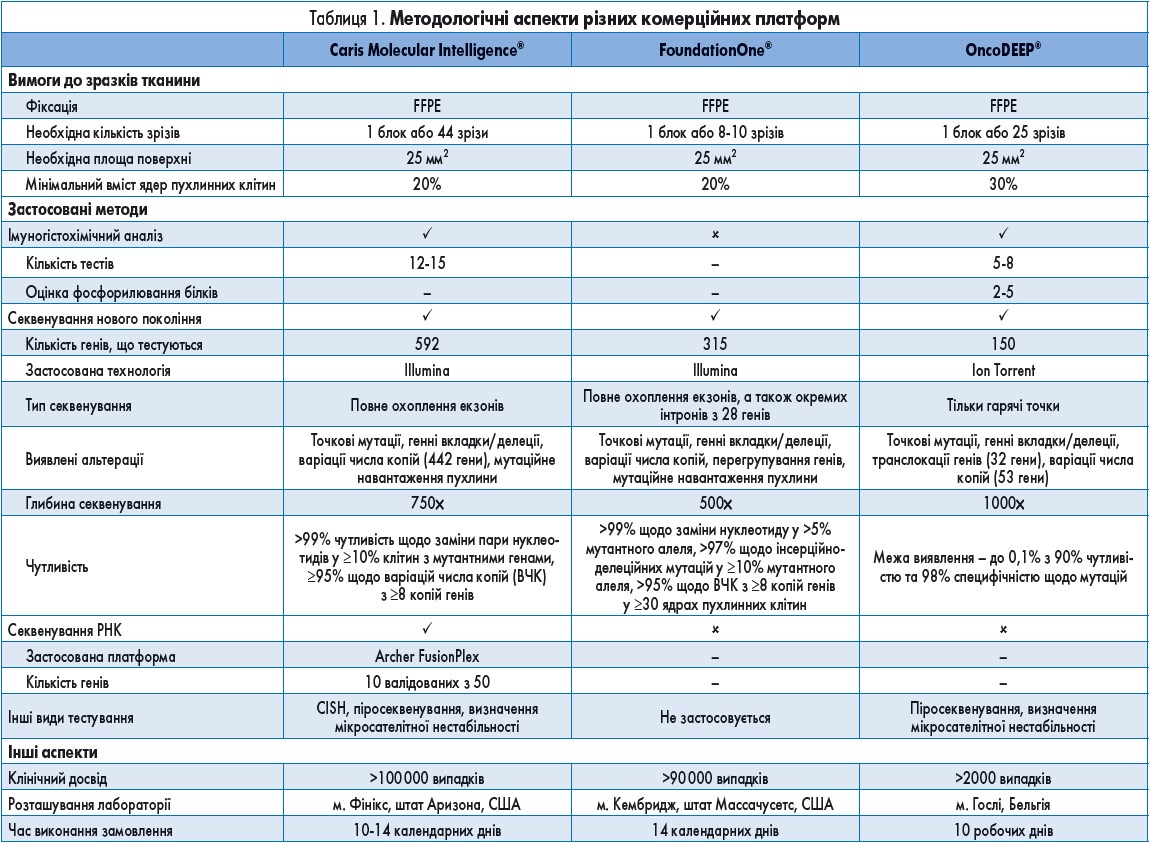
На основі інформації, отриманої з веб-сайтів відповідних компаній, було здійснено стислий огляд вимог до зразків пухлинних тканин, застосовуваних технологій та інших технічних аспектів трьох комерційних діагностичних систем, представлений у таблиці 1. Інформацію було отримано з веб-сайтів відповідних компаній станом на 5 жовтня 2016 р.
Caris Molecular Intelligence® базується на мультиплатформному підході, згідно з яким для визначення варіантів лікування використовується вся клінічно значуща інформація. Наразі тестова система включає 12-15 тестів IHC, 592 гени, оцінювані з повним охопленням екзонів методом NGS (зокрема, варіації числа копій 442 генів та оцінку загального мутаційного навантаження), 10 генів із секвенуванням РНК для виявлення злиття генів, а також інші тести, такі як CISH, піросеквенування та визначення мікросателітної нестабільності, що виконуються за певних показань.
FoundationOne® базується на одноплатформному підході, згідно з яким застосовується лише метод NGS. Дані щодо розробки та валідації цього підходу опубліковані. Наразі система включає панель із 315 генів, оцінюваних з повним охопленням екзонів, а також інтронів із 28 генів, в яких при онкологічному захворюванні часто відбувається перегрупування або альтерація (включно з оцінкою повного мутаційного навантаження).
OncoDEEP® базується на мультиплатформному підході, згідно з яким для визначення варіантів лікування використовується вся клінічно значуща інформація. На сьогоднішній день система включає 5-8 тестів IHC (у тому числі 2-5 тестів фосфорилювання білків), 150 генів, оцінюваних методом NGS із застосуванням панелі гарячих точок, генні транслокації у 32 генах, варіації числа копій у 53 генах та інші тести, такі як піросеквенування та визначення мікросателітної нестабільності, що виконуються за певних показань.
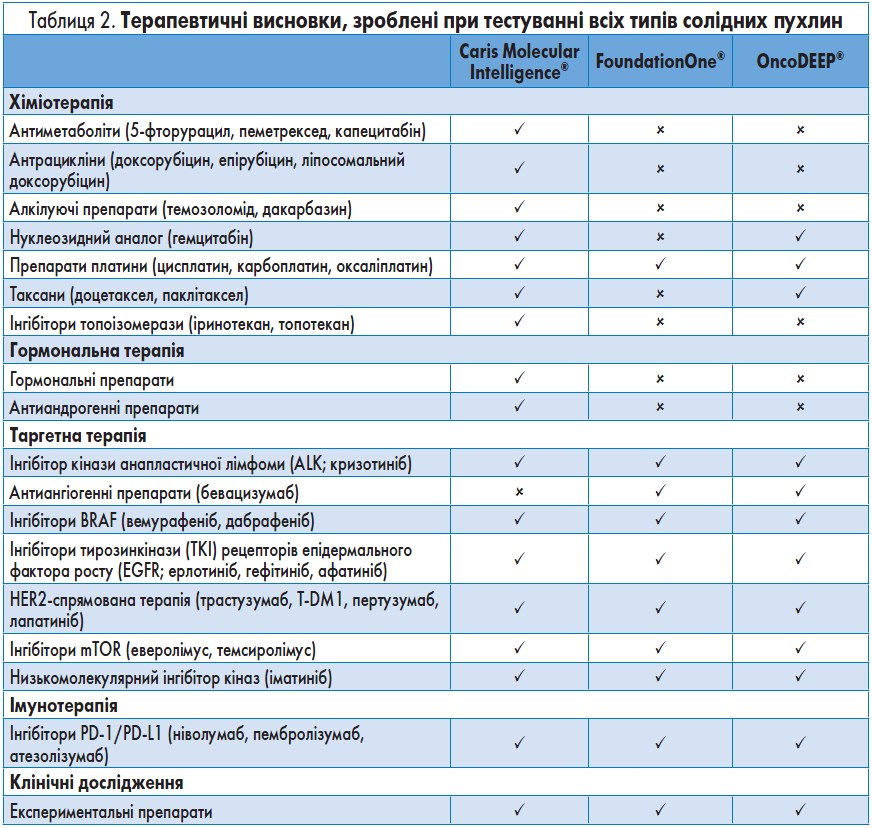
Дані, які формують терапевтичні висновки. Перелік терапевтичних висновків для кожної комерційної платформи наведено у таблиці 2.
Caris Molecular Intelligence®: 96% висновків, викладених на першій сторінці звіту щодо результатів тестування за допомогою системи Caris, базуються на даних 1 або 2 рівня доказовості. Екстраполяції, які ґрунтуються на клінічних даних 3 рівня або доклінічних даних, представлені як експериментальні можливості та являють собою основу для проведення серії клінічних досліджень. У звіті про результати тестування за допомогою системи Caris надаються висновки щодо застосування широкого діапазону хіміотерапевтичних, гормональних, таргетних, імунотерапевтичних, а також експериментальних препаратів.
FoundationOne®: у звітах щодо результатів тестування за допомогою системи FoundationOne® зазначаються виявлені альтерації, які часто спонукають лікарів розглянути додаткові варіанти лікування пацієнтів. Тестування фокусується на висновках щодо застосування таргетних та експериментальних препаратів. Також надаються прогнозні висновки щодо застосування препаратів платини (на основі мутацій BRCA1/2) та імунотерапевтичних препаратів (на основі мутаційного навантаження пухлини). Рівень клінічних даних, що лежать в основі запропонованих висновків, не визначений, а сила доказів не класифікована.
OncoDEEP®: звіт щодо результатів тестування за допомогою системи OncoDEEP® фокусується на таргетній терапії, а висновки ґрунтуються на результатах NGS та аналізах фосфорилювання білків. Також надаються прогнозні висновки щодо застосування окремих хіміотерапевтичних, гормональних, імунотерапевтичних та експериментальних препаратів. Рівень клінічних даних, що лежать в основі запропонованих висновків, не визначений, а сила доказів не класифікована.
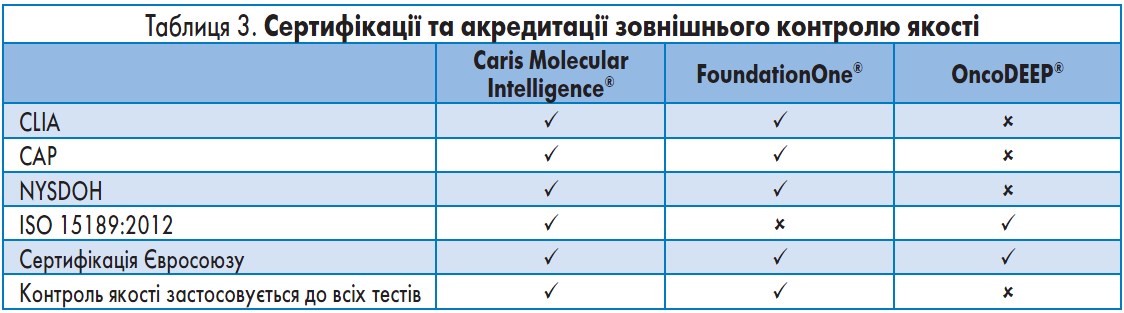
Документально підтверджені стандарти якості. Важливо, щоб діагностичні тести in vitro (IVD) та тести, розроблені в лабораторних умовах (LDT), виконувалися згідно з високими аналітичними стандартами, щоб медичні працівники не призначали пацієнтам зайві чи невідповідні препарати й не зволікали з наданням необхідного лікування. Стислий огляд сертифікацій та акредитацій кожної лабораторії, яка використовує описані в цій статті системи, наведено в таблиці 3.
Caris Molecular Intelligence®: усі тести, виконані в лабораторії Caris, сертифіковані/схвалені CLIA, CAP та NYSDOH. Лабораторія Caris також має ліцензії штатів Каліфорнія, Флорида, Меріленд, Пенсильванія та Род-Айленд. Окрім того, Caris – єдина біолабораторія в США, яка отримала Європейський сертифікат ISO 15189:2012. Діагностична система має сертифікацію Євросоюзу. При виконанні аналізів за допомогою системи CMI лабораторія Caris зазвичай користується комерційними наборами для діагностики in vitro (IVD). За відсутності наборів лабораторія Caris розробляє власні тести для виконання аналізів.
FoundationOne®: усі тести, виконані в медичній лабораторії Foundation, сертифіковані/схвалені CLIA, CAP та NYSDOH, а також мають сертифікацію Євросоюзу.
OncoDEEP®: усі аналізи в рамках системи OncoDEEP виконуються Інститутом патології та генетики у м. Гослі. Ця лабораторія має сертифікат ISO 15189, у тому числі щодо генетичного секвенування за технологією Ion Torrent, що виконується в рамках системи OncoDEEP®. Усі інші аспекти тестової платформи в сертифікаті ISO 15189 не зазначені.
Клінічна цінність та вплив на результати лікування пацієнтів
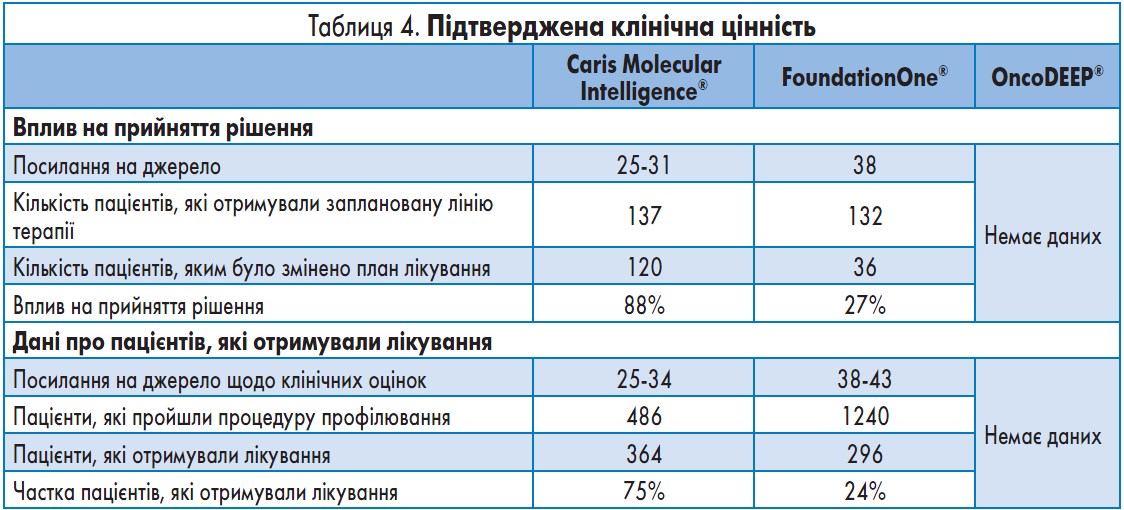
Клінічна цінність. Клінічна цінність у широкому сенсі може стосуватися будь-якого використання результатів аналізів для прийняття виваженого клінічного рішення. Стислий огляд даних, отриманих при застосуванні проаналізованих діагностичних систем, та кількість пацієнтів, які пройшли процедуру профілювання, наведено в таблиці 4, а детальний опис викладено нижче.
Caris Molecular Intelligence®. У випадках, коли лікування було призначене до отримання результатів тесту за допомогою системи CMI (n=137), для оцінювання системи можна було здійснити порівняння з фактично застосованою терапією. У 120 випадках зі 137 (88%) після отримання результатів тесту терапевтичне рішення було змінено. Триста сорок вісім із 473 пацієнтів (74%), які пройшли процедуру профілювання в рамках оцінювання системи CMI у звичайній клінічній практиці, у цілому отримували лікування, порівнянне з результатами тестування. Найнижчі показники відзначалися при тестуванні пацієнтів з раком шлунка (28 із 46 пацієнтів; 61%) та раком підшлункової залози (30 з 55 пацієнтів; 55%). Це пояснюється агресивним характером захворювання та тим, що в багатьох випадках через швидке прогресування пацієнти вже не могли отримувати лікування згідно з результатами профілювання. На цей показник впливають також проміжні результати проспективного дослідження в Австрії, відбір пацієнтів у яке все ще триває та в ході якого багато пацієнтів поки не отримують лікування, оскільки на момент оцінювання в них не відбулося прогресування на тлі попередньої терапії.
FoundationOne®. Дослідження впливу на рішення при застосуванні системи FoundationOne® показало, що терапевтичне рішення було змінено у 36 випадках зі 132 (27%). У дослідженнях із застосуванням системи FoundationOne®, проведених у ключових академічних центрах США та Бразилії, тільки 285 з 1174 пацієнтів (24%), які пройшли процедуру профілювання, отримували лікування за результатами секвенування.
OncoDEEP®. Опубліковані дані щодо клінічної цінності системи OncoDEEP® відсутні.
 Клінічна користь. Інший аспект клінічної цінності, який слід враховувати, – це вплив терапевтичних рішень, прийнятих після профілювання, на результати лікування пацієнтів. До показників користі належать виживаність без прогресування, відповідь на лікування або стабілізація захворювання (стабілізація захворювання ≥6 міс / часткова відповідь / повна відповідь), час до наступної терапії та загальна виживаність. Огляд підтвердженої клінічної користі наведено в таблиці 5, а детальний опис викладено нижче.
Клінічна користь. Інший аспект клінічної цінності, який слід враховувати, – це вплив терапевтичних рішень, прийнятих після профілювання, на результати лікування пацієнтів. До показників користі належать виживаність без прогресування, відповідь на лікування або стабілізація захворювання (стабілізація захворювання ≥6 міс / часткова відповідь / повна відповідь), час до наступної терапії та загальна виживаність. Огляд підтвердженої клінічної користі наведено в таблиці 5, а детальний опис викладено нижче.
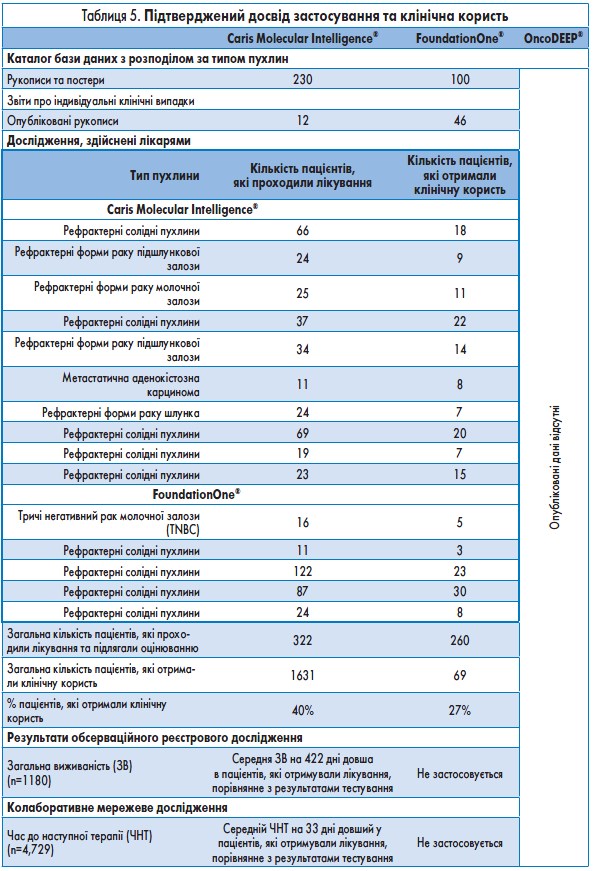
Caris Molecular Intelligence®. Компанія Caris опублікувала 12 звітів про клінічні випадки, які демонструють вплив правильного вибору препарату на результати лікування пацієнтів з пухлинами будь-якого типу. Окрім того, компанія Caris провела низку проспективних та ретроспективних оцінювань системи під керівництвом лікарів. Нещодавно було опубліковано результати незалежного огляду клінічних даних при застосуванні системи Caris Molecular Intelligence®, здійсненого найавторитетнішими спеціалістами з Великої Британії, Бельгії та Італії. З 322 оцінюваних пацієнтів 131 (40%), за оцінкою їхніх лікарів, отримали клінічну користь. Наразі триває проспективне обсерваційне дослідження для оцінки загальної виживаності серед 3000 пацієнтів, які пройшли процедуру профілювання. 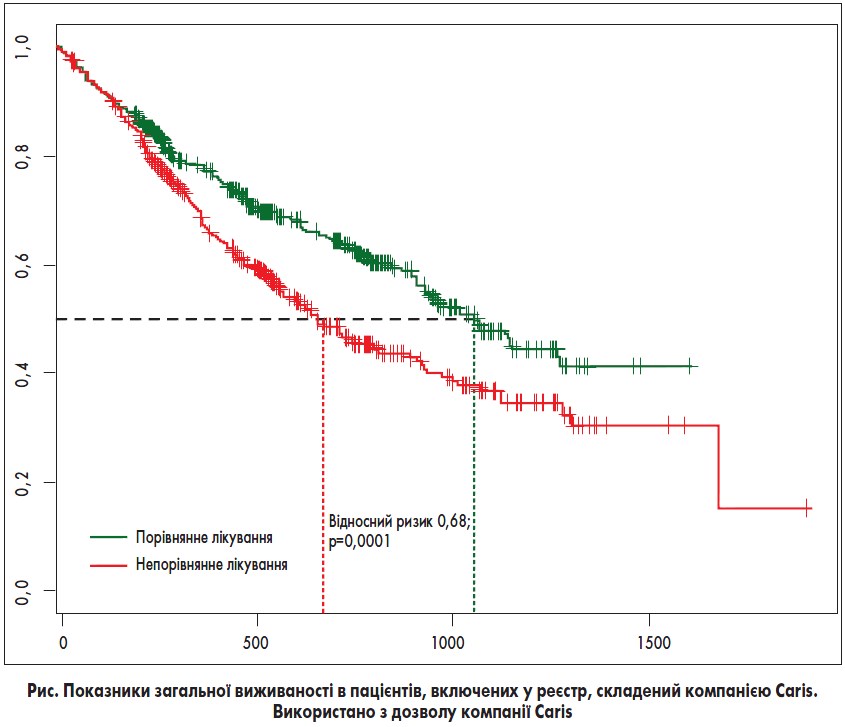 Дослідження, яке почалося у 2009 р., надало перші результати лікування 1180 пацієнтів із солідними пухлинами різних типів. Пацієнтів розподілили на дві групи, залежно від того, чи було їх лікування порівнянним з результатами тестування. Група порівнянного лікування складалася з 534 пацієнтів, а група непорівнянного лікування – з 493. Обидві групи були збалансовані з точки зору демографічних даних пацієнтів та типів пухлин. Як видно з рисунка, пацієнти в групі порівнянного лікування мали значно довший період загальної виживаності, ніж пацієнти в групі непорівнянного лікування; при цьому середнє збільшення загальної виживаності становило 422 дні (відносний ризик – ВР – 0,68, p=0,001). За даними цього дослідження, пацієнти в групі порівнянного лікування отримували менше ліній терапії, ніж пацієнти в групі непорівнянного лікування (середня кількість ліній терапії після отримання результатів тестування за допомогою системи Caris складала 3,2 та 4,2 відповідно). Нещодавно Herzog і співавт. опублікували статтю, в якій зазначено, що в пацієнток з раком яєчника, які отримували лікування, порівнянне з результатами тестування, відзначався вищий середній показник 9-місячної загальної виживаності.
Дослідження, яке почалося у 2009 р., надало перші результати лікування 1180 пацієнтів із солідними пухлинами різних типів. Пацієнтів розподілили на дві групи, залежно від того, чи було їх лікування порівнянним з результатами тестування. Група порівнянного лікування складалася з 534 пацієнтів, а група непорівнянного лікування – з 493. Обидві групи були збалансовані з точки зору демографічних даних пацієнтів та типів пухлин. Як видно з рисунка, пацієнти в групі порівнянного лікування мали значно довший період загальної виживаності, ніж пацієнти в групі непорівнянного лікування; при цьому середнє збільшення загальної виживаності становило 422 дні (відносний ризик – ВР – 0,68, p=0,001). За даними цього дослідження, пацієнти в групі порівнянного лікування отримували менше ліній терапії, ніж пацієнти в групі непорівнянного лікування (середня кількість ліній терапії після отримання результатів тестування за допомогою системи Caris складала 3,2 та 4,2 відповідно). Нещодавно Herzog і співавт. опублікували статтю, в якій зазначено, що в пацієнток з раком яєчника, які отримували лікування, порівнянне з результатами тестування, відзначався вищий середній показник 9-місячної загальної виживаності.
На початку 2015 р. компанія Caris організувала мережу Центрів передового досвіду з метою відстеження віддалених клінічних результатів та їх введення в комплексну базу молекулярних даних. Ретроспективно було зібрано терапевтичні дані з електронних медичних карток понад 4700 пацієнтів із солідними пухлинами різних типів, які в рамках лікування пройшли процедуру профілювання за допомогою системи Caris Molecular Intelligence®.
Час до наступної терапії (ЧНТ) визначався як період між датами початку першої та другої терапії після взяття зразка. Враховуючи відсутність в електронних медичних картках достовірної інформації щодо прогресування, у цій групі пацієнтів ЧНТ застосовується як замінник показника виживаності без прогресування. Коректність даних щодо лікування, отриманих з електронних медичних карток, дозволяє точно та повною мірою визначити ЧНТ.
Для оцінки впливу тестування за допомогою системи Caris Molecular Intelligence® на ЧНТ було визначено дві групи пацієнтів залежно від першої терапії, застосованої після взяття зразка. У групі порівнянного лікування (n=3 011) пацієнти отримували тільки ті препарати, користь яких була зазначена у звіті щодо результатів тестування за допомогою CMI. У групі непорівнянного лікування пацієнти отримували хоча б один препарат, який система CMI визначила як такий, що не принесе користі (n=1718). Дані щодо ЧНТ аналізувалися через 1 рік. У пацієнтів групи порівнянного лікування ЧНТ був значно довшим, ніж у пацієнтів групи непорівнянного лікування (середній ЧНТ – 248 та 215 днів; ВР 0,85; p=0,00018).
FoundationOne®. З 339 пацієнтів, які пройшли процедуру профілювання, у 317 (93,5%) було виявлено щонайменше одну альтерацію, яка потребувала вжиття відповідних заходів. Більше третини пацієнтів (36,5%; 122 з 339) отримували лікування відповідно до результатів профілювання. Зі 118 оцінюваних пацієнтів, які отримували порівнянне лікування, 45 мали безпосередню, а 73 – опосередковану порівнянність з відповідною таргетною терапією. Решта 66 пацієнтів отримували непорівнянне лікування. У групі порівнянного лікування клінічну користь отримали 23 пацієнти (19%; стабілізація захворювання ≥6 міс / часткова відповідь / повна відповідь), а у групі непорівнянного лікування – лише 5 з 64 пацієнтів (8%).
Середній час до терапевтичної невдачі був значно довшим (2,8 міс проти 1,9; p=0,001), а також спостерігалася тенденція до більш тривалого періоду загальної виживаності (9,3 міс проти 7,2). Цікаво, що клінічна користь не обов’язково означає безпосередню користь з точки зору загальної виживаності. У підгрупі порівнянного лікування з безпосередньою порівнянністю 6 із 45 пацієнтів (13%) отримали клінічну користь, при цьому середня загальна виживаність становила 11,3 міс. Для порівняння, більшість пацієнтів, які отримали клінічну користь, належали до підгрупи з опосередкованою порівнянністю (23%, 17 із 73), але в них відзначався коротший середній період загальної виживаності – 7,3 міс.
OncoDEEP®. Опубліковані дані щодо клінічної користі застосування системи OncoDEEP® відсутні.
Висновки
Аналіз різних систем для молекулярного профілювання свідчить, що новий підхід має високу потенційну клінічну цінність та при правильному застосуванні може принести значну користь пацієнтам. Ключовим питанням є визначення пацієнтів, для яких молекулярне профілювання є необхідним та забезпечить найбільшу користь. Існує кілька умов, за яких застосування молекулярних тестів є добре обґрунтованим.
По-перше, це тестування пацієнтів із захворюваннями, для лікування яких зареєстровано інноваційні таргетні препарати. Важливо підтвердити наявність відповідних мішеней, щоб застосувати до них такі препарати. Прикладом є геномний аналіз ALK та EGFR при недрібноклітинному раку легені, який зазвичай виконують у місцевих лабораторіях, оскільки існують комерційно доступні набори для тестування.
По-друге, це скринінг пацієнтів, котрі можуть бути кандидатами на участь у клінічних дослідженнях нових препаратів, які необхідно протестувати на пацієнтах із пухлинами, що мають специфічний молекулярний профіль. На сьогоднішній день спеціалізовані клініки можуть включати у клінічні дослідження велику кількість пацієнтів. Це можливо лише при застосуванні молекулярного профілювання, яке виявляє мутації, здатні обґрунтувати включення пацієнта в дослідження відповідного препарату. Зазвичай із цією метою здійснюється більш широке геномне профілювання, яке може бути запроваджене у спеціалізованій місцевій лабораторії або полегшене за допомогою системи для профілювання, подібної до тих, які були проаналізовані в цьому огляді.
Третій варіант клінічного застосування – тестування пацієнтів, у яких аналіз на стандартні біомаркери не дав дієвого результату, а участь у клінічному дослідженні не є оптимальним варіантом. Після невдачі стандартного лікування можна розпочати розширений пошук для визначення препаратів, потенційно ефективних для лікування відповідного захворювання. Це можуть бути препарати, які зазвичай не застосовуються, отже, пошук необхідно здійснювати за всіма класами препаратів, тобто розглядати застосування традиційних цитотоксичних хіміотерапевтичних засобів, гормональних та таргетних препаратів.
Враховуючи це завдання, цей огляд свідчить, що система CMI компанії Caris пропонує найбільш повний багатоплатформний профіль, при застосуванні якого були отримані сприятливі клінічні результати. Клінічні дані чітко демонструють, що при правильному підході більш широке застосування у клінічній практиці є добре обґрунтованим, оскільки забезпечує клінічну користь. Обмеження цього огляду полягають у тому, що інформація стосовно використання платформ для молекулярного профілювання постійно оновлюється, а більшість отриманих нових даних офіційно не публікуються та не індексуються. Було проаналізовано доступні в Іспанії комерційні платформи, які, до того ж, є найбільш поширеними. На думку авторів, наведена загальна схема аналізу може бути застосована для оцінювання інших платформ.
Що стосується пацієнтів, перед тестуванням їм необхідно надати чітку, прозору та чесну медичну інформацію, оскільки не всі протестовані пацієнти отримають безпосередню користь. Також слід враховувати обмеження й перешкоди, пов’язані з лікуванням після тестування, приділяючи особливу увагу деяким поширеним ситуаціям: швидке погіршення стану пацієнта, якщо тестування замовлено на занадто пізній стадії захворювання, обмеження доступності та пільгового забезпечення незареєстрованими препаратами пацієнтів зі специфічними захворюваннями, особливо при таргетній терапії.
Автори вважають, що саме час ввести мультиплатформне профілювання в загальну клінічну практику. Для цього важливо запроваджувати його в закладах, де досвідчені онкологи можуть ефективно інтерпретувати дані молекулярного профілю, де є можливість звернутися до експертів, які допоможуть охарактеризувати неочікувані результати, та де мультидисциплінарний обмін є частиною загальної клінічної практики. Доступні наразі системи, подібні до тих, що проаналізовані в цьому огляді, доповнять та розширять дослідницькі можливості закладів і можуть бути застосовані для відбору пацієнтів, які з найбільшою імовірністю отримають від цього користь. У певних добре визначених клінічних умовах, наприклад, при рідкісних пухлинах, карциномі невідомої первинної локалізації, тричі негативному раку молочної залози або застосуванні третьої лінії терапії колоректального раку, слід розглядати можливість офіційного ухвалення та пільгового фінансування мультиплатформного профілювання. Пільговому фінансуванню мають підлягати тільки затверджені системи, які відповідають найжорсткішим критеріям якості та надають достовірні дані для забезпечення максимальної користі.
При запровадженні молекулярного профілювання у клінічну практику необхідно враховувати, що лікарі-онкологи повинні інформувати пацієнтів належним чином, щоб їх очікування були відповідними.
Стаття друкується у скороченні.
Список літератури знаходиться в редакції.
Capdevila J., Rojo F., Gonzalez-Martin A., Grande E., Martin-Algarra S., Puente J., Lopez B.S., Vera R., Garcia-Foncillas J. Molecular Profiling for Clinical Decision Making in Advanced Cancer: A Clinical Appraisal: Journal of Cancer Research and Treatment. 2017; 5(3): 77-85.
Матеріал наданий компанією «Амакса Фарма»
Тематичний номер «Онкологія» № 2 (53), травень 2018 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...