Оксазолідинони – альтернатива глікопептидам у лікуванні грампозитивної хірургічної інфекції, спричиненої метицилінрезистентним золотистим стафілококом
 У 1978 році групою дослідників компанії DuPont вперше були синтезовані оксазолідинони, а в 1987-му відкриті їхні антибактеріальні властивості. Фармацевтична компанія Upjohn 1993 року закупила у фірми DuPont лінезолід, після чого розпочалися клінічні дослідження, на основі яких у квітні 2000 року Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) зареєструвало препарат лінезолід.
У 1978 році групою дослідників компанії DuPont вперше були синтезовані оксазолідинони, а в 1987-му відкриті їхні антибактеріальні властивості. Фармацевтична компанія Upjohn 1993 року закупила у фірми DuPont лінезолід, після чого розпочалися клінічні дослідження, на основі яких у квітні 2000 року Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) зареєструвало препарат лінезолід.
Лінезолід продається в США під назвою Зивокс, в Європі – Зивоксид. В Україні одним із перших з’явився вітчизняний Лінезолідин (виробництва корпорації «Артеріум», Україна) в ін’єкційній і таблетованій формах. FDA 20 червня 2014 року зареєструвало інший препарат цієї групи – тедизолід. Іще кілька препаратів класу оксазолідинонів перебувають у стадії розробки.
Як інгібітор синтезу білків лінезолід пригнічує ріст бактерій. Стійкість бактерій до лінезоліду залишається дуже низькою (про перші випадки резистентності стало відомо в 1999 році), але некоректне використання препарату в майбутньому може спровокувати швидкий ріст резистентності до нього [13, 50].
Оксазолідинони – антибактеріальні засоби, високоактивні стосовно грампозитивних мікроорганізмів. Препарат зазначеного класу лінезолід має такі властивості:
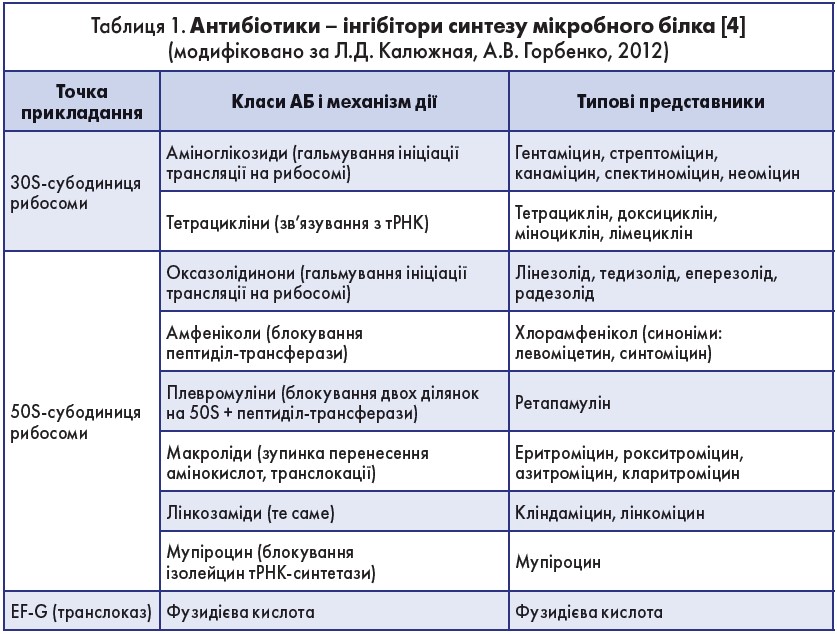
- здатність пригнічувати синтез білка в бактеріальній клітині. На відміну від інших антибіотиків (АБ), які впливають на білковий синтез, лінезолід діє на ранніх етапах трансляції шляхом незворотного зв’язування з 30S- і 50S-субодиницею рибосом, у результаті чого порушуються утворення ініціюючого 70S-комплексу і формування пептидного ланцюга. Цей унікальний механізм перешкоджає розвитку перехресної резистентності з такими АБ, як макроліди, аміноглікозиди, лінкозаміди, тетрациклін, хлорамфенікол;
- бактеріостатичний тип дії. Бактерицидна активність встановлена для Bacteroides fragilis, Clostridium perfringens і деяких штамів стрептококів, як-от Streptococcus pneumoniae і Streptococcus pyogenes;
- спектр впливу на штами включає основні грампозитивні мікроорганізми, у тому числі метицилінрезистентні стафілококи (MРЗС), пеніцилін- і макролідрезистентні пневмококи і глікопептидрезистентні ентерококи. Менш активний лінезолід відносно грамнегативних бактерій;
- у великій концентрації накопичується в бронхолегеневому епітелії. Добре проникає в шкіру, у м’які тканини, легені, серце, кишечник, печінку, нирки, центральну нервову систему, синовіальну рідину, кістки, жовчний міхур. Має майже 100% біодоступність;
- резистентність до лінезоліду розвивається дуже повільно, це пов’язують із тривалим парентеральним застосуванням (4-6 тиж).
Результати клінічних досліджень довели ефективність лінезоліду в лікуванні госпітальної пневмонії (у комбінації з АБ, активними стосовно грамнегативних мікробів); інфекцій, спричинених ванкоміцинрезистентними ентерококами; інфекцій шкіри і м’яких тканин (ІШМТ).
Іще у 2004 році D.L. Stevens і співавт.зазначили, що резистентність грампозитивних бактерій, таких як MРЗС і Enterococcus faecium, до існуючих АБ продовжує зростати і нові АБ, які будуть активні стосовно зазначених патогенів, користуватимуться попитом. Лінезолід має значущу протимікробну активність щодо широкого спектра грампозитивних патогенів, зокрема резистентних до метициліну й ванкоміцину.
Лінезолід доступний для внутрішньовенного і перорального застосування і характеризується високою біодоступністю. Він демонструє високий рівень проникнення в легені, а також у шкіру та її структури і не потребує корекції дози за наявності печінкової або ниркової дисфункції. У лінезоліду, який зазвичай добре переноситься, є один несприятливий ефект, що корелює з тривалістю застосування, – це зворотна тромбоцитопенія.
Лінезолід є неселективним інгібітором моноаміноксидази, тому слід проводити ретельне спостереження та моніторинг стану пацієнта у разі застосування лінезоліду одночасно з адренергічними або серотонінергічними препаратами.
Клінічні дослідження ефективності лінезоліду в лікуванні ІШМТ, інфекцій нижніх дихальних шляхів і ентерококових інфекцій, резистентних до ванкоміцину, показали, що лінезолід є дієвим терапевтичним агентом. Останні дані свідчать про те, що лінезолід за клінічною ефективністю може перевершувати ванкоміцин у лікуванні інфекцій, що спричинені MРЗС або іншими резистентними грампозитивними патогенними мікроорганізмами. У подальшому це підтверджено у ході низки оглядових статей та метааналізів [10, 12, 17, 22].
У лінезоліду відсутня клінічно значуща дія на більшість грамнегативних бактерій. Pseudomonas spp. і ентеробактерії нечутливі до препарату. In vitro він активний стосовно пастерел, фузобактерій, легіонел, бордетел і помірно активний до Moraxella catarrhalis. Спектр активності лінезоліду подібний до такого глікопептидного АБ ванкоміцину, який входить до стандарту лікування інфекцій, спричинених MРЗС, і ці препарати часто стають об’єктами порівняння в дослідженнях.
До інших подібних АБ належать тейкопланін, хінупристин-дальфопристин (поєднання двох стрептограмінів, неактивних до ентерококів) і даптоміцин (ліпопептид), цефтобіпрол, далбаванцин і телаванцин. Із вищенаведеного тільки лінезолід застосовується перорально.
Отже, лінезолід має високу активність стосовно грампозитивних мікроорганізмів – стафілококів, ентерококів, пневмококів, стрептококів (групи А, В, С та S. viridans), анаеробних коків і клостридій. Грамнегативні аеробні мікроорганізми є природно стійкими до лінезоліду, за винятком Moraxella catarrhalis, Haemophilus influenzae, Bordetella pertussis, Legionella spp., до яких препарат виявляє помірну активність (мінімальна пригнічувальна концентрація – МПК90 ≥4-8 мкг/мл). Практичного значення набуває здатність препарату зберігати активність стосовно як метицилінрезистентних, так і метицилінчутливих штамів (за показниками МПК), хоча впродовж останніх двох років почали з’являтися повідомлення про виділення штамів стафілококів, стійких до лінезоліду.
Стабільну активність лінезолід виявляє стосовно E. faecalis, E. faecium та інших ентерококів (МПК90 1-4 мкг/мл). Важливою характеристикою препарату є збереження його активності стосовно резистентних до ванкоміцину штамів ентерококів навіть за наявності у їхніх різних фенотипах стійкості до глікопептидів (Van A і Van B). Лінезолід має подібну до ванкоміцину активність стосовно грампозитивних анаеробів – C. perfringens, C. difficile і пептострептококів. На відміну від ванкоміцину лінезолід впливає на грамнегативні анаеробні бактерії, такі як Bacteroides fragilis, Fusobacterim spp., Prevotella spp. [1, 6-9].
Механізм дії
Оксазолідинони є інгібіторами синтезу білка – вони зупиняють ріст і розмноження бактерій, порушуючи трансляцію білків у рибосомах (табл. 1). Хоча механізм дії лінезоліду повністю ще не з’ясований, АБ імовірно діє на першому етапі синтезу білків – ініціації, на відміну від інших інгібіторів синтезу білків, які перешкоджають елонгації. Препарат здійснює це завдяки запобіганню утворенню ініціюючого комплексу, що складається з 30S- і 50S-субодиниць рибосоми, тРНК і мРНК.
Лінезолід зв’язується з 23S частиною 50S-субодиниці (центр дії пептиділ-трансферази), поруч із ділянкою зв’язування хлорамфеніколу, лінкоміцину та інших АБ. Враховуючи цей унікальний механізм дії, перехресна резистентність між лінезолідом та іншими інгібіторами синтезу білка виникає дуже рідко або взагалі відсутня. Лінезолід є інгібітором монооаміноксідази, тому може посилювати дію дофаміну, адреналіну й серотоніну. У разі одночасного прийому можливе підвищення пресорної відповіді на допамінергічні, вазопресорні або симпатоміметичні препарати, що потребує зниження дози.
Отже, найперспективнішою групою АБ є група, що впливає на 50S-субодиницю рибосом, а точніше, на одну або кілька критичних ділянок, від яких залежить трансляція. Незворотність зв’язування з цими ділянками, а також одночасне зв’язування з декількома з них збільшують надійність антимікробної терапії. Тому оксазолідінони й інші класи середників із подібним впливом на бактерії характеризуються багаторівневим механізмом дії на процеси синтезу білка в мікробних клітинах.
Фармакокінетика
Спочатку зазначимо низку найбільш значущих характеристик препарату:
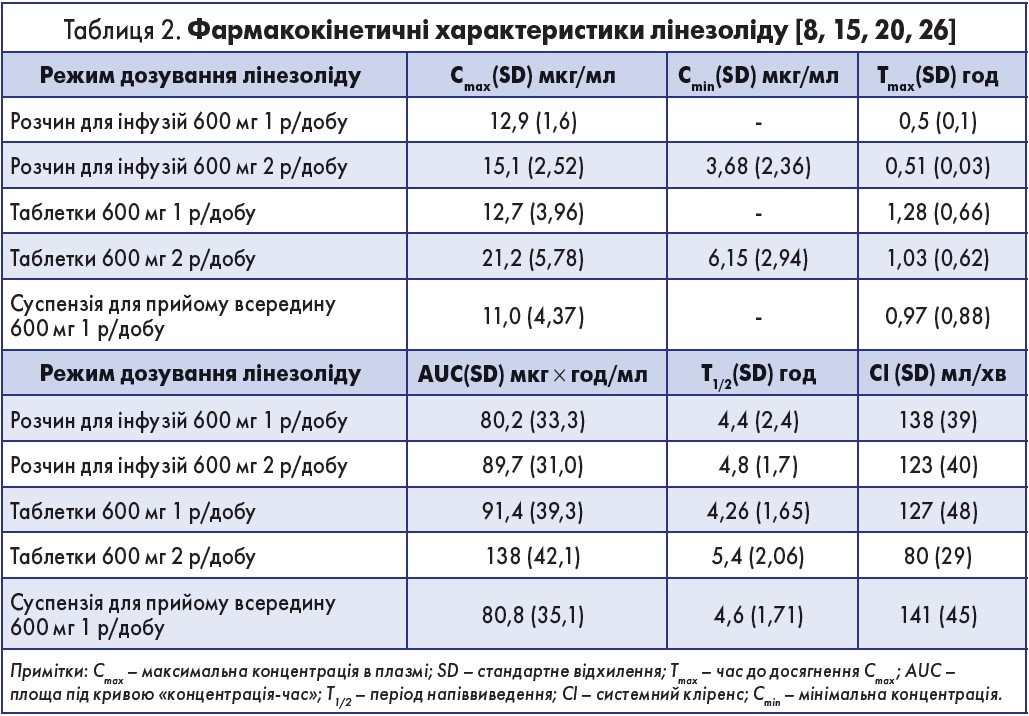
- після прийому всередину лінезолід швидко й інтенсивно всмоктується з шлунково-кишкового тракту (ШКТ);
- Cmax у плазмі крові досягається через 1-2 год;
- майже 100% біодоступність, що дозволяє проводити секвенційну терапію;
- проникність у тканини не залежить від порушення тканинного кровопостачання, що дає змогу з високою ефективністю застосовувати цей АБ у пацієнтів з порушеннями периферичного кровообігу (діабетична стопа, облітеруючий атеросклероз) [8, 15].
Крім цього у разі прийому лінезоліду з їжею можливе незначне зниження його абсорбції. Лінезолід також має низьку здатність до зв’язування з білками плазми (близько 31%), він добре розподіляється по всіх тканинах організму, крім кісткового матриксу й білої жирової тканини. Важливим є те, що концентрація лінезоліду в бронхіальній рідині, середостінні не менша, а часто й вища, ніж у сироватці крові, чим пояснюється висока ефективність препарату в лікуванні пневмонії, медіастинітів, плевритів.
Концентрація лінезоліду в спинномозковій рідині варіює, в останній максимальна концентрація нижча за таку в сироватці крові через повільну дифузію крізь гематоенцефалічний бар’єр. Середній період напіврозпаду становить 3 год у дітей, 4 год у підлітків і 5 год у дорослих. Лінезолід метаболізується в печінці шляхом окислення морфолінового кільця без участі системи цитохрому Р450. Кліренс лінезоліду залежить від віку й статі хворого – найшвидший він у дітей і, ймовірно, на 20% нижчий в жінок. Основні фармакокінетичні властивості лінезоліду наведено в таблиці 2.
Синергісти. Лінезолід + цефалоспорини. Лінезолід + фторхінолони. Антагоністи. Лінезолід + амфотерицин В.
- У боротьбі з поліасоційованою флорою, за наявності грамнегативних збудників, лінезолід допустимо використовувати в комбінації з цефалоспоринами III-IV поколінь або з фторхінолонами.
- Лінезолід у розчині для інфузій хімічно несумісний з такими препаратами: амфотерицин В, хлорпромазину гідрохлорид, діазепам, пентамідину ізотіонат, фенітоїн натрію, еритроміцину лактобіонат, триметоприм/сульфаметоксазол.
Рекомендовано такий режим дозування: 600 мг (перорально або внутрішньовенно) кожні 12 годин. Лінезолід можна застосовувати в режимі ступінчастої терапії з початковим призначенням парентерально, потім перорально (на 3-5-й день), що зумовлює його фармакоекономічні переваги як альтернативи ванкоміцину. Для лікування ІШМТ доза становить 400 мг кожні 12 годин. Доведена добра переносимість як перорального, так і внутрішньовенного методів застосування.
Основними показаннями до призначення лінезоліду є ІШМТ, а також пневмонія, у тому числі госпітальна; останнім часом усе частіше препарат використовують і в лікуванні інших захворювань. Нетривалий прийом всередину лінезоліду є відносно безпечним, препарат можна застосувавати в терапії хворих будь-якого віку та в пацієнтів із захворюваннями печінки або нирковою недостатністю.
Загальними побічними ефектами на тлі короткотривалого перорального прийому є головний біль, нудота та діарея. А ось прийом лінезоліду протягом довгого часу може спричинити появу серйозних небажаних явищ, наприклад пригнічення функції кісткового мозку і тромбоцитопенію, особливо у разі використання лінезоліду >2 тижнів. Триваліше застосування може супроводжуватися периферичною нейропатією (яка в деяких випадках стає незворотною), ураженням зорового нерва та лактатацидозом.
Причиною всіх цих ускладнень, ймовірно, є токсичне ураження мітохондрій. Препарат не має застосовуватися проти бактерій, чутливих до АБ з вужчим спектром дії, таких як пеніциліни і цефалоспорини. У літературі лінезолід іноді називають «резервний антибіотик», який треба застосовувати з обережністю як препарат «останньої інстанції» до потенційно нечутливих інфекцій.
У США затвердженими показаннями до використання лінезоліду є:
- ванкоміцинрезистентні ентерококові інфекції з/без бактеріємії;
- госпітальні й позагоспітальні пневмонії, спричинені пневмококом або золотистим стафілококом;
- ускладнені інфекції шкіри, спричинені чутливими бактеріями, у тому числі інфекції діабетичної стопи з остеомієлітом;
- неускладнені ІШМТ, спричинені Streptococcus pyogenes або золотистим стафілококом [7, 10, 14-18, 21]. Не рекомендується застосовувати лінезолід у терапії позагоспітальних пневмоній і неускладнених ІШМТ. Вважається, що лінезолід безпечний і ефективний для застосування у дітей і новонароджених.
Медіастиніт є доволі рідкісною локалізацією інфекції із залученням структур середостіння в патологічний процес внаслідок численних причин, які складають основу етіології, у тому числі перфорації стравоходу; поширення інфекцій з голови і шиї; запалення легень; наявність інфікованих лімфатичних вузлів; гнійно-септичних ускладнень після стернотомії.
АБ традиційно використовують для лікування медіастинітів, які спричинені MРЗС-інфекцією. Відомості про нові терапевтичні підходи в даній царині вельми скудні. Встановлено, що рівень проникнення АБ (наприклад, ванкоміцину) у простір середостіння є низьким, оскільки воно відокремлено від кровотоку.
Доведено, що пенетрація лінезоліду в тканини порівняно з ванкоміцином відбувається краще, а рівень проникнення в запальну рідину становить 104%, тому лінезолід може бути використаний як ефективний лікувальний агент у терапії медіастиніту. Y. Tsuji і співавт. (2013) дослідили фармакокінетичні особливості лінезоліду при медіастініті та рівень проникнення препарату в плевру. Отримані результати свідчать, що концентрація лінезоліду в середостінні й плевральній порожнині вища за таку в сироватці. Автори зазначили, що лінезолід легко переноситься з крові в середостіння і плевральну тканину. Результати цього дослідження продемонстрували, що застосування лінезоліду для лікування MРЗС-медіастиніту є обґрунтованим [20].
З огляду на те що частота вторинних інфекцій, спричинених резистентними до більшості стандартних АБ мікроорганізмами (такими як стафілокок), продовжує зростати, доцільним є проведення подальших досліджень у цьому напрямі. АБ, що використовуються в лікуванні інфекцій середостіння, зокрема лінезолід, слід вважати основою для подальшої розробки ефективних схем лікування медіастиніту, спричиненого MРЗС-інфекцією.
Одним з актуальних напрямів застосування оксазолідінонів є їхнє використання в лікуванні полірезистентних до більшості антибактеріальних агентів різних форм туберкульозу (ТБ) (Скрягина Е.М. і співавт., 2010).
У схеми протитуберкульозної хіміотерапії входять різні агенти, які поділяють на 5 основних груп:
- Протитуберкульозні препарати (ПТБП) 1-го ряду для прийому всередину.
- Ін’єкційні ПТБП.
- Фторхінолони.
- ПТБП 2-го ряду – мають бактеріостатичну дію і призначені для прийому всередину.
- ПТБП із неясною активністю. Інформація з безпеки, переносимості та ефективності ПТБП цієї групи є вкрай необхідною для покращення результатів лікування й контролю над поширенням полірезистентних форм ТБ, що характеризуються стійкістю, яка виходить за межі препаратів 1-го ряду.
Дослідження іn vitro і in vivo свідчать про те, що лінезолід може бути ефективним у лікуванні інфекцій, які спричинені мікобактеріями.
Однак досвід клінічного використання лінезоліду в терапії захворювань, спровокованих нетуберкульозними мікобактеріями, є недостатнім.
Так, 28 пацієнтів отримували лінезолід у дозі 600 мг/добу, 57-1200 мг/добу впродовж (M±sd) 222±249 (Me=93) днів. Середня тривалість введення лінезоліду склала 32 тижні. Тільки в 1 (3,6%; 95% ДІ 0,3-10,4) з 28 пацієнтів, які отримували лінезолід у дозі 600 мг/добу, виникли побічні ефекти протягом перших 8 тиж лікування. Перевагу лінезоліду достовірно було доведено тільки в групі хворих із полірезистентними формами ТБ, стійкими до більш як 7 ПТБП [3].
Отже, у ході дослідження показано, що застосування лінезоліду забезпечує кращі результати лікування в пацієнтів із полірезистентними формами ТБ. Водночас ефективність дози лінезоліду 600 мг/добу є зіставною з такою дози 1200 мг/добу, але з достовірно меншою кількістю побічних ефектів. Відомо, що тривале застосування лінезоліду пов’язано з частотою побічних ефектів (анемія, тромбоцитопенія, полінейропатія) і потребує постійного моніторингу в разі лікування протягом понад 8 тижнів.
Побічні ефекти
За умови застосування лінезоліду впродовж короткого періоду це відносно безпечний АБ. Його загальні побічні ефекти виникають в 1% осіб, і це діарея (3-11% учасників клінічних досліджень), головний біль (1-11%), нудота (3-10%), блювання (1-4%), висипання (2%), закрепи (2%), зміни в сприйнятті смаку (1-2%), зміни кольору язика (0,2-1%). Можливі грибкові інфекції (оральний або вагінальний кандидоз), оскільки лінезолід пригнічує бактеріальну флору в організмі і відкриває нішу для грибків.
Рідше спостерігаються (потенційно важчі) алергічні реакції, панкреатит, підвищення рівня трансаміназ, що може свідчити про ураження печінки. На відміну від деяких АБ, таких як еритроміцин і фторхінолони, лінезолід не впливає на інтервал QT на електрокардіограмі (ЕКГ). У дітей побічні ефекти подібні до таких у дорослих. Застосування лінезоліду (як, власне, й інших АБ) може призвести до появи Clostridium difficile-асоційованої діареї і псевдомембранозного коліту, хоча епізоди останнього виникають рідко, приблизно в 1 з 2 тис пацієнтів.
Тривале застосування
Лікування лінезолідом може призвести до пригнічення функції кісткового мозку, що найчастіше проявляється тромбоцитопенією. Вважається, що це єдина побічна дія, яка розвивається частіше на тлі застосування лінезоліду, аніж глікопептидів і β-лактамних АБ. Таке ускладнення рідко виникає у хворих, які приймали препарат впродовж 14 діб. Тривале застосування лінезоліду асоціюється з периферичною та оптичною невропатією, які найчастіше трапляються після кількох місяців лікування і можуть призводити до незворотних змін. Хоча механізм цих небажаних явищ поки що незрозумілий, найімовірнішою їх причиною вважається токсичне пошкодження мітохондрій [26].
Вплив тривалого лікування лінезолідом на флору кишки людини дослідили D.P. Kofteridis і співавт. (2009). Автори виявили, що через 6 міс лікування лінезолід призвів до пригнічення кишкової грампозитивної анаеробної флори в пацієнта, за виключенням найважливіших анаеробних грамнегативних бактерій (Bacteroides spp. та Prevotella spp.). Під час аналізу калу були виявлені підвищені концентрації грамнегативних мікроорганізмів: P. aeruginosa, K. pneumoniae, M. morganii, E. сoli, C. braakii, C. аlbicans. Хоча концентрація лінезоліду в калі була мінімальною, зміна кишкової флори може бути віднесена до спектра активності препарату і його тривалого застосування.
Через 6 тиж після припинення лікування дослідження культури в калі виявили нормалізацію флори з відсутністю більшості опортуністичних грамнегативних мікроорганізмів і зменшення концентрації кишкової палички і C. аlbicans.
Кишечник людини є природним середовищем багатьох видів бактерій. Приблизно 99,9% із них є анаеробами. Нормальна бактеріальна мікрофлора запобігає колонізації кишечника патогенними бактеріями. Антибіотикотерапія є основною причиною змін нормального стану флори в бік патогенних мікроорганізмів, таких як Pseudomonas spp., Klebsiella spp., Candida spp. або Clostridium spp. та інших видів патогенів.
Дані про концентрацію C. аlbicans у кишечнику після лікування лінезолідом зареєстровані в моделі на мишах. Поширення цих організмів може спровокувати виникнення тяжких системних інфекцій, передусім у пацієнтів з ослабленим імунітетом, і проявляється проносами внаслідок зміни нормальної мікрофлори кишечника під час або після лікування.
Автори зазначили, що це перший випадок дослідження впливу тривалого щоденного лікування лінезолідом на флору кишечника людини, який довів заміну нормальних організмів на грамнегативні патогени і підвищення концентрації Candida spp. Однак, з погляду переносимості, лінезолід показує сприятливий профіль безпеки. Найпоширенішими побічними ефектами є анемія і тромбоцитопенія, і перш за все – на тлі тривалого лікування лінезолідом тяжких форм інфекції кісток і суглобів [11].
Застосування в різних групах пацієнтів
Дорослим і дітям >12 років лінезолід призначається кожні 12 год перорально або внутрішньовенно. Дітям молодшого віку або немовлятам – кожні 8 годин. Для хворих похилого віку, пацієнтів із легкою або помірною печінковою недостатністю або з порушенням функції нирок точного дозування лінезоліду поки що не встановлено. Хворі на гемодіалізі мусять отримувати препарат після процедури, тому що під час її проведення з організму видаляється 30-40% дози препарату.
Поки що не існує остаточних рекомендацій стосовно дози в пацієнтів, що знаходяться на постійній гемофільтрації, хоча для них може бути виправдано більш часте введення препарату. Лінезолід у США має для вагітних клас доказів C, тобто достатньої кількості досліджень безпеки його застосування у вагітних жінок немає. Незважаючи на те що дослідження на тваринах виявили помірну токсичність для плода, переваги використання препарату можуть перевищувати ризик. Лінезолід проникає в грудне молоко, однак клінічне значення цього факту не з’ясоване [1, 8, 14, 22].
Резистентність
Про випадки набутої стійкості до лінезоліду повідомлялося ще в 1999 році, це були два випадки множинної стійкості до АБ у пацієнтів із тяжкою інфекцією Enterococcus faecium. Резистентний до лінезоліду Staphylococcus aureus вперше був виявлений 2001 року. З 2004 року нечутливість до лінезоліду моніторується в США у рамках загальнонаціональної програми і залишається відтоді стабільною й доволі низькою.
Подібна міжнародна програма діє з 2002 року в країнах Європи. Загальна стійкість до лінезоліду становила 0,2% і не спостерігалася серед стрептококів. Нечутливість була виявлена тільки в Бразилії, Китаї, Ірландії та Італії й тільки серед ентерококів і частини штамів коагулазонегативних і золотистих стафілококів. У грампозитивних бактерій найчастіше розвивається стійкість до препарату після точкової мутації, відомої як G2576T, у результаті якої гуанін заміщується тиміном в алелі 2576 генів, що кодують 23S рибосомальну рибонуклеїнову кислоту (рРНК).
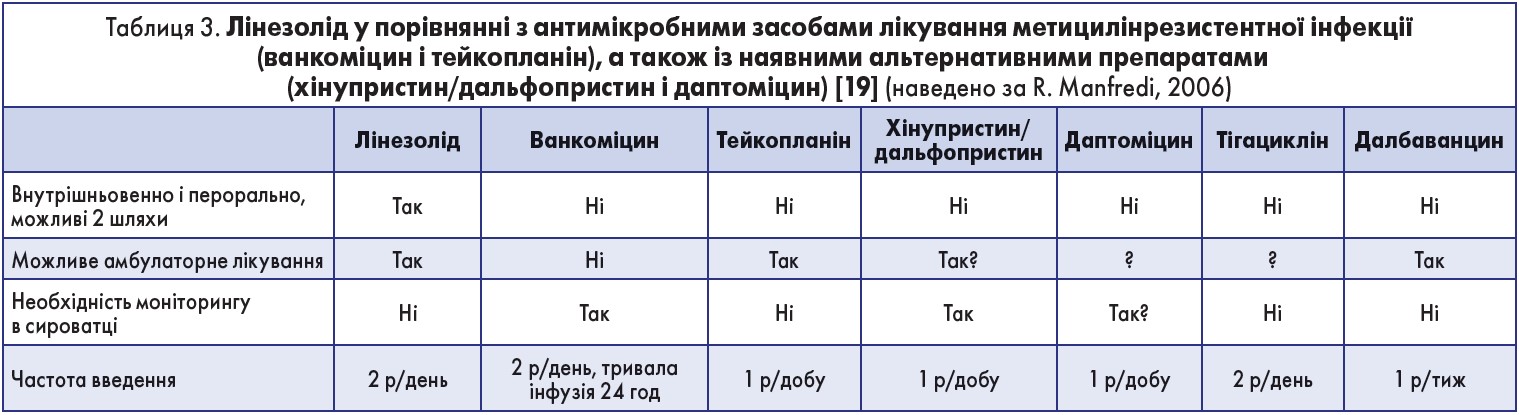
Це найчастіший механізм формування нечутливості до лінезоліду в стафілококів. Інші механізми були виявлені в пневмококів (у тому числі мутації в РНК-метилтрансферазі, яка метилює G2445 із 23S рРНК, і мутації, що призводять до підвищення експресії гену транспортеру АВС), а також в епідермального стафілокока [1, 7, 9, 15, 16]. Переваги лінезоліду в лікуванні метицилінрезистентної інфекції стосовно альтернативних препаратів наведено в таблиці 3.
Дані про антибіотикорезистентність клінічних штамів золотистого стафілокока в Україні наведені в роботі А.Г. Салманова і співавт. (2011). Усього було проведено 361 683 дослідження чутливості 24 284 клінічних штамів S. aureus до 37 АБ. У ході аналізу результатів було показано, що 28,5±0,08% штамів S. aureus виявилися резистентними до тестованих АБ. Стосовно оксазолідинонів було здійснено 4997 досліджень, виявлено 556 резистентних штамів.
Представник оксозолідинонів – лінезолід серед досліджуваних АБ виявив найбільшу антимікробну активність стосовно S. aureus, нечутливими до нього виявилися лише 11,1±0,44% штамів. Аналіз результатів антибіотикорезистентності засвідчив, що в стаціонарах України у 2010 р. найактивнішими до клінічних штамів S. aureus були лінезолід, нетилміцин, меропенем, ванкоміцин, іміпенем і цефтріаксон. Резистентність нозокоміальних штамів S. aureus у стаціонарах становить серйозну терапевтичну та епідеміологічну проблему. Частота виділення метицилінрезистентних штамів S. aureus у хірургічних стаціонарах України становить 37,4% [5].
З-поміж резистентних грампозитивних мікроорганізмів найактуальнішими є стафілококи, нечутливі до метициліну й оксациліну (МРЗС, ОРЗС). MРЗС мають найбільше клінічне значення в якості збудників багатьох нозокоміальних інфекцій. MРЗС традиційно дуже поширені в стаціонарах, особливо в деяких реанімаційних відділеннях, відділеннях термічної травми, гнійної і кардіохірургії, де їх частота зазвичай перевищує 50% серед усіх стафілококів.
Клініцистам необхідно пам’ятати, що MРЗС стійкі не тільки до метициліну та інших β-лактамів, а й до більшості інших груп антибактеріальних препаратів, тобто вони є полірезистентними бактеріями. Стосовно MРЗС виявляють активність глікопептиди (ванкоміцин, тейкопланін, телаванцин), оксазолідинони (лінезолід, тедизолід), ліпопептиди (даптоміцин), гліцилцикліни (тігациклін) і, частково, – триметоприм/сульфаметоксазол, фузидієва кислота [6].
Традиційно для лікування MРЗС-інфекцій різної локалізації використовують ванкоміцин. Однак останні 10 років ефективність ванкоміцину істотно знизилася, оскільки широкого поширення набули штами MРЗ зі зниженою чутливістю до ванкоміцину (МПК 1,5-2 мкг/мл) і проміжною стійкістю – VISA (МПК 4-8 мкг/мл). Доведено, що зі збільшенням МПК ванкоміцину з 1 до 2 мкг/мл (у діапазоні мікробіологічної чутливості MРЗС) клінічна ефективність ванкоміцину в лікуванні MРЗС-інфекцій знижується в 2 рази і ризик смерті, зокрема за наявності ангіогенних інфекцій, достовірно збільшується.
Рівень подібних штамів MРЗС із МПК 2 мкг/мл сягає 30%. Таким чином, ванкоміцин не може розглядатися як оптимальний АБ для терапії пацієнтів із тяжкою MРЗС-інфекцією. Крім цього ванкоміцин характеризується поганим проникненням у тканини, де не завжди створюються достатні терапевтичні концентрації [20].
У процесі рандомізованих досліджень доведено достовірно вищу ефективність лінезоліду порівняно з ванкоміцином у лікуванні нозокоміальної пневмонії, у тому числі асоційованої зі штучною вентиляцією легень, і некротичних ІШМТ. Чинниками, які незначуще лімітують застосування лінезоліду, є: високий ризик лікарських взаємодій; токсичний вплив на функцію кістково-мозкового кровотворення з розвитком тромбоцитопенії і лейкопенії, а також поява в останні 5-7 років стафілококів, стійких до лінезоліду [6, 7].
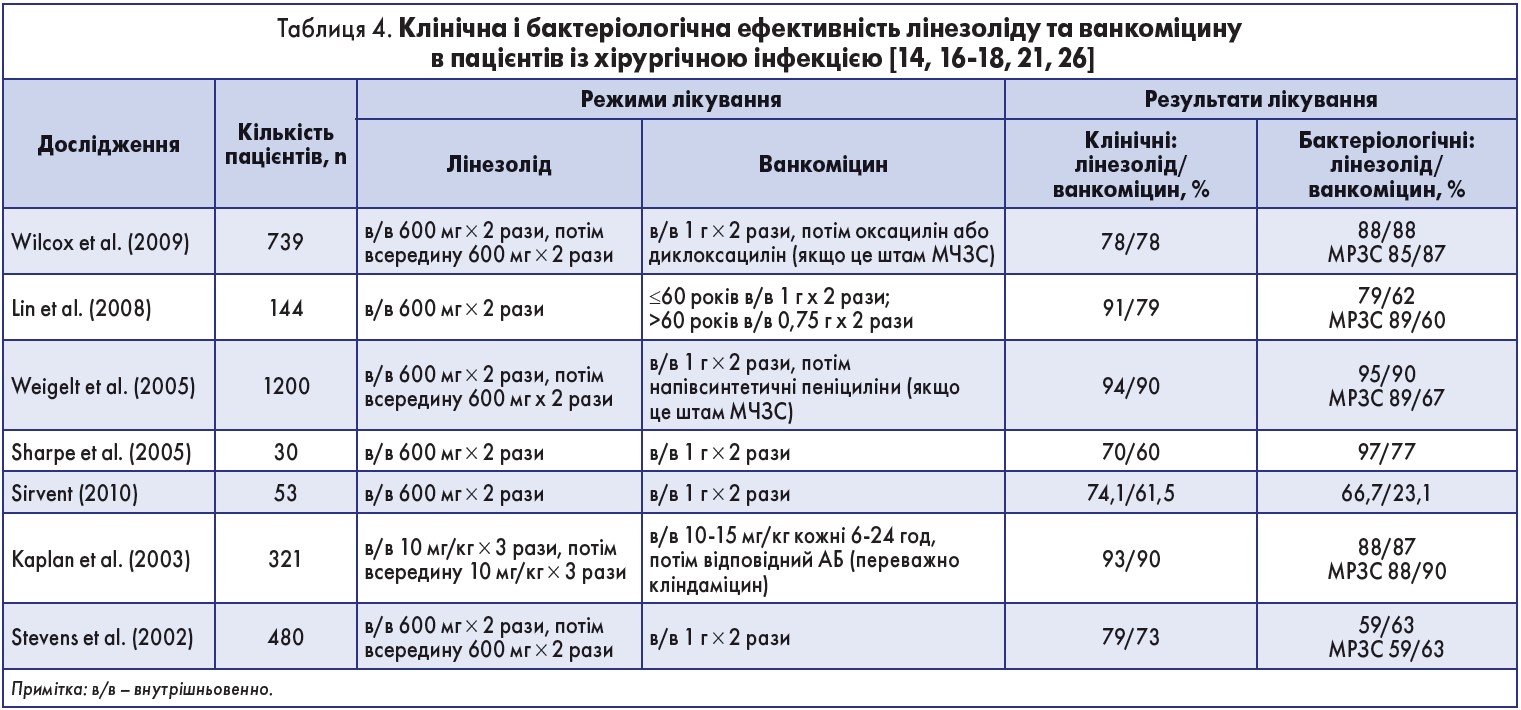
З огляду на зазначені властивості лінезоліду, сьогодні більшість дослідників в якості стандарту лікування хірургічної інфекції рекомендують саме цей препарат, клінічна й бактеріологічна активність якого зіставна з такою ванкоміцину [9, 10, 16-18, 21]. Результати порівняння лінезоліду та ванкоміцину наведені в таблиці 4.
Загалом лінезолід за ефективністю стосовно грампозитивної інфекції не поступається ванкоміцину, однак має перевагу в лікуванні інфекцій, спричинених резистентними штамами бактерій, а в разі ускладнених форм ІШМТ (некротизуючі фасціїти, діабетична стопа) суттєво зменшує кількість ампутацій і летальних вислідів.
Для оцінки ефективності й безпеки лінезоліду порівняно з глікопептидами (ванкоміцин і тейкопланін) для лікування інфекцій, спричинених золотистим стафілококом, J. Fu. і співавт. (2013) провели метааналіз відповідних рандомізованих контрольованих досліджень.
Застосували ретельний пошук Pubmed та інші бази даних для аналізу (13 досліджень, залучено 3863 клінічно оцінені пацієнти). Лінезолід виявився результативнішим за глікопептиди (співвідношення ризиків (СР) 1,05; 95% ДІ 1,01-1,10), виявив вищу за останні клінічну (СР 1,38; 95% ДІ 1,17-1,64) і мікробіологічну (СР 1,38; 95% ДІ 1,15-1,65) ефективність.
Лінезолід асоціювався з кращими результатами лікування пацієнтів з ІШМТ (СР 1,61; 95% ДІ 1,22-2,12), нижче – у разі бактеріємії (СР 1,24; 95% ДІ 0,78-1,97) і пневмонії (СР 1,25; 95% ДІ 0,97-1,60). Не виявлено різниці в показниках смертності між лінезолідом і глікопептидами (СР 0,98; 95% ДІ 0,83-1,15). Доведено, що застосування лінезоліду корелює з гематологічними (СР 2,23; 95% ДІ 1,07-4,65) і шлунково-кишковими розладами (СР 2,34; 95% ДІ 1,53-3,59), значно менше – з побічними проявами на шкірі (СР 0,27; 95% ДІ 0,16-0,46) і явищами нефротоксичності (СР 0,45; 95% ДІ 0,28-0,72).
На основі аналізу отриманих результатів рандомізованих контрольованих досліджень є підстави вважати лінезолід кращим, аніж глікопептиди, вибором у лікуванні пацієнтів з інфекціями, спричиненими золотистим стафілококом, передусім у хворих з ІШМТ [23]. Проте, коли лікарі вважають за краще використовувати лінезолід, слід ураховувати ризик гематологічних проявів і розлади з боку ШКТ відповідно до характеристик конкретних груп пацієнтів.
Рівень смертності й витрати на лікування ІШМТ є достатньо високими. На сучасному етапі лінезолід і ванкоміцин залишаються АБ вибору в лікуванні заавансованих форм ІШМТ. Особливо це стосується інфекції, спричиненої штамами MРЗС. J. Yue. і співавт. (2016) проаналізували результати 9 контрольованих рандомізованих досліджень (3144 учасники).
Автори зазначали, що лінезолід асоціюється зі значно кращими клінічними (СР 1,09; 95% ДІ 1,03-1,16) і мікробіологічними результатами лікування в дорослих (СР 1,08; 95% ДІ 1,01-1,16). Не встановлено значущих відмінностей показників смертності в групах лінезоліду і ванкоміцину (СР 1,44; 95% ДІ 0,75-2,80).
Зазначено менше випадків синдрому «червоної людини» (СР 0,04; 95% ДІ 0,01-0,29), свербіжу шкіри (СР 0,36; 95% ДІ 0,17-0,75) і висипок на ній (СР 0,27; 95% ДІ 0,12-0,58) у групі лінезоліду порівняно з ванкоміцином. Однак більше випадків тромбоцитопенії (СР 13,06; 95% ДІ 1,72-99,22) і нудоти (СР 2,45; 95% ДІ 1,52-3,94) виявили в групі лінезоліду.
Згідно з аналізом тривалість перебування в стаціонарі була коротшою в учасників із групи лінезоліду, ніж у пацієнтів, які отримували ванкоміцин. Добова вартість терапії була меншою при пероральному застосуванні лінезоліду, ніж при внутрішньовенному введенні ванкоміцину. Незважаючи на те що стаціонарне лікування в день лінезолідом виявилося вищим за таке ванкоміцином, середня тривалість перебування в стаціонарі була в першому випадку на три дні коротшою.
Отже, загальні лікарняні витрати на 1 пацієнта виявилися меншими в разі лікування лінезолідом проти застосування ванкоміцину. Висновки авторів: лінезолід ефективніший за ванкоміцин у лікуванні ІШМТ, у тому числі інфекцій, спричинених MРЗС [12].
У деяких країнах із різними моделями системи охорони здоров’я були проведені дослідження економічної ефективності лінезоліду порівняно з глікопептидами (ванкоміцином і тейкопланіном). У більшості країн лінезолід виявив більшу рентабельність стосовно інших АБ у терапії госпітальної пневмонії та ІШМТ завдяки як ефективнішому лікуванню й зменшенню смертності, так і зниженню загальних витрат на лікування.
Ще одним представником групи оксазолідинонів (після лінезоліду) є тедізолід, який було схвалено FDA 20 червня 2014 року для лікування інфекцій шкіри, спричинених метицилінрезистентним стафілококом. До тедізоліду чутливі й інші грампозитивні бактерії, у тому числі метицилінчутливі стафілококи, Streptococcus pyogenes, Streptococcus agalactiae, ентерококи, коагулазонегативні стафілококи та стафілококи, нечутливі до лінезоліду. Тедізолід – оксазолідинон ІІ покоління потенційно в декілька разів активніший за лінезолід до метицилінрезистентних стафілококів. Препарат випускається у вигляді проліків – тедізоліду фосфату, який в організмі під дією ферментів плазми крові перетворюється в активний препарат – тедізолід. Як і в інших препаратів із групи оксазолідинонів, механізм дії тедізоліду полягає в порушенні синтезу білка в клітинах бактерій завдяки зупинці трансляції білків у рибосомах.
Р. Prokocimer і співавт. (2013), а згодом G.J. Moran і співавт. (2014) здійснили рандомізоване подвійне сліпе дослідження, в якому порівнювались ефективність і безпека лікування ІШМТ препаратами сімейства оксазолідинонів. До випробування залучили 666 пацієнтів і розподілили їх на 2 групи. 1-ша група (n=332) отримувала тедізолід у дозі по 200 мг 1 раз на добу (спочатку внутрішньовенно, а згодом перорально) впродовж 6 днів.
Учасники 2-ї групи (n=334) отримували лінезолід по 600 мг 2 рази на добу за вищезазначеною схемою впродовж 10 днів. Виявилося, що ранній клінічний ефект досягнуто у 283 (85%) пацієнтів із групи тедізоліду і у 276 (83%) – з групи лінезоліду (СР 2,6%; 95% ДІ від -3,0 до 8,2). Частота побічних ефектів із боку ШКТ була нижчою в групі тедізоліду порівняно з групою лінезоліду і становила, відповідно, 52 (16%) випадки з 331 пацієнта 1-ї групи і 67 (20%) випадків із 327 хворих 2-ї групи дослідження. Негативні ефекти, що призвели до припинення застосування препарату, були зареєстровані в 1 (<1%) пацієнта в групі тедізоліду і в 4 (1%) хворих у групі лінезоліду.
Автори дійшли висновку, що внутрішньовенне, а згодом пероральне застосування 1 раз на добу тедізоліду в дозі 200 мг впродовж 6 днів не поступається за рівнем результативності дворазовій добовій дозі в 600 мг лінезоліду тривалістю 10 днів для лікування хворих з гострою бактеріальною ІШМТ. Тедізолід згодом може стати альтернативним варіантом для лікування гострих бактеріальних інфекцій в лікарнях і амбулаторних умовах [24, 25].
З переліку переваг тедізоліду необхідно виділити такі:
- Тедізолід має вищу, порівняно з лінезолідом, природну активність проти MРЗС (МПК90 0,25 і 2 мкг/мл відповідно), а також проти оксацилінчутливих стафілококів (МПК90 0,5 і 2 мкг/мл відповідно), S. pyogenes і E. faecalis (0,5 і 2 мкг/мл відповідно), ванкоміцинрезистентних E. faecium (0,5 і 2 мкг/мл відповідно).
- Тедізолід проявляє активність стосовно більшості штамів MРЗС, стійких до лінезоліду, потенціал розвитку резистентності до тедізоліду в 16 разів нижчий за такий до лінезоліду.
- Відсутність лікарських взаємодій (зокрема, з пресорними амінами), характерних для лінезоліду.
- Пролонгована фармакокінетика дає можливість застосовувати тедізолід 1 раз на добу.
- Тедізолід не пригнічує функцію кісткового мозку і краще переноситься, частота небажаних явищ з боку ШКТ і тромбоцитопенія є меншими.
На підставі проведених подвійних сліпих досліджень ESTABLISH‑1 і -2 у хворих з ускладненими ІШМТ було доведено, що тедізолід у дозі 200 мг на добу впродовж 6 днів не поступається за клінічною та бактеріологічною ефективністю лінезоліду в дозі 1200 мг на добу впродовж 10 днів. Отже, в арсеналі клініцистів з’явився ще один оксазолідинон для лікування тяжких форм ІШМТ [24, 25].
За своєю ефективністю стосовно грампозитивної інфекції оксазолідинони не поступаються глікопептидам, однак мають перевагу в лікуванні інфекцій, спричинених резистентними штамами бактерій, а у випадку ускладнених форм інфекції (інфекція діабетичної стопи, медіастиніти, полірезистентні форми ТБ) значуще зменшують кількість ускладнень і летальних вислідів. Не менш важливим є й економічний аспект. Так, Лінезолідин виробництва корпорації «Артеріум» має кращі показники за економічними витратами впродовж лікування.
Висновки
- Лікування хірургічної інфекції становить серйозну проблему сучасної світової медицини з огляду на глобальне зростання резистентності грампозитивної флори до традиційних АБ, зокрема метицилінрезистентних штамів стафілококів.
- У контексті сучасних епідеміологічних та етіологічних особливостей інфекції до протоколів її лікування доцільно залучати препарати з вираженою активністю проти MРЗС, зокрема оксазолідинони.
- Оксазолідинони характеризуються високою активністю стосовно штамів, стійких до глікопептидів, можливістю проведення секвенційної терапії (внутрішньовенно і перорально), кращими фармакокінетичними властивостями, низьким відсотком небажаних явищ та побічних реакцій. Фармакоекономічний ефект секвенційної терапії оксазолідинонами дозволяє рекомендувати їх для широкого застосування в лікуванні хірургічної інфекції.
Література
1. Буданов С.В. Линезолид – новый антибактериальный препарат группы оксазолидинов: значение в контроле распространения и при лечении множественноустойчивой грамположительной инфекции / С.В. Буданов, Л.Б. Смирнова // Антибиотики и химиотерапия. –2002 . – Т. 47. –
№ 7. – С. 38-42.
2. Иванов Д.Д. Шестая Международная конференция по макролидам, азалидам, стрептограминам, кетолидам и оксазолидонам. 23-25 января 2002 г., Болонья, Италия / Д.Д. Иванов, С.П. Ломоносов // Український медичний часопис. – 2002. – № 1 (27). – C. 5-9.
3. Использование линезолида в лечении множественно лекарственно-устойчивого туберкулеза / /Е.М. Скрягина, М.И. Дюсьмикеева, А.Е. Скрягин и др. // Рецепт. – 2010. – № 6. – С. 72-78.
4. Калюжная Л.Д. Ретапамулин – первый представитель отдельного класса топических антибиотиков: возможности и перспективы в дерматологии / Л.Д. Калюжная, А.В. Горбенко // Український журнал дерматології, венерології, косметології. – 2012. – № 3 (46). – C. 42-47.
5. Салманов А.Г. Антибіотикорезистентність клінічних штамів Saphylococcus aureus у хірургічних стаціонарах України в 2010 році / А.Г. Салманов, В.В. Лазоришинець, В.Ф. Марієвський // Хірургія України. – 2011. – № 3. – С. 26-31.
6. Яковлев С.В. Оптимизация использования антибиотиков для лечения грамположительных инфекций: фокус на оксазолидиноны / С.В. Яковлев // Современные проблемы и перспективы антимикробной терапии: Тезисы докладов и научных работ XVIII Российской конференции с международным участием. – Москва, 17-18 ноября 2016 г. – C. 12-13.
7. Яковлев С.В. Линезолид: новые возможности терапии инфекций, вызванных полирезистентными грамположительными микроорганизмами / С.В. Яковлев, Д.Н. Проценко // Инфекции и антимикробная терапия. – 2004. – Т. 6. – № 2. – С. 61-68.
8. Dryden M.S. Linezolid pharmacokinetics and pharmacodynamics in clinical treatment / M.S. Dryden // J Antimicrob Chemother. – 2011; 66(4):7-15.
9. Efficacy and safety of linezolid versus vancomycin for the treatment of complicated skin and soft-tissue infections proven to be caused by methicillin-resistant Staphylococcus aureus / K.M.F. Itani, M.S. Dryden, H. Bhattacharyya et al. // Am. J Surg. – 2010; 1996):804-816.
10. Efficacy and safety of tigecycline compared with vancomycin or linezolid for treatment of serious infections with methicillin-resistant Staphylococcus aureus or vancomycin-resistant enterococci: a Phase 3, multicentre, double-blind, randomized study / I. Florescu1, M. Beuran, R. Dimov et al. // J Antimicrob. Chemother. – 2008; 62(1):17-28.
11. Impact of prolonged treatment with linezolid on the human gut flora / D.P. Kofteridis, P. Malliotakis, S. Maraki et al. // Internat. J Infect. Dis. – 2009; 13(5):313-315.
12. Linezolid versus vancomycin for skin and soft tissue infections / J. Yue, B.R. Dong, M. Yang et al. // Cochrane Database Syst. Rev. –2016; (1): CD008056. doi: 10.1002/14651858.
13. Linezolid in the treatment of antibiotic-resistant gram-positive infections of the musculoskeletal system / D. Jahoda, O. Nyc, D. Pokornу et al. // Acta Chir. Orthop. Traumatol. Cech. –2006; 73(5):329-33.
14. Linezolid more efficacious than vancomycin to eradicate infecting organism in critically ill patients with Gram-positive infections / J.-M. Sirvent, L. Pineiro, M. de la Torre et al. // Rev. Esp. Quimioter. – 2010; 23(1):27-35.
15. Linezolid tissue penetration and serum activity against strains of methicillin-resistant Staphylococcus aureus with reduced vancomycin susceptibility in diabetic patients with foot infections / G.E. Stein, S. Schooley, C.A. Peloquin et al. // J Antimicrob. Chemother. – 2007; 60P: 819-823.
16. Linezolid versus Vancomycin for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections /D.L. Stevens, D. Herr, H. Lampiris et al. // Clin. Infect. Dis. – 2002; 34:1481-90.
17. Linezolid versus vancomycin for the treatment of Gram-positive bacterial infections: meta-analysis of randomised controlled trials / Liang Beibei, Cai Yun, Chen Mengli et al. // Internat. J Antimicrob. Agents. – 2010; 35:3-12.
18. Linezolid versus Vancomycin in Treatment of Complicated Skin and Soft Tissue Infections / J. Weigelt, K. Itani, D. Stevens et al. // Antimicrob. Agents Chemother. – 2005; 49(6):2260-2266.
19. Manfredi R. Update on the appropriate use of linezolid in clinical practice / R. Manfredi // Therap. Clin. Risk Manag. – 2006; 2(4): 455-464.
20. Pharmacokinetics of linezolid in the mediastinum and pleural space / Y. Tsuji, W. Hashimoto, Sh. Taniguchi et al. // Internat. J Infect. Dis. –2013; 17(11):1060-1061.
21. Sharpe J.N. Clinical and economic outcomes of oral linezolid versus intravenous vancomycin in the treatment of MRSA-complicated, lower-extremity skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus / J.N. Sharpe, E.H. Shively, H.C. Polk Jr. // Amer. J Surg. – 2005; 189:425-428.
22. Stevens D.L. A review of linezolid: the first oxazolidinone antibiotic / D.L. Stevens, B. Dotter, K. Madaras-Kelly // Expert. Rev. Anti Infect. Ther. – 2004; 2(1):51-9.
23. The efficacy and safety of linezolid and glycopeptides in the treatment of Staphylococcus aureus infections / J. Fu, X. Ye, C. Chen et al. // PLoS One. – 2013; 8(3): e58240.doi: 10.1371 /journal. pone.0058240.
24. Tedizolid phosphate vs linezolid for treatment of acute bacterial skin and skin structure infections: the ESTABLISH‑1 randomized trial / P. Prokocimer, C. De Anda et al. // JAMA. –2013; 309(6):559-69.
25. Tedizolid for 6 days versus linezolid for 10 days for acute bacterial skin and skin-structure infections (ESTABLISH‑2): a randomised, double-blind, phase 3, non-inferiority trial / G.J. Moran, E. Fang, G.R. Corey et al. // Lancet. – 2014; 8(14):696-705.
26. Usefulness of monitoring linezolid trough serum concentration in prolonged treatments / R. Sousa, R. Lоpez, J.C. Martіnez-Pastor et.al // Rev. Esp. Quimioter. – 2011; 24(3):151-3.
УДК: 617-022:576.851.252]-085.33.001.36
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 2 (32), травень 2018 р.
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...