Функциональные нарушения желудочно-кишечного тракта у детей раннего возраста
 В настоящее время среди детского населения очень часто выявляют функциональные расстройства органов пищеварения. В частности, по данным многочисленных исследований установлено, что по меньшей мере от 20 до 45% детей имеют хронические симптомы, связанные с нарушением гастродуоденальной функции. При этом у большинства из них не отмечается каких-либо структурных изменений со стороны желудочно-кишечного тракта [1-4].
В настоящее время среди детского населения очень часто выявляют функциональные расстройства органов пищеварения. В частности, по данным многочисленных исследований установлено, что по меньшей мере от 20 до 45% детей имеют хронические симптомы, связанные с нарушением гастродуоденальной функции. При этом у большинства из них не отмечается каких-либо структурных изменений со стороны желудочно-кишечного тракта [1-4].
В Римских критериях IV после обсуждений и согласований было принято конструктивное, научно обоснованное рабочее определение: нарушения цереброинтестинального взаимодействия (ранее – функциональные нарушения желудочно-кишечного тракта) являются нарушениями взаимодействия между кишечником и головным мозгом [5].
Это понятие объединяет группу заболеваний, классифицированных по симптомам со стороны желудочно-кишечного тракта, которые, в свою очередь, являются произвольной комбинацией следующих функций: моторика; висцеральная гиперчувствительность; состояние слизистой оболочки и иммунных функций желудочно-кишечного тракта (ЖКТ); состояние кишечной микрофлоры; нарушение деятельности центральной нервной системы [1-6]. Следовательно, новая система классификации не только упорядочила обсуждаемые нарушения, но и предполагает эффективность лечения на основе биопсихосоциального подхода, учитывающего изменчивость и сложность симптомов у пациентов этой группы.
В основе функциональных расстройств органов пищеварения, как было установлено во многочисленных исследованиях, лежит нарушение микроэкологии ЖКТ. В настоящее время нормальная микрофлора рассматривается как качественное и количественное соотношение популяций микробов отдельных органов и систем, поддерживающих биохимическое, метаболическое и иммунологическое равновесие организма-хозяина, необходимое для сохранения здоровья. Нормальная микрофлора включает более 500 разнообразных видов микроорганизмов с общим численным составом более 1011-1013 клеток. Это составляет около 95% общего количества клеток человеческого организма, находящихся во взаимодействии друг с другом [7, 8].
Особенно важное значение имеет ЖКТ, который содержит целый ряд комменсальных микробов, действующих как отдельная экосистема. Желудочно-кишечную микрофлору можно рассматривать как отдельный орган в органе, способствующий пищеварению хозяина, регуляции развития кишечного ангиогенеза, защите от патогенов и развитию иммунного ответа [7].
Нормальная микрофлора выполняет ряд важных функций, обеспечивающих колонизационную резистентность, антитоксическое действие, поддержание оптимального уровня метаболических и ферментативных процессов, иммунного статуса, антимутагенной и антиканцерогенной активности [7].
В последние годы пробиотические препараты все чаще стали применяться в комплексной терапии ряда патологических состояний на фоне нарушений микрофлоры организма человека. Если в 1954 году база данных РubMed по ключевому слову «probiotics» содержала только 2 публикации, то по стоянию на 20 июля 2018 года – 18 777 публикаций.
И.И. Мечников после проведения исследований первым в мире оценил важность открытия болгарского студента Стамена Григорова, показавшего положительное значение для организма болгарской молочнокислой палочки (Lactobacillus delbrueckii subsp. bulgaricus). Еще в 1905 году И.И. Мечников как директор Института Пастера пригласил молодого ученого в Париж, чтобы он прочел лекцию о своем открытии перед светилами микробиологии того времени. И.И. Мечников лично повторил исследования Стамена Григорова, чтобы убедиться в их состоятельности [9].
В 1908 году, в годовщину французской академии наук, он опубликовал статью «Несколько слов о кислом молоке» [10]. Исследуя вопросы старения и собрав данные по 36 странам, И.И. Мечников установил, что самое большое количество «столетников» в Болгарии – 4 на 1000 человек. Он связал это с употреблением болгарского йогурта (в Болгарии его называют кисело мляко – кислое молоко). В своих трудах И.И. Мечников стал популяризировать среди широкой общественности болгарский йогурт. Сам он до конца жизни регулярно употреблял не только молочнокислые продукты, но и чистую культуру болгарской палочки.
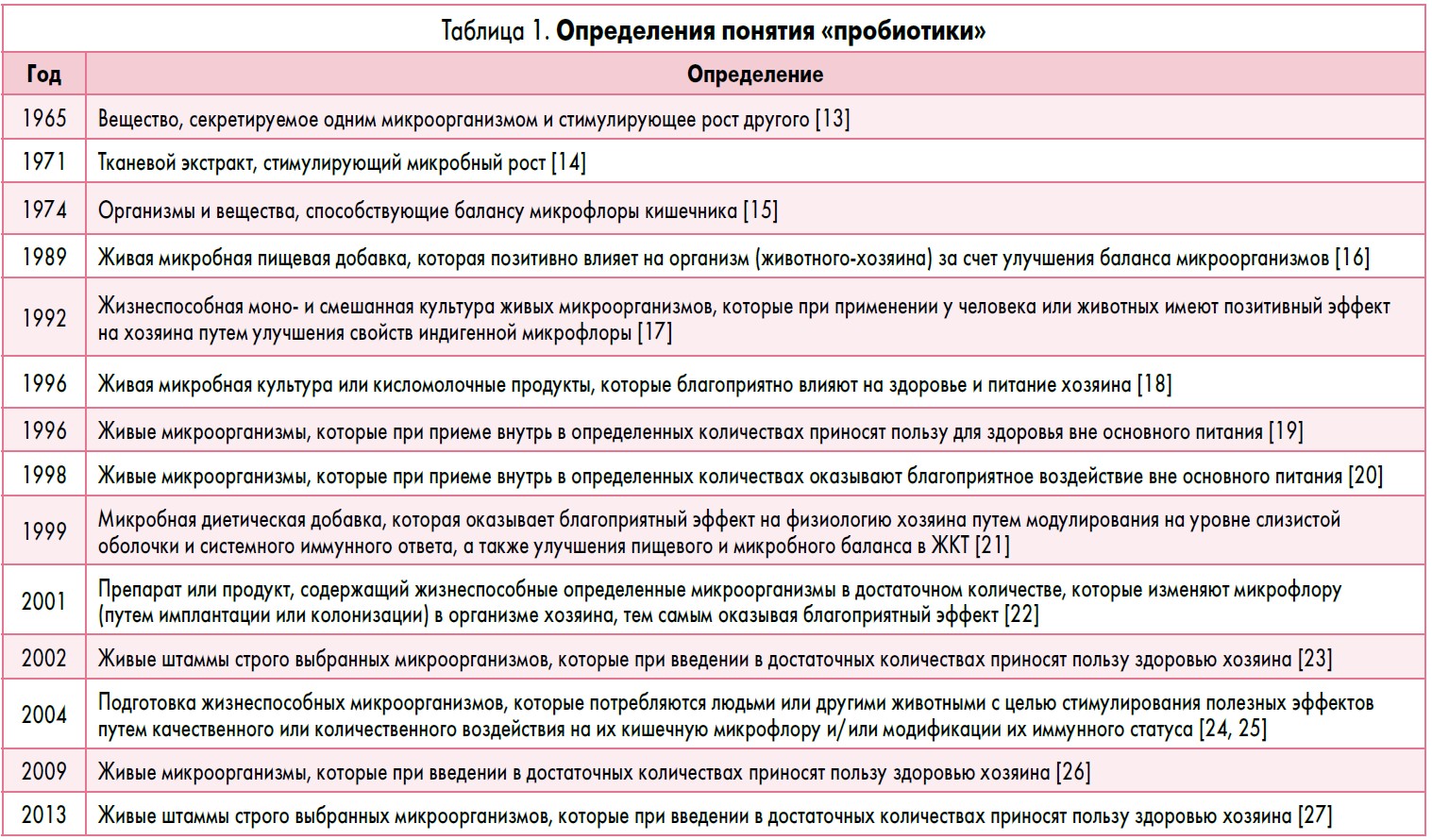
Термин «пробиотики» предложили использовать в медицинской литературе Lilly и Stillwell в 1965 году [11]. Однако под этим термином подразумевали «вещество, секретируемое одним микроорганизмом и стимулирующее рост других микроорганизмов» [13].
С тех пор предложено множество определений понятия «пробиотики» (табл. 1). Наиболее общепринятым является определение, приведенное недавно, но, вероятно, не последнее: «Живые микроорганизмы, которые приносят пользу здоровью хозяина в случае введения в адекватных количествах» («Live microorganisms, which when administered in adequate amounts, confer a health benefit on the host») [26]. Следовательно, пробиотики – это непатогенные живые микроорганизмы, оказывающие положительное влияние на здоровье организма-хозяина при употреблении в адекватных количествах.
Классификация препаратов пробиотиков. Наиболее часто в качестве пробиотиков используют некоторые виды молочнокислых бактерий (Lactobacillus), бифидобактерий (Bifidobacterium), сахаромицетов (Saccharomyces cerevisiae), кишечной палочки (E. coli), а также отдельные разновидности бацилл (Bacillus; табл. 2).
 Одним из наиболее перспективных является использование бифидобактерий, в частности штамма Bifidobacterium animalis subsp. lactis (BB‑12®) – одного из наиболее изученных штаммов бифидобактерий (рис.). Его представители являются грамположительными неподвижными анаэробными бактериями, которые морфологически представляют собой чрезвычайно вариабельные по форме неспорообразующие палочки, несколько изогнутые, булавовидные и часто разветвленные. Концы клеток бифидобактерий могут быть раздвоены, истончены или утолщены в виде шаровидных вздутий.
Одним из наиболее перспективных является использование бифидобактерий, в частности штамма Bifidobacterium animalis subsp. lactis (BB‑12®) – одного из наиболее изученных штаммов бифидобактерий (рис.). Его представители являются грамположительными неподвижными анаэробными бактериями, которые морфологически представляют собой чрезвычайно вариабельные по форме неспорообразующие палочки, несколько изогнутые, булавовидные и часто разветвленные. Концы клеток бифидобактерий могут быть раздвоены, истончены или утолщены в виде шаровидных вздутий.
Расположение клеток одиночное, парами, V-образное, иногда цепочками или розетками. При формировании биопленки микробные клетки окружены поверхностным слоем экзополисахаридов [28]. Указанные штаммы продуцируют молочную кислоту и не проявляют каталазной активности.
Они являются одними из наиболее распространенных бактерий, входящих в состав пробиотиков, а также популярным модельным объектом для изучения свойств бифидобактерий [28].
Показано, что большая часть бифидобактерий располагается в толстой кишке, являясь ее основной пристеночной и просветной микрофлорой. У детей такая флора составляет более 90% всех микроорганизмов кишечника в зависимости от возраста. Так, бифидобактерии занимают доминирующее положение в микробном пейзаже кишечника у здоровых новорожденных, находящихся на естественном вскармливании, к 5-20-му дню жизни. Необходимо обратить внимание, что микробиота ЖКТ недоношенных новорожденных отличается от таковой у доношенных. В частности, отмечается отсрочка колонизации кишечника недоношенных детей бифидобактериями [29]. Однако дополнительное введение пробиотика Bifidobacterium lactis BB‑12® способствовало увеличению количества бифидобактерий и уменьшению количества энтеробактерий и клостридий [29].
 Необходимо отметить, что штамм Bifidobacterium animalis subsp. lactis (BB‑12®; штамм DSM 15954) обладает высокой безопасностью, в частности он имеет статус GRAS (Generally Regarded As Safe – общепризнан как безопасный), присвоенный Управлением по контролю качества пищевых продуктов и лекарственных препаратов США – FDA (GRAS Notice No. GRN000049, 2002) [28]. Он также обладает хорошей переносимостью и клинической эффективностью у детей с периода новорожденности.
Необходимо отметить, что штамм Bifidobacterium animalis subsp. lactis (BB‑12®; штамм DSM 15954) обладает высокой безопасностью, в частности он имеет статус GRAS (Generally Regarded As Safe – общепризнан как безопасный), присвоенный Управлением по контролю качества пищевых продуктов и лекарственных препаратов США – FDA (GRAS Notice No. GRN000049, 2002) [28]. Он также обладает хорошей переносимостью и клинической эффективностью у детей с периода новорожденности.
Штамм Bifidobacterium animalis subsp. lactis (BB‑12®; штамм DSM 15954) является основой лекарственного средства Линекс Беби®, а также диетической добавки Линекс® Детские капли.
Следует также отметить, что штамм Bifidobacterium animalis subsp. lactis (BB‑12®) является самой упоминаемой пробиотической Bifidobacterium в мире: он описан более чем в 300 научных публикациях, из которых более 130 – публикации результатов клинических исследований, проведенных с 1987 года.
Механизм действия пробиотиков. На рынке Украины для детей раннего возраста также представлен препарат Линекс®, выпускаемый в форме капсул. Все микроорганизмы, входящие в состав препарата Линекс®, обладают синергическим эффектом по отношению друг к другу.
Кроме того, они устойчивы к действию антибиотиков (пенициллинов, в том числе полусинтетических, макролидов, цефалоспоринов, фторхинолонов и тетрациклинов) и других химиотерапевтических препаратов. Это является результатом того, что культуры микроорганизмов, входящие в состав пробиотика Линекс®, получены выращиванием на средах с добавлением антибиотиков, поэтому обладают устойчивостью к большинству антибактериальных средств и способны размножаться даже в условиях антибактериальной терапии. Устойчивость полученных штаммов к антибиотикам настолько высока, что сохраняется при повторных инокуляциях 30 поколений, а также in vivo. При этом не отмечено переноса генов антибактериальной резистентности к другим видам микроорганизмов.
Это очень важно с точки зрения последствий применения препарата Линекс©: как на фоне приема, так и после его отмены нет опасности выработки резистентности к антибиотикам со стороны патогенных бактерий и собственной микрофлоры. Соответственно препарат Линекс® можно применять во время антибиотикотерапии, начиная с 1-го дня.
Линекс® обладает антагонизмом к патогенной и условно-патогенной флоре и действует на протяжении всего кишечника. По результатам дезинтеграционного теста препарат имеет высокую кислотоустойчивость, позитивно влияя на количественный и качественный состав флоры кишечника. Лактобациллы и энтерококки, входящие в состав комплекса Линекс®, продуцируют антимикробные субстанции: бактериоцины (лантибиотики, немодифицированные белки, литические и нелитические, циклические белки), обладающие прямым антибактериальным и противовирусным действием, а также молочную кислоту, короткоцепочечные жирные кислоты и перекиси.
Попадая в кишечник, составляющие пробиотика Линекс® выполняют все функции собственной нормальной кишечной микрофлоры: снижают рН содержимого, создают неблагоприятные условия для размножения и жизнедеятельности патогенных микроорганизмов, участвуют в синтезе витаминов группы В, РР, К, Е, С, фолиевой кислоты (нормальная микрофлора полностью обеспечивает потребность человека в витаминах В12, В6 и Н, причем витамин В12 в природных условиях синтезируется только микроорганизмами). Компоненты этого препарата создают благоприятные условия для абсорбции железа, кальция, витаминов B в кишечнике (за счет ацидификации кишечного содержимого).
Молочнокислые микроорганизмы, входящие в его состав, колонизируют тонкий кишечник и осуществляют ферментативное расщепление белков, жиров, сложных углеводов, в том числе при лактазной недостаточности у детей. Белки и углеводы, не всосавшиеся в тонкой кишке, подвергаются более глубокому расщеплению в толстом кишечнике анаэробами, в том числе бифидобактериями, входящими в состав пробиотика Линекс®.
Бифидобактерии продуцируют фермент фосфопротеинфосфатазу, необходимую для метаболизма казеина молока у детей грудного возраста. Компоненты препарата Линекс® также участвуют в обмене желчных кислот (образование стеркобилина, копростерина, дезоксихолевой и литохолевой кислот, реабсорбция желчных кислот).
Линекс® обладает способностью наиболее физиологичным образом нормализовать микрофлору кишечника у пациентов с острыми кишечными инфекциями и дисбиозом: попадая в кишечник, живые бактерии расселяются на всем его протяжении – от толстой до тонкой кишки, в течение длительного времени выполняя все функции нормальной кишечной микрофлоры – антимикробную, пищеварительную, витаминообразующую.
Возможность пролонгированного выполнения активной физиологической роли путем постоянной продукции важнейших субстанций естественной флоры обеспечивает комплексу Линекс® преимущество перед препаратами – пребиотиками (содержащими только продукты метаболизма бактерий). Линекс® обладает более широким спектром ферментной активности, что обусловленно его трехкомпонентным составом. Это важнейшие преимущества, особенно при лечении расстройств пищеварения у детей, находящихся на искусственном вскармливании.
Линекс Беби® содержит Bifidobacterium animalis subsp. lactis (BB‑12®; штамм DSM 15954) в форме порошка для приготовления оральной суспензии в количестве 1×109 КОЕ (как известно, они входят в состав микрофлоры кишечника человека). Данные микроорганизмы особенно характерны для новорожденных, находящихся на грудном вскармливании. Именно эти бактерии считаются важными в ранний период развития младенца.
Существует несколько потенциальных механизмов, с помощью которых обеспечивается защитный и терапевтический эффект Bifidobacterium animalis subsp. lactis. Они ингибируют рост патогенных бактерий путем:
- снижения уровня рН в кишечнике (в результате способности Bifidobacterium animalis subsp. lactis к выработке кислот);
- продукции метаболитов, токсичных для патогенных бактерий (в частности, H2O2);
- выработки антибактериальных веществ, бактериоцинов;
- конкуренции с патогенными бактериями за питательные вещества;
- блокировки адгезивных рецепторов и таким образом ингибирования колонизации другими потенциально патогенными микроорганизмами.
Необходимо обратить внимание, что Bifidobacterium animalis subsp. lactis также оказывают стимулирующее влияние на иммунную систему.
Нарушение баланса микрофлоры кишечника (например, в результате действия вирусных или желудочно-кишечных инфекций, в частности ротавирусных инфекций, – лечение с применением антибиотиков широкого спектра действия и препаратов, предназначенных для химиотерапии) или задержка в формировании постоянной микрофлоры кишечника у новорожденных может индуцировать расстройства со стороны системы пищеварения (такие как колики, метеоризм, диарея и запор) и атопический дерматит.
Регулярный прием Bifidobacterium animalis subsp. lactis эффективно снижает частоту и тяжесть слабых или умеренных симптомов нарушений со стороны пищеварительной системы (главным образом диареи), связанных с нарушением нормальной микрофлоры кишечника, и обеспечивает нормальное функционирование кишечника. Линекс® Беби можно применять с целью профилактики и в составе комплексной терапии атопического дерматита, а также в качестве поддерживающего средства для стабилизации функции иммунной системы кишечника.
Bifidobacterium animalis subsp. lactis действуют местно в ЖКТ. После приема системная абсорбция не наблюдается, следовательно стандартные исследования фармакокинетики не применяются. Резистентность Bifidobacterium animalis subsp. lactis к желудочному соку и желчи дает возможность обеспечить высокий процент выживаемости штамма при прохождении через желудок и двенадцатиперстную кишку. Штамм может создавать тесную связь со слизью кишечника. Так же, как другие микроорганизмы, содержащиеся в ЖКТ, он постепенно выводится в результате перистальтики и дефекации.
Необходимо обратить внимание, что Линекс Беби® является лекарственным средством, которое можно назначать детям с первого дня жизни и до 12 лет. Препарат применяют:
- для стабилизации и поддержки баланса и функции микрофлоры кишечника;
- как профилактическое и поддерживающее средство при диарее, метеоризме и других нарушениях, вызванных вирусными и бактериальными инфекциями ЖКТ (например, ротавирусной инфекцией);
- при лечении с применением противомикробных препаратов (антибиотиков и других синтетических противомикробных средств).
Детям с первого дня жизни и до 2 лет Линекс Беби® назначают по 1 пакету 1 раз в сутки во время еды, а в возрасте от 2 до 12 лет – по 1 пакету 1-2 раза в сутки во время еды. Содержимое пакета смешивают с водой, соком, молоком или детским питанием, но ни в коем случае не следует принимать с горячими напитками. Линекс Беби® можно применять до тех пор, пока сохраняются соответствующие симптомы.
Необходимо обратить внимание, что все же, как и другие бактерии, бифидобактерии чувствительны к антибиотикам, и поэтому рекомендуется принимать Линекс Беби® не менее чем через 3 ч после приема антибиотиков [30].
Что касается Линекс® Детские капли, то эту пищевую добавку применяют для:
- установления и поддержания равновесия состава и функционального состояния микрофлоры кишечника, в том числе у детей первого года жизни, при таких пищеварительных расстройствах, как колики, метеоризм, нарушение дефекации (запор, диарея) и др.;
- поддержания равновесия состава и функционального состояния микрофлоры кишечника при приеме антибиотиков и после окончания курса лечения этими препаратами;
- снижения риска развития диареи, вызванной вирусными или бактериальными инфекциями ЖКТ (включая ротавирусную инфекцию);
- поддержания формирования и функционирования иммунной системы;
- профилактики атопического дерматита у детей.
Линекс® Детские капли назначают младенцам и детям в возрасте до 12 лет по 6 капель 1 раз в сутки во время еды. Содержание лиофилизированных бактерий Bifidobacterium animalis subsp. lactis (BB‑12®) в суточной порции (6 капель) не менее 1×109 КОЕ.
Не следует превышать рекомендуемую суточную дозу. Капли можно добавлять в молоко, молочные или другие негорячие напитки, поскольку возможна инактивация бактерий. Перед употреблением следует интенсивно взболтать. Средняя продолжительность приема 14-28 дней (определяется индивидуально). Возможен повторный прием Линекс® Детские капли в течение года.
Диарея. Данные литературы свидетельствуют, что Линекс Беби®, содержащий Bifidobacterium animalis subsp. lactis (BB‑12®), оказывает протективный эффект при острой и персистирующей диарее. Так, в многоцентровом двойном слепом плацебо-контролируемом исследовании оценивали эффективность молочной смеси, дополненной BB‑12® для профилактики острой диареи у 90 здоровых детей в возрасте до восьми месяцев, проживающих в детских домах или приемных центрах. Наблюдалась тенденция к снижению частоты диареи у детей, получавших BB‑12® (28,3%), тогда как у 38,6% детей, получавших плацебо, отмечали острую диарею [31].
Количество дней с диареей было статистически меньше в группе получавших BB‑12®, у них также отмечалась более низкая вероятность развития диареи. Эти результаты свидетельствуют о том, что BB‑12® оказывают протективное действие в отношении диареи [31].
В другом исследовании с использованием аналогичной методологии госпитализированные дети раннего возраста были рандомизированы для получения стандартной детской смеси или той же смеси, дополненной BB‑12® и Streptococcus thermophilus TH‑4® [32].
Ежедневно оценивали наличие у них диареи, а образцы кала исследовали на ротавирусный антиген с помощью иммуноферментного анализа. Образцы кала также брали во время диареи для вирусологического и бактериологического анализа. Полученные результаты свидетельствуют о том, что добавление к детской смеси BB‑12® и S. thermophilus TH‑4® может снизить частоту острой диареи и ротавирусной инфекции у госпитализированных детей [32].
А.И. Хавкин и Е.С. Кешишян [33] провели исследование переносимости и эффективности пробиотического штамма Bifidobacterium animalis subsp. lactis (DSM 15954; BB‑12®) при функциональных нарушениях пищеварения у детей раннего возраста. Обследовано 60 детей от 0 до 2 лет с функциональными нарушениями пищеварения во время и после приема антибиотиков во время и после вирусно-бактериальных заболеваний. Дети основной группы получали пробиотический штамм Bifidobacterium animalis subsp. lactis (штамм DSM 15954; BB‑12®).
Изучали индивидуальную переносимость пробиотика по данным клинико-лабораторного исследования и путем регистрации побочных эффектов; влияние пробиотика на функциональное состояние ЖКТ и состояние микрофлоры.
В схему исследования входили 2 визита с оценкой клинических признаков, количественный микробиологический посев фекалий, определение концентрации лизоцима и уровня slgA в копрофильтратах методом иммуноферментного анализа. В результате было установлено, что пробиотический штамм Bifidobacterium animalis subsp. lactis (DSM 15954; BB‑12®) хорошо переносился, не вызвал ни одного побочного или нежелательного явления.
Отмечено, что применение пробиотика в стандартной дозировке в течение 3-4 недель способствовало клиническому и лабораторному улучшению состояния ЖКТ [32].
Установлено, что указанный пробиотический штамм способствует значительному увеличению в копрофильтратах концентрации slgA и лизоцима. Концентрация slgA у детей основной группы до лечения составила 54,2±7,51 мг/100 г, после лечения – 142,1±5,49 мг/100 г (Р<0,001), в группе сравнения – 62,2±8,61 и 107,1±10,5 мг/100 г соответственно. Концентрация лизоцима в копрофильтратах в основной группе до лечения составила 5,1±0,27 мкг/г, после лечения 33,8±2,3 мкг/г (Р<0,001), в группе сравнения – 6,4±0,71 и 6,5±0,3 мкг/г соответственно.
Межгрупповые различия статистически достоверны. Следовательно, данный пробиотик можно рекомендовать для широкого использования у детей раннего возраста при функциональных расстройствах ЖКТ и любых неблагоприятных состояниях, сопряженных с риском нарушения микробиоценоза и иммунологической толерантности кишечника [33].
Таким образом, проведенные исследования подтверждают, что BB‑12® может уменьшать как частоту, так и продолжительность диареи у младенцев и детей.
Некротический энтероколит (НЭК) – это тяжелое заболевание, которое особенно часто развивается у недоношенных детей. Предполагается, что одним из возможных этиологических факторов является аномальное развитие желудочно-кишечной микрофлоры. Согласно метаанализу литературы, пробиотические добавки могут значительно снизить риск развития НЭК у недоношенных новорожденных независимо от гестационного возраста и стадии НЭК [34]. Добавление пробиотиков не повышало риск возникновения сепсиса или смертность. Кроме того, пробиотические добавки не оказывают отрицательного влияния на нормальное питание и рост ребенка [34].
Антибиотикассоциированная диарея (ААД). Обращает внимание эффективность пробиотика Линекс® в качестве средства профилактики ААД. Это продемонстрировано в ряде клинических исследований [35-37]. Так, в слепом плацебо-контролируемом исследовании при диарее, обусловленной длительной противомикробной терапией, или диарее неустановленной этиологии высокая эффективность пробиотика (прекращение диареи менее чем через 3 дня лечения) была отмечена у 80% пациентов, у остальных 20% эффект также был достаточно выраженным – диарея прекратилась в течение 3-5 дней после начала лечения [35].
Аналогичные результаты получены и в исследовании с участием детей в возрасте до 7 лет с разными формами острых кишечных инфекций и дисбиозом с преобладанием условно-патогенной флоры (клебсиелла, протей, стафилококк, гемолизирующая кишечная палочка и др.) [36].
Заболевания желудочно-кишечного тракта. В клинических исследованиях с участием пациентов с язвенной болезнью было показано, что ввиду возможности возникновения побочных эффектов, связанных с дисбиотическими изменениями в кишечнике, в схему терапии рационально включатть пробиотики, в частности Lactobacillus acidophilus (sp. L. gasseri), Bifidobacterium infants, Enterococcus faecium, содержащие антибиотикорезистентные штаммы микроорганизмов, что позволяет заселять ими кишечник на разных уровнях [38].
Несколько позднее О.В. Добровольский и С.Ю. Сереброва [39] отметили, что конкурентными преимуществами Lactobacillus acidophilus (sp. L. gasseri), Bifidobacterium infants, Enterococcus faecium, применяемых для коррекции возможных при лечении язвенной болезни изменений микрофлоры кишечника, являются высокая функциональная активность и способность к адгезии, устойчивость к действию кислотно-пептической среды желудка и антибиотикорезистентность, позволяющие применять указанные штаммы одновременно с антибактериальными препаратами.
Заслуживающие внимания результаты были получены в крупномасштабном многоцентровом двойном слепом рандомизированном плацебо-контролируемом исследовании, в котором было изучено влияние Bifidobacterium animalis subsp. lactis (BB‑12®) на частоту дефекации и абдоминальный дискомфорт [40]. В исследовании приняли участие 1248 взрослых здоровых лиц с низкой частотой дефекации в неделю и абдоминальным дискомфортом. После 2 недель вводного периода пациенты были рандомизированы на 3 группы.
Пациенты первой группы получали капсулы с пробиотиком BB‑12® в дозировке 1×109 КОЕ/сутки; второй группе были назначены капсулы с BB‑12® в дозировке 10×109 КОЕ/сутки; пациенты третьей группы получали капсулы с плацебо. Длительность лечения составляла 4 недели.
Отношение шансов (ОШ) увеличения частоты дефекаций на ≥50% по сравнению с показателем до лечения среди получавших пробиотик составило 1,31 (95% доверительный интервал – ДИ – 0,98-1,75; Р=0,071), при этом доза пробиотика не оказывала влияния на частоту дефекации [40].
В ходе исследования было установлено значимое влияние изучаемого лечения на среднее количество дефекаций (Р=0,0065), при этом частота дефекации была статистически достоверно выше в группах применения пробиотиков по сравнению с плацебо на протяжении 4 недель лечения [40].
Влияние на частоту дефекации было сопоставимым между группами, принимавшими разные дозы пробиотиков, что свидетельствует о достижении предельно желаемого эффекта при использовании BB‑12® в дозе 1×109 КОЕ/сутки. Было также установлено отсутствие различий между группами по влиянию на абдоминальный дискомфорт, что свидетельствует о хорошем профиле переносимости пробиотика BB‑12® [40].
Ранее была продемонстрирована эффективность и целесообразность назначения Lactobacillus acidophilus (sp. L. gasseri), Bifidobacterium infants, Enterococcus faecium при антихеликобактерной терапии. В исследовании с участием 334 детей с гастритом или язвенной болезнью двенадцатиперстной кишки добавление Lactobacillus acidophilus (sp. L. gasseri), Bifidobacterium infants, Enterococcus faecium к антихеликобактерной терапии позволяло значительно снизить частоту ее побочных эффектов [41], которые наблюдались в 2,2 раза реже у пациентов, получавших указанные штаммы, по сравнению с детьми, не принимавшими препарат.
У детей, не получавших это лекарственное средство, наиболее частыми побочными эффектами были диарея (61%), метеоризм (31%) и запор (9%). В основной группе не было отмечено запоров, диарейный синдром был выражен значительно меньше, отмена антибактериальных препаратов детям, получавшим Lactobacillus acidophilus (sp. L. gasseri), Bifidobacterium infants, Enterococcus faecium, не потребовалась [41].
Острые вирусные респираторные заболевания. Обращают внимание результаты, полученные в ходе двойного слепого рандомизированного плацебо-контролируемого исследования, проведенного у здоровых детей первого года жизни [42]. В нем изучали влияние использования Bifidobacterium animalis subsp. lactis (ВB‑12®) на риск возникновения острых инфекционных заболеваний.
В исследовании приняли участие 109 детей в возрасте 1 месяца, которые были случайным образом распределены для получения B. lactis ВВ‑12® (n=55) или плацебо (n=54) до достижения ими 8 месяцев. В ходе исследования не было зарегистрировано статистически достоверных различий между сравниваемыми группами по частоте возникновения симптоматики со стороны ЖКТ, частоте развития острого среднего отита или использования антибиотиков.
В то же время достоверно меньшее количество эпизодов инфекций дыхательных путей было отмечено у детей, получавших Bifidobacterium animalis subsp. lactis (ВB‑12®) по сравнению с контрольной группой (65 против 94%, отношение рисков 0,69; 95% ДИ 0,53-0,89; Р=0,014) [42]. Таким образом, результаты данного исследования еще раз подтвердили профилактическую эффективность пробиотиков, а именно Bifidobacterium animalis subsp. lactis (ВB‑12®) в отношении инфекций дыхательных путей.
Атопический дерматит. По данным многочисленных исследований было продемонстрировано, что перинатальное применение пробиотиков эффективно для первичной профилактики атопического дерматита в раннем детском возрасте [43]. В то же время долговременные эффекты от применения пробиотиков на развитие и течение атопического дерматита и других аллергических заболеваний значительно менее изучены. Ранее опубликованные данные свидетельствуют о статистически достоверном снижении кумулятивной частоты развития атопического дерматита у детей к возрасту 2 лет после получения их матерями пробиотиков [43].
Отмечена тенденция к более низкой частоте развития атопического дерматита в группе пробиотиков по сравнению с плацебо (ОШ 0,64; 95% ДИ 0,39-1,07; Р=0,086; число больных, которых необходимо лечить – NNT=10). Эти различия оказались статистически достоверными при проведении заключительного анализа (ОШ 0,48; 95% ДИ 0,25-0,92; Р=0,027; NNT=6) [43]. Распространенность астмы, атопической сенсибилизации и общая частота развития аллергического риноконъюнктивита между сравниваемыми группами статистически достоверно не различались [43].
Таким образом, данное долговременное исследование продемонстрировало, что употребление пробиотиков только матерью может быть достаточным для длительного профилактического эффекта в отношении кумулятивной частоты развития атопического дерматита, но не других аллергических заболеваний.
Приведенные в этом обзоре данные позволили обобщить позитивное влияние штамма Bifidobacterium animalis subsp. lactis (BB‑12®) у детей (табл. 3).
Литература
1. Бельмер С.В., Печкуров Д.В. Римский консенсус IV: Современный взгляд на функциональные расстройства органов пищеварения. Вопросы детской диетологии. 2016; (5): 42-49.
2. Майданник В.Г. Римські критерії IV (2016): Що нового? Міжнародний журнал педіатрії, акушерства та гінекології. 2016; 10(1): 8-18.
3. Hyams J.S., Di Lorenzo C., Saps M. et al. Functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2016; 150(6): 1456-1468.
4. Benninga M.A., Nurko S., Faure C. et al. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology 2016; 150(6): 1443-1455.
…
43. Simpson M.R., Dotterud C.K., Storro O. et al. Perinatal probiotic supplementation in the prevention of allergy related disease: 6 year follow up of a randomised controlled trial. BMC Dermatol. 2015; 15(1): 13.
Информация для специалистов сферы здравоохранения.
4-59-ЛИН-ОТС‑0818
Тематичний номер «Педіатрія» №3 (46), вересень-жовтень 2018 р.
СТАТТІ ЗА ТЕМОЮ Педіатрія
Вроджена дисфункція кори надниркових залоз (ВДКНЗ) – це захворювання з автосомно-рецесивним типом успадкування, в основі якого лежить дефект чи дефіцит ферментів або транспортних білків, що беруть участь у біосинтезі кортизолу. Рання діагностика і початок лікування пацієнтів з ВДКНЗ сприяє покращенню показників виживаності та якості життя пацієнтів....
Алергічний риніт (АР) є поширеним запальним захворюванням верхніх дихальних шляхів (ВДШ), особливо серед педіатричних пацієнтів. Ця патологія може знижувати якість життя, погіршувати сон та щоденну продуктивність. Метою наведеного огляду є надання оновленої інформації щодо епідеміології АР та його діагностики, з урахуванням зв’язку з бронхіальною астмою (БА). ...
Американська академія педіатрії (AAP) оновила рекомендації щодо контролю грипу серед дитячого населення під час сезону 2023-2024 рр. Згідно з оновленим керівництвом, для профілактики та лікування грипу в дітей необхідно проводити планову вакцинацію з 6-місячного віку, а також своєчасно застосовувати противірусні препарати за наявності показань. ...
Поширеність і вплив алергічних захворювань часто недооцінюють [1]. Ключовим фактором алергічної відповіді є імуноглобулін (Ig) Е, присутній на поверхні тучних клітин і базофілів. Взаємодія алергену з IgЕ та його рецепторним комплексом призводить до активації цих клітин і вивільнення речовин, у тому числі гістаміну, які викликають симптоми алергії [2]. Враховуючи ключову роль гістаміну в розвитку алергічних реакцій, при багатьох алергічних станах, включаючи алергічний риніт і кропив’янку, пацієнту призначають антигістамінні препарати [3, 4]....