Топические нестероидные противовоспалительные препараты в терапии острой мышечно-скелетной боли у взрослых
Острая мышечно-скелетная боль (МСБ) – ведущий симптом при травматических повреждениях опорно-двигательного аппарата, не сопровождающихся нарушением целостности кожных покровов. Несмотря на то что в большинстве случаев такие травмы проходят самостоятельно в течение нескольких недель, болезненность и ограничение подвижности во время этого периода существенно ухудшают качество жизни и трудоспособность пациентов. Для лечения острой МСБ в современной ортопедической практике все чаще используются топические нестероидные противовоспалительные препараты (НПВП), которые обеспечивают адекватную аналгезию без развития побочных эффектов, свойственных системным НПВП.
Актуальность топической аналгезии при травмах
Совсем еще недавно широкое использование в ортопедической практике топических НПВП для адекватного обезболивания при травмах опорно-двигательного аппарата было предметом дискуссии. Например, в США до 2010-х годов данную группу препаратов с этой целью практически не применяли.
В странах Западной Европы аналгетический эффект топических НПВП рассматривали как сравнимый с таковым у плацебо, а любой клинически очевидный результат приписывался процессу растирания травмированного участка. И это несмотря на полученные ранее веские доказательства результативности топических НПВП при острой и хронической МСБ (Mason L. et al., 2004; Moore R.A. et al., 1998).
При этом в США топические НПВП разрешены Управлением по контролю качества пищевых препаратов и лекарственных средств – FDA (Food and Drug Administration) с 2007 г., а в Англии данная группа препаратов была включена Национальным институтом здоровья и качества медицинской помощи – NICE (National Institute for Health and Care Excellence) в первую линию терапии остеоартрита в 2008 г.
Более ранние систематические обзоры по топическим аналгетикам также охватывали фундаментальные исследования, объясняющие биологические эффекты этих препаратов в дополнение к клиническим испытаниям (Moore R.A. et al., 2008).
Топические НПВП при острой травматической боли
Считается, что острая МСБ длится менее 3 мес и обычно вызвана травмой, включая сдавливание, растяжения, ушибы, а также мышечной болезненностью и судорогами.
Для лечения легкой и умеренной боли клиницисты применяют НПВП, являющиеся наиболее часто назначаемыми аналгетиками. Их результативность в лечении острой боли подтверждена обширной доказательной базой (Moore R.A. et al., 2003).
Известно, что НПВП, принимаемые перорально или парентерально, воздействуют на все органы и системы и для достижения эффективных локальных концентраций препарата при болях необходимы относительно высокие его дозы. Это, в свою очередь, может приводить к развитию нежелательных эффектов и осложнений (в частности, диспепсии и желудочно-кишечных кровотечений).
Топические НПВП лишены указанных недостатков; к тому же у этих препаратов существует целый ряд лекарственных форм (кремы, пены, гели, лосьоны, мази, пластыри и т.п.), что еще больше повышает комплайенс пациентов. Кроме того, состав и форму топического препарата можно изменять в соответствии с требованием к скорости его абсорбции через кожу. Так, при необходимости постоянного медленного поступления НПВП в очаг воспаления или боли и поддержания его низких концентраций назначают пластыри с модифицированным высвобождением действующего вещества, а для создания высокой локальной концентрации – гелевые формы препаратов.
Поэтому фармакокинетические свойства различных форм топических НПВП позволяют широко применять их при различных травмах и воспалительных заболеваниях опорно-двигательного аппарата, которые не сопровождаются нарушением целостности кожи.
В обзоре M.L. McPherson и N.M. Cimino (2013) была показана польза топических НПВП как с точки зрения терапевтической эффективности, так и в плане уменьшения неблагоприятного системного воздействия, вот почему их все чаще включают в современные международные клинические рекомендации.
Механизмы терапевтического воздействия топических НПВП
Установлено, что НПВП обратимо ингибируют циклооксигеназу (ЦОГ) (простагландиновая эндопероксид-синтаза), которая опосредует синтез простагландинов и тромбоксана А2 (FitzGerald G.A. et al., 2001). Терапевтическая эффективность различных молекул топических НПВП зависит от их физико-химических свойств, размера активной молекулы, а также состава лекарственной формы и концентрации в ней действующего вещества. Все эти характеристики влияют на фармакодинамические свойства препарата (Galer B.S., 2008).
Для оптимизации абсорбции также необходим баланс между липофильностью и гидрофильностью того или иного препарата, поэтому для повышения проницаемости было предложено использовать в составе топических НПВП сложные эфиры. Было выявлено, что для лучшей абсорбции через все слои кожи к очагу боли и воспаления препарат должен обладать дифильными свойствами (Singh Р., Roberts M.S., 1994), а его оптимальная атомная единица массы – составлять не более 500 Да (Brown М.В. et al., 2006).
Например, размеры молекулы диклофенака составляют 294 Да, кетопрофена – 253 Да (Kokki Н. et al., 2008). Сравнительные исследования, проведенные с искусственными мембранами и человеческим эпидермисом, продемонстрировали, что гели или спреи более эффективны, чем кремы.
Топические НПВП проявляют свое действие главным образом путем локального уменьшения болевого синдрома. Это достигается созданием высокой концентрации действующего вещества (в очаге боли и/или воспаления), достаточного для ингибирования ЦОГ и, соответственно, синтеза простагландинов, что само по себе уменьшает локальное воспаление и снимает боль (Haroutiunian S. et al., 2010; Moore R.A. et al., 2008).
При этом плазменные концентрации после местного применения НПВП существенно меньше (в среднем 5%) таковых при системном введении препаратов данной группы. В свое время было установлено, что минимизация плазменных концентраций топических НПВП позволяет ограничить развитие неблагоприятных системных событий, особенно у пациентов с факторами риска (Evans J.M. et al., 1995; Zimmerman J. et al., 1995).
Эффективность и безопасность топических НПВП
В 2004 г. L. Mason и соавт. опубликовали результаты метаанализа электронных баз данных рандомизированных двойных слепых исследований, в которых топические НПВП сравнивались с плацебо или другими способами аналгезии у взрослых пациентов с острой болью в результате спортивных травм. Особенностью метаанализа стало изучение и сравнение документальных данных относительно эффективности и безопасности топических НПВП, представленных их производителями.
Критериями эффективности сравниваемых препаратов были уменьшение боли на 50% в течение одной недели лечения, а также отсутствие побочных эффектов и необходимости прекращения терапии.
По результатам метаанализа 26 рандомизированных двойных слепых исследований (n=2853) в 19 из них было продемонстрировано, что топические НПВП значительно более эффективны по сравнению с плацебо. Относительное преимущество составило 1,6 (95% ДИ 1,4-1,7), эквивалентный 50% уменьшению боли в течение 7 дней индекс NNT – 3,8 (95% ДИ 3,4-4,4).
При косвенных сравнениях отдельных топических НПВП было установлено, что кетопрофен проявил преимущества по сравнению с другими препаратами (самый низкий индекс NNT – 2,6 при медиане 3,8 для всех сравниваемых топических НПВП), тогда как эффективность индометацина почти не отличалась от плацебо. У всех сравниваемых препаратов редкие побочные эффекты в виде местных проявлений (кожные реакции) были сопоставимы с плацебо и не требовали отмены лечения.
Высокая эффективность топического кетопрофена позже была подтверждена результатами других метаанализов.
В 2010 г. T. Masssey и соавт. представили результаты систематического обзора, в который были включены 47 исследований (n=3445).
В большинстве исследований топические НПВП в форме геля, крема или спрея сравнивались с аналогичными формами плацебо. Для сравниваемых препаратов индекс NNT, эквивалентный 50% облегчению боли в течение 6-14 дней лечения, составил: 3,9 (73%) для кетопрофена; 4,6 (55%) для ибуфпрофена; 3,7 (52%) для диклофенака; 4,4 (70%) для пироксикама. Из побочных эффектов отмечались только слабые и кратковременные местные кожные реакции, сопоставимые с плацебо и не требовавшие отмены лечения.
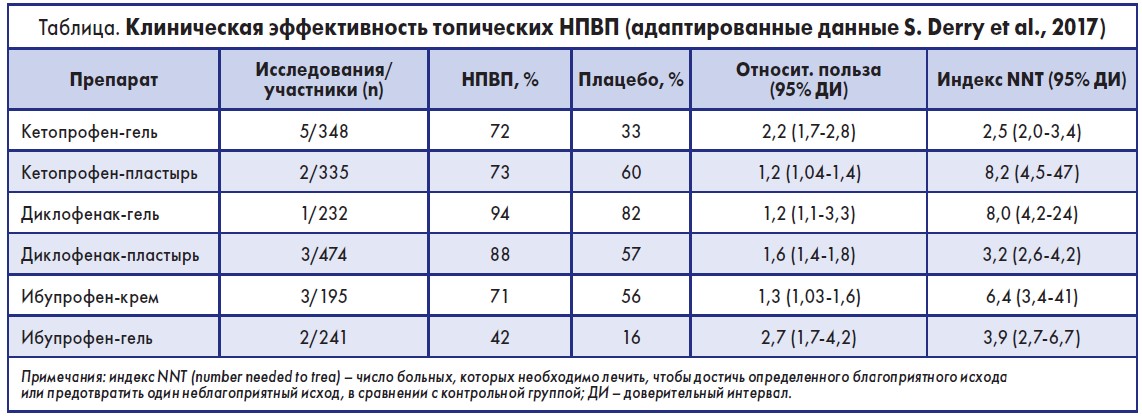
Результаты Кокрановского обзора, опубликованные в 2017 г. S. Derry и соавт., включили 61 исследование. 5311 участвующих в этих исследованиях пациентов получали топические НПВП в различных лекарственных формах (гель, мазь, пластырь), 3479 – местные плацебо (в аналогичных формах) и 220 – пероральные НПВП.
Участников обновленного систематического обзора оказалось на 63% больше, чем в предыдущей версии за 2010 год (47 исследований). Кроме этого в ходе анализа был выявлен большой объем ранее неопубликованных данных, полученных в процессе исследований эффективности (n=5900) и неблагоприятных явлений (n=5300) применения топических НПВП.
По результатам обновленного обзора одними из наиболее эффективных и безопасных препаратов были признаны кетопрофен, диклофенак, ибупрофен для местного применения в виде геля (табл.).
Кетопрофен и диклофенак были сопоставимы по своей результативности и по эффективности превосходили ибупрофен. Все три препарата продемонстрировали значительно более высокие показатели клинической эффективности (больше участников исследований с 50% облегчением боли) по сравнению с плацебо и другими топическими НПВП (данные умеренного и высокого качества доказательств). Во всех исследованиях среднее значение индекса NNT было ниже 4, что указывает на высокую эффективность препаратов.
Также было установлено, что гелевые формы препаратов статистически более эффективны, чем пластыри: р-значение для кетопрофена равно 0,00014, для диклофенака – 0,00001.
Что касается безопасности, то лечение топическими НПВП (кетопрофен, диклофенак, ибупрофен) не было связано с увеличением частоты местных нежелательных явлений (кожных реакций) или необходимости прекращения лечения по сравнению с плацебо. Также не отмечалось развития системных нарушений (доказательства высокого качества).
В феврале 2017 г. S. Derry и соавт. представили результаты более масштабного систематического обзора, включившего 13 предыдущих метаанализов (206 исследований с участием почти 30 700 пациентов), в которых оценивались результативность и безопасность топических НПВП для лечения острой и хронической МСБ у взрослых.
В этом метаанализе также была подтверждена высокая клиническая эффективность и безопасность кетопрофена в сравнении с плацебо и косвенном сравнении с другими топическими НПВП.
Ключевым вопросом клинической успешности и безопасности той или иной лекарственной формы топического НПВП является наименьшая доза активного вещества, способного вызвать обезболивающее действие (Moore R.A. et. al., 2008). Наименьшая концентрация (0,025 г/г) активного вещества содержится в 2,5% геле кетопрофена.
Учитывая вышеприведенные результаты систематического анализа, несомненный интерес для клиницистов могут представлять данные двух новых исследований M. Serinken и соавт. (2016), осуществленных на базе отделений неотложной помощи (ОНП). Важным аргументом для проведения этих исследований стало отсутствие данных о применении топических НПВП при оказании неотложной помощи взрослым пациентам с острыми МСБ.
В первом исследовании изучалась эффективность местного применения кетопрофена в ОНП у 140 пациентов, поступивших с острой механической болью в спине (79 мужчин и 61 женщина, средний возраст составил 35±12 лет). Всем участникам вводили 2,0 г декскетопрофена внутривенно, а в качестве дополнительного лечения местно – 2,5% гель кетопрофена (основная группа) или плацебо (контрольная группа).
Выраженность болевого синдрома оценивалась по визуальной аналоговой шкале (ВАШ) через 15 и 30 мин после применения местного лечения. Дополнительно регистрировались побочные явления и необходимость интенсификации терапии острой боли в спине при отсутствии клинического эффекта.
По результатам исследования среднее значение уменьшения боли по ВАШ в течение 30 мин составило 52±18 в группе кетопрофена и 37±17 в группе плацебо, динамическая оценка интенсивности боли в основной группе была в среднем 16 мм (значения от 10 до 21 мм, 95% ДИ). При этом в группе плацебо 10 (14%) пациентам потребовалась интенсификация медикаментозной терапии острой боли в спине, в то время как в группе кетопрофена таких пациентов было всего 2 (3%).
На основании полученных результатов исследователи пришли к выводу, что в ОНП местное применение 2,5% геля кетопрофена в качестве дополнительной терапии в течение 30 мин улучшает самочувствие у пациентов с острой механической болью в спине по сравнению с плацебо.
Во втором исследовании изучалось местное использование кетопрофена у пациентов, поступивших в ОНП с растяжением связок голеностопного сустава. 100 пациентов были рандомизированы по группам: основная группа получала местно 2,5% гель кетопрофена, контрольная – плацебо. Площадь нанесения препаратов составила 5 см. Уменьшение боли оценивали по ВАШ через 15 и 30 мин.
Среднее значение уменьшения интенсивности боли через 15 мин в группах кетопрофена и плацебо составило 27 (19,8-33,4) и 9 (7,6-17) соответственно. В течение 30 мин медиана уменьшения боли в каждой группе составила 42 (36-50,8) и 20 (17-24,4) соответственно.
Таким образом, снижение боли через 15 и 30 мин было клинически более значимым в группе кетопрофена: средняя разница составила 16 (9-22) и 21 (15-27) соответственно. Гель кетопрофена значительно превосходил по эффективности плацебо в отношении снижения острой МСБ у пациентов с растяжением голеностопного сустава. В обеих группах не отмечалось развития нежелательных явлений.
В Украине широко используется 2,5% гель кетопрофена, представленный препаратом Фастум® гель («А. Менарини», Италия). Преимущества препарата обусловлены особенностями физико-химических свойств активной молекулы кетопрофена. Дифильность и малые размеры молекул кетопрофена способствуют легкому проникновению их через верхние слои кожи и созданию терапевтических локальных концентраций в очаге боли и воспаления.
Минимальное содержание действующего вещества (0,025 г/г) в препарате позволяет обеспечить высокую безопасность без потери эффективности. Комплексные преимущества препарата Фастум® гель обеспечены следующими его фармакодинамическими свойствами:
• быстрое проникновение через кожный барьер в очаг боли и воспаления;
• длительное нахождение в тканях сустава;
• низкий уровень системной абсорбции (при нанесении от 50 до 150 мг препарата плазменная концентрация кетопрофена через 5-8 ч составляет всего лишь 0,08-0,15 мкг/мл);
• быстрая элиминация из организма, что снижает риск кумуляции кетопрофена даже у пациентов с нарушением функции печени и почек.
Все это обеспечивает выраженный аналгетический, противовоспалительный эффекты и безопасность препарата Фастум® гель, а его благоприятные фармакоэкономические аспекты дополнительно повышают приверженность пациентов к лечению.
Подготовила Наталия Позднякова
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 3 (33), вересень-жовтень 2018 р.
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...