Неспецифічний аортоартеріїт (хвороба Такаясу) і серцево-судинна система (продовження)
Діагностика
 Важливими є рання діагностика неспецифічного аортоартеріїту (НАА) та своєчасне призначення терапії для попередження прогресування і розвитку загострень, таких як артеріальна гіпертензія (АГ) та її ускладнення, ретинопатія, аортальна недостатність, інфаркт міокарда (ІМ), серцева недостатність (СН) і церебральні судинні події [66, 104]. Згідно з рекомендаціями Європейської протиревматичної ліги (EULAR, 2009), доцільно провести ретельну клінічну оцінку та дослідження артерій із візуалізацією у разі підозри НАА (рекомендація 1, рівень доказів 3, сила рекомендації С) [46].
Важливими є рання діагностика неспецифічного аортоартеріїту (НАА) та своєчасне призначення терапії для попередження прогресування і розвитку загострень, таких як артеріальна гіпертензія (АГ) та її ускладнення, ретинопатія, аортальна недостатність, інфаркт міокарда (ІМ), серцева недостатність (СН) і церебральні судинні події [66, 104]. Згідно з рекомендаціями Європейської протиревматичної ліги (EULAR, 2009), доцільно провести ретельну клінічну оцінку та дослідження артерій із візуалізацією у разі підозри НАА (рекомендація 1, рівень доказів 3, сила рекомендації С) [46].
 Постановка діагнозу НАА утруднена внаслідок неспецифічності симптомів на ранній стадії захворювання [88, 150]. Неспецифічні клінічні прояви та відсутність специфічних лабораторних маркерів хвороби часто призводять до пізньої діагностики НАА і несвоєчасного лікування [50, 88, 94]. Це підтверджують дані дослідження, проведеного у США, за якими середня затримка встановлення НАА становила 17,5 (7-41,8 міс) і 44,8 міс для пацієнтів старше 40 років [130]. За даними іншого випробування, затримання діагностики НАА складає від декількох місяців до декількох років від появи перших симптомів [151]. Незважаючи на існування діагностичних критеріїв НАА [8], на ранній престенотичній стадії захворювання вони можуть бути відсутніми [94]. Діагноз НАА в основному ґрунтується на наявності характерних клінічних ознак, серед яких біль по ходу уражених артерій, шуми над сонними і підключичними артеріями, ослаблення чи відсутність пульсу та асиметричність артеріального тиску (АТ) на верхніх кінцівках, а також АГ та симптомів ішемії – стенокардія чи переміжна кульгавість, в осіб молодого віку у поєднанні з типовими ангіографічними змінами [7, 88, 116].
Постановка діагнозу НАА утруднена внаслідок неспецифічності симптомів на ранній стадії захворювання [88, 150]. Неспецифічні клінічні прояви та відсутність специфічних лабораторних маркерів хвороби часто призводять до пізньої діагностики НАА і несвоєчасного лікування [50, 88, 94]. Це підтверджують дані дослідження, проведеного у США, за якими середня затримка встановлення НАА становила 17,5 (7-41,8 міс) і 44,8 міс для пацієнтів старше 40 років [130]. За даними іншого випробування, затримання діагностики НАА складає від декількох місяців до декількох років від появи перших симптомів [151]. Незважаючи на існування діагностичних критеріїв НАА [8], на ранній престенотичній стадії захворювання вони можуть бути відсутніми [94]. Діагноз НАА в основному ґрунтується на наявності характерних клінічних ознак, серед яких біль по ходу уражених артерій, шуми над сонними і підключичними артеріями, ослаблення чи відсутність пульсу та асиметричність артеріального тиску (АТ) на верхніх кінцівках, а також АГ та симптомів ішемії – стенокардія чи переміжна кульгавість, в осіб молодого віку у поєднанні з типовими ангіографічними змінами [7, 88, 116].
У таблиці 4 наведені клінічні ознаки/симптоми, так звані червоні прапорці, наявність яких підвищує імовірність НАА у пацієнтів віком до 40 років [94].
Лабораторні методи дослідження
НАА не має специфічних діагностичних маркерів [50]. У загальному аналізі крові можна виявити нормохромну нормоцитарну анемію у 50% пацієнтів [122], підвищення швидкості осідання еритроцитів (ШОЕ), лейкоцитоз, тромбоцитоз [7, 122]. Дослідження рівня маркерів запалення корисне при оцінці активності захворювання, однак їхні підвищені рівні спостерігаються лише у 50-70% пацієнтів [130, 149], які в багатьох випадках не корелюють із системними симптомами чи прогресуванням змін за даними досліджень із візуалізацією судин. Виявлення активності патології у таких хворих є складним завданням і встановлюється наявністю нових уражень судин за допомогою методів візуалізації та/або запальних змін у зразках тканин, отриманих при хірургічних втручаннях [149]. Так, прогресування ураження артерій у динаміці (визначалося наявністю нових ушкоджень судин) встановлено більш ніж у 50% осіб із клінічно стабільними даними та нормальною ШОЕ [88]. Окрім того, можлива субклінічна активність захворювання, що підтверджують результати дослідження, за якими у 44% клінічно стабільних пацієнтів із НАА виявляли гістопатологічні дані запалення судин [130]. При біохімічному аналізі крові можна виявити збільшення концентрації С-реактивного білка (CРБ), фібриногену [7]. У деяких випадках відмічають підвищення рівня трансаміназ, імуноглобулінів G, M і A, антигену фактора фон Віллебранда (антиген VIII фактора) і гіпоальбумінемію [61, 122]. Ревматоїдний фактор збільшений у 15% пацієнтів із НАА [122], антифосфоліпідні антитіла виявляють у 45% [67], наявність яких асоційовано з підвищеним ризиком судинних ускладнень, зокрема тяжкої аортальної недостатності, та необхідністю хірургічної корекції вади серця [67]. За даними іншого дослідження, проведеного G.Y. Lee і співавт., анемію виявляли у 44,6% випадках, підвищення ШОЕ – у 54,9% (>21 мм/год) і СРБ – у 29,9% (>0,9 мг/дл) [80].
Отримані результати показали потенційну роль рівня пентраксину‑3 (PTX‑3) як гострофазового реактанта і маркера активності НАА, який був ідентифікований в артеріальній стінці при НАА [62]. Концентрація PTX‑3 у плазмі крові точніше свідчить про активність/неактивність захворювання, ніж ШОЕ та СРБ. Однак необхідні подальші дослідження для визначення того, чи рівень PTX‑3 буде корисний для моніторингу пацієнтів із НАА у клінічній практиці [62].
Із метою діагностики СН показане визначення натрійуретичного пептиду типу В (BNP) та N-кінцевого фрагмента мозкового натрійуретичного пептиду (NT-proBNP) [86]. Проведено дослідження для оцінки асоціації високочутливого СРБ та NT-proBNP і основних несприятливих серцево-судинних подій (смерть від серцевих причин, ІМ, нефатальна реваскуляризація уражених судин або повторні госпіталізації внаслідок нестабільної прогресуючої стенокардії) у 60 пацієнтів із НАА та ішемічною хворобою серця (ІХС), а також 60 осіб із ІХС. Хворі на ІХС порівняно з такими із НАА та ІХС мали більш атерогенний ліпідний профіль крові: вищий рівень холестерину ліпопротеїнів низької щільності (2,5±0,9 проти 2,2±1,1 ммоль/л, р=0,04) та нижчий рівень холестерину ліпопротеїнів високої щільності (1,0±0,2 проти 1,3±0,3 ммоль/л, р=0,01). За допомогою мультиваріантної моделі Кокса показано, що концентрація високочутливого СРБ є значущим та незалежним предиктором основних несприятливих подій, без зв’язку з іншими прогностичними маркерами у пацієнтів із ІХС, що асоційована з НАА [152]. За даними дослідження, проведеного Q. Liu і співавт., рівень NT-proBNP значно підвищений в осіб з активним НАА, що мали ускладнення. Окрім того, цей показник був незалежно асоційований із запаленням. Отримані результати вказують на те, що NT-proBNP може бути корисним маркером для оцінки стану, тяжкості та прогресування захворювання [86].
Гістологічна оцінка обмежується зразками тканин, отриманими при хірургічних втручаннях [66, 84], та даними аутопсій [150]. Відзначають гранулематозний артеріїт із наявністю в інфільтраті мононуклеарів, багатоядерних гігантських клітин, цитотоксичних і γδ-T-лімфоцитів та інших клітин [27, 84], а також проліферацію інтими й гладеньком’язових клітин, руйнування еластичних волокон, фіброз інтими та адвентиції [27].
Інструментальні методи дослідження
У пацієнтів із НАА на електрокардіограмі (ЕКГ) можуть виявляти блокаду правої ніжки пучка Гіса (при легеневій гіпертензії) [50], зміни, що характерні для ІМ [7], перикардиту [49] та ін.
У 2018 р. розроблено 12 рекомендацій EULAR щодо використання методів візуалізації для діагностики, моніторингу і прогнозування наслідків первинних системних васкулітів (СВ), що вражають судини великого діаметра. Вони включають ультразвукове дослідження (УЗД), магнітно-резонансну (МРТ), комп`ютерну (КТ) і позитронно-емісійну томографію (ПЕТ) із використанням 18F-фтордезоксиглюкози. Ці методи дозволяють ефективно оцінити черепні, екстракраніальні артерії й аорту та є менш інвазивними, більш чутливими і доступними, ніж біопсія темпоральної артерії та ангіографія, які були єдиними діагностичними стандартами при гігантоклітинному артеріїті (ГКА) та НАА відповідно упродовж десятиліть [47]. Методом дослідження першої лінії за рекомендаціями EULAR є проведення МРТ. КТ або ПЕТ – альтернативні процедури. За необхідності використовують додаткові дослідження та/або методи з візуалізацією [47]. У пацієнтів з активним захворюванням останні можуть допомогти у кращій оцінці. Частота та вибір методу дослідження для довгострокового моніторингу структурних уражень вирішується індивідуально. Окрім того, слід проводити ретельну діагностику пацієнтів із ризиком формування аневризми аорти [47].
Необхідно відмітити, що за допомогою aнгіографії візуалізують зміни просвіту артерій, викликані васкулітом, такі як стеноз або оклюзія, але цей метод не надає інформації щодо патології стінки судин. Крім того, проведення цього дослідження має ризик алергічних реакцій, гематом, ятрогенних емболізацій та дисекції артерій [47]. Сучасні візуалізаційні процедури майже замінили ангіографію, якщо її не виконують з метою проведення втручань на судинах [40].
В осіб із підозрою на НАА, згідно з рекомендаціями EULAR (рекомендація 7, рівень доказів 3, рівень згоди 9,1 (1,4) 90%>8), потрібно проводити МРТ для діагностики запалення стінки судин та/або зміни їх просвіту як тест із візуалізацією першої лінії з метою постановки діагнозу НАА, за умови високої кваліфікації лікаря та наявності обладнання. Слід відмітити, що при цьому методі дослідження відсутнє опромінення пацієнтів [47]. За даними дослідження I. Yamada і співавт., МРТ-ангіографія має 100% чутливість і специфічність у хворих на НАА [154]. Недоліком є обмежена доступність порівняно з УЗД або КТ [47]. ПЕТ, КТ і/або УЗД можна використовувати як альтернативні методи візуалізації судин у пацієнтів із підозрою на НАА. УЗД має обмежене значення для оцінки змін грудного відділу аорти. Слід відмітити, що УЗД може бути особливо цінним у пацієнтів із переміжною кульгавістю верхніх та/або нижніх кінцівок [47]. КТ (також у поєднанні з ПЕТ) дозволяє візуалізувати стінку судин та зміни їхнього просвіту і є доступним методом, але наявне опромінення пацієнта [47]. Дані дослідження показали, що КТ-ангіографія має 100% чутливість та специфічність для діагностики НАА [155].
За рекомендаціями EULAR (рекомендація 9, рівень доказів 5, рівень згоди 9,8 (0,6) 100%>8), ангіографію не слід застосовувати для виявлення ГКА або НАА, оскільки її замінили раніше згаданими методами візуалізації. Ця процедура була золотим стандартом діагностики СВ, що вражають судини великого діаметра, упродовж декількох десятиліть, але є інвазивною і пов'язана з високим рівнем ризику порівняно з іншими. Крім того, ангіографія не надає жодних відомостей про морфологію стінки судин, хоча інформативна щодо змін їхнього просвіту [47]. Основним показанням для її виконання при СВ, що вражають судини великого діаметра, є проведення перкутанної ангіопластики або стентування [55].
Зазначено, що рутинні методи дослідження з візуалізацією не рекомендуються пацієнтам із клінічною та біохімічною ремісією (рекомендація 10, рівень доказів 5, рівень згоди 9,4 (0,8) 100%>8). У пацієнтів із ГКА чи НАА МРТ-/КТ-ангіографія і/або УЗД можна використовувати для довгострокового моніторингу структурних пошкоджень, особливо для виявлення стенозу, оклюзії, дилатації та/або аневризми [47]. Частота, а також метод обстеження розглядаються на індивідуальній основі (рекомендація 11, рівень доказів 5, рівень згоди 9,3 (1,2) 95%>8). Вибір способу візуалізації залежить від локалізації ураження артерій та досвіду лікаря. Моніторинг пацієнта із запаленням і/або дилатацією аорти, наприклад, потребує проведення МРТ або КТ, тоді як стеноз пахвових/підключичних артерій можна діагностувати за допомогою УЗД [47].
У таблиці 5 наведені вимоги до неінвазивних методів з візуалізацією [94].
За допомогою методів обстеження з візуалізацією (УЗД, МРТ/МРТ-ангіографія, КТ/КТ-ангіографія, ПЕТ у пацієнтів із НАА виявляють стенози, оклюзію, рідше – дилатацію та аневризми [134, 136, 147]. Відзначають, що тоді дилатація і аневризми аорти можуть бути виявлені при НАА та аортиті іншої етіології, стеноз і коарктація аорти є специфічною особливістю НАА [135].
Доплерівська ехокардіографія (ЕхоКГ) є доступним неінвазивним методом діагностики змін сегментарного руху стінок та клапанного апарату, розмірів камер серця, товщини його стінок, функції шлуночків та оцінки деяких відділів аорти тощо [30, 122, 136]. Так, за даними ЕхоКГ, у 40,7% пацієнтів із НАА виявлено аортальну регургітацію, у 25% – мітральну регургітацію, у 7% – трикуспідальну недостатність та у 13% – легеневу гіпертензію, у 8% хворих діагностовано аневризму висхідної аорти та у 9% – стеноз низхідної аорти [136]. За результатами УЗД, в осіб із НАА ураження аорти і ниркових артерій спостерігали у 91 і 75% відповідно [133]. За даними трансторакальної ЕхоКГ, що проведено у 76 пацієнтів із НАА, концентричну гіпертрофію лівого шлуночка (ЛШ) виявлено у 50% із 56 осіб із АГ. Необхідно відмітити, що 5-річне виживання пацієнтів із концентричною гіпертрофією ЛШ складало 80% порівняно з 95% без гіпертрофії ЛШ (р=0,01) [136].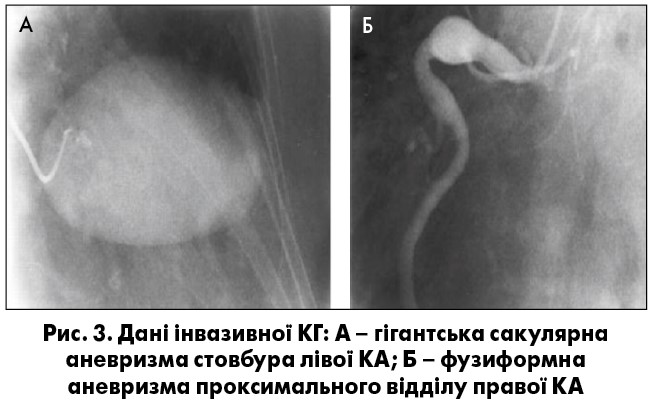
За даними ангіографії, частота ураження аорти та її гілок наступна: черевний відділ аорти – 63,2%, низхідна аорта – 57,2%, висхідна аорта – 47,8%, дуга аорти – 37,9%. Залучення у патологічний процес лівої загальної сонної артерії відмічали у 72,1% пацієнтів, лівої підключичної артерії – 67,1%, правої загальної сонної артерії – 63,7% і правої підключичної артерії – 55,2%. Найчастіше в уражених артеріях спостерігали стеноз, окрім висхідної аорти. У 25,4% випадків встановлено аневризми або дилатацію висхідної аорти [80]. При проведенні коронарографії виявляли стенози/оклюзії та аневризми коронарних артерій (КА) [7]. На рисунку 3 представлені результати дослідження 46-річної пацієнтки з НАА [141].
Класифікаційні критерії
При встановленні діагнозу НАА (табл. 6) використовують критерії Американської колегії ревматологів (ACR, 1990) [8]. Наявність будь-яких трьох чи більше критеріїв дозволяє встановити діагноз НАА з чутливістю 90,5% і специфічністю 97,8% [8].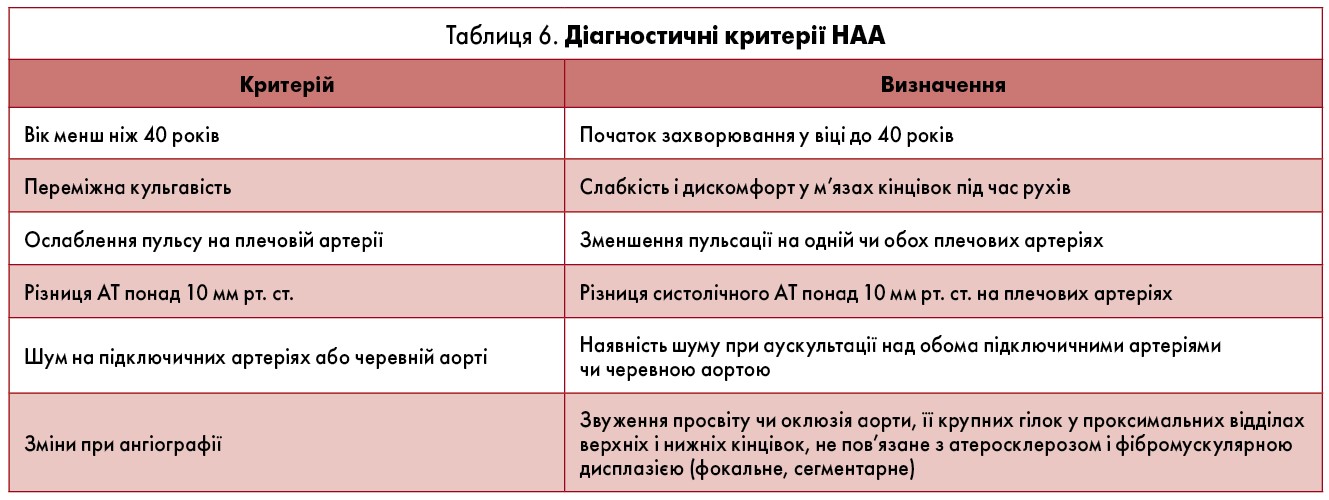
Як було відмічено вище, діагностика НАА ускладнена відсутністю специфічних лабораторних маркерів [50]. Необхідно відзначити, що у деяких пацієнтів розвивається ураження серця, що, як правило, розглядається як наслідок АГ, пошкодження легеневих артерій, ІХС та аортальної недостатності [143]. До того ж оцінка активності захворювання при НАА є непростим завданням, оскільки часто існує недостатня кореляція між клінічними даними і результатами лабораторного та інструментального обстеження [71]. Складність аналізу активності патології при НАА пов’язана з тим, що у хворих у клінічній ремісії гістологічні дані свідчать про активний процес у 45% [71]. За результатами дослідження 204 осіб із НАА, у 69,2% виявлено активну хворобу. У цих пацієнтів частіше визначали ураження висхідної аорти, дуги аорти та її основних гілок, виражену аортальну регургітацію та легеневу гіпертензію і вищий рівень NT-proBNP порівняно із хворими з неактивною патологією. Ці дані свідчать про те, що більш значна активність НАА асоційована з вищою серцево-судинною захворюваністю порівняно з пацієнтами з низькою активністю запалення [80].
Диференційний діагноз слід проводити з васкулітами, що вражають судини великого діаметра: аортитом іншої етіології (при сифілісі, туберкульозі, системному червоному вовчаку, ревматоїдному артриті, спондилоартриті, хворобі Бехчета, хворобі Кавасакі, гігантоклітинному артеріїті); вродженими патологіями аорти (коарктація аорти, синдром Марфана, Елерса – Данлоса IV типу, Лойса – Дітца) тощо [66].
Лікування
Ранній початок імуносупресивного лікування має вирішальне значення для контролю активності захворювання та мінімізації ураження артерій (збереження судинної компетенції) при незначних довгострокових побічних ефектах у пацієнтів із НАА. Гірші результати пов'язані з затримкою постановки діагнозу, пізнім призначенням терапії та показаннями й термінами проведення хірургічного втручання [72, 94].
Медикаментозне лікування. Рекомендоване раннє призначення глюкокортикоїдів (ГК) у високих дозах для індукції ремісії при СВ, що вражають судини великого діаметра (EULAR, 2009; рекомендація 3, рівень доказів 3, сила рекомендації С) [46, 88]. Початкова доза преднізолону становить 1 мг/кг/добу (максимум 60 мг/добу), яка має зберігатися упродовж місяця і з наступним поступовим зниженням [88, 112]. Окрім того, всі пацієнти повинні отримувати терапію для профілактики остеопорозу за відсутності протипоказань відповідно до локальних протоколів [46].
Як ад’ювантне лікування осіб із НАА рекомендоване призначення імуносупресивної терапії (EULAR, 2009; рівень доказовості 3, сила рекомендацій С) [46]. Незважаючи на використання ГК, захворювання може залишатися активним на субклінічному рівні [71]. Так, ремісії було досягнуто щонайменше один раз при застосуванні лише ГК у 60% пацієнтів [71]. Тому виникає необхідність у додатковому призначенні цитостатиків – метотрексату (20-25 мг на тиждень) чи азатіоприну (2 мг/кг/добу) [112]. Це може допомогти покращити контроль над захворюванням і знизити кумулятивну дозу ГК [46]. У невеликому дослідженні показано ефективність циклофосфаміду у резистентних до ГК хворих на НАА [46].
Окрім того, для лікування пацієнтів із НАА можна використовувати імунобіологічні препарати, зокрема моноклональні антитіла з високою афінністю як до розчинних, так і трансмембранних форм фактора некрозу пухлин α, ФНО-α (інфліксимаб), рекомбінантні гуманізовані моноклональні антитіла до людського рецептора інтерлейкіну‑6, ІЛ‑6 (тоцилізумаб) та генно-інженерні химерні моноклональні антитіла миші/людини, які мають специфічність до CD20-антигену В-лімфоцитів (ритуксимаб) [28, 53]. Є повідомлення про ефективне застосування ритуксимабу з добрим клінічним та лабораторним контролем [111]. Дані дослідження показали, що використання препаратів анти-ФНО-α приводить до ремісії у 70-90% випадків [28] та значно поліпшує контроль за активністю захворювання у пацієнтів із НАА, у яких відмічаються рецидиви при зменшенні дози ГК [59]. При застосуванні рекомбінантних гуманізованих моноклональних антитіл проти рецептора ІЛ‑6 (тоцилізумаб) позитивна клінічна реакція спостерігалася у 92,6% хворих, а рецидиви – у 21% [28, 53].
Згідно з рекомендаціями EULAR (2009), моніторинг ефективності терапії має бути клінічним і здійснюється за допомогою визначення маркерів запалення (рівень доказовості 3, сила рекомендації С) [46]. Оскільки валідні біомаркери для оцінки відповіді та діагностики рецидивів при СВ, що вражають судини великого діаметра, відсутні [46], періодичне виконання МРТ може сприяти оцінці активності захворювання. Також для моніторингу захворювання ПЕТ, ймовірно, є корисною [46].
Лікування АГ. Така терапія є важливою, оскільки неконтрольована чи не діагностована АГ може призводити до ускладнень [89]. Слід відмітити, що реноваскулярна АГ резистентна до медикаментозних методів та часто потребує стратегій інвазивного лікування, таких як ангіопластика або операції шунтування [25].
Лікування ІХС при НАА полягає у призначенні ГК у комбінації з іншими імуносупресивними препаратами за наявності активності. Аортокоронарне шунтування, стентування використовуються залежно від поширеності, локалізації та характеру ураження КА [45]. Окрім того, у літературі є дані щодо призначення аспірину, клопідогрелю, інгібіторів ангіотензинперетворювального ферменту (іАПФ), антагоністів кальцію, β-адреноблокаторів пацієнтам із НАА та ІХС [110, 118]. За результатами дослідження, проведеного A.W. de Souza і співавт., при застосуванні аспірину відмічали зниження ризику розвитку транзиторної ішемічної атаки, ішемічної оптичної невропатії, інсульту, ІМ та нестабільної стенокардії у хворих на НАА [38].
Необхідна також терапія СН за стандартними протоколами [138]. У таких випадках корекція основної причини розвитку СН, серед яких стентування ниркової артерії, протезування аортального клапану або коронарна реваскуляризація, та симптоматична терапія (наприклад, бета-адреноблокатори, іАПФ) є важливими, оскільки застійна СН є фактором ризику несприятливого прогнозу при цій патології. [32].
Інтервенційне та хірургічне лікування при НАА слід проводити у фазі ремісії в експертному центрі (рекомендації EULAR, 2009; рівень доказовості 3, сила рекомендації С) [46], яке може бути необхідним 70% пацієнтів із НАА, наприклад, при реноваскулярній АГ [88, 148]. За даними інших досліджень, інтервенційні/хірургічні втручання при стенозі судин або аортальній недостатності повинні були виконуватися у половини до двох третин осіб із НАА за середній період спостереження, що складав 3-5 років [71, 88]. Проведена в експертних центрах реваскуляризація має добрі результати, але нерідко потрібне повторне втручання [46, 88]. При виконанні перкутанної ангіопластики та стентування спостерігають вищу частоту рестенозу порівняно з хірургічною реваскуляризацією, але ці процедури можуть бути доцільними у деяких категоріях пацієнтів [88, 115]. Частота рестенозу упродовж 5-10 років значно вища після ангіопластики зі стентуванням, ніж внаслідок шунтування (10-80% проти 5-40%) [88, 107]. Проведення цих втручань є успішнішим на ранніх стадіях НАА. За даними дослідження M.C. Park і співавт., рестеноз після хірургічних або перкутанних процедур спостерігали у 31,7% пацієнтів (показаннями до інтервенційних втручань були реноваскулярна АГ, виражена кульгавість кінцівок, інфаркт головного мозку та ІХС). Відзначали нижчу частоту рестенозу, коли втручання виконували в неактивній фазі захворювання і при проведенні імуносупресивного лікування після процедур [113].
Показаннями до ендоваскулярного чи хірургічного втручання при НАА є: неконтрольована АГ внаслідок стенозу ниркової артерії, тяжке симптоматичне ураження КА або цереброваскулярна патологія, виражена аортальна недостатність і коарктація, стенотичні або оклюзійні ураження, що призводять до критичної ішемії кінцівок, та аневризми з ризиком розриву. У цих випадках співвідношення ризик/користь втручання переважає користь [115].
Як відмічено вище, оптимально реваскуляризацію слід проводити у період ремісії захворювання [46], що підтверджують дані випробувань [121]. У ретроспективному дослідженні за участю 79 пацієнтів із НАА, які перенесли операції реваскуляризації, наявність запалення на момент втручання асоціювалася з артеріальними ускладненнями [121]. Рекомендовано проводити імуносупресивне лікування як до, так і після операції. У дослідженні, що включало 97 пацієнтів із 6-річним спостереженням, результати після втручання на судинах були значно кращими у тих, хто отримував передопераційну імуносупресивну терапію, особливо у групі хворих після перкутанної реваскуляризації [116]. За даними іншого дослідження, показано, що післяопераційне імуносупресивне лікування – як ГК, так і комбінованою терапією, знижує ризик рестенозу після операції (відносний ризик 0,41, р=0,044) [116].
Стеноз чи рестеноз буває результатом поєднання проліферації інтими, аутоімунних механізмів та атеросклерозу при НАА. Тому рекомендують імплантацію елютинг-стентів і прийом ГК, оскільки така терапія може запобігти рестенозу стента в пацієнтів із НАА [158]. Ці дані підтверджують результати іншого дослідження, згідно з якими імплантація елютинг-стентів знижує ризик розвитку цього ускладнення. Ретельний контроль активності захворювання за допомогою ГК і/або інших імуносупресивних препаратів є основою успішних наслідків втручань [113]. Використання елютинг-стентів може забезпечити позитивні результати завдяки антипроліферативному ефекту. Проте через відмінності – як в етіології, так і в характері запалення / імуноопосередкованих процесах при атеросклерозі та НАА, застосування стентів, що ефективно використовуються для лікування стенозів артерій атеросклеротичного генезу, може бути неефективним при НАА [80].
За даними ретроспективного багатоцентрового дослідження проаналізовано результати хірургічного втручання у 79 пацієнтів із НАА (середній вік склав 39 років, 79,7% – жінки), яким провели 166 судинних процедур, з яких хірургічне втручання – 104 (62,7%), перкутанна ангіопластика – 62 (37,3%) для лікування артеріальних ускладнень. Після спостереження орієнтовно впродовж 6,5 років було виявлено 70 випадків, які включали рестеноз (n=53), тромбоз (n=7), кровотечу (n=6) та інсульт (n=4). Виживаність протягом 1, 3, 5 і 10 років без артеріальних ускладнень становила 78, 67, 56 і 45% відповідно. П’ятирічна частота уражень дорівнювала 44%. Зі 104 хірургічних операцій ускладнення відзначали у 37,5% пацієнтів порівняно з 50% внаслідок ендоваскулярних втручань. За допомогою мультиваріантного аналізу виявлено, що наявність запалення під час реваскуляризації асоційовано з розвитком артеріальних ускладнень після проведення процедур на судинах. Хворі, які зазнали ускладнень, мали вищі рівні ШОЕ (р<0,001), СРБ (р<0,001) та фібриногену (р<0,005) у сироватці крові порівняно з тими, у кого їх не встановлено [121].
За результатами дослідження, проведеного А. Perera і співавт., 6-річна виживаність у пацієнтів після хірургічних втручань становила 97%, загальний показник успішної відкритої хірургії (середня прохідність шунта – 9,4 року) – 79%, а для перкутанних процедур – 52% (р=0,035) [116]. Однак, враховуючи останні досягнення інтервенційного лікування, ефективність перкутанної ангіопластики в осіб із НАА потребує подальшого вивчення. Слід відмітити, що дані про цей метод були отримані у невеликій вибірці пацієнтів, або повідомлялися окремі випадки захворювання, а довгострокових результатів не відзначали [121].
Прогноз
Хронічна захворюваність та інвалідизація є характерними при НАА, які корелюють із басейном уражених артерій, частотою рецидивів захворювання та поширеністю ушкоджень [88]. Згідно з нещодавнім дослідженням L. Yang і співавт. АГ, ускладнення та прогресуючий перебіг патології є важливими предикторами 5-річної виживаності [156]. Крім того, значна захворюваність асоціюється з імуносупресивною терапією НАА (наприклад, інфекції, АГ, цукровий діабет, остеопороз або катаракта, пов'язана з використанням ГК). Хоча 5-, 10- та 15-річні показники виживаності становлять 97, 97 і 86% відповідно, рівень смертності залишається підвищеним у пацієнтів із НАА порівняно із загальною популяцією [130]. За результатами іншого дослідження, кумулятивна виживаність через 5 років після початку захворювання дорівнювала 91%, а через 10 років – 84% [72], що підтвержують M.C. Park і співавт. За отриманими даними, 5- та 10-річна виживаність становила 92,9 і 87,2% відповідно, а наявність двох або більше ускладнень були чинником ризику смертності [112].
Смертність при НАА має географічні відмінності, що частково може відображати різні підходи до лікування [88]. Так, в Індії виживаність за 10 років становить 80-85% [94] з аналогічними даними у Мексиці [94]. У США показник складає до 94-96% упродовж тривалого періоду [71, 88], проте в Кореї – 93% за 5 років і 87% – 10 років [112].
Причинами летальних випадків найчастіше були серцево-судинні ускладнення, які включали застійну СН, розрив аневризми, інсульт або кровотечу [84]. Це підтвердили дані дослідження, за якими основними причинами смерті у пацієнтів із НАА були СН (46%), ниркова недостатність (11%), інсульт (9,5%) та розрив аневризми аорти (11%) [100].
Згідно з результатами ретроспективного багатоцентрового дослідження за період спостереження, що склав орієнтовно 6,1 рік, рецидиви були у 43% випадків, судинні ускладнення – у 38% та летальні наслідки – у 5%. Виживаність упродовж 5 та 10 років без подій становила 48,2 і 36,4%, без рецидивів – 58,6 і 47,7% та без ускладнень – 69,9 і 53,7% відповідно [31].
НАА може призводити до інвалідності та погіршення якості життя пацієнтів. Так, у 74% хворих відмічають зниження щоденної діяльності та у 23% – втрату працездатності [71, 88]. C.J. Abularrage і співавт. провели вивчення якості життя, пов’язаної зі здоров’ям (QoL), у 158 осіб із НАА. Показники були гіршими порівняно з пацієнтами, які страждали на ІХС, АГ, цукровий діабет чи захворювання периферичних артерій (усі р<0,0001). За допомогою мультиваріантного аналізу предикторами кращого фізичного компонента QoL був молодий вік (р=0,003), а фізичного і психічного – ремісія захворювання (р=0,0002 і р=0,002 відповідно) [1].
Таким чином, НАА є рідкісним СВ, що вражає аорту та її гілки і призводить до розвитку стенозів/оклюзій, дилатацій та аневризм. Рідкість НАА та різнорідність клінічних проявів часто пов’язані з пізнім виявленням та затримкою лікування. Тому діагностика НАА має базуватися на оцінці клінічних проявів, лабораторних даних та методів дослідження з візуалізацією судин. При постановці діагнозу необхідно враховувати молодий вік пацієнта, що має симптоми ішемії, асиметричний АТ або ослаблення/відсутність пульсу на променевих артеріях і дані процедур із візуалізацією. Рання діагностика НАА за допомогою МРТ-ангіографії, КТ та інших методів дозволяє своєчасно призначити імуносупресивну терапію, що приводить до покращення прогнозу пацієнтів із НАА. Своєчасне лікування ГК та іншими імуносупресивними препаратами важливе для уникнення швидкого прогресування ураження судин та може запобігти незворотним серцево-судинним ускладненням. Імуносупресивні засоби залишаються наріжним каменем медикаментозної терапії, за показаннями застосовуються хірургічні чи інтервенційні втручання. Пацієнти із НАА потребують міждисциплінарного підходу і тісної співпраці терапевтів, кардіологів, ревматологів, інтервенційних кардіологів, судинних хірургів, радіологів та інших спеціалістів.
Література
- Abularrage C.J., Slidell M.B., Sidawy A.N. et al. (2008). Quality of life of patients with Takayasu’s arteritis // Journal of Vascular Surgery. – 47 (1). – Р. 131-137.
- Akazawa H., Ikeda U., Yamamoto K. et al. Hypercoagulable state in patients with Takayasu’s arteritis // Thromb Haemost. – 1996. – 75. – Р. 712-716.
- Aksu K., Donmez A., Keser G. Inflammation-induced thrombosis: mechanisms, disease associations and management // Curr Pharm Des. – 2012. – 18. – Р. 1478-1493.
- Alibaz-Oner F., Yentur S.P., Saruhan-Direskeneli G. et al. Serum cytokine profiles in Takayasu’s arteritis: search for biomarkers // Clin Exp Rheumatol. – 2015. – 33 (2, Suppl 89): S32-5.
- Amano J., Suzuki A. Coronary artery involvement in Takayasu’s arteritis. Collective review and guideline for surgical treatment // J Thorac Cardiovasc Surg. – 1991. – 102 (4). – Р. 554-560.
- An X., Han Y., Zhang B. et al. Takayasu arteritis presented with acute heart failure: case report and review of literature // ESC Heart Fail. – 2017. – 4 (4). – Р. 649-654.
- Araszkiewicz A., Prech M., Hrycaj P. et al. Acute myocardial infarction and rapid development of coronary aneurysms in young woman-Unusual presentation of Takayasu arteritis? // Canadian J of Cardiology. – 2007. – 23 (1). – Р. 61-63.
- Arend W.P., Michel B.A., Bloch D.A. et al. The American College of Rheumatology 1990 Criteria for the classification of Takayasu arteritis // Arthritis Rheum. – 1990. – 33. – Р. 1129-1134.
- Arnaud L., Haroche J., Mathian A. et al. Review Pathogenesis of Takayasu’s arteritis: a 2011 update // Autoimmun Rev. – 2011. – 11 (1). – Р. 61-67.
- Arnaud L., Kahn J.E., Girszyn N. et al. Takayasu’s arteritis: an update on physiopathology // Eur J Intern Med. – 2006. – 17. – Р. 241-246.
- Arora P., Kher V., Singhal M.K. et al. Renal artery stenosis in aortoarteritis: spectrum of disease in children and adults // Kidney Blood Press Res. – 1997. – 20 (5). – Р. 285-289.
- Bicakcigil M., Aksu K., Kamali S. et al. Takayasu’s arteritis in Turkey – clinical and angiographic features of 248 patients // Clin Exp Rheumatol. – 2009. – 27. – S59-64.
- Borazan A., Sevindik O.G., Solmaz D. et al. A rare cause of renovascular hypertension: Takayasu arteritis with only renal artery involvement // Ren Fail. – 2009. – 31 (4). – Р. 327-331.
- Brunner J., Feldman B.M., Tyrrell P.N. et al. Takayasu arteritis in children and adolescents // Rheumatology (Oxford). – 2010. – 49. – Р. 1806-1814.
- Camuglia A.C., Randhawa V.K., Lavi S. Takayasu arteritis involving the left main coronary artery treated with a bioresorbable vascular scaffold // Int J Cardiol. – 2015. – 190. – Р. 1-3.
- Castlemain T.M. Takayasu’s arteritis with associated aortic insufficiency and coronary ostial obliteration // J Am Acad Nurse Pract. – 2010. – 22 (6). – Р. 305-311.
- Chaudhry M.A., Latif F. Takayasu’s arteritis and its role in causing renal artery stenosis // Am J Med Sci. – 2013. – 346 (4). – Р. 314-318.
- Chougule A., Bal A., Das A., Jain S., Bahl A. Uncommon associations and catastrophic manifestation in Takayasu arteritis: an autopsy case report // Cardiovasc Pathol. – 2014. – 23 (5). – Р. 313-316.
- Cid M.C., Font C., Coll-Vinent B., Grau J.M. Large vessel vasculitides // Curr Opin Rheumatol. – 1998. – 10. – Р. 18-28.
- Clifford A., Hoffman G.S. Recent advances in the medical management of Takayasu arteritis: an update on the use of biologic therapies // Curr Opin Rheumatol. – 2014. – 26. – Р. 7-15.
- Cohen Tervaert J.W. Cardiovascular disease due to accelerated atherosclerosis in systemic vasculitides // Best Pract Res Clin Rheumatol. – 2013. – 27 (1). – Р. 33-44.
- Comarmond C, Cluzel P, Toledano D, et al. Findings of cardiac magnetic resonance imaging in asymptomatic myocardial ischemic disease in Takayasu arteritis // Am J Cardiol. – 2014. – 113. – Р. 881-887.
Повний список літератури знаходиться в редакції.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (60) листопад 2018 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




