Механизмы статинассоциированных побочных эффектов
К настоящему времени изучено большое количество соединений, обладающих гиполипидемическим действием и имеющих различную химическую природу.
Среди лечебных препаратов, способных снижать в крови содержание холестерина (ХС), триглицеридов (ТГ) и, соответственно, липопротеинов, в состав которых входят эти липиды, наибольшее признание получили статины, секвенаторы желчных кислот, фибраты, никотиновая кислота, ингибитор абсорбции ХС в кишечнике, омега‑3 полиненасыщенные жирные кислоты.
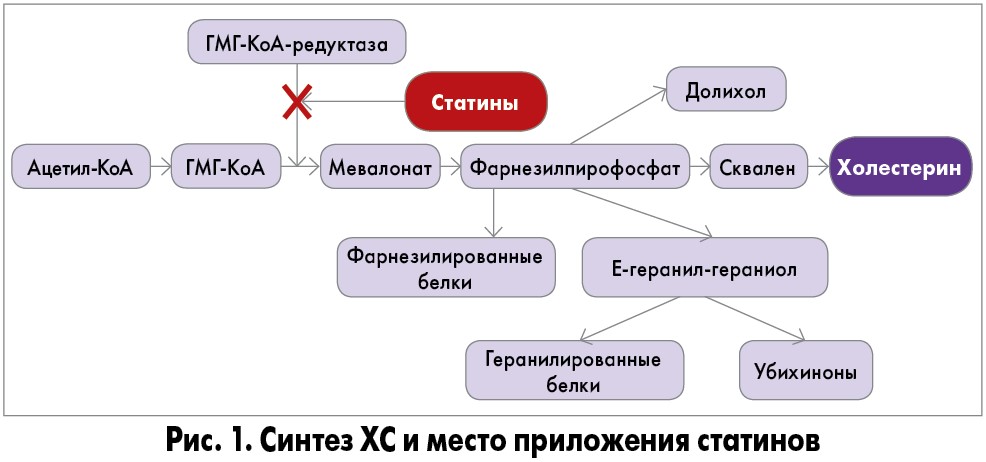
Особого внимания заслуживает рассмотрение возможностей применения статинов и побочных эффектов, отмеченных в последнее время, для этих лекарственных средств. Показано, что статины подавляют активность 3-гидрокси‑3-метилглутарил-коэнзим А редуктазы (ГМГ-КоА-редуктаза) – фермента, лимитирующего скорость биосинтеза ХС в организме по конкурентному принципу (рис. 1).
В организме статины накапливаются преимущественно в печени, где подавляют синтез ХС, что приводит к снижению его содержания и образованию дополнительного количества рецепторов для аполипопротеинов В, Е (АпоВ/Е) на плазматических мембранах. В результате увеличивается захват гепатоцитами ХС липопротеинов низкой плотности (ХС ЛПНП) для обеспечения клеток ХС, необходимым для образования желчных кислот. Это приводит к снижению уровня ХС ЛПНП и ХС в крови.
В клинической практике нашли применение такие статины, как ловастатин, правастатин, симвастатин, флувастатин, аторвастатин, розувастатин. К основным эффектам статинов относят снижение ХС, ХС ЛПНП, ТГ, а к плейотропным (дополнительным, не липидным) – антитромботическое, противовоспалительное и антиоксидантное действие, снижение периферического сопротивления.
Хотя на сегодняшний день статины являются наиболее часто назначаемыми фармацевтическими препаратами, они стали одним из самых противоречивых классов лекарственных средств. В течение многих лет отрицались жизнеугрожающие побочные эффекты данных препаратов, а на первый план выдвигались их очевидные преимущества. Список нежелательных явлений у статинов достаточно большой. Неблагоприятные события на фоне приема статинов включают миопатию, рабдомиолиз, диспепсию, метеоризм, запор, головную боль, миалгию, сахарный диабет, нарушение сократимости миокарда, аутоиммунные заболевания, эректильную и митохондриальную дисфункцию, нарушение сна, нейропатию [1-6]. Опубликовано около 900 исследований, связанных с указанными побочными эффектами статинов [7].
Побочные реакции статинов
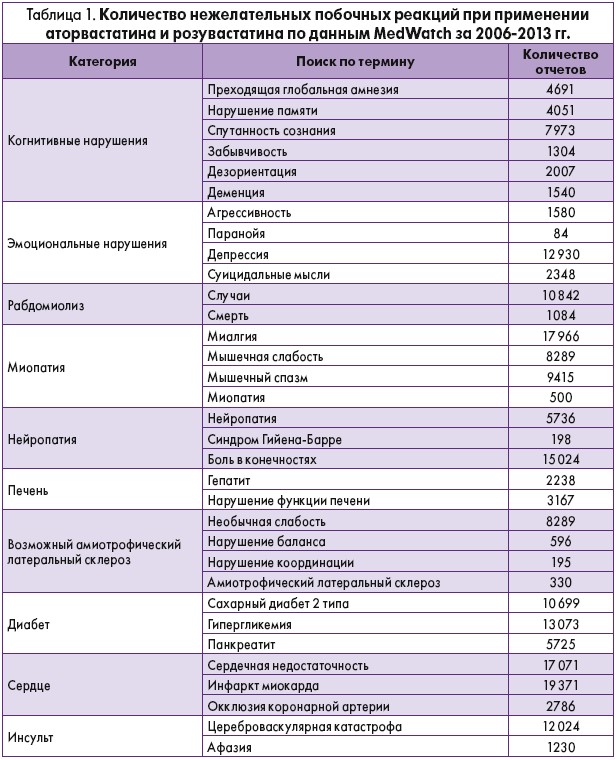
В 2006 г. FDA открыло базу данных MedWatch для тех, кто хотел проверить статус отчетов о побочных эффектах статинов [8]. В таблице 1 приведены данные MedWatch за 2006-2013 гг., основанные на побочных эффектах аторвастатина (Lipitor) и розувастатина (Crestor).
P. Thompson и соавт. [9] осуществили поиск в PubMed метаанализов и обзоров возможных побочных явлений статинов с использованием логической поисковой системы «статин» и «побочный эффект» (рис. 2).
Статинассоциированные мышечные симптомы
Статинассоциированные мышечные симптомы (САМС) – наиболее распространенные побочные эффекты статинов, проявляются у пациентов, получающих данный вид терапии, с частотой до 10% [10, 11]. Понятие САМС включает в себя следующие симптомы:
- миалгия (мышечная боль);
- миопатия (мышечная слабость);
- миозит (мышечное воспаление);
- мионекроз (мышечное повреждение);
- рабдомиолиз (миоглобулинурия и/или острое повреждение почек).
Механизмы, лежащие в основе возникновения статининдуцированного повреждения мышц, до сих пор до конца не ясны. Однако результаты клинических исследований убедительно свидетельствуют о том, что все статины проявляют токсичность для скелетно-мышечной системы, причем некоторые из них наиболее токсичны [12]. В данном случае особое значение имеют химические свойства молекул. Так, липофильные статины, такие как симвастатин и ловастатин, могут проникать через клеточную мембрану путем диффузии и более широко распределяться в клетках печени по сравнению с гидрофильными статинами (правастатин). Это является одной из основных причин вероятного воздействия на мышцы [13]. Токсичность статинов также связана с увеличением их биодоступности из-за нарушения метаболизма, которое возникает у людей пожилого возраста или при нарушении функции печени, почечной недостаточности. Показано влияние интерференции лекарственных препаратов при одновременном лечении статинами, что приводит к увеличению частоты повреждения мышц [14]. Симвастатин, аторвастатин и ловастатин метаболизируются изоферментом 3А4 цитохрома Р450 (CYP3A4) [15]. Интересно, что более 60% зарегистрированных случаев рабдомиолиза, вызванного этими статинами, отмечалось при совместном введении препаратов, которые ингибируют или конкурируют за систему CYP3A4. К таким относят ингибиторы протеазы, циклоспорин, амиодарон, макролидные антибиотики и противогрибковые лекарственные средства [16]. В противоположность этому флувастатин и розувастатин биотрансформируются в основном системой CYP2A9, а правастатин подвергается метаболизму в почках. Данные фармакокинетические свойства могут повышать риск миопатии из-за взаимодействия между лекарственными препаратами [17, 18]. Особое значение имеет связь гемфиброзила и афибрата, которые применяются в сочетании со статинами у пациентов со смешанной дислипидемией. Совместное использование гемфиброзила со статинами (ингибирует глюкуронизацию, конкурирует за УДФ-глюкуронил-трансферазу 1А1 и 1А3) приводит к повышению в плазме уровней аторвастатина, ловастатина, правастатина, симвастатина [19]. В связи с этим сочетание статинов с гемфиброзилом связано с большим риском развития миопатии по сравнению с фибратами, которые используют другие системы для своего метаболизма, например фенофибрат и безафибрат.
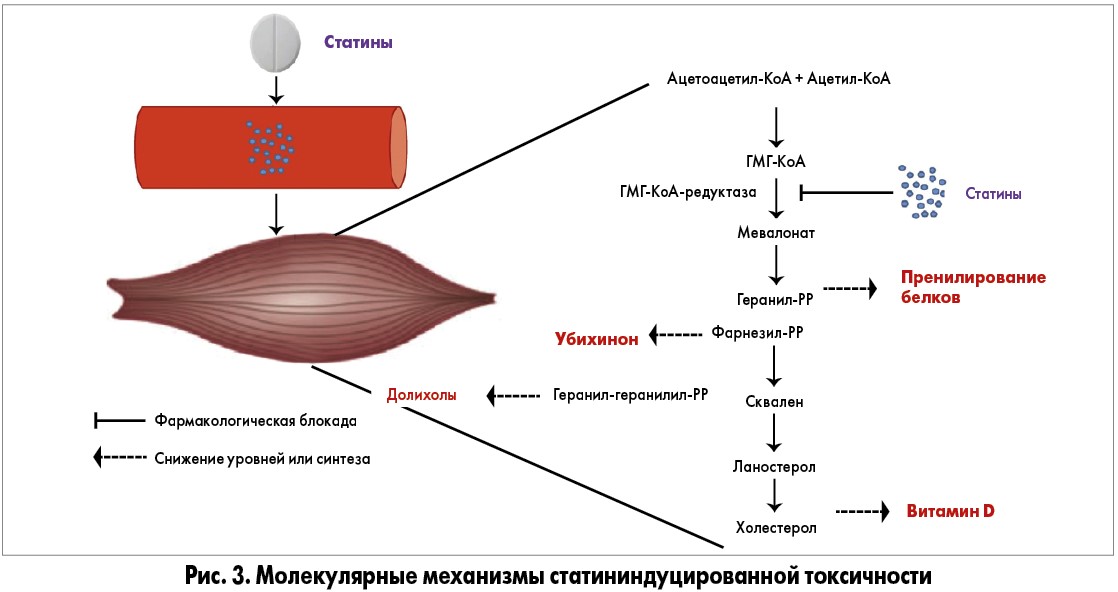
В биопсийном материале, полученном от пациентов с миопатией после лечения статинами, наблюдается вакуолизация внутриклеточной тубулярной системы с интактной сарколеммой [20, 21]. Интересно, что эти признаки были обнаружены при отсутствии увеличения активности креатинкиназы. Следующим важным аспектом статининдуцированной миопатии является тканевая специфичность (миокард и гладкие мышцы не затрагиваются) [22, 23]. Уязвимость скелетных мышц может быть объяснена более высокой чувствительностью этой ткани к индуцированному статинами ингибированию синтеза ХС. Как показали исследования in vitro, значения коэффициента концентрации полумаксимального ингибирования (IC50) для ингибирования ГМГ-КоА-редуктазы в клетках скелетных мышц человека в 40 раз ниже, чем в гепатоцитах [24]. Кроме того, статины способствуют образованию небольшого количества реактивных форм кислорода (РФК) в клетках сердца, активируя тем самым защитные механизмы митохондриального биогенеза, тогда как в скелетных мышцах вырабатывается гораздо большее количество РФК, которые запускают вредоносные эффекты и влияют на функцию митохондрий. Эксперименты на крысах, получавших симвастатин, выявили селективность миотоксичности статинов по отношению к быстро сокращающимся мышцам, которые содержат преимущественно гликолитические волокна типа IIВ, по сравнению с медленно сокращающимися мышцами, содержащими волокна типа I [25]. Терапия симвастатином снижает содержание в мышцах белков, гликогена, нуклеиновых кислот и липидов, что приводит к увеличению текучести мембран. Биохимические изменения были более выражены в быстро сокращающихся мышцах (мышца разгибателя пальцев) по сравнению с медленными или смешанными мышечными волокнами (камбаловидная и мышца диафрагмы) [26]. Эксперименты с клетками скелетных мышц крыс показали, что изменения в синтезе белка и жизнеспособности клеток, вызванные статинами, возвращаются к исходному уровню при введении мевалоната, являющегося прямым продуктом реакции, катализируемой ГМГ-КоА-редуктазой. Следовательно, токсические эффекты статинов могут быть результатом действия этих препаратов на их цель – фермент ГМГ-КоА-редуктазу. Степень повреждения клеток также положительно коррелирует с дозой статина и его эффективностью в ингибировании активности ГМГ-КоА-редуктазы. Ингибирование сквален-синтазы (фермента, ответственного за синтез сквалена в мевалонатном пути) не приводит к токсичности в культивируемых клетках скелетных мышц [27]. Эти наблюдения позволяют предположить, что причиной токсичности является снижение доступности метаболитов, продуцируемых мевалонатным путем, включая внутриклеточный ХС, но не исключает, что снижение ХС ЛПНП само по себе может способствовать увеличению доступности внутриклеточного ХС и приводить к изменениям в мышцах (рис. 3).
Мевалонатный путь является ключевым клеточным метаболическим путем, сохраняющимся у всех высших эукариот. Он – основа для синтеза ХС, важного компонента всех биологических мембран, и предшественник синтеза стероидных гормонов, витамина D и желчных кислот. В дополнение к холестериновому пути мевалонат имеет важное значение для производства диметилалил пирофосфата и изопентенил пирофосфата, изопреновых звеньев, которые служат строительными блоками для биосинтеза геранил пирофосфата и фарнезил пирофосфата. Последние используются в нескольких процессах, таких как терпеноидный синтез, пренилирование белков и N-гликозилирование [28]. Пренилирование белков является посттранскрипционной модификацией, которая особенно важна для клеточного гомеостаза. Добавление изопреноидной липофильной группы приводит к конформационным изменениям или закреплению на клеточных мембранах, которые необходимы для функционирования участвующих в этих процессах белков. Типичными примерами являются пренилирование ГТФ-азы, ламинов и т-РНК. Небольшие ГТФ-азы (белки Ras и Rab) участвуют в регуляции внутриклеточной передачи сигнала и везикулярного транспорта. Их прениляция снижается при действии статинов, что приводит к апоптотической гибели клеток [29, 30].
Пренилированные ламины – основной компонент внутреннего ядра, регулируют транскрипцию генов и механические свойства ядра, его структурные изменения и хроматин, что наблюдается в миоцитах, инкубированных с высокими дозами статинов. Это индуцирует апоптоз. Исследования экспрессии генов в культивируемых клетках и тканях показали, что гены, вовлеченные в биосинтез ХС, являются потенциальными факторами, лежащими в основе изменений мышечной функции, наблюдаемой у пациентов, получавших статины, что указывает на связь между блокадой синтеза ХС и активацией апоптических путей. Другие важные производные изопреноидов – долихолы, полиизопрены, которые опосредуют N-гликозилирование полипептидов, а также убихинон, известный как коэнзим Q10, являющийся компонентом дыхательной цепи. Индуцированное статинами снижение внутриклеточного уровня этих молекул нарушает экспрессию и локализацию мембранных белков, снижая окислительный метаболизм, что приводит к дисфункции митохондрий и в некоторых случаях к гибели клеток [31].
Важный метаболит, полученный из ХС, – витамин D, который вырабатывается путем превращения 7-дегидрохолестерина под действием ультрафиолетового света в витамин D3 в коже. Из-за дефицита этого витамина возникает мышечная слабость, боль. Уровень витамина D3 <30 нмоль/л связан со снижением силы мышц [32]. Перекрестное исследование у пациентов, получавших статины, показало, что низкие уровни витамина D, проявляющиеся в жалобах пациентов на боль в мышцах, были статининдуцированы. [33].
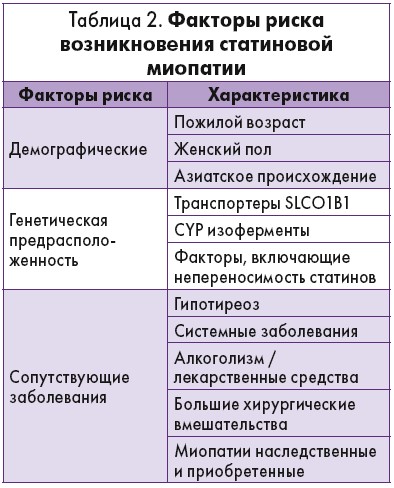 Факторы риска статининдуцированной миопатии представлены в таблице 2.
Факторы риска статининдуцированной миопатии представлены в таблице 2.
Симптомы статининдуцированной миопатии возникают в мышцах предплечья, плеч, таза и бедер. На поздней стадии заболевания могут быть затронуты мышцы ног и рук. Общие жалобы, особенно в нижней части тела, включают в себя судороги, ощущение тяжести, жесткости. При симптомах рабдомиолиза наблюдаются сильные мышечные боли по всему телу, темная моча, мышечная слабость, повреждение почек. У физически активных лиц чаще отмечается миопатия по сравнению с теми, кто ведет сидячий образ жизни.
Действие статинов на центральную нервную систему; когнитивные нарушения
Среди сообщений о побочных эффектах статинов когнитивные нарушения уступают только САМС [34]. Гиперлипидемия является установленным фактором риска при болезни Альцгеймера и деменции [35]. Имеется приблизительно 60 сообщений о случаях статинассоциированных побочных эффектов, связанных с потерей памяти или слабоумием, которые прекращаются после отмены статинов [36]. Если учитывать широкое использование указанных лекарственных средств, то данное количество отчетов является небольшим. Это можно объяснить тем, что побочное влияние статинов на память игнорируют или ошибочно относят к старческому возрасту, другим сопутствующим заболеваниям. В 2 рандомизированных клинических исследованиях с участием 308 взрослых пациентов, которые принимали 10 или 40 мг симвастатина в течение 6 мес, и 209 лиц, использовавших 20 мг ловастатина на протяжении 6 мес, обнаружили, что у больных с гиперхолестеринемией наблюдалось снижение познавательной способности при терапии статинами [37, 38]. В 2012 г. FDA на основании отчетов о нежелательных явлениях изменила маркировку для статинов, указав: « снижение памяти, забывчивость и дезориентация были зарегистрированы при использовании статинов. Эти проявления исчезали при отмене статинов.» [39].
Механизмы возможных эффектов статинов на ЦНС
Статины могут влиять на центральную нервную систему (ЦНС) напрямую, подавляя синтез ХС, или косвенно, изменяя другие соединения, участвующие в когнитивной функции. В мозге ХС является относительно инертным с периодом полураспада от 6 мес до 5 лет. Всего лишь 0,02% от общего количества ХС ежедневно обновляется [40], поэтому прямое ингибирование синтеза ХС считается маловероятным механизмом для возможного эффекта статинов в ЦНС (особенно краткосрочных). Необходимо отметить, что статины различаются по своим способностям преодолевать гематоэнцефалический барьер (липофильные вещества проникают более свободно, чем гидрофильные). Таким образом, эффект любого статина зависит от самого статина, а также от его дозы и продолжительности лечения.
Сахарный диабет и терапия статинами
В масштабном рандомизированном клиническом исследовании JUPITER показан риск развития сахарного диабета (СД) при терапии статинами[41]. Всего в исследование было включено 17 802 участника, которые принимали розувастатин 20 мг/день (n=8901) или плацебо (n=8901), с ХС ЛПНП ≤130 мг/дл и высокочувствительным С-реактивным белком (hs-CRP) ≥2 мг/дл. После приблизительно 2 лет наблюдений отмечено, что количество новых случаев СД было на 0,6% выше в группе пациентов, принимавших розувастатин 20 мг/день. Исследование JUPITER было первым, в котором наблюдалось увеличение новых случаев СД, возможно, потому что критерии включения требовали повышенного hs-CRP как одного из маркеров инсулинорезистентности [42], а пациенты, принимавшие статины (41%) или плацебо (41,8%), имели метаболический синдром.
В исследовании PROSPER установлено 32% увеличение частоты новых случаев СД в группе правастатина (40 мг/сут) по сравнению с контролем, а в дополнительном анализе исследования PROVEIT TIMI 22 показано существенное повышение гликированного гемоглобина (HbA1c >6%) у больных с/без СД при терапии статинами.
Факторы риска статинассоциированного СД
Риск СД во время терапии статинами увеличивается, если присутствуют обычные факторы риска СД, зависит также от дозы статина и этнической принадлежности. Так, участники исследования JUPITER, у которых было ≥1 фактора риска СД (глюкоза натощак >100 мг/дл, индекс массы тела >30 кг/м2 или HbA1c >6%), имели 28% увеличение риска по сравнению с пациентами без указанных факторов [43]. Не отмечено новых случаев СД среди тех, кто не имел факторов риска на исходном уровне. При этом к факторам риска относят пожилой возраст, женский пол и азиатское происхождение.
Механизмы статинассоциированного СД
Каким образом статины увеличивают риск СД пока неясно, однако этому может способствовать низкий уровень ХС при их использовании. Изменения содержания ХС в клетке могут нарушать секрецию инсулина путем трансформации функционирования потенциалзависимых Ca2+ каналов в β-клетках поджелудочной железы, тем самым уменьшая взаимодействие молекул инсулина с клеточной мембраной для последующего экспорта [44]. Статины также могут снизить периферическую чувствительность к инсулину или метаболизм глюкозы путем уменьшения митохондриальной функции миоцитов или через влияние на метаболизм мышц. Статины изменяют активность группы генов FOXO, которые принимают участие в окислении углеводов [45]; могут оказывать губительное воздействие на адипоциты и митохондриальную функцию β-клеток поджелудочной железы, снижать экспрессию адипоцитов, отвечающих за инсулиновый переносчик глюкозы GLUT4 [46-49]. Таким образом, все статины способны к небольшому увеличению относительного и абсолютного риска развития СД. Однако этот риск значительно превосходит их пользу. 28 февраля 2012 г. FDA опубликовало сообщение, где говорится о том, что пациенты, получающие терапию с применением статинов, могут иметь повышенный риск развития гипергликемии и СД 2 типа.
Повышение функциональных печеночных тестов
Действие статинов часто связано с повышением функциональных печеночных тестов, особенно в начале лечения (первые 12 нед) [50]. Увеличение активности трансаминаз наблюдается у 1-3% пациентов и обычно не связано с печеночной дисфункцией. Нет существенных различий между действием статинов в отношении гепатотоксичности. Случаи печеночной недостаточности из-за использования статинов чрезвычайно редки, а клинические проявления имеют бессимптомный характер. Перед началом терапии статинами полезно оценить исходную функцию печени рутинным мониторингом. Пациенты с умеренным нарушением активности трансаминаз могут принимать статины только под тщательным контролем. Последние рекомендации не требуют регулярного мониторинга функциональных печеночных проб из-за редкости основных заболеваний печени при использовании статинов [51].
Влияние статинов на функцию почек
Статины могут влиять на почки двумя основными путями. Во-первых, рабдомиолиз может вызывать обструкцию почечных канальцев, что приводит к их повреждению и ишемии. Во-вторых, терапия статинами может быть связана с легкой формой протеинурии из-за ингибирования канальцевой реабсорбции низкомолекулярных белков. В клинических исследованиях показано, что дозы статинов, превышающие терапевтические, могут вызвать повреждение почечных канальцев [52]. Однако в рутинной клинической практике частота выявления почечной недостаточности у пациентов, получающих терапию статинами, является низкой и составляет 0,3-0,6 случая на 1 млн назначений. При использовании всех известных статинов достаточно редко регистрируются случаи развития гематурии и протеинурии. Прием статинов не может быть причиной развития острой и хронической почечной недостаточности (исключение составляет рабдомиолиз). Использование терапевтических доз статинов обычно не сопровождается развитием выраженной протеинурии. Это может быть скорее физиологической реакцией, а не следствием токсического влияния, так как снижение концентрации мевалоната под действием ингибиторов ГМГ-КоА-редуктазы нарушает рецептор-опосредованный эндоцитоз альбумина в проксимальных канальцах, снижая его реабсорбцию и приводя к появлению протеинурии. Тем не менее до начала терапии статинами оправданной является оценка состояния функции почек (рутинное мониторирование креатинина и протеинурии не требуется). При нарастании уровня креатинина у пациентов без признаков рабдомиолиза не показан полный отказ от терапии статинами, однако коррекция дозы целесообразна.
Статины и геморрагический инсульт
Механизмы, посредством которых статины могут повышать частоту геморрагических инсультов, изучены недостаточно. Известно, что данный класс лекарственных средств обладает антитромботическим и фибринолитическим действием, поэтому они могут повышать активность других фибринолитических агентов [53]. Если суммировать результаты международных рандомизированных клинических исследований, то следует констатировать, что статины снижают частоту ишемических инсультов, но повышают при этом риск развития геморрагических [54, 55].
Онкологические заболевания и статины
Связь между статинами и раком являлась предметом интереса с момента первых исследований (80-е гг. ХХ ст.), когда наблюдали подавление статинами функции лимфоцитов in vitro. В 1996 г. обнаружено, что ингибирующая активность симвастатина в отношении синтеза стерола в лимфоцитах была в 430 раз более сильной, чем у правастатина [56, 57]. Однако результаты экспериментов на животных и людях показывают, что следует избегать медикаментозного лечения, снижающего уровень липидов, за исключением пациентов с высоким риском развития ишемической болезни сердца. Ангиогенез является необходимой особенностью процессов заживления и восстановления в организме, но, как и большинство процессов, находится под строгим контролем. При повышенной активности ангиогенез – основной фактор развития рака. В некоторых исследованиях показано, что высокие уровни ХС могут быть необходимы для оптимального функционирования иммунной системы. Эффекты снижения ХС и коэнзима Q10, являющихся ключевыми питательными веществами для иммунной системы, могут повысить восприимчивость к раку (особенно в высоких дозах). На сегодняшний день вопрос о том, обладают ли статины канцерогенным или антиканцерогенным эффектом, остается открытым. Хотя рост опухолевых клеток in vitro, как правило, подавляется в присутствии липофильных статинов, клинические данные об их противоопухолевом действии противоречивы. Поэтому использование статинов с целью профилактики онкологических заболеваний не может быть рекомендовано из-за отсутствия убедительных данных.
Лекарственные взаимодействия статинов
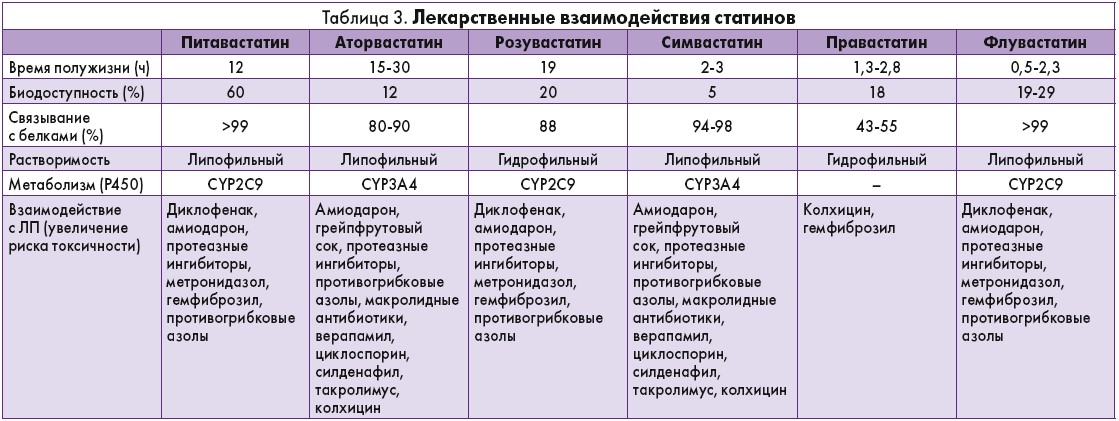
Важно отметить, что статины имеют многочисленные потенциальные взаимодействия с другими лекарственными средствами, которые могут увеличить риск нежелательных реакций и проявить токсичность. Все препараты статинов, кроме правастатина, метаболизируются группой ферментов цитохрома Р450. Ингибиторы этих ферментов могут повышать уровень статинов. Аторвастатин, симвастатин и правастатин также являются субстратами для Р-гликопротеина, который служит транспортным каналом лекарственных средств в желудочно-кишечном тракте. Лекарственные взаимодействия статинов представлены в таблице 3.
Выводы
Многолетний клинический опыт использования статинов показал, что степень снижения ХС и ХС ЛПНП в значительной мере зависит от конкретного типа применяемого статина и дозы лекарственного средства. В современных рекомендациях постоянно подчеркивается, что частота назначений статинов лицам, имеющим показания к их использованию, далека от идеальной. Поэтому перед назначением статинов и в процессе лечения необходимо оценить возможные риски у каждого конкретного пациента на основании лабораторных тестов.
Базисные тесты перед назначением статинов: липидный профиль, глюкоза натощак, оценка скорости клубочковой фильтрации, соотношение альбумин/креатинин в моче, уровень тиреотропного гормона, активность креатинкиназы, АЛТ, АСТ.
После начала приема статинов при первом наблюдении: липидный профиль, HbA1c, АЛТ, АСТ, креатинкиназа, скорость клубочковой фильтрации.
При назначении статинов врач-клиницист всегда должен взвешивать соотношение риск/польза.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 12 (457), червень 2019 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....