Повторный тромбоз стента: причина и особенности терапии
Рассмотрим клинический случай пациента с повторным тромбозом стента. Мужчина, 47 лет, поступил ургентно в реперфузионный центр с жалобами на выраженную сжимающую боль в области сердца, за грудиной с иррадиацией в левую руку.
Анамнез: артериальная гипертензия (АГ) в течение многих лет, не лечился.
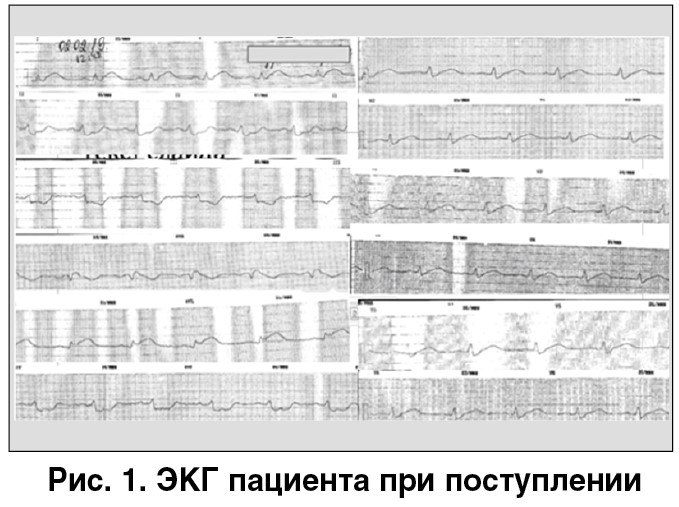 02.02.2019, 10:00 – внезапно появилась боль за грудиной, принял валидол, капли от сердца – без эффекта. Вызвана скорая медицинская помощь, на месте снята электрокардиограмма (ЭКГ): синусовый ритм, частота сердечных сокращений (ЧСС) – 80 уд./мин. Элевация интервала ST по передней стенке левого желудочка (ЛЖ) до 5 мм (рис. 1). Больной ургентно госпитализирован для первичного чрескожного коронарного вмешательства (ЧКВ).
02.02.2019, 10:00 – внезапно появилась боль за грудиной, принял валидол, капли от сердца – без эффекта. Вызвана скорая медицинская помощь, на месте снята электрокардиограмма (ЭКГ): синусовый ритм, частота сердечных сокращений (ЧСС) – 80 уд./мин. Элевация интервала ST по передней стенке левого желудочка (ЛЖ) до 5 мм (рис. 1). Больной ургентно госпитализирован для первичного чрескожного коронарного вмешательства (ЧКВ).
Объективно: состояние тяжелое. Кожные покровы бледные, отеков нет. Избыточный вес. Частота дыхания – 18 движений в минуту, Killip I. Тоны сердца глухие, АД 160/120 мм рт. ст.; ЧСС – 85 уд./мин. Тропонин I – 0,1 нг/мл (+). Коронароангиография (КАГ) и первичная ЧКВ лучевым доступом. Преобладающий тип: правый. Передняя нисходящая ветвь левой коронарной артерии (ЛКА): норма. Огибающая артерия: норма. Правая коронарная артерия: норма. Ствол ЛКА: норма. Огибающая ветвь ЛКА: норма. Коллатерали: нет. Критический стеноз передней межжелудочковой ветви (ПМЖВ) ЛКА. Проведено стентирование (стент Integrity). Дистальный кровоток TIMI III (рис. 2). Назначена стандартная терапия: ацетилсалициловая кислота, тикагрелор, эноксапарин, аторвастатин, бисопролол, рамиприл, эплеренон, пантопразол.
06.02.2019 в состоянии покоя наблюдался повторный ангинозный статус. Проведены ургентная КАГ и повторное стентирование.
КАГ: Острый тромбоз стента в ПМЖВ ЛКА (рис. 3). Реканализация ПМЖВ, получен дистальный кровоток по инфаркт-зависимой артерии. Пластика в стенте 2 осуществлена баллон-катетерами River. В данной ситуации нельзя было исключить диссекцию дистальнее стента, поэтому имплантирован стент Integrity по методике «стент в стент».
Контрольная КАГ: артерия проходима, дистальный кровоток TIMI II. Продолжена антитромботическая терапия в полном объеме.
08.02.2019 у пациента впервые возник пароксизм мерцательной аритмии. Купирован, более не возобновлялся.
13.02.2019 повторно возник ангинозный приступ, заподозрен повторный тромбоз стента. Вновь в срочном порядке проведена КАГ, по результатам которой установлена острая окклюзия в стенте в ПМЖВ ЛКА.
Проведено ЧКВ: реканализация ПМЖВ. Тромбэкстракция двумя аспирационными катетерами Capture. Интракоронарно введен интегрилин. Пластику в стенте реализовано баллон-катетером River.
Контрольная КАГ: артерия проходима, дистальный кровоток TIMI II (рис. 4).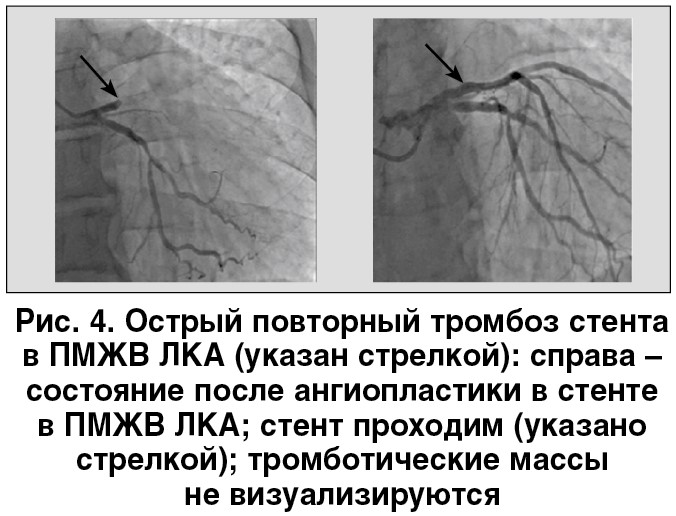
Учитывая отсутствие данных о повторной мальпозиции стента, диссекции КА, эффективности современной антитромботической терапии в полном объеме и ее продлении с учетом первого тромбоза стента, перед врачами встала необходимость дифференцировать резистентность к тикагрелору или наличие иной природы тромбоза стента как проявления сопутствующего заболевания в сочетании с атеросклерозом. Для решения вопроса о наличии резистентности к антитромбоцитарным препаратам проведена серия исследований световой агрегатометрии с индуктором АДФ (конечная С – 5 мкмоль/л) с тикагрелором по 90 мг дважды в день, клопидогрелем в нагрузочной дозе 600 мг, назначена терапия клопидогрелем в стандартной дозе 75 мг/сут. Получены следующие результаты: тикагрелор (14.02.2019) – 12,6% (N33%); клопидогрель, нагрузочная доза (15.02.2019) – 31,2%; продолжение лечения (25.02.2019): 12,3%, что доказало отсутствие резистентности и достаточный антиагрегантный эффект обоих препаратов.
Для определения сопутствующей патологии как причины тромбоза стента проведен более тщательный расспрос больного и выяснено наличие частых артралгий в анамнезе. Дополнительный анализ всех параклинических данных показал ряд их особенностей. Общий анализ крови – сохранение лейкоцитоза (12,1‑12,8‑9,2 Г/л с абсолютным лимфоцитозом – 32‑37‑32%), постоянно сниженная скорость клубочковой фильтрации (СКФ) – 30,0‑30,0‑38 мл/мин, повышение уровня С-реактивного белка – 96 мг/л, общих циркулирующих иммунных комплексов (0,115 ед. опт. пл.), при отсутствии специфического гуморального ответа на стрептококковую инфекцию (АСЛ-О), серонегативный ревматоидный фактор, наряду с гиперхолестеринемией (6,0 ммоль/л) и верхними значениями нормы международного нормализованного значения (МНО, 1,3) при поступлении.
Начальная ЭхоКГ (04.02.2019) выявила фракцию выброса (ФВ) – 54,91%, нормальный тип геометрии левого желудочка (ЛЖ), отсутствие расширения полостей сердца, незначительную недостаточность створок митрального (МК) и трикуспидального клапана (ТК), фиброз створок МК, аортального клапана (АК), корня аорты. Расхождение листков перикарда по задней стенке ЛЖ – 0,7 см, гидроперикард с небольшим количеством жидкости.
Последующая ЭхоКГ (14.02.2019): сохранение ФВ ЛЖ – 50,5%; аналогичная характеристика МК и ТК, гипокинезия и утоньшение всех отделов межжелудочковой перегородки (МЖП) – была 1,45, стала 1,1 см, верхушки ЛЖ. Организованный тромб в области верхушки ЛЖ.
УЗИ сосудов конечностей (15.02.2019): нижних – артерии и вены без особенностей; верхних (без локальных поверхностных признаков воспаления и экхимозов, лучевой доступ при КАГ, ЧКВ) – пристеночные слабоорганизованные тромботические массы, стенозирующие просвет правой лучевой артерии на 15‑20%, глубокие и поверхностные вены проходимы.
Таким образом, развитие воспаления с лимфоцитозом, снижение функции почек, фиброз и недостаточность МК и ТК с незначительным перикардитом уже при поступлении, наличие тромбозов без локального воспаления в местах манипуляций, тромб ЛЖ на фоне гипокоагуляции на верхней границе нормы позволили заподозрить возникновение тромбофилии, наиболее вероятно, аутоиммунного генеза.
Были проведены дополнительные исследования на фоне недельной терапии глюкокортикостероидами (ГКС) по 16 мг/сут (20.02.2019): гомоцистеин – 22,98 мкмоль/л (N до 12), волчаночный антикоагулянт (ВА) – 60,5 с (N до 44 с), LA-Auto – 1,6994 (умеренный риск), антитела IgG к β2-гликопротеиду I – 35,2 Ед/мл (умеренно позитивные), антитела к кардиолипину – 19,5 Ед/мл (слабо позитивные), позитивные антинуклеарные антитела и антитела к 2-спиральной ДНК дали основание заключить о наличии у больного вторичного антифосфолипидного синдрома (АФС) (тройной позитивный, высокий риск тромбозов [1]: 10-летний – 37%, годичный – 5,3%) как следствия возможной системной красной волчанки (СКВ) (поражение сердца, суставов (?), почек, признаки аутоиммунного воспаления: повышение титров антифосфолипидных антител, антинуклеарных антител, антител к 2-спиральной ДНК, лейкоцитоз с лимфоцитозом).
Даны рекомендации по продолжению комплексной антитромботической терапии: двойная терапия клопидогрелем + лечение ривароксабаном по 15 мг. Поддерживающая доза ГКС (4‑8 мг/с). Статинотерапия умеренной интенсивности; на фоне месячного применения 20 мг/сут аторвастатина общий холестерин (ОХС) – 3,0 ммоль/л; липопротеины низкой плотности (ЛПНП) – 1,7 ммоль/л. В течение четырех месяцев больной жалоб не предъявляет.
Обоснование характера антитромботической терапии требует отдельных пояснений, поскольку находится вне четких рекомендаций в связи с редкостью подобных случаев. До последнего времени стандартом использования антикоагулянтов при АФС являлся варфарин, однако среди пациентов не было стентированных. В нашем случае больному уже было проведено стентирование до установления диагноза, соответственно, он нуждается в обязательном антитромбоцитарном препарате.
Основными требованиями к антитромботическому лечению являются эффективность и безопасность. Если экстраполировать указанные условия на наш случай, то по результатам недавнего многоцентрового исследования PIONEER было убедительно доказано, что двойная терапия клопидогрелем и ривароксабаном в сниженной дозе (15 мг/сут) не уступает по эффективности тройной терапии аспирин + клопидогрель + варфарин (кардиоваскулярная смерть, инфаркт миокарда или инсульт): относительный риск (ОР) 1,08; 95% доверительный интервал (ДИ) 0,69‑1,68; p=0,750 [2]. Более того, такое лечение является значительно более безопасным в отношении кровотечений (TIMI большие, малые или требующие медицинского внимания): ОР 0,59; 95% ДИ 0,47‑0,76; p<0,001. Последнее особенно значимо в связи с необходимостью постоянной терапии ГКС и их ульцерогенным действием.
Наш больной – ВА+, поэтому контроль МНО при терапии варфарином дополнительно затруднен. Вопрос сохранения дозы 15 мг ривароксабана, несмотря на низкий уровень СКФ, связан с необходимостью более высокого уровня антикоагуляции (поддержание МНО – 3,0‑3,5 на варфарине) при наличии артериальных тромбозов аутоиммунного генеза [3]. Использование пероральных антикоагулянтов при АФС (но без отдельного рассмотрения ситуаций стентирования) широко рассмотрено в современном обзоре Cohen et al. [4]. На сегодняшний день наибольшая база данных имеется по применению ривароксабана. Закончено исследование RAPS – фаза 2/3 [5]. Так, 116 лиц с ВТЭ (АФС-антитела +/-) получали 20 мг/сут орального ривароксабана в течение 180 дней (исключены больные АФС, принимавшие варфарин, с терапевтическим МНО 2,0‑3,0).
Все пациенты соответствовали международным критериям АФС, при этом тест на АФС-антитела (28% – тройные позитивные, как в нашем клиническом случае) проводили согласно национальным и международным рекомендациям. Все больные СКВ соответствовали пересмотренным критериям Американского колледжа ревматологов (ACR) и были проверены в клиниках волчанки опытными клиницистами по стандартным показателям активности и оценки повреждений, хотя результаты не были частью этого исследования. Средний период наблюдения составил 210 дней: в течение шести месяцев у больных не было ВТЭ, ривароксабан не уступал варфарину по эффективности, при этом у больных отмечалось улучшение качества жизни. Именно ривароксабан подавлял генерацию тромбина в цельной крови, а также достоверно снижал С3а-компонент комплемента, ограничивая образование терминального мембран-атакующего комплекса (SC5b‑9), что ведет к ограничению активации комплемента; как известно, активация этих механизмов наблюдается при СКВ.
Выводы
Для данного клинического случая характерно сочетание острого коронарного синдрома и стентирования с тромбофилией, что обусловило чрезвычайно высокий тромботический риск и привело к повторным артериальным тромбозам несмотря на адекватную и эффективную антитромботическую терапию. Важной клинической особенностью считается тот факт, что наличие тромбоза стента, не связанное с погрешностями манипуляции, не является всегда прямым следствием резистентности к антитромбоцитарному препарату. Таковая должна быть подтверждена. Стандартный и действенный метод – световая агрегометрия. Кроме того, должен быть проведен расширенный поиск сопутствующих заболеваний и состояний, сопровождающихся тромбофилией. В настоящее время у таких больных с уже установленными стентами терапией выбора может быть моноантитромбоцитарная терапия (клопидогрель/тикагрелор) в сочетании с пероральным антикоагулянтом ривароксабаном.
Литература
- Pengo V., Ruffatti A., Legnani C., Testa S., Fierro T., Marongiu F., De Micheli V., Gresele P., Tonello M., Ghirarduzzi A., Bison E., Denas G., Banzato A., Padayattil Jose S., Iliceto S. Incidence of a first thromboembolic event in asymptomatic carriers of high-risk antiphospholipid antibody profile: a multicenter prospective study // Blood. – 2011. – 118. – Р. 4714‑4718.
- Gibson C.M. et al. New Engl J Med, 2016; doi: 10.1056/NEJMoa1611594.
- Kearon C., Akl E.A., Ornelas J., Blaivas A., Jimenez D., Bouna-meaux H., Huisman M., King C.S., Morris T.A., Sood N., Stevens S.M., Vintch J.R., Wells P., Woller S.C., Moores L. Antithrombotic therapy for VTE disease: CHEST Guideline and Expert Panel Report // Chest. – 2016. – 149. – Р. 315‑352.
- Cohen H., Efthymiou M., Isenberg D.A. Journal of Thrombosis and Haemostasis. – 2018. – 16 (6). – Р. 102.
- Cohen H., Hunt B.J., Efthymiou M., Arachchillage D.R., Mackie I.J., Clawson S., Sylvestre Y., Machin S.J., Bertolaccini M.L., Ruiz-Castel- lano M., Muirhead N., Dore C.J., Khamashta M., Isenberg D.A. Rivaroxaban versus warfarin to treat patients with thrombotic antiphospholipid syndrome, with or without systemic lupus erythe- matosus (RAPS): a randomised, controlled, open-label, phase 2/3, non-inferiority trial // Lancet Haematol. – 2016. – 3: e426‑36.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




