Вплив фізичних вправ на покращення кардіоваскулярного здоров’я
Поширеність ожиріння та асоційованих із ним хвороб швидко зростає як у США, так і в цілому світі. Ожиріння пов’язане з низкою негативних впливів на стан здоров’я, зокрема зі збільшенням ризику серцево-судинних захворювань (ССЗ), цукрового діабету (ЦД) 2 типу, певних різновидів раку, смерті. В осіб із надмірною вагою імовірність розвитку ССЗ удвічі вища, а в пацієнтів із вираженим ожирінням – удесятеро вища, ніж у людей із нормальною вагою. Регулярні фізичні вправи (ФВ) роблять сприятливий вплив на загальний стан здоров’я, не тільки знижуючи масу тіла, а й протидіючи ЦД 2 типу та ССЗ. Кілька нещодавніх досліджень показали, що регулярна фізична активність асоціюється зі зниженням маркерів запалення, покращенням метаболічного здоров’я, зменшенням ризику серцевої недостатності (СН) і зростанням загальної виживаності.
ФВ зміцнюють загальне метаболічне здоров’я і зменшують імовірність розвитку ЦД 2 типу шляхом покращення толерантності до глюкози, збільшення інсуліночутливості та зниження концентрації циркулюючих ліпідів. Ці ефекти розвиваються передусім у зв’язку з адаптацією скелетних м’язів, печінки та жирової тканини до навантаження. ФВ також покращують функцію серця та судин. Регулярні ФВ зменшують частоту серцевих скорочень (ЧСС) у спокої, артеріальний тиск (АТ) та рівень маркерів атерогенезу, а також збільшують фізіологічну гіпертрофію серця. Вправи покращують перфузію міокарда і підвищують концентрацію холестерину ліпопротеїнів високої щільності (ЛПВЩ), що зменшує навантаження на серце та покращує його функцію як у здорових, так і у хворих осіб.
У пропонованому огляді обговорено сприятливий вплив ФВ на кардіоваскулярне здоров’я і потенційні механізми такого впливу.
ССЗ
ССЗ є провідною причиною захворюваності та смертності в цілому світі. Близько половини дорослих США має щонайменше один ключовий фактор ризику розвитку ССЗ (високий АТ, збільшений рівень холестерину, куріння). ССЗ охоплюють широке коло станів, що негативно впливають на серце та судини, зокрема аритмії, дилатаційні, гіпертрофічні та ідіопатичні кардіоміопатії, СН, атеросклероз. Ці стани можуть призвести до потенційно фатальних подій: інсульту, інфаркту міокарда, зупинки серця. Саме тому пошук різноманітних способів знизити поширеність ССЗ є життєво важливим.
Хоча ССЗ постають у відповідь на вплив багатьох чинників, поширеність хвороб судин і серця, пов’язаних з ожирінням, навально зростає. Однією з причин цього є те, що багата на жири дієта та ожиріння здатні спричиняти артеріальну гіпертензію (АГ). За ожиріння секреція ангіотензину II та альдостерону абдомінальною підшкірною жировою клітковиною активує ренін-ангіотензинову систему (РАС). Ангіотензин II спричиняє вазоконстрикцію артеріол, підвищуючи їх опір та системний АТ, а також стимулює вивільнення антидіуретичного гормона, який, своєю чергою, посилює реабсорбцію води в нирках. Альдостерон також збільшує реабсорбцію води та натрію, що призводить до збільшення об’єму позаклітинної рідини і зростання АТ. РАС впливає на симпатичну нервову систему шляхом пригнічення зворотного захоплення норепінефрину в пресинаптичних закінченнях симпатичних нервів, що збільшує концентрацію норепінефрину в спокої і, зрештою, підвищує ЧСС у спокої, призводячи до розвитку АГ. Отже, РАС і симпатична нервова система створюють передумови для АГ у разі ожиріння.
Стійка АГ збільшує постнавантаження на лівий шлуночок, змушуючи його важче працювати. Це призводить до патологічної гіпертрофії стінок шлуночка та дилатації його камер, через певний час спричиняючи погіршення функції міокарда й розвиток СН. У міру погіршення функції міокарда порушується робота всієї серцево-судинної системи, провокуючи недостатній кровоплин. Постачання кисню й нутрієнтів не відповідає потребам організму, що призводить до тахікардії та надмірної втомлюваності, а у важких випадках – до застою в легенях, затримки рідини, аритмій.
Іншою потенційною причиною ССЗ, пов’язаних з ожирінням, є метаболічне перевантаження серця, яке трапляється незалежно від АГ. Серце є «метаболічно всеїдним», але за ожиріння та інсулінорезистентності зростає захоплення та утилізація жирних кислот, що може призводити до неефективного β-окиснення та інтраміокардіального нагромадження ліпідів. Здатність серця зберігати хоч би які речовини обмежена, тож надмір жирів та їхніх токсичних метаболітів призводить до т. зв. ліпотоксичності й дисфункції серця. У кількох дослідженнях показано, що структурним змінам у серці зазвичай передують метаболічні.
Обмін речовин у серці змінений і у пацієнтів із ЦД 2 типу без ожиріння. Цей феномен є наслідком асоціації ЦД 2 типу з підвищенням кількості вільних жирних кислот у кровообігу, збільшенням захоплення та утилізації їх у міокарді, а також наслідком інсулінорезистентності міокарда зі зниженням захоплення та утилізації глюкози.
Головним підґрунтям ССЗ є атеросклероз, що повільно розвивається у відповідь на нездоровий сидячий спосіб життя й ожиріння. За ожиріння зростає рівень тригліцеридів (ТГ) і холестерину ліпопротеїнів низької щільності (ЛПНЩ), наслідком чого під ендотеліальними клітинами артерій формуються невеликі бляшки. Тимчасом як нормальні ендотеліоцити здатні запобігати склеюванню цих бляшок із лейкоцитами, за ожиріння молекули ЛПНЩ окиснюються, спричиняючи експресію молекул клітинної адгезії та хемоатрактантів. У відповідь на дію останніх макрофаги захоплюють окиснені ліпопротеїни, перетворюючись на пінисті клітини, які стимулюють утворення атеросклеротичних бляшок. Бляшки потовщують і ущільнюють стінки судин, перешкоджаючи кровоплину, а в разі значного збільшення кількості бляшок або розвитку тромбозу трапляються інсульти, інфаркти міокарда та інші потенційно фатальні кардіоваскулярні події.
Сидячий спосіб життя є одним із найважливіших факторів розвитку й прогресування ССЗ, тож підвищення фізичної активності та зменшення маси тіла безперечно покращує кардіоваскулярне здоров’я.
ФВ зменшують вплив факторів кардіоваскулярного ризику
Регулярні ФВ здатні знизити ймовірність розвитку та прогресування ожиріння, ЦД 2 типу та ССЗ, що було підтверджено рандомізованими клінічними дослідженнями. В осіб із метаболічним синдромом (МС), що протягом 4 міс брали участь у програмі фізичних навантажень або обмеження калорійності їжі, спостерігали зменшення маси жирової тканини, систолічного, діастолічного і середнього АТ, загального холестерину та холестерину ЛПНЩ порівняно з групою контролю.
У багатьох дослідженнях показано, що правильне харчування, ФВ і поєднання цих чинників призводять до зменшення маси тіла й вісцерального ожиріння, знижують рівень ТГ, глюкози, ЛПНЩ і АТ. Важливо, що окремі сприятливі ефекти не залежать від утрати ваги, зокрема покращення обміну глюкози, нормалізація ендотеліальної функції й АТ. Проте не слід нехтувати важливість поєднання ФВ і правильного харчування, адже в багатьох дослідженнях це сполучення забезпечувало активніший вплив на кардіометаболічне здоров’я, ніж те чи те втручання поодинці.
ФВ мають однаковий вплив на кардіоваскулярне здоров’я у нормоглікемічних осіб із нормальною масою тіла і надмірною вагою. У дослідженні з участю осіб без ожиріння підвищення витрат енергії на 16-20% за допомогою будь-яких вправ без жодних змін харчування призводило до зниження маси жирової тканини на 22,3%, а також до зменшення холестерину ЛПНЩ, співвідношення загального холестерину і холестерину ЛПВЩ, С‑реактивного білка. В осіб із надвагою 7-9 міс ФВ низької ефективності (прогулянки в межах 19 км/тиж при 40-55% пікового об’єму кисню) значно покращували кардіореспіраторну функцію порівняно з людьми, що провадили сидячий спосіб життя. Ці дані свідчать, що ФВ знижують ризик і тяжкість ССЗ у осіб із нормальною масою тіла, з ожирінням чи ЦД 2 типу.
ФВ покращують функції серця і судин у пацієнтів із ССЗ
ФВ є важливим методом лікування ССЗ. Систематичний огляд 63 досліджень показав, що реабілітація на основі ФВ покращує кардіоваскулярну функцію. Долучені до огляду дослідження передбачали різноманітні форми аеробних вправ відмінної інтенсивності (від 50 до 95% пікового об’єму кисню) і тривалості (1-47 міс). ФВ вірогідно знижували смертність від ССЗ і ризик інфаркту міокарда, покращували якість життя.
В іншому дослідженні взяли участь хворі, що підлягали реваскуляризації. В осіб, які щодня мали 60-хвилинне навантаження на велоергометрі протягом 4 тиж, спостерігали зростання резерву кровоплину на 29% і покращення ендотелійзалежної вазодилатації. У хворих після інфаркту міокарда і коронарного втручання, що підлягали персоналізованій реабілітації на основі ФВ, зафіксовано вищу фракцію викиду (60,81 проти 53% у групі контролю), більшу толерантність до фізичних навантажень і зменшення кардіоваскулярного ризику вже через 6 міс після початку реабілітаційної програми. Зазначене покращення, імовірно, є результатом посилення перфузії міокарда у відповідь на вправи.
Однією з важливих характеристик СН є непереносимість фізичних навантажень, тож пацієнтам із СН, які народилися до 1950-х, рекомендували ліжковий режим. Однак показано, що контрольована програма реабілітації на основі ФВ помірної інтенсивності є безпечною для пацієнтів із СН як важливий спосіб лікування цих хворих. Метааналізи й системні огляди продемонстрували, що ФВ у пацієнтів із СН асоціюються з покращенням якості життя, зменшенням ризику госпіталізації та зниженням смертності протягом тривалого періоду. Аеробні ФВ (прогулянки, їзда велосипедом) при 60-70% максимальної ЧСС 3-5 р/тиж протягом 3 років покращували здоров’я та якість життя хворих із СН.
Нещодавнє дослідження з’ясувало, що високоінтенсивні інтервальні тренування (ВІІТ) протягом 12 тиж добре переносять пацієнти із СН та зниженою фракцією викиду лівого шлуночка; такі тренування забезпечують покращення ремоделювання аеробної здатності організму. ВІІТ протягом 4 тиж у пацієнтів із СН та збереженою фракцією викиду збільшували піковий об’єм кисню та зменшували діастолічну дисфункцію виразніше, ніж регулярні тренування помірної інтенсивності. Отже, і середньо-, і високоінтенсивні тренування покращують кардіоваскулярну функцію у пацієнтів із СН, імовірно, шляхом поліпшення ендотелійзалежної вазодилатації та зростання аеробної здатності.
Механізми регуляції сприятливого впливу ФВ на кардіоваскулярне здоров’я
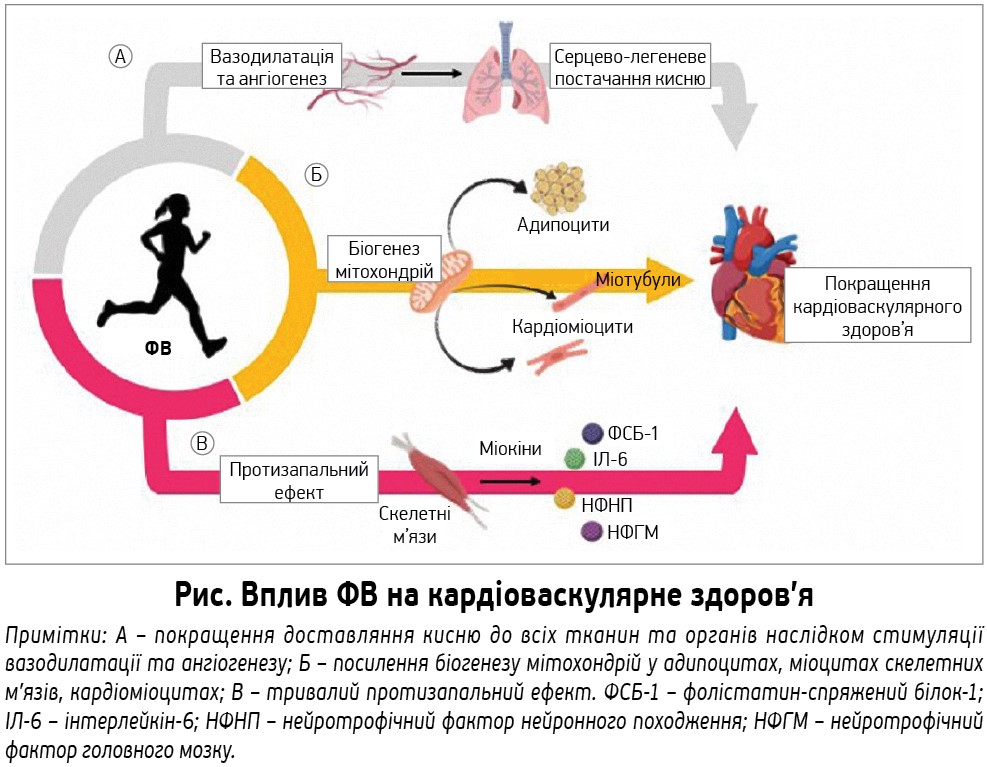
Вплив регулярних ФВ на кардіоваскулярне здоров’я опосередкований багатьма механізмами (рис.). Вправи є серйозним викликом для гомеостазу цілого організму, бо провокують зміни в багатьох клітинах, тканинах і органах шляхом зростання метаболічних потреб.
ФВ спричиняють адаптаційні зміни в низці клітин і тканин, зокрема в адипоцитах, міоцитах скелетних м’язів і кардіоміоцитах, збільшуючи у них активність аеробного дихання. Крім того, ФВ покращують доставляння кисню у всьому тілі шляхом вазодилатації й ангіогенезу та захищають серце від ішемічно-реперфузійного пошкодження. А ще ФВ чинять тривалий протизапальний ефект. Ця дія частково опосередковується міокінами, що вивільняються зі скелетних м’язів при навантаженні та сприяють взаємодії між тканинами організму.
ФВ покращують біогенез і функціонування мітохондрій
Значна кількість сприятливих ефектів ФВ є наслідком мітохондріальних адаптацій в організмі. Наприклад, ФВ покращують загальний стан здоров’я серця і легень шляхом збільшення вмісту мітохондрій та десатурації міоглобіну в м’язовій тканині. Збільшення захоплення та утилізації кисню скелетними м’язами у відповідь на регулярні ФВ виступає протектором щодо зниження артеріовенозної різниці у вмісті кисню в разі ожиріння, через яке людина потребує більше крові, щоб мати ту саму кількість кисню.
У відповідь на ФВ посилюється і біогенез мітохондрій у кардіоміоцитах. Імовірною причиною цього виступає активація аденозинмонофосфат (АМФ)-активованої протеїнкінази. ФВ посилюють здатність мітохондрій окиснювати жирні кислоти (головний енергетичний субстрат здорового міокарда), підвищуючи потенціал синтезу аденозинтрифосфату (АТФ).
Ожиріння асоціюється з порушеним мітохондріальним біогенезом у міокарді та зниженням здатності мітохондрій до окисного фосфорилювання і синтезу АТФ. СН знижує захоплення й утилізацію жирних кислот, що спричиняє зсув метаболізму міокарда в бік глюкози з метою зберегти функції серця й судин. Проте за тяжкої СН, за ЦД або ожиріння може розвиватися інсулінорезистентність тканин міокарда з порушенням захоплення глюкози та пришвидшенням розвитку дисфункції серця. Важливо, що регулярні ФВ підвищують інсуліночутливість.
Активні форми кисню (АФК) є фізіологічним побічним продуктом аеробного метаболізму в мітохондріях. Хоча цих молекул треба для апоптозу й відновлення клітин, їх підвищений рівень асоціюється із запаленням і ССЗ. Хоча ФВ збільшують безпосереднє вироблення АФК мітохондріями, сумарне окисне навантаження на клітину зменшується через активацію антиоксидантних систем. Отже, ФВ створюють умови, за яких клітини мало контактують з АФК, а антиоксидантні системи працюють максимально ефективно.
Збільшуючи здатність мітохондрій запобігати окисному пошкодженню, ФВ протидіють ішемічно-реперфузійному ураженню серця. Під час ішемії відсутність кисню створює умови, коли відновлення багатого на кисень кровоплину призводить до запалення й окисного стресу, а не до відновлення нормальної функції. На противагу цьому індуковані ФВ адаптаційні зміни в мітохондріях кардіоміоцитів послаблюють окисне пошкодження за ішемії-реперфузії, що зменшує ризик розвитку серцевої дисфункції та ризик смерті.
ФВ покращують перфузію міокарда й судин
ФВ спричиняють адаптаційні зміни судин у багатьох тканинах. Так, посилюється васкуляризація серця, що зменшує ймовірність кардіоваскулярних подій.
Ці адаптаційні зміни опосередковано збільшенням експресії судинної ендотеліальної синтази оксиду азоту (NO‑синтази, eNOS). В ендотелії судин остання каталізує продукування оксиду азоту, який спричиняє вазодилатацію, гальмує агрегацію тромбоцитів і запобігає адгезії лейкоцитів до стінок судин, протидіючи атеросклерозові, тромбозу, ішемії тощо.
ФВ також індукують ангіогенез, хоч регулювальні механізми цього ефекту не визначено. Гадають, що зростання продукції оксиду азоту після ФВ посилює активність проангіогенних факторів, зокрема фактора росту ендотелію судин (VEGF). У мишей-самців, що підлягали ФВ через 10 тиж після інфаркту міокарда, спостерігали зростання фосфорилювання eNOS і реактивацію активності VEGF, наслідком чого посилювався ангіогенез. Хоч механізм цих ефектів достеменно не з’ясовано, годі заперечити, що ФВ індукують артеріогенез і чинять вазопротективну дію, зменшуючи імовірність кардіоваскулярних подій.
ФВ знижують хронічне запалення
Запалення є складною природною біологічною реакцією на ушкоджувальні чинники. Хронічне запалення є асоційованим із низкою захворювань, зокрема з ожирінням, ЦД 2 типу й ССЗ. Надлишкове споживання нутрієнтів призводить до того, що окремі категорії клітин, наприклад адипоцити, гепатоцити, острівцеві клітини та клітини скелетних м’язів, активують транскрипцію ядерного фактора каппа-бі (NF‑κB) та активаторного білка‑1 (AP‑1), підвищують експресію тол-подібних рецепторів‑4 (TLR4) і стимулюють вивільнення низки цитокінів (фактор некрозу пухлин (ФНП), інтерлейкіни (ІЛ)-6 та ІЛ‑1β тощо). Хоча запалення, що трапляється наслідком цих процесів, є помірним порівняно із запальною відповіддю на інфекцію або поранення, воно виступає хронічною відповіддю на ожиріння і має назву метазапалення.
ФВ забезпечують тривалу протизапальну дію. Індуковане вправами зниження активності метазапалення може бути опосередковане зниженням: експресії NF‑κB, нагромадження моноцитів, вивільнення ФНП та інших прозапальних адипокінів, що разом створюють протизапальні умови.
Надмірно потужне функціонування імунної системи на тлі ожиріння є особливо небезпечним для судинного здоров’я, бо активація рецепторів TLR4 сприяє залученню до патологічного процесу моноцитів і перетворенню їх на пінисті клітини з наступним прогресуванням атеросклерозу. ФВ запобігають розвиткові атеросклерозу шляхом зменшення експресії TLR на моноцитах і макрофагах, що, своєю чергою, знижує доступність TLR4-лігандів і гальмує продукцію прозапальних цитокінів. Вправи також знижують рівень прозапального N‑термінального промозкового натрійуретичного пептиду (NT‑proBNP) і високочутливого С‑реактивного білка у тканинах серця. Це дуже важливо, тому що ці речовини є предикторами СН за атеросклерозу.
ФВ покращують міжтканинну комунікацію шляхом вивільнення міокінів
Скелетні м’язи можуть функціонувати як секреторний орган, стимулюючи скороченням вироблення, секрецію та експресію певних міокінів. Міокіни є хімічними посередниками, які автокринним, паракринним чи ендокринним шляхом впливають на взаємодію між різними тканинами, зокрема скелетними м’язами, печінкою і жировою тканиною. Міокіни частково опосередковують протективний вплив ФВ на кардіоваскулярне здоров’я. Провідними міокінами, які впливають на стан серця й судин, є ІЛ‑6, міонектин, фолістатин-спряжений білок (ФСБ) і нейротрофічний фактор нейронного походження (НФНП).
ІЛ‑6
ІЛ‑6 уперше ідентифіковано як міокін близько 10 років тому. Рівень циркуляції ІЛ‑6 зростає у відповідь на аеробне фізичне навантаження. Цей ІЛ може діяти в ендокринний спосіб, покращуючи метаболічне й кардіоваскулярне здоров’я. Індуковане ФВ підвищення ІЛ‑6 стимулює секрецію глюкагоноподібного пептиду‑1 L‑клітинами кишечнику та α-клітинами підшлункової залози, що нормалізує секрецію інсуліну та глікемію. ІЛ‑6 також посилює ліполіз та окиснення жирних кислот у жировій тканині й може посилювати захоплення глюкози шляхом стимуляції сигнального шляху АМФ‑активованої протеїнкінази. Щодо кардіоваскулярної функції, то ІЛ‑6 здатен знижувати інтенсивність запалення, інгібуючи ФНП. Це інгібування має кардіопротективну дію, адже ФНП залучений до патогенезу атеросклерозу, розвитку СН і відповідних ускладнень, інфаркту міокарда. Щоб визначити безпосередні впливи ІЛ‑6 на кардіоваскулярне здоров’я, потрібні додаткові дослідження.
Міонектин
Міонектин, також відомий як CTRP15, значною мірою експресується у скелетних м’язах і зростає у відповідь на регулярні аеробні вправи. Цікаво, що ін’єкційне введення міонектину мишам дикого типу знижує рівень циркуляції жирних кислот, збільшуючи захоплення їх адипоцитами й гепатоцитами. Показано, що міонектинові властивий протективний вплив на кардіоваскулярне здоров’я. Миші з дефіцитом міонектину характеризувалися посиленим ішемічним ушкодженням за інфаркту міокарда, тоді як системне призначення міонектину зменшувало таке ушкодження. За наступних досліджень треба з’ясувати, чи зазначені сприятливі ефекти постають у відповідь на індуковане ФВ вивільнення міонектину.
ФСБ
ФСБ, також відомий як TSC‑36, являє собою секретований глікопротеїн, що належить до родини фолістатинових білків. Кількість ФСБ зростає у відповідь на ФВ. Збільшена експресія цього протеїну й опосередкована ним кардіопротекція фіксуються у мишей за ішемії та гіпертрофії серця. Системне призначення ФСБ у експериментальних моделях на мишах і свинях спричиняло зниження апоптозу, запалення й розміру ушкодження за ішемії-реперфузії. In vitro внесення ФСБ у культуру кардіоміоцитів також зменшувало активність апоптозу у відповідь на гіпоксію-реоксигенацію шляхом активації АМФ‑активованої протеїнкінази. Нещодавнє дослідження показало, що ФСБ стимулює ранню активацію фібробластів, потрібну для загоєння гострих ушкоджень, і захищає серце від розривів за ішемії-реперфузії. Хоча точного значення індукованого вправами зростання ФСБ для серця й судин остаточно не виявлено, проте відомо, що, по-перше, ФСБ підвищується у відповідь на ФВ, а по-друге, зростання рівня циркуляції ФСБ сприяє загоєнню ушкоджень у серцево-судинній системі та покращенню кардіоваскулярної функції.
НФНП
НФНП є глікозильованим протеїном, що секретується ендотеліальними клітинами судин скелетних м’язів. Хоча вперше цей нейротрофічний фактор виявлено в головному та спинному мозку мишей, НФНП також вивільняють скелетні м’язи у відповідь на ФВ. НФНП діє як індукований гіпоксією проангіогенний фактор, який стимулює роботу ендотеліальних клітин шляхом активації сигнального шляху Akt/eNOS. Цей проангіогенний ефект є важливим складником відновлення серця після інфаркту міокарда. В експериментальній моделі цього ураження на мишах внутрішньом’язове призначення НФНП покращувало систолічну функцію. Збільшений рівень НФНП також асоціюється зі зменшенням гіпертрофії міокарда та апоптозу в клітинах міокарда пацієнтів, що мали інфаркт.
Інше дослідження показало, що пригнічення регуляції НФНП за допомогою відповідних малих інтерферуючих РНК протидіє відновленню серця після ішемічно-реперфузійного ушкодження. Внесення НФНП у культуру кардіоміоцитів зменшує активність індукованого гіпоксією апоптозу. Окрім того, підвищення концентрації НФНП, що вивільняється скелетними м’язами за ФВ, посилює окиснення жирних кислот шляхом активації АМФ‑активованої протеїнкінази. Ці дані демонструють важливість НФНП як ендогенного фактора, що індукується ішемією та фізичними навантаженнями, і може посилювати реваскуляризацію, реалізуючи кардіовазопротективний ефект.
Висновки
Поширеність пов’язаних з ожирінням ССЗ швидко зростає і часто асоціюється з додатковими коморбідними станами на кшталт ЦД 2 типу. Годі заперечити, що ФВ знижують кардіоваскулярний ризик, зокрема незалежно від зниження маси тіла чи протидії діабету. ФВ є важливим складником лікування пацієнтів із ССЗ. У зазначених осіб ФВ покращують ендотелійзалежну вазодилатацію, збільшують фракцію викиду й толерантність до фізичного навантаження, покращують якість життя, знижують смертність від ССЗ. Механізмами сприятливого впливу ФВ є мітохондріальний біогенез, окиснення жирних кислот, вазодилатація з покращенням перфузії міокарда, зниження інтенсивності запалення та протидія атеросклерозові. Міокіни, що вивільняються скелетними м’язами під час ФВ, також опосередковують низку сприятливих для серця й судин ефектів.
Вивчення молекулярних механізмів впливу ФВ на ССЗ стимулює створення лікарських засобів, що підсилюють ефект тренувань або можуть застосовуватися щодо осіб, неспроможних витримувати фізичні навантаження.
Подальші дослідження варто спрямувати на вивчення впливу кардіоспецифічних білків на стан серця й судин; з’ясування взаємозв’язків між різними органами і тканинами, зокрема між скелетними м’язами і серцем; виявлення впливу міокінів на кардіоваскулярні функції, мітохондріальну активність, ангіогенез та запальну відповідь. Міокіни можуть стати потенційними мішенями профілактики й лікування ССЗ.
Викладені результати досліджень увиразнюють важливість ФВ у запобіганні ССЗ, стимуляції відновлення після кардіоваскулярних подій та покращенні стану здоров’я кардіологічних пацієнтів.
Pinkard K., Baskin K. K., Stanford K. I. Effects of Exercise to Improve Cardiovascular Health.Front Cardiovasc Med. 2019; 6: 69.
Переклала з англ. Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 17 (462), вересень 2019 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....