Прихильність пацієнтів із шизофренією до терапії ін’єкційними антипсихотиками тривалої дії для профілактики рецидивів
До вашої уваги представлено огляд статті «Impact of paliperidone palmitate one-month formulation on relapse prevention in patients with schizophrenia: A post-hoc analysis of a one-year, open-label study stratified by medication adherence» T. Si et al., опублікованої в журналі J Psychopharmacol (2018; 32 (6): 691‑701). Матеріал присвячено оцінюванню ефективності застосування ін’єкційних антипсихотичних препаратів тривалої дії для профілактики рецидивів шизофренії.
Симптоматичні рецидиви під час підтримувального лікування пацієнтів із шизофренією часто призводять до погіршення стану і підвищують ризик госпіталізації (Kane, 2013; Carbon, Correll, 2014). Довгострокові наслідки загострень включають збільшення ймовірності самоушкодження та тягаря як для особистості, так і для системи охорони здоров’я загалом, зниження психосоціальних і професійних можливостей, соціальну стигматизацію та прогредієнтне погіршення стану хворого (Almond et al., 2004; Kane, 2007; Thornicroft et al., 2009). Тож відстрочення рецидиву та досягнення оптимального контролю симптомів є основними цілями ведення пацієнтів із шизофренією, зазначеними в настановах із клінічної практики (Kane, Garcia-Ribera, 2009; Malla et al., 2013).
Погана прихильність (приймання <70‑80% від призначених препаратів) або недотримання режиму терапії антипсихотиками визнані серйозними факторами ризику рецидивів при шизофренії (Agid et al., 2010; Kane et al., 2013). Припинення використання ліків суттєво підвищує ризик загострень протягом критичного періоду хвороби (перші 2‑5 років), що зумовлює довгостроковий перебіг лікування (Chien et al., 2016). При проведенні аналізу тривалості часу до рецидиву завершення приймання антипсихотиків було найсильнішим предиктором загострень, яке підвищувало ризик їхнього розвитку в п’ять разів порівняно з пацієнтами, які продовжили терапію: відносний ризик (ВР) першого рецидиву = 4,89; 99% довірчий інтервал (ДІ ) 2,49‑9,60 (Robinson et al., 1999).
Аналогічні результати були отримані в іншому випробуванні за участю хворих із першим епізодом шизофренії. Так, недотримання призначеної терапії антипсихотиками виявилося єдиним предиктором рецидиву і підвищувало його ризик приблизно у п’ять разів (ВР=4,8; 95% ДІ 2,9‑7,7) (Caseiro et al., 2012). Також в 1-річному дослідженні, проведеному в реальних умовах у КНР, це було найзначнішим фактором ризику, пов’язаним із загостреннями: відношення шансів (ВШ) = 4,6; 95% ДІ 3,4‑6,2 (Xiao et al., 2015). Крім того, результати опитування 1854 психіатрів у КНР показали, що близько 56% пацієнтів із шизофренією були частково або повністю не прихильні до фармакотерапії (Olivares et al., 2013).
Показано, що використання ін’єкційних антипсихотиків тривалої дії (ІАПТД) на різних стадіях шизофренії підвищує комплаєнс та знижує частоту наступних рецидивів і госпіталізацій (Heres et al., 2014; Correll et al., 2016). Результати масштабних досліджень продемонстрували ефективність 1-місячної ін’єкційної форми паліперидону пальмітату (ПП1M), атипового антипсихотика – антагоніста рецепторів дофаміну (D2) й серотоніну (5-HT2A), а також практичні переваги вмісту препарату в плазмі крові на терапевтичному рівні протягом тривалого часу, спрощених схем приймання ліків та ефективного моніторингу лікування (Alphs et al., 2013; Gonzalez-Rodriguez et al., 2015).
У масштабне проспективне відкрите дослідження Si et al. (2015) із гнучким дозуванням ПП1M увійшли хворі на гостру шизофренію, які недостатньо відповідали на попереднє лікування антипсихотиками. Автори виконали ретроспективний аналіз спостереження тривалістю один рік після короткочасної 13-тижневої терапії. Роль ПП1M у запобіганні рецидиву шизофренії оцінювали в реальних умовах у пацієнтів, які продовжували приймати ПП1M або були переведені на інші антипсихотичні засоби. Крім того, дослідники вивчали предиктори профілактики загострень, зокрема взаємозв’язок між часом до першого рецидиву (ЧПР) та ступенем прихильності до лікування.
Загалом основною метою аналізу було оцінити вплив ПП1M порівняно з іншими антипсихотиками на запобігання рецидиву шизофренії у пацієнтів із різними рівнями прихильності до лікування та визначити фактори, що впливають на ЧПР.
Матеріали й методи
Дизайн дослідження
Проаналізовано дані відкритого простого багатоцентрового дослідження 4-ї фази тривалістю близько двох років, що проводилося у 22 центрах КНР і складалося із трьох етапів: фази скринінгу (до 7 днів), 13-тижневого періоду короткотривалого лікування та спостереження протягом року.
У дослідження увійшли пацієнти віком 18‑65 років із діагнозом «гостра шизофренія» на основі критеріїв Керівництва з діагностики та статистики психічних розладів 4-го перегляду (DSM‑IV), які не отримали задовільного ефекту від попереднього лікування пероральними антипсихотиками. Хворі мали загальний показник 70‑120 балів за шкалою оцінки позитивних та негативних симптомів (PANSS) на початку спостереження. Основними критеріями виключення були: активний діагноз розладу (не шизофренії) за DSM‑IV (вісь I); спроба самогубства протягом 12 місяців до скринінгу або неминучий ризик суїцидальної/насильницької поведінки; фактори ризику піруетної тахікардії, раптової смерті, подовження інтервалу QT; лікування клозапіном або інгібіторами моноаміноксидази протягом місяця до скринінгу; використання ІАПТД, зокрема ПП1M (за період, що дорівнює шести інтервалам між ін’єкціями, до обстеження); застосування електроконвульсивної терапії за місяць до скринінгу. Для ретроспективного аналізу використовували дані пацієнтів зі стабільними симптомами (загальний бал за PANSS <70) на 13-му тижні, які продовжували брати участь у фазі спостереження та отримували ПП1M або будь-який антипсихотик у 1-й місяць підтримувальної терапії після основного лікування.
Лікування
Упродовж 13 тижнів пацієнти отримували ін’єкції ПП1M (Invega Sustenna, Janssen) у дельтоподібний м’яз у дозі 150 мг-екв. паліперидону (що дорівнює 234 мг паліперидону) в 1-й день та 100 мг-екв. (156 мг паліперидону) на 8-й день, а надалі – щомісяця ін’єкції в дельтоподібний або сідничний м’яз у гнучкому дозуванні 75‑150 мг-екв. (117‑234 мг паліперидону). Пероральні антипсихотики, які хворі приймали до початку дослідження, відмінили, поступово зменшуючи дозу впродовж перших двох тижнів після початку терапії ПП1M. Протягом періоду спостереження пацієнти продовжували отримувати ін’єкції ПП1M або переходили на інші пероральні препарати / ІАПТД, або припиняли фармакотерапію відповідно до уподобань хворого та суджень лікаря.
Оцінка стану пацієнтів
Первинною кінцевою точкою була оцінка ЧПР за аналізований період (через 30 днів після фази 13-тижневого лікування до дати першого рецидиву або завершення випробування). Стан пацієнтів, у яких протягом періоду спостереження не було загострень, оцінювали в кінці дослідження. Рецидив визначали як (Hough et al., 2010):
- госпіталізацію через симптоми шизофренії;
- збільшення загального балу за PANSS на 25% при двох послідовних аналізах у пацієнтів із загальним показником >40 або на 10 балів у хворих із загальною оцінкою ≤40 на вихідному рівні;
- навмисне самопошкодження або агресію, спроби самогубства чи вбивства або клінічно значущу агресивну поведінку;
- збільшення балів за пунктами PANSS (P1, P2, P3, P6, P7 та G8) від ≤3 на вихідному рівні до ≥5 при двох послідовних оцінках (або від 4 до ≥6).
Прихильність до антипсихотиків (будь-яких ІАПТД та/або пероральних) розраховували як відношення сукупної тривалості лікування до ЧПР або часу до завершення участі в дослідженні (для пацієнтів без рецидиву). Тривалість дії ІАПТД визначали як 30-денний період після останньої ін’єкції. Вплив антипсихотика розглядали і як безперервну (частка часу із прихильністю), і як категорійну змінну (за дотримання <80% усіх призначень прихильність вважали поганою, а ≥80% – хорошою).
Для дослідження впливу ПП1M порівняно з іншими антипсихотиками було оцінено частку використання ПП1M як фактора, що впливає на ЧПР. Крім того, у межах аналізу чутливості вивчали ефект усіх ІАПТД на ЧПР, а також розраховували співвідношення тривалості кумулятивного впливу ПП1M / усіх ІАПТД та будь-яких антипсихотиків. Відношення тривалості використання ПП1М / усіх ІАПТД оцінювали і як безперервну, і як категорійну змінну. Як категорійна змінна, цей параметр був поділений на три типи:
- частка пацієнтів, які не застосовували ІАПТД до рецидиву або завершення участі в дослідженні (відношення ПП1M / будь-які ІАПТД = 0);
- хворі, які перервали приймання ПП1M / будь-яких ІАПТД (відношення ПП1M / будь-які ІАПТД >0, але <100%), тобто отримали принаймні одну ін’єкцію ПП1M / будь-якого ІАПТД до рецидиву або завершення спостереження;
- пацієнти, які тривалий час використовували ПП1M / будь-які ІАПТД (відношення ПП1M / будь-які ІАПТД = 100%) до розвитку загострень або закінчення випробування.
Ефективність лікування оцінювали під час візитів кожні три місяці за такими показниками:
- загальний бал за PANSS – 30‑210: вищий вказує на значну психопатологічну симптоматику (Marder et al., 1997);
- оцінка за шкалою загального клінічного враження про тяжкість захворювання (CGI-S): кількість балів варіювала від 1 (норма) до 7 (екстремально тяжкий стан) (Busner, Targum, 2007);
- бальна оцінка за шкалою особистої та соціальної діяльності (PSP): 71‑100 – легкий ступінь дисфункції; 31‑70 – помірний ступінь дисфункції; ≤30 – порушення функціонування, за якого пацієнт потребує інтенсивного нагляду (Morosini et al., 2000);
- бальна оцінка за опитувальником щодо ступеня задоволеності лікарським засобом (MSQ): від 1 – вкрай незадоволений до 7 – надзвичайно задоволений (Gharabawi et al., 2006; Vernon et al., 2010).
Оцінка безпеки включала реєстрацію побічних ефектів, пов’язаних із лікуванням, показників життєдіяльності, лабораторних параметрів та електрокардіограми.
Статистичний аналіз
Первинну кінцеву точку (ЧПР) оцінювали за допомогою методу Каплана – Мейєра. Регресійна модель Кокса була використана для аналізу асоціації конкретних змінних із ЧПР, ВР та 95% ДІ. Уніваріантну асоціацію окремих змінних із ЧПР розраховували окремо для пацієнтів, які застосовували ПП1M або будь-які антипсихотики. В однофакторному аналізі враховували: вік, стать, місячний рівень доходу, кількість госпіталізацій за попередній рік, тривалість захворювання, дотримання схеми приймання всіх призначених антипсихотиків (0%; від >0 до <80%; >80%); використання ПП1M, бали за MSQ, PSP, CGI-S та загальний показник за PANSS на початку та у кінцевій точці впродовж короткотривалого лікування. Незалежні змінні з рівнем значущості p≤0,15 в уніваріантному аналізі та їхню потенційну взаємодію дослідили за допомогою покрокового скринінгу для побудови багатоваріантної регресійної моделі Кокса. Рівень значущості p=0,05 застосовували для визначення того, додавати чи вилучати змінні з багатоваріантної моделі, за допомогою якої також вивчали асоціації у двох підгрупах окремо (порівняння поганої та хорошої прихильності до терапії антипсихотиками).
Результати та обговорення
Профілактика рецидивів під час підтримувального лікування шизофренії є важливим клінічним наслідком, що зумовлює коротко- та довгострокові переваги. В поточному дослідженні у значної частини пацієнтів, що отримували антипсихотики після 13-тижневої терапії ПП1М, загострень протягом року спостереження не траплялося, що узгоджується з низькими показниками рецидивів у масштабному випробуванні впливу ПП1M (Hough et al., 2010). Отримані результати свідчать про мінливість ефекту ПП1M щодо подовження ЧПР. Ефективність профілактики рецидивів значною мірою залежала від безперервності їхнього використання, що було клінічно більш значущим в осіб із субоптимальною прихильністю до терапії антипсихотиками.
Із 477 пацієнтів, які закінчили фазу короткотривалої терапії, 367 осіб з оцінкою за PANSS <70 на 13-му тижні були включені в аналіз ЧПР. Частка хворих, що застосовували ПП1M протягом року спостереження, коливалася від 18,10 до 29,01%. Кількість пацієнтів, які приймали інші ІАПТД, була незначною і становила від 2,45 до 3,59%. Загалом 362 учасники продовжили дослідження впродовж ≥30 днів після останнього введення ПП1M. Середній вік пацієнтів становив 31,4 року, чоловіків було дещо більше, ніж жінок (54,14%). Протягом періоду спостереження більшість хворих (79,59%) мали хорошу прихильність (дотримувалися ≥80% усіх призначень), 10,77% – слабку (дотримувалися <80% усіх призначень), а 35 (9,67%) відмовилися від лікування. Таким чином, до регресійного аналізу Кокса було включено 327 пацієнтів із прихильністю >0% до всіх застосовуваних антипсихотиків.
У 45 із 362 пацієнтів (12,4%) протягом року спостереження трапився рецидив (частка без загострень – 84,6%; 95% ДІ 79,2‑88,7; оцінка за методом Каплана – Мейєра).
В уніваріантному аналізі поганий комплаєнс щодо терапії антипсихотиками (ВР=2,97; 95% ДІ 1,48‑5,98; p=0,002) та кількість госпіталізацій за попередній рік (ВР=1,29; 95% ДІ 1,02‑1,62, p=0,03) були пов’язані зі значно меншими показниками ЧПР як при використанні ПП1М, так і всіх ІАПТД. Прихильність до лікування будь-якими антипсихотиками, застосування ПП1M (як перерване, так безперервне), бали за MSQ та загальна оцінка за PANSS на початку короткотривалої терапії являли собою потенційно важливі фактори для ЧПР (p≤0,15) і також були включені у багатофакторний регресійний аналіз Кокса. Результати показали, що частка пацієнтів на ПП1M та прихильних до лікування будь-якими антипсихотиками, а також взаємодія комплаєнсу із кількістю тих, що приймали ПП1M (p=0,03) та будь-які ІАПТД (p=0,04), значущо асоціювалися із ЧПР. Було проаналізовано, як прихильність до ІАПТД (хороша та погана) впливала на ЧПР. Інші змінні, які чинили суттєву дію на ЧПР, включали число госпіталізацій за попередній рік та загальний бал за PANSS на вихідному рівні. Взаємодія між часом застосування ІАПТД та комплаєнсом щодо лікування будь-якими антипсихотиками також впливала на ЧПР (ПП1M: p=0,04; усі ІАПТД: p=0,06).
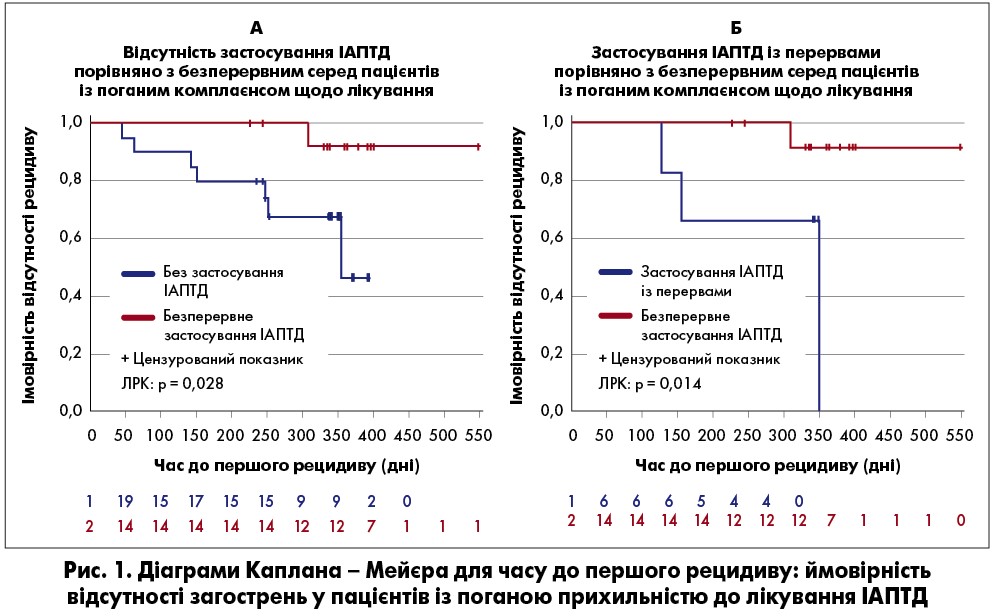
Стратифікований аналіз показав, що в підгрупі лікування будь-якими ІАПТД схема використання препаратів суттєво не впливала на ЧПР в осіб із хорошим комплаєнсом. Однак у пацієнтів із поганою прихильністю переваги безперервного застосування ІАПТД були продемонстровані за допомогою методу Каплана – Мейєра (рис. 1). Ті, хто постійно приймав будь-які ІАПТД (логарифмічний ранговий критерій [ЛРК]: p=0,028) або приймав із перервами (ЛРК: p=0,014), навіть за поганого комплаєнсу мали значущо довший період без рецидивів.
Подібні результати були отримані для підгрупи ПП1M (постійно чи з перервами; 91% пацієнтів, які приймали ІАПТД). В осіб із хорошою прихильністю схема використання ПП1M суттєво не впливала на ЧПР. Однак режим терапії ПП1M чинив дію на ризик рецидиву (серед тих, хто приймав безперервно та не приймав узагалі: ВР=1,18; 95% ДI 0,47‑2,97, p=0,7308; серед тих, хто приймав безперервно та з перервами: ВР=1,59; 95% ДI 0,45‑5,65, p=0,4709). З-поміж пацієнтів із хорошим комплаєнсом, що постійно використовували ПП1M, проти тих, хто не отримував узагалі (ЛРК: p=0,75) та із перервами (ЛРК: p=0,451), не було продемонстровано суттєвої користі щодо профілактики рецидивів. Однак серед хворих із поганою прихильністю, що не застосовували ПП1M (ВР=13,13; 95% ДІ 1,33‑129,96, р=0,0277) та із перервами (ВР=11,04; 95% ДІ 1,03‑118,60, р=0,0474) ризик загострень був значно вищий порівняно з тими, хто приймав ПП1M безперервно. За методом Каплана – Мейєра спостерігалися переваги постійного застосування ПП1М у пацієнтів із поганим комплаєнсом. Ті, хто постійно отримував ПП1М (ЛРК: p=0,035) або із перервами (ЛРК: p=0,016), навіть за поганої прихильності до лікування мали значущо довший період без рецидивів (рис. 2). Це свідчить на користь підтримувальної терапії ПП1M при шизофренії.
Безпеку терапії оцінювали у 362 пацієнтів, чия участь у дослідженні тривала не менше за 30 днів від дати останньої ін’єкції ПП1М у фазу короткотривалого лікування. Загалом несприятливі явища, про які протягом року спостереження в реальних умовах повідомили 13,8% хворих, відповідали профілю безпеки та переносимості ПП1M (Gopal et al., 2011; Pandina et al., 2011). Найчастішими (≥1% випадків) були симптоми шизофренії (2,8%), екстрапірамідні розлади (1,9%), збільшення маси тіла (1,7%), назофарингіт (1,4%), порушення функції печінки (1,4%) та інфекція верхніх дихальних шляхів (1,1%). Лише в одного пацієнта прояви шизофренії призвели до припинення терапії, а про серйозні побічні ефекти повідомили 12 (3,3%) хворих.
Хоча результати лікування в реальних умовах більшою мірою узгоджуються з повсякденною клінічною практикою, ніж такі рандомізованих контрольованих та порівняльних випробувань, слід брати до уваги певні обмеження. По-перше, відкритий дизайн, імовірно, зумовлює упередженість, що впливає на наслідки, а дизайн непорівняльного дослідження може обмежити інтерпретацію цих даних. По-друге, у випробуванні оцінювали профілактику рецидивів у пацієнтів зі стійкою шизофренією (після лікування ПП1М у гострій фазі). Така стратегія відбору хворих мінімізує вплив факторів, що спотворюють результати, проте вона потенційно обмежує можливість їхнього узагальнення. Оцінка прихильності базувалася на моніторингу застосування препаратів протягом року спостереження, однак не враховувала ймовірних розбіжностей між призначеннями та фактичним використанням. Нарешті, дослідники не оцінювали можливий ефект супутньої фармакотерапії або немедикаментозних втручань.
Висновки
Підсумовуючи, автори зазначають, що >30% осіб із шизофренією продовжували терапію ІАПТД (із них >90% – ПП1M) упродовж 1-річного періоду в реальних умовах після короткотривалої стабілізаційної терапії ПП1M. Було показано прийнятну переносимість ПП1M при тривалому лікуванні. Ефективність безперервного використання ПП1M та будь-яких ІАПТД щодо подовження ЧПР була виразнішою у пацієнтів із факторами ризику рецидиву, які включали недостатню або погану прихильність до терапії антипсихотиками за період дослідження, госпіталізації протягом попереднього року та більший ступінь тяжкості хвороби перед початком короткотривалого лікування. Сукупність цих даних може допомогти клініцистам у відборі пацієнтів, які отримають максимальну користь від підтримувальної терапії ін’єкційними антипсихотиками тривалої дії.
Підготувала Наталія Купко
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 3 (50) жовтень 2019 р.
СТАТТІ ЗА ТЕМОЮ Психіатрія
У березні відбулася науково-практична конференція «Мультидисциплінарний підхід до проблемних питань неврології та психіатрії: нові стратегії лікування. Стрес-асоційовані розлади – виклики сьогодення». Захід був присвячений питанням вирішення проблем психічного та неврологічного характеру як однієї з загроз сучасного суспільства. ...
У сучасному світі люди щодня мають справу з величезною кількістю стресових ситуацій. Стрес – неспецифічна реакція організму у відповідь на стресовий фактор / небезпеку [1]. Сьогодення – вкрай стресовий час; ми постійно відчуваємо ті чи інші стресові ситуації, але в частки людей стресова подія трансформується і прогресує у тривожні розлади; іноді достатньо щонайменшого стресового епізоду, щоб зумовити розвиток тривожних розладів. Деякі люди, які перманентно перебувають у поточній стресовій ситуації, котрі зазнають один стрес за іншим, зберігають достатньо адекватне емоційне реагування, тобто адекватна емоційна реакція не перетворюється на тривожні розлади. ...
Наші діти зростають та живуть у складний час. Під час воєнного стану окупантами завдано значної шкоди як інфраструктурі України, так і життю й здоров’ю багатьох людей, особливо дітей, адже це найнезахищеніша категорія нашої спільноти. Найвищими цінностями зараз залишаються відчуття захищеності та безпеки як дітей, так і родини; однак на сучасному етапі наявність стійких стресів, постійної потреби переміщатися із класів або домівки до сховища на тлі відчуття страху обстрілів, почуття особистої тривоги, внутрішнього занепокоєння є невід’ємними супутниками загального стану наших дітей....
Депресія – це тяжка й поширена хвороба, яка уражає понад 300 млн осіб у всьому світі та вважається однією з найвагоміших проблем громадського здоров’я у ХХІ столітті (WHO, 2017). Інвалідизувальна природа депресії призводить до низки професійних, економічних, соціальних та особистих несприятливих наслідків (Thompson C., 2010). Протягом останніх років кількість випадків депресії значно зросла, перевантажуючи систему охорони здоров’я (Cipriani A. et al., 2018)....