Нутритивна підтримка імунної системи дітей
.jpg) Часта захворюваність дітей є ознакою порушення становлення їх імунної системи. Особливо часто (50-75%) хворіють діти в ранньому, дошкільному та молодшому шкільному віці [1]. Один зі способів підтримки імунної системи у дітей – регулярне вживання комплексів вітамінів та мінералів. Доведено, що їжа не може повністю задовольнити потреби дитини в усіх основних мікронутрієнтах. Найшвидший, фізіологічно обґрунтований і прийнятний шлях вирішення цієї проблеми – вживання додаткових препаратів, що містять мікронутрієнти. Це необхідно практично кожній дитині, навіть здоровій, особливо в зимово-весняний період.
Часта захворюваність дітей є ознакою порушення становлення їх імунної системи. Особливо часто (50-75%) хворіють діти в ранньому, дошкільному та молодшому шкільному віці [1]. Один зі способів підтримки імунної системи у дітей – регулярне вживання комплексів вітамінів та мінералів. Доведено, що їжа не може повністю задовольнити потреби дитини в усіх основних мікронутрієнтах. Найшвидший, фізіологічно обґрунтований і прийнятний шлях вирішення цієї проблеми – вживання додаткових препаратів, що містять мікронутрієнти. Це необхідно практично кожній дитині, навіть здоровій, особливо в зимово-весняний період.
Існують дві тактики застосування мікронутрієнтів – лікувальна і профілактична. Лікувальна передбачає використання більш високих доз мікронутрієнтів, проведення інтенсивних й іноді більш тривалих курсів корекції, використовується при доведеному дефіциті і під постійним лікарським контролем. Профілактична тактика є основною в педіатрії: своєчасно розпочатий прийом комплексів вітамінів і мінералів у дозах, що відповідають віковій добовій потребі, допомагає запобігти розвитку наслідків їх дефіциту [2].
Розглянемо можливість застосування дієтичної добавки Мультимакс® Імунітет для підтримки імунної системи дітей. У жувальній пастилці міститься 50 мг вітаміну С (L-аскорбінової кислоти), 8 мг рутину, 2,6 мг цинку та 5 мкг вітаміну D (холекальциферолу), рекомендується застосовувати по 1 пастилці на добу дітям від 3 років.
Як відомо, L-аскорбінова кислота (вітамін С) є всюдисущою вуглеводоподібною сполукою, яка відіграє важливу роль у ряді фізіологічних процесів, таких як продукція гормонів, енергетичний обмін, синтез колагену, клітинне окиснення тощо [8]. Також вітамін С відіграє ключову роль в епігенетичній регуляції активності генів, функціонуючи як кофактор певних ферментів, що викликають деметилювання ДНК [25].
Аскорбінова кислота (АК) може зворотно окиснюватися до дегідроаскорбінової кислоти (ДГАК). Внутрішньоклітинний транспорт вітаміну С (рис. 1) відбувається в усіх видах клітин у вигляді ДГАК за градієнтом концентрації через транспортери глюкози (GLUT) через схожість структури з глюкозою або активно, як АК, через натрійзалежні транспортери вітаміну С (SVCT) у таких органах, як тонка кишка, печінка, нирки, наднирники, мозок, сітківка. Всередині клітини ДГАК згодом перетворюється на АК. У фізіологічних умовах АК здатна до накопичення у високих концентраціях у нейтрофілах, лімфоцитах і моноцитах [15].
 Рис. 1. Орієнтовний механізм дії вітаміну С [8]
Рис. 1. Орієнтовний механізм дії вітаміну С [8]
Примітка: SVCT – натрійзалежний транспортер вітаміну C; GLUT – транспортер глюкози, AК – аскорбінова кислота, ДГАК – дегідроаскорбінова кислота.
При гострих інфекційних захворюваннях у пацієнтів виявляють низький рівень циркулюючого рівня вітаміну C (ймовірно, через надлишкову утилізацію внаслідок стресу). Вітамін С має корисні імуномодулювальні властивості переважно за рахунок збільшення вироблення інтерферонів (IFN) α та β і зниження рівня регулювання продукування протизапальних цитокінів [21]. Так, доведено, що вітамін С, особливо у формі ДГАК, чинить пряму противірусну дію, гальмуючи реплікацію вірусу грипу типу А [15, 24], зокрема через збільшення вироблення IFN-α та IFN-β [23].
Ще у 1961 році було проведено дослідження та встановлено, що у дітей у лижній школі Швейцарських Альп, які приймали аскорбінову кислоту в дозі 1 г/добу, була менша частота та тривалість захворювань на грип. На початку 70-х років американський хімік та лауреат двох Нобелівських премій у галузі хімії Карл Полінг зробив висновок, що вживання аскорбінової кислоти у дозі більше 1 г/добу може суттєво зменшити кількість і тяжкість епізодів застуди. Крім цього, вітамін С у високих дозах полегшує та попереджує симптоми грипу.
В експериментальних дослідженнях отримано підтвердження того, що вітамін С у дозі 125 мг/кг та 250 мг/кг зменшує смертність та тяжкість перебігу пневмонії у мишей зі стресом знерухомлення, викликаним вірусом A/FM/1/47(H1N1). При цьому вітамін С значно знижував експресію генів, у т.ч. мітохондріального антивірусного сигнального та інтерферон-регуляторного фактора, і підвищував експресію нуклеарного фактора NF-kB [11].
Як відомо, вірусні інфекції часто призводять до оксидативного стресу в інфікованих клітинах. Інфекція призводить до активації фагоцитів, при цьому відбувається вивільнення активних форм кисню (АФК). АФК відіграють важливу роль у дезактивації вірусів. Однак надлишок АФК (оксидативний стрес) є шкідливим для клітин людського організму, і при недостатності антиоксидантної системи виникає токсичний вплив на легеневу тканину. Оскільки вітамін С є найважливішим антиоксидантом, який безпосередньо впливає і знешкоджує АФК, а також відновлює активність інших клітинних антиоксидантів, включаючи тетрагідробіоптерин і α-токоферол [8], забезпечуючи репарацію ДНК [8] та імуномодулювальну дію [11, 29], він критично необхідний для захисту клітинних компонентів від окисного пошкодження, спричиненого токсичними вільними радикалами та іншими АФК [25], що і забезпечує потужну антиоксидантну дію, відповідно, і захист клітин від «цитокінового шторму». Таким чином, вітамін С може зменшувати викликану вірусом окиснювальну травму [28]. Також він пригнічує реплікацію вірусу простого герпесу 1 типу, поліовірусу 1 типу [15, 28]. Доведено, що вітамін С ефективно інактивував вірус сказу in vitro [26], а також йому притаманні антибактеріальні ефекти [29].
Назва «рутин» (його ще називають рутозидом, кверцетин-3-рутинозидом) походить від рослини Ruta graveolens. Це флавонол, який у значній кількості міститься в гречці, чаю та яблуках [16].
У багатьох дослідженнях доведено антиоксидантні [3, 13, 30, 37], противірусні [12, 22] та антибактеріальні [16] властивості рутину. Так, у присутності рутину спостерігаються періоди повного гальмування окисних процесів, пропорційні концентрації інгібітора [3]. Встановлено синергізм аскорбінової кислоти та рутину. Застосування аскорбінової кислоти або рутину в монотерапії знижує продукцію вільних радикалів через інгібування ксантиноксидази приблизно на 30%, тоді як їх комбінації – на 50%. У комбінації з рутином неферментативна антиоксидантна активність аскорбінової кислоти зростає на 15-20%. Також аскорбінова кислота і рутин комплементарні у транспортних та сигнальних функціях [17]. Більш значиме зниження рівня глюкози натщесерце було у групі пацієнтів із цукровим діабетом 2 типу, які отримували комбінацію рутину з аскорбіновою кислотою, ніж у групі пацієнтів, які отримували лише аскорбінову кислоту (p=0,0165 проти p=0,0388) [31].
Доведено високу активність рутину щодо респіраторного синцитіального вірусу [22] та антибактеріальну протидію по відношенню до Proteus vulgaris, Shigella sonnei, Klebsiella spp., Escherichia coli, Pseudomonas auruginossa, Bacillus subtilis. Серед механізмів антибактеріальної дії проти E. coli описано інгібування рутином ДНК ізомерази IV. Також рутин виявляв синергійний антибактеріальний вплив, знижуючи мінімальну інгібуючу концентрацію інших флавоноїдів [16].
Як відомо, метали є есенціальними компонентами і забезпечують функціональну активність більше половини ферментів [35]. Цинк є важливим мікроелементом, особливо необхідним для функціонування імунної системи [9, 33], зокрема, для підтримки вродженого імунітету й активації Т-клітин. Через відповідні канали цинк регулює різноманітні сигнальні каскади (рис. 2), опосередковані рецепторами гормону та фактора росту, цитокіновими рецепторами, Toll-like-рецепторами (TLR), рецепторами антигенів («цинкова сигналізація») [20]. Зниження рівня внутрішньоклітинного цинку є критичним для активації TLR.
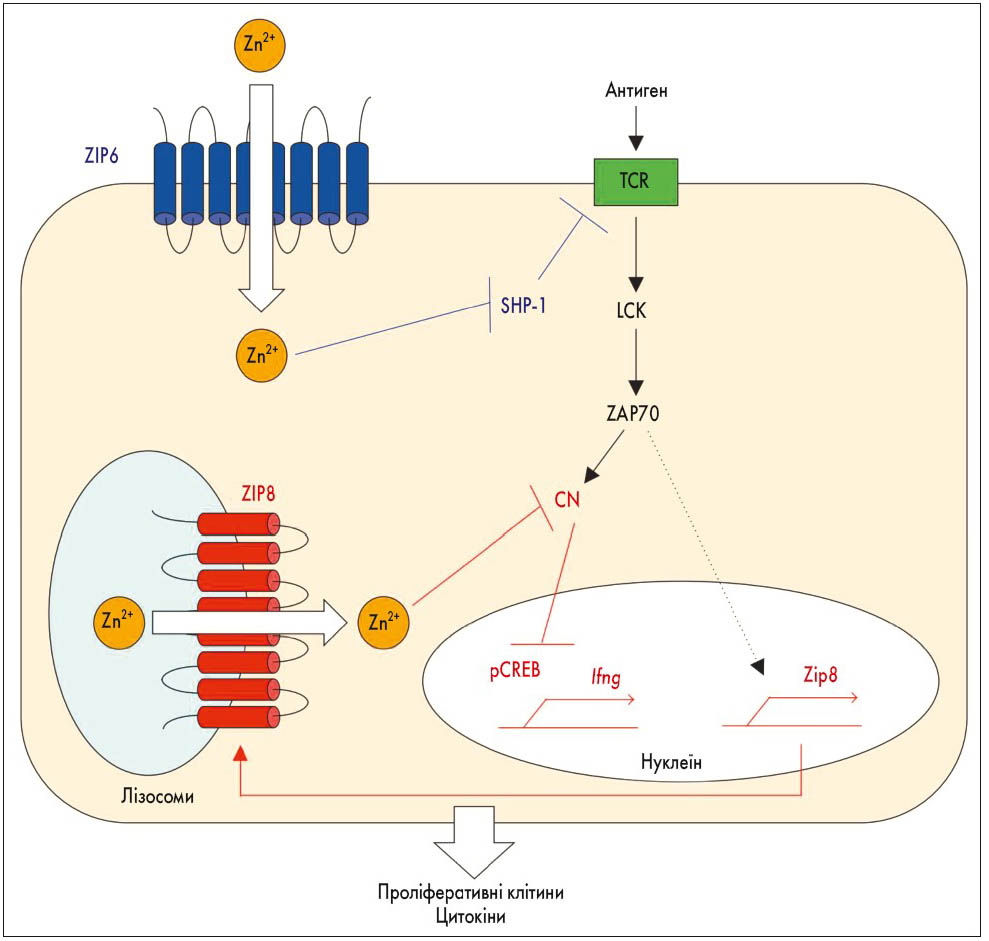 Рис. 2. Роль цинку у внутрішньоклітинній сигналізації [20]
Рис. 2. Роль цинку у внутрішньоклітинній сигналізації [20]
Більшість продуктів, багатих цинком, тваринного походження (м’ясо, молоко тощо). Тому діти, які проживають у країнах із низьким рівнем доходів, часто неправильно харчуються і мають дефіцит цього мікроелементу в організмі. Це зумовлює порушення росту, підвищення захворюваності та ризику тяжкого перебігу респіраторних інфекцій [5].
За результатами метааналізу 4 клінічних досліджень встановлено, що періодичний прийом дитиною цинку протягом більш ніж трьох місяців знижує частоту та тривалість інфекції нижніх дихальних шляхів (відносний ризик (RR) 0,60; 95% ДІ 0,70, 0,92). Результати метааналізу 10 рандомізованих клінічних досліджень (загалом обстежено 49 450 дітей) дозволили також встановити, що цинк зменшує частоту виникнення гострої інфекції нижніх дихальних шляхів. Серед механізмів, за допомогою яких цинк змінює чутливість до інфекції, – регуляція протизапальної цитокінової секреції, проліферація лімфоцитів та захист цілісності клітин епітелію дихальних шляхів в умовах гострого запального ураження легень [32].
Як відомо, вітамін D є жиророзчинним. Вітаміни D2 і D3 потрапляють до організму з продуктами харчування. Вітамін D3 у значній кількості міститься в лососевих, тунці, сардинах, риб’ячому жирі. Тому запаси цього вітаміну у дорослих поповнюються продуктами харчування лише на 10-20%, у той час як у дітей цей показник може бути ще меншим. Певна кількість вітаміну D3 синтезується в шкірі під впливом ультрафіолетових сонячних променів. Взимку, коли синтез вітаміну D обмежений через коротку тривалість світлового дня, кута падіння сонячного світла й обмеженої площі шкірних покривів, відкритих сонячному світлу, дорослі й діти частіше страждають від гострих інфекцій нижніх дихальних шляхів [4]. Тому особливий інтерес останнім часом викликають дослідження ролі вітаміну D у підтримці як вродженого, так і адаптивного імунітету. Доведено, що вітамін D відіграє важливу роль у регулюванні роботи імунної системи і може захищати від інфекцій, його прийом знижує частоту і тяжкість перебігу гострих інфекцій нижніх дихальних шляхів, а також скорочує смертність від них [4]. За результатами подвійного сліпого рандомізованого плацебо-контрольованого дослідження, у якому взяли участь 453 дитини з негоспітальною пневмонією віком від 1 до 36 місяців (224 дитини отримували вітамін D3, а 229 – плацебо), встановлено, що ризик повторного епізоду пневмонії протягом 90 днів після прийому вітаміну D3 був меншим (92/204; 45%), ніж у групі плацебо (122/211; 58%; RR 0,78; 95% ДІ 0,64, 0,94; р=0,01) [27].
Було проведено метааналіз 18 незалежних рандомізованих контрольованих досліджень (загалом 57 311 учасників), в яких учасники приймали додатково вітамін D у добовій дозі 300-2000 МО (в середньому 528 МО). Було відмічено 4 777 випадків смерті з будь-яких причин. Сумарний відносний ризик смерті при додатковому вживанні вітаміну D становив 0,93 (95% ДІ 0,87-0,99) [7].
Механізми впливу вітаміну D на імунну систему активно вивчаються. В імунних клітинах виявлено рецептор до вітаміну D (VDR) [19]. Доведено, що активовані Т- і В-лімфоцити людини, а також клітини ендотелію, що вистилають верхні та нижні дихальні шляхи, можуть метаболізувати неактивний метаболіт 25-гідроксихолекальциферол 25(OH)D в активний 1α,25(OH)2D. Ця сполука діє на імунні клітини аутокринним, паракринним або внутрішньокринним способом (тобто всіма внутрішньоклітинними шляхами) [19]. Імуномодулювальну дію вітаміну D пов’язують як із ранньою, так і пізньою фазами інфекції [14].
Вважається, що основним механізмом протиінфекційної дії вітаміну D є його здатність індукувати утворення в макрофагах, нейтрофілах і епітеліальних клітинах антимікробних протеїнів (β-дефензинів і кателіцидину), які спричинюють загибель мікроорганізмів в аутофагосомах, проявляючи активність щодо бактерій, вірусів і грибів.
Доведено, що сироватковий рівень вітаміну D у пацієнтів із грипом корелює з рівнем IgM та IgG3 [21].
Взаємодія інфекційних агентів із макрофагом через TLR призводить до індукції транскрипції мітохондріального ферменту 1α-гідроксилази і VDR. Як наслідок, у реакції, каталізованій цим ферментом, відбувається посилення внутрішньоклітинного перетворення 25(ОН)D в активну форму – 1α,25(ОН)2D. Останній у комплексі з VDR на генному рівні підвищує експресію молекул кателіцидину, які потім трансформуються у фагосоми, де реалізують свої антибактеріальні властивості. Крім того, 1α,25(ОН)2D, що утворюється в макрофагах, може зумовлювати і паракринні ефекти, впливаючи на функцію моноцитів, Т- і В-лімфоцитів [1].
Ефективність профілактичної дії вітаміну D щодо захворюваності на грип підтверджена результатами рандомізованого подвійного сліпого плацебо-контрольованого дослідження [36]. Встановлено, що зі 167 школярів, які отримували вітамін D3 у дозі 1200 МО на добу з грудня по березень, 18 учнів (10,8%) перехворіли на грип, тоді як у контрольній групі – 31 зі 167 (18,6%) (RR 0,58; 95% ДІ 0,34, 0,99; р=0,04). Лише у двох дітей із бронхіальною астмою було зафіксовано її загострення, тоді як із групи плацебо – у 12 дітей (RR 0,17; 95% ДІ 0,04, 0,73; р=0,006) [36].
Як показали результати останніх досліджень, у хворих на COVID-19 розвивається гострий респіраторний дистрес-синдром, який може призвести до пошкодження декількох органів. Ці симптоми зумовлені цитокіновою бурею. Вважається, що застосування вітаміну D може зменшити ризик захворюваності на COVID-19 за рахунок збільшення рівня ангіотензин-перетворювального ферменту 2 типу. Це може запобігти розвитку окcидативного стресу та ураженню органів за рахунок зменшення рівня запальних цитокінів у багатьох тканинах. Вітамін D може посилювати антимікробну активність за рахунок підвищення рівня пептидів дефенсинів та кателіцидинів і це також асоціюється з підвищенням ефективності при COVID-19 [6]. Гіпотеза, що додатковий прийом вітаміну D може знизити ризик захворюваності та смертності від COVID-19, має бути перевірена у ході клінічних досліджень із визначенням сироваткового рівня 25(OH)D [18]. У квітні 2020 року розпочато клінічне дослідження зі встановлення ефективності та безпечності застосування вітаміну D для профілактики та лікування COVID-19 [34].
Американська академія педіатрії рекомендує щоденно приймати 400 МО вітаміну D дітям молодшого і середнього віку, а також підліткам [4].
Нутритивна підтримка є важливою складовою забезпечення активності імунної системи у дітей. Дієтична добавка Мультимакс® Імунітет містить спеціально підібрані вітаміни для підвищення дитячого імунітету. Вітаміни С, D, рутин та цинк забезпечують антиоксидантний захист, чинять пряму противірусну та протибактеріальну дію, підвищують активність як вродженого, так і адаптивного імунітету, що сприяє зниженню частоти та тяжкості інфекційних захворювань, а також зменшує потребу в антибіотикотерапії та її тривалість.
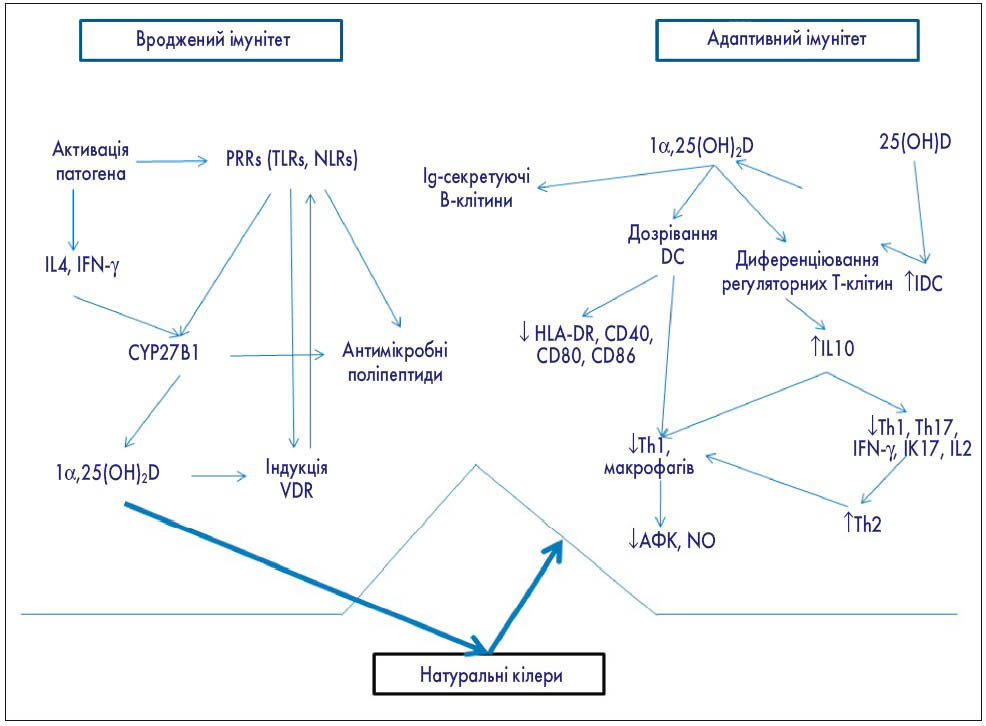 Рис. 3. Роль вітаміну D в імунній відповіді [19 в модифікації]
Рис. 3. Роль вітаміну D в імунній відповіді [19 в модифікації]
PRRs – рецептори розпізнавання патогенів; TLRs – Toll-like-рецептори; NLRs – нуклеотид-зв'язуючий домен олігомеризації (NOD) like-рецепторів; IL – інтерлейкін; IFN-γ – інтерферон-γ; CYP27B1 – цитохром-P450-пов’язана 25(OH)D(3)-1α-гідроксилаза; VDR – рецептори вітаміну D; Ig – імуноглобулін; DC – дендритні клітини; HLA-DR – людські лейкоцитарні антигени; CD – костимулюючі молекули; Th – T-helper-клітини; АФК – активні форми кисню; NO – оксид азоту.
Література
- Квашніна Л.В. Нормалізація рівня вітаміну D та мікробіоценозу кишечнику – обов’язкові складові неспецифічної імунопрофілактики і реабілітації дітей, що часто хворіють. – Дитячий лікар; 2014; 36 (7): 20-26. https://d-l.com.ua/uploads/files/2014/7%20(36)/86940189.pdf.
- Косенко И.М. Микронутриенты и здоровье детей. – Вопросы современной педиатрии; 2011; 10 (6): 179-185. https://cyberleninka.ru/article/n/mikronutrienty-i-zdorovie-detey.
- Музиева М.Е. Антиоксидантная эффективность рутина в условиях гомогенной и водно-эмульсионной кинетической моделей. – Химические науки, с. 20-23. https://cyberleninka.ru/article/n/antioksidantnaya-effektivnost-rutina-v-usloviyah-gomogennoy-i-vodno-emulsionnoy-kineticheskoy-modeley.
- Назначение витамина D детям с респираторными инфекциями для улучшения исхода лечения. Биологические, поведенческие и контекстуальные обоснования. https://www.who.int/elena/titles/bbc/vitamind_pneumonia_children/ru/.
- Назначение препаратов цинка детям с респираторными инфекциями для улучшения исхода лечения. Биологические, поведенческие и контекстуальные обоснования. https://www.who.int/elena/titles/bbc/zinc_pneumonia_children/ru/.
- Aygun Н. Vitamin D can prevent COVID-19 infection-induced multiple organ damage. – Naunyn-Schmiedeberg’s Arch Pharmacol; 2020; 393 (7): 1157-1160. doi: 10.1007/s00210-020-01911-4.
- Autier Р., Gandini S. Vitamin D Supplementation and Total Mortality: A Meta-Analysis of Randomized Controlled Trials. – Arch Intern Med; 2007; 167 (16): 1730-1737. doi: 10.1001/archinte.167.16.1730.
- Bevan R.J. Can vitamin C induce nucleotide excision repair? Support from in vitro evidence. – British Journal of Nutrition; 2010; 103: 686-695. doi:10.1017/S0007114509992285.
- Bobeck E.A. Nutrition and health: companion animal applications: Functional nutrition in livestock and companion animals to modulate the immune response. – J Anim Sci.; 2020 Mar 1; 98 (3). pii: skaa035. doi: 10.1093/jas/skaa035.
- Brinkevich S.D. et al. Radical-regulating and antiviral properties of ascorbic acid and its derivatives. – Bioorganic & Medicinal Chemistry Letters; 2012; 22: 2424-2427. https://doi.org/10.1016/j.bmcl.2012.02.022.
- Cai Y. et al. A New Mechanism of Vitamin C Effects on A/FM/1/47(H1N1) Virus-Induced Pneumonia in Restraint-Stressed Mice. – BioMed Research International; 2015; 675149 | 1-12 | http://dx.doi.org/10.1155/2015/675149.
- Cheron N. et al. Repurposing of rutin for the inhibition of norovirus replication. – Arch Virol.; 2015 Sep; 160 (9): 2353-8. doi: 10.1007/s00705-015-2495-y.
- Enogieru A.B. et al. Rutin as a Potent Antioxidant: Implications for Neurodegenerative Disorders. – Oxidative Medicine and Cellular Longevity; 2018; 6241017 | 1-17 | https://doi.org/10.1155/2018/6241017.
- Friis H. et al. Hypovitaminosis D is common among pulmonary tuberculosis patients in Tanzania but is not explained by the acute phase response. – J. Nutr.; 2008; 138 (12): 2474-2480. doi: 10.3945/jn.108.094979.
- Furuya A. et al. Antiviral effects of ascorbic and dehydroascorbic acids in vitro. – International journal of molecular medicine; 2008; 22: 541-545. DOI: 10.3892/ijmm_00000053.
- Ganeshpurkar A., Saluja A.K. The Pharmacological Potential of Rutin. – Saudi Pharmaceutical Journal; 2017; 25, 149-164. http://dx.doi.org/10.1016/j.jsps.2016.04.025.
- Gegotek A., Ambrozewicz E., Jastrzab A., Jarocka-Karpowicz I., Skrzydlewska E. Rutin and ascorbic acid cooperation in antioxidant and antiapoptotic effect on human skin keratinocytes and fibroblasts exposed to UVA and UVB radiation. – Archives of Dermatological Research; 2019; 311: 203-219. https://doi.org/10.1007/s00403-019-01898-w.
- Grant W.B., Lahore H., McDonnell S.L. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. – Nutrients; 2020; 12 (4): 988. doi:10.3390/nu12040988.
- Gruber-Bzura B.M. Vitamin D and Influenza – Prevention or Therapy? – International Journal of Molecular Sciences; 2018; 19, 2419; doi:10.3390/ijms19082419.
- Hojyo S., Fukada T. Roles of Zinc Signaling in the Immune System. – Journal of Immunology Research; 2016; 6762343, 1-21. http://dx.doi.org/10.1155/2016/ 6762343.
- Jones B.G. et al. Retinol binding protein and vitamin D associations with serum antibody isotypes, serum influenza virus-specific neutralizing activities and airway cytokine profiles. – Clin Exp Immunol.; 2016 Feb;183 (2): 239-47. doi: 10.1111/cei.12718.
- Kant K., Lal U.R., Ghosh M. Computational Breakthrough of Natural Lead Hits from the Genus of Arisaema against Human Respiratory Syncytial Virus. – Pharmacogn Mag.; 2018 Jan; 13 (Suppl 4): S780-S785. doi: 10.4103/pm.pm_459_16.
- Kim Y. et al. Vitamin C Is an Essential Factor on the Anti-viral Immune Responses through the Production of Interferon-α/β at the Initial Stage of Influenza A Virus (H3N2) Infection. – Immune network; 2013; 13 (2): 70-74. http://dx.doi.org/10.4110/in.2013.13.2.70.
- Kim H. et al. Red ginseng and vitamin C increase immune cell activity and decrease lung inflammation induced by influenza A virus/H1N1 infection. – Journal of Pharmacy and Pharmacology; 2016; 68 (3): 406-420. doi: 10.1111/jphp.12529.
- Macan A.M. et al. Therapeutic Perspective of Vitamin C and Its Derivatives. Antioxidants; 2019; 8, 247; doi:10.3390/antiox8080247.
- Madhusudana S.N., Shamsundar R., Seetharaman S. In vitro inactivation of the rabies virus by ascorbic acid. – International journal of infectious diseases; 2004; 8 (1): 21-25. DOI: 10.1016/j.ijid.2003.09.002.
- Manaseki-Holland S., Qader G., Masher M.I. et al. Effects of Vitamin D Supplementation to Children Diagnosed With Pneumonia in Kabul: A Randomised Controlled Trial. – Trop Med Int Health; 2010; 15 (10): 1148-1155. doi: 10.1111/j.1365-3156.2010.02578.x.
- Manuel R. et al. The antiviral properties of vitamin C. – Expert Review of Anti-infective Therapy; 2020; 18: 2, 99-101, DOI: 10.1080/14787210.2020.1706483.
- Mousavi S. et al. Immunomodulatory and Antimicrobial Effects of Vitamin C. – European Journal of Microbiology and Immunology; 2019; 9 (3): 73-79. DOI: 10.1556/1886.2019.00016.
- Nishimura M. et al. Effectiveness of rutin-rich Tartary buckwheat (Fagopyrum tataricum Gaertn.) «Manten-Kirari» in body weight reduction related to its antioxidant properties: A randomised, double-blind, placebo-controlled study. – Journal of Functional Foods; 2016; 26: 460-469.
- Ragheb S.R., El Wakeel L.M., Nasr, M.S., Sabri N.A. Impact of Rutin and Vitamin C combination on oxidative stress and glycemic control in patients with type 2 diabetes. – Clinical Nutrition Espen; 2019. doi:https://doi.org/10.1016/j.clnesp.2019.10.015.
- Roth D.E., Richard S.A., Black R.E. Zinc Supplementation for the Prevention of Acute Lower Respiratory Infection in Children in Developing Countries: Meta-Analysis and Meta-Regression of Randomized Trials. – Int J Epidemiol; 2010; 39 (3): 795-808. doi: 10.1093/ije/dyp391.
- K. Schuhladen et al. Cu, Zn doped borate bioactive glasses: antibacterial efficacy and dose-dependent in vitro modulation of murine dendritic cells. – Biomater Sci; 2020 Apr 6. doi: 10.1039/c9bm01691k.
- Vitamin D on prevention and treatment of COVID-19. https://clinicaltrials.gov/ct2/show/NCT04334005.
- Wang C. et al. Metalloimmunology: The metal ion-controlled immunity. – Adv Immunol; 2020; 145: 187-241. doi: 10.1016/bs.ai.2019.11.007.
- Urashima M. et al. Randomized trial of vitamin D supplementation to prezent seasonal influenza A in schoolchildren. – Am. J. Clin. Nutr.; 2010; 91, 1255-1260. DOI: 10.3945/ajcn.2009.29094.
- Zhang Y. et al. Effect of rutin on cisplatin-induced damage in human mesangial cells via apoptotic pathway. – Hum Exp Toxicol.; 2019 Jan; 38 (1): 118-128. doi: 10.1177/0960327118785233.
Тематичний номер «Педіатрія» №4 (55) 2020 р.
СТАТТІ ЗА ТЕМОЮ Педіатрія
Вроджена дисфункція кори надниркових залоз (ВДКНЗ) – це захворювання з автосомно-рецесивним типом успадкування, в основі якого лежить дефект чи дефіцит ферментів або транспортних білків, що беруть участь у біосинтезі кортизолу. Рання діагностика і початок лікування пацієнтів з ВДКНЗ сприяє покращенню показників виживаності та якості життя пацієнтів....
Алергічний риніт (АР) є поширеним запальним захворюванням верхніх дихальних шляхів (ВДШ), особливо серед педіатричних пацієнтів. Ця патологія може знижувати якість життя, погіршувати сон та щоденну продуктивність. Метою наведеного огляду є надання оновленої інформації щодо епідеміології АР та його діагностики, з урахуванням зв’язку з бронхіальною астмою (БА). ...
Американська академія педіатрії (AAP) оновила рекомендації щодо контролю грипу серед дитячого населення під час сезону 2023-2024 рр. Згідно з оновленим керівництвом, для профілактики та лікування грипу в дітей необхідно проводити планову вакцинацію з 6-місячного віку, а також своєчасно застосовувати противірусні препарати за наявності показань. ...
Поширеність і вплив алергічних захворювань часто недооцінюють [1]. Ключовим фактором алергічної відповіді є імуноглобулін (Ig) Е, присутній на поверхні тучних клітин і базофілів. Взаємодія алергену з IgЕ та його рецепторним комплексом призводить до активації цих клітин і вивільнення речовин, у тому числі гістаміну, які викликають симптоми алергії [2]. Враховуючи ключову роль гістаміну в розвитку алергічних реакцій, при багатьох алергічних станах, включаючи алергічний риніт і кропив’янку, пацієнту призначають антигістамінні препарати [3, 4]....




