Стратегія ведення пацієнток із вперше виявленим раком яєчника
Циторедуктивна хірургія та хіміотерапія (ХТ) є невід’ємними складовими лікування пацієнток із раком яєчника (РЯ). Однак ХХІ сторіччя ознаменувалося появою в онкології сучасних таргетних та імунних препаратів, таргетні препарати зайняли свою нішу, зокрема, і в терапії РЯ. Проте успішний результат лікування при РЯ можливий за умови урахування низки факторів, розглянутих у рамках онлайн-заходу «Школа циторедуктивної хірургії у пацієнток з раком яєчників. Досвід клініки Lisod».
 Головний лікар Лікарні ізраїльської онкології Lisod, доктор медичних наук, професор Алла Борисівна Вінницька свою доповідь присвятила персоналізованому підходу до ведення пацієнток з РЯ.
Головний лікар Лікарні ізраїльської онкології Lisod, доктор медичних наук, професор Алла Борисівна Вінницька свою доповідь присвятила персоналізованому підходу до ведення пацієнток з РЯ.
– РЯ є однією з основних причин смертності від раку у всьому світі. Згідно з даними Міжнародного агентства з вивчення раку (IACR), за 2018 р. від РЯ померло понад 184 тис. осіб різних вікових категорій. За цей час було встановлено понад 300 тис. нових діагнозів РЯ, із них близько 60% пацієнток мали запущену стадію раку. За даними різних авторів, через 3 роки після закінчення 1-ї лінії терапії у 70% жінок стається рецидив хвороби (A. du Bois et al., 2009; J.A. Ledermann et al., 2013). П’ятирічна виживаність пацієнток з уперше встановленим діагнозом поширений РЯ складає 30-50% (J.A. Ledermann et al., 2013; K.S. Tewari et al., 2019).
Від 1975 р. відбулася помітна еволюція підходів до 1-ї лінії терапії при РЯ. Першим значущим досягненням у лікуванні пацієнток з РЯ стало застосування схеми з цисплатином, який пізніше був замінений на карбоплатин. Режим карбоплатин + паклітаксел 1 раз через кожні 3 тижні залишається стандартом 1-ї лінії ХТ, оскільки фінальні результати дослідження, що були презентовані на останьому конгресі ESMO-2020, не показали істотної переваги щотижневої ХТ над стандартним 3-тижневим режимом (A.R. Clamp et al., 2019; 2020).
На фоні проведення ХТ у великої частини пацієнток з РЯ стається рецидив, який може зумовлювати різний прогноз. Найменш сприятливий прогноз мають пацієнтки з рефрактерною пухлиною яєчника, у яких спостерігається прогресування хвороби на фоні ХТ. До прогностично несприятливих належить платинорезистентний рецидив, який розвивається протягом 6 міс після 1-ї лінії терапії. Розвиток рецидиву більш ніж через 6 міс після закінчення 1-ї лінії ХТ визначається як платиночутливий рецидив РЯ, який характеризується кращим прогнозом для пацієнтки і дає можливість повторити курс лікування препаратами платини.
Метааналіз даних пацієнток з РЯ IIB-IV стадії за FIGO у рамках досліджень AGO3 (AGO Ovar 3, 5, 7), яким було проведено ХТ 1-ї лінії, показав, що 21,8% пацієнток мали платинорезистентний рецидив, 54,1% – платиночутливий, а у 22,6% рецидиву не спостерігалося протягом 5 років (A. du Bois et al., 2009). На ефективність наступних ліній ХТ при РЯ впливає тривалість так званого безплатинового періоду. Так, що коротший інтервал між попередньою та наступною лініями терапії, то нижчий рівень загальної відповіді, виживаності без прогресування (ВБП) і загальної виживаності (ЗВ).
Важливим кроком в еволюції методів лікування РЯ стало проведення первинної циторедукції, яка дозволяє істотно підвищити рівень виживаності пацієнток. За даними A. du Bois та співавт. (2009), проведення повної циторедукції без макроскопічних ознак пухлини дозволяє збільшити медіану ЗВ на 60,3 міс при IIB-ІІІВ стадії за FIGO, на 46,9 міс – при ІІІС стадії та на 30,0 міс – при IV стадії. У разі мінімальної макроскопічної резидуальної пухлини розміром 0,1-1,0 см після виконання циторедукції ЗВ менша на 30 міс, а ВБП – на 14 міс порівняно з відсутністю макроскопічних ознак пухлини. Наявність макроскопічних залишків пухлини розміром >1 см зменшує ЗВ та ВБП ще на 10 та 4 міс відповідно (M. Luis, 2016). Таким чином, відсутність макроскопічних ознак пухлини має бути основною метою циторедуктивної операції.
Новим етапом удосконалення наявних схем медикаментозного лікування в онкогінекології стало впровадження підтримуючої терапії – лікування за допомогою препаратів, які зазвичай застосовуються після початкової терапії. Підтримуюча терапія може включати ХТ, гормональну і таргетну терапію. Підтримуюча терапія є пролонгованою і застосовується з метою запобігання рецидиву у пацієнток, у яких отримано відповідь на перший етап лікування, а також для сповільнення подальшого поширення пухлинного процесу та продовження тривалості життя.
Підтримуюча терапія застосовується у разі серозного РЯ високого ступеня злоякісності (HGSOC) як 1-ша лінія терапії та для лікування рецидиву (бевацизумаб, олапариб), а при РЯ низького ступеня злоякісності (LGSOC) – додатково до 1-ї лінії терапії (ендокринна терапія інгібіторами ароматази, тамоксифеном).
Бевацизумаб – моноклональне антитіло, інгібітор ангіогенезу, дія якого спрямована на рецептор VEGF1. Бевацизумаб безпосередньо зв’язується з судинним ендотеліальним фактором росту (VEGF), блокує його зв’язування з рецепторами Flt‑1 (VEGFR‑1) і KDR (VEGFR‑2) на поверхні ендотеліальних клітин судин і таким чином пригнічує неоангіогенез. Олапариб – потужний інгібітор полі(АДФ-рибози)-полімераз людини (PARP‑1, PARP‑2 і PARP‑3), який блокує ефективну репарацію одноланцюгових розривів ДНК і призводить до загибелі пухлинних клітин.
Підтримуюча терапія бевацизумабом: доказова база
У рандомізованому дослідженні III фази GOG‑0218 оцінювали вплив бевацизумабу (15 мг/кг маси тіла) на тривалість виживаності пацієнток з РЯ ІІІ-IV стадії. Усіх учасниць було розподілено на 3 групи: контрольна група (ХТ + плацебо), група з бевацизумабом під час ХТ без подальшої підтримуючої терапії та група з бевацизумабом під час ХТ із підтримуючою терапією. Результати дослідження показали, що додавання до ХТ бевацизумабу без продовження його прийому у підтримуючому режимі не має статистично значущого впливу на медіану ВБП. Схема ХТ + бевацизумаб з продовженням його застосування в підтримуючому режимі покращує медіану ВБП лише на 3,8 міс порівняно з тільки ХТ (відношення ризиків – ВР – 0,717; R.A. Burger et al., 2011). Що стосується ЗВ, то не спостерігалося статистично значущої різниці в пацієнток, котрі отримували бевацизумаб і лише ХТ, окрім підгрупи осіб з IV стадією захворювання (ВР 0,75; 95% довірчий інтервал – ДІ – 0,59-0,95) та з АС (ВР 0,82; 95% ДІ 0,70‑0,96; p=0,014; S. Tewari et al., 2019).
Результати багатоцентрового рандомізованого дослідження III фази ICON7 показали, що додавання бевацизумабу (7,5 мг/кг) до ХТ та продовження його прийому в підтримуючому режимі не має статистично значущого впливу на медіану ВБП та ЗВ у загальній групі пацієнток порівняно лише з ХТ. Додавання бевацизумабу статистично значуще покращує медіану ВБП на 5,5 міс та медіану ЗВ на 9,4 міс порівняно з лише ХТ у пацієнток із високим ризиком: III стадія з неоптимальною циторедукцією, IV стадія або неоперабельні пацієнтки (A.M. Oza et al., 2015).
За даними досліджень, застосування бевацизумабу з ХТ без подальшого продовження його прийому у підтримуючому режимі не впливає на виживаність пацієнток з РЯ.
До сьогодні стандартом 1-ї лінії терапії при РЯ є комбінація карбоплатин + паклітаксел. За останні 20 років ЗВ пацієнток з РЯ майже не змінилася, а підтримуюча терапія бевацизумабом дозволила незначно продовжити медіану ВБП, але не ЗВ.
Значення BRCA-статусу у веденні пацієнток з РЯ
Згідно з настановами авторитетних міжнародних організацій (NCCN, SGO, ASCO, ESMО), визначення BRCA-статусу рекомендовано в усіх жінок із немуцинозним РЯ під час встановлення діагнозу, незалежно від сімейного анамнезу. Мутації BRCA є прогностичним маркером у пацієнток з РЯ. Як правило, хворі з мутацією BRCA2 мають більш сприятливий прогноз, ніж з мутацією BRCA1 чи BRCA-негативним статусом (F.J. Candido-dos-Reis et al., 2015). Визначення мутації BRCA має значення перед обранням стратегії лікування пацієнтки. Результати дослідження B. Norquist та співавт. (2018) показали, що додавання бевацизумабу у схему терапії пацієнток з мутаціями BRCA не мало статистично достовірного впливу на ВБП, натомість у хворих без мутації BRCA бевацизумаб статистично значуще покращив ВПБ.
Підтримуюча терапія олапарибом: доказова база
У міжнародному відкритому рандомізованому дослідженні III фази SOLO‑1 оцінювали ефективність підтримуючої терапії олапарибом у пацієнток з уперше встановленим діагнозом серозний чи ендометріоїдний РЯ високого ступеня злоякісності ІІІ-IV стадії за FIGO, рак маткових труб або первинний перитонеальний рак із мутаціями BRCA1, BRCA2 чи обох генів (BRCA1/2), у яких отримано повну або часткову відповідь на ХТ. Пацієнтки були рандомізовані у співвідношенні 2:1 у групу олапарибу (n=260) та групу плацебо (n=131). Лікування проводили до прогресування хвороби, у разі відсутності ознак хвороби терапію припиняли через 2 роки, пацієнтки з частковою відповіддю могли отримувати лікування довше ніж 2 роки. Через 1 рік підтримуючої терапії майже у 50% пацієнток з групи плацебо виявлено прогресування хвороби порівняно з 12% у групі олапарибу. Через 5 років спостереження ефективність 2-річної підтримуючої терапії олапарибом за ВБП зберігалася навіть після її закінчення зі зниженням ризику прогресування чи смерті на 67%. П’ятирічна ВБП у пацієнток, котрі приймали олапариб, становила 48%, що більше як у 2 рази, ніж в групі плацебо – 21% (рис. 1). Що стосується часу проведення циторедукції, то первинна циторедукція забезпечувала вищу ВБП в обох групах порівняно з інтервальною циторедукцією. Однак у пацієнток з інтервальною циторедукцією в групі олапарибу ВБП була вищою, ніж у хворих із первинною циторедукцією в групі плацебо. Застосування олапарибу також сприяло кращим показникам виживаності, незалежно від результатів операції: у пацієнток з групи олапарибу із залишковою резидуальною пухлиною після циторедукції ВБП була більшою, ніж у групі плацебо без залишкової резидуальної пухлини. Така ж тенденція спостерігалася щодо відповіді на ХТ: у пацієнток з групи олапарибу із частковою відповіддю ВБП була вищою, ніж у групі плацебо з повною відповіддю. Пацієнтки з частковою відповіддю після ХТ при застосуванні олапарибу досягали повної відповіді в 2,3 разу частіше порівняно з плацебо. Переваги олапарибу над плацебо були продемонстровані у хворих із різним прогнозом (рис. 2). Найчастішими побічними ефектами, пов’язаними із прийомом олапарибу, були нудота, втома/астенія, блювання, анемія, діарея, запор, дисгевзія, артралгії, нейтропенія (K. Moore et al., 2018; S. Banerjee et al., 2020).
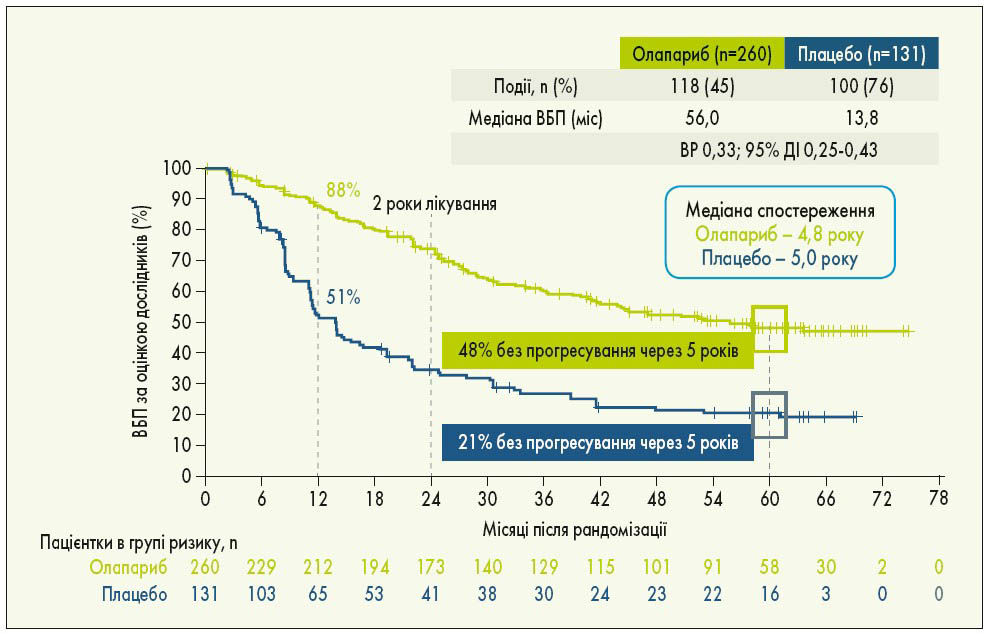 Рис. 1. Дані 5-річного спостереження SOLO‑1
Рис. 1. Дані 5-річного спостереження SOLO‑1
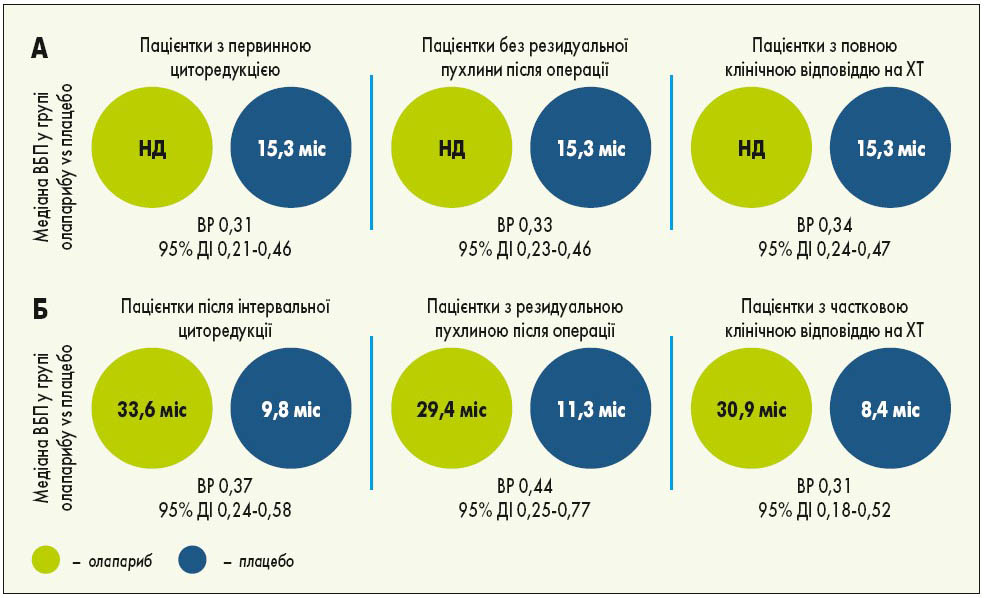 Рис. 2. Переваги олапарибу порівняно з плацебо у пацієнток із більш сприятливим прогнозом (А) та менш сприятливим прогнозом (Б). НД – не досягнута
Рис. 2. Переваги олапарибу порівняно з плацебо у пацієнток із більш сприятливим прогнозом (А) та менш сприятливим прогнозом (Б). НД – не досягнута
Важливо наголосити на тому, що підтримуючу терапію олапарибом слід проводити у 1-й лінії, адже далі після виникнення рецидиву імовірність отримання користі від його призначення різко знижується. Так, у дослідженні SOLO‑1 у групі плацебо у близько 20% пацієнток протягом перших 6 міс після ХТ виник платинорезистентний рецидив, при якому PARP-інгібітори не застосовуються. Приблизно 55% учасниць мали платиночутливий рецидив, проте 40% з них не будуть мати відповіді на наступні лінії ХТ, а отже – не зможуть отримати лікування PARP-інгібіторами у 2-й лінії (І. Bruchim et al., 2013; C. Aghajanian et al., 2012).
У процесі гомологічної рекомбінації крім гена BRCA беруть участь і інші гени, мутації яких призводять до дефіциту гомологічної рекомбінації (HRD). Такі пухлини називаються HRD-позитивними, вони також чутливі до олапарибу, що було продемонстровано у дослідженні PAOLA‑1.
У рандомізоване дослідження PAOLA‑1 були включені пацієнтки з РЯ (серозним або ендометріоїдним) з високим ризиком і ІІІ-IV стадією за FIGO, у яких досягнута відповідь на 1-шу лінію ХТ з бевацизумабом. Попередньо учасницям дослідження визначили BRCA- та HRD-статус: 48% жінок мали HRD-позитивний статус, у 29% була виявлена мутація BRCA. Пацієнтки були рандомізовані у співвідношенні 2:1 на 2 групи: 1-ша група отримувала олапариб у дозі 300 мг 2 р/добу протягом 24 міс, 2-га група – плацебо. Усі пацієнтки приймали бевацизумаб у дозі 15 мг/кг через кожні 3 тижні. Результати дослідження показали, що олапариб істотно підвищує ВБП порівняно з плацебо (22,1 проти 16,6 міс; ВР 0,59; 95% ДІ 0,49-0,72; p<0,0001; рис. 3). Груповий аналіз продемонстрував значну перевагу олапарибу у пацієнток з HRD-позитивним статусом (включаючи мутації BRCA) порівняно з плацебо: медіана ВБП становила 37,2 та 17,7 міс відповідно (ВР 0,33; 95% ДІ 0,25-0,45; рис. 4). Додавання олапарибу до бевацизумабу подвоїло частоту повної відповіді у пацієнток з HRD-позитивним статусом порівняно з підтримуючою терапією лише бевацизумабом. Через 3 роки спостереження у загальній популяції дослідження статистично значуща перевага в точці ВБП2 (після першого прогресування хвороби) зафіксована при використанні олапарибу + бевацизумабу порівняно із застосуванням лише бевацизумабу. Особливо помітною була перевага використання комбінації з олапарибом у пацієнток із HRD-позитивним статусом (I. Ray-Coquard et al., 2019).
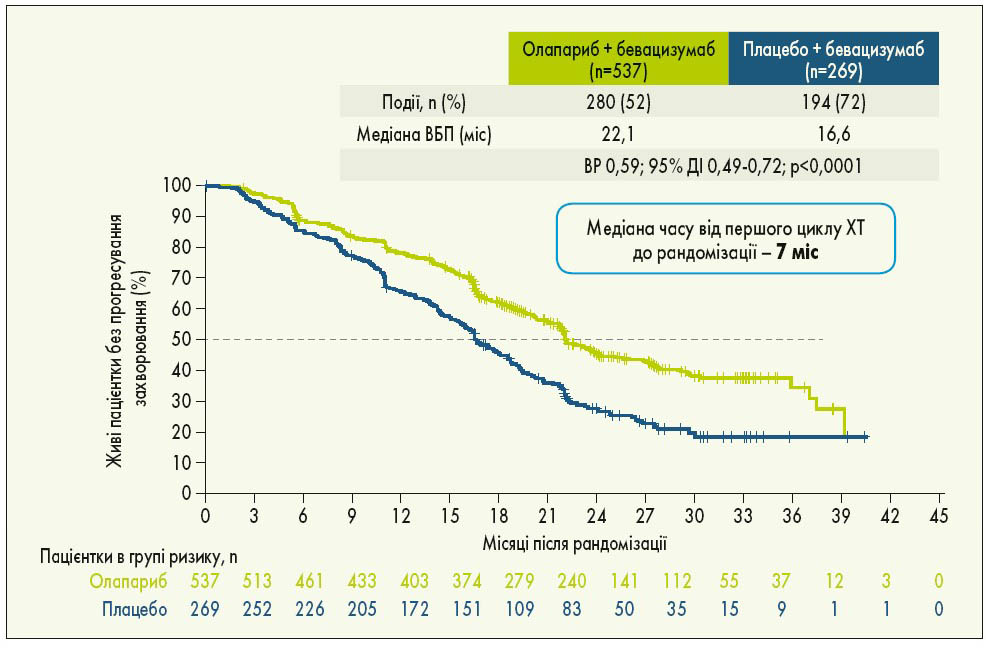 Рис. 3. ВБП у загальній популяції пацієнток у дослідженні PAOLA‑1
Рис. 3. ВБП у загальній популяції пацієнток у дослідженні PAOLA‑1
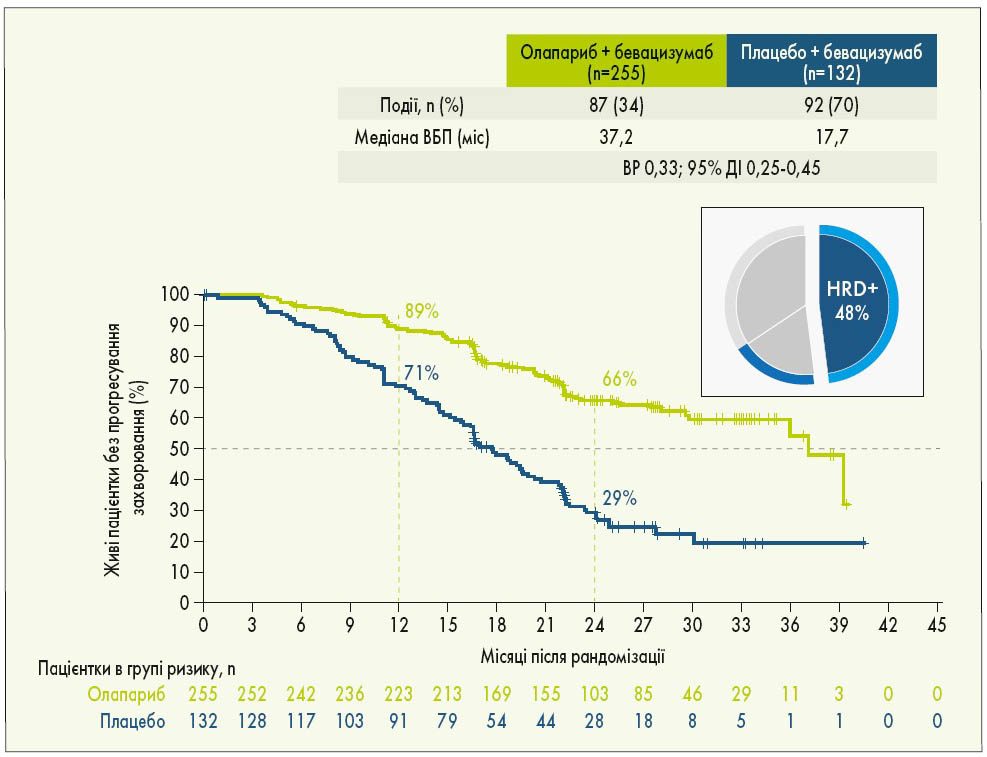 Рис. 4. ВБП у пацієнток з HRD-позитивним статусом (включаючи мутації BRCA) у дослідженні PAOLA‑1
Рис. 4. ВБП у пацієнток з HRD-позитивним статусом (включаючи мутації BRCA) у дослідженні PAOLA‑1
Згідно з настановами Національної онкологічної мережі США (NCCN, 2020) щодо ведення пацієнток з епітеліальним РЯ, раком маткових труб і первинним перитонеальним раком II-IV стадії, перед призначенням підтримуючої терапії потрібно визначати BRCA-статус. При виявленні мутації BRCA може застосовуватися монотерапія олапарибом або комбінована терапія олапариб + бевацизумаб (у разі використання бевацизумабу у попередніх лініях терапії). При HRD-позитивному статусі слід розглянути можливість призначення комбінації олапариб + бевацизумаб.
 Заступник головного лікаря з хірургічної роботи Лікарні ізраїльської онкології Lisod, кандидат медичних наук Сергій Вікторович Байдо розповів про те, як досягти мети при виконанні первинної циторедукції у хворих на РЯ.
Заступник головного лікаря з хірургічної роботи Лікарні ізраїльської онкології Lisod, кандидат медичних наук Сергій Вікторович Байдо розповів про те, як досягти мети при виконанні первинної циторедукції у хворих на РЯ.
– Інтерес до теми циторедуктивної хірургії у лікуванні поширеного РЯ виник близько 30 років тому. Так, результати першого метааналізу R.E. Bristow (2002) показали чіткий кореляційний зв’язок між об’ємом максимальної циторедукції та середньою виживаністю пацієнток. У дослідженні W.J. Hoskins та співавт. (1994) було продемонстровано, що ЗВ залежить від об’єму резидуальної хвороби: за відсутності макроскопічних ознак пухлини після циторедукції показники ЗВ істотно вищі, ніж за наявності залишкової пухлини.
У сучасній термінології циторедуктивної хірургії та поширеного РЯ виділяють повну циторедукцію (при відсутності макроскопічних ознак пухлини), оптимальну циторедукцію (при наявності мінімальної резидуальної хвороби, визначається пухлина розміром до 1 см) та субоптимальну циторедукцію (діаметр залишкової пухлини перевищує 2 см). За часом виконання виділяють такі типи циторедукції: первинну (без попередньої ХТ), інтервальну (після ХТ), повторну (після попереднього лікування, яке включає ХТ і циторедукцію). Окремо виділяють оперативне втручання дебалкінг, яке спрямоване на зменшення маси пухлини, але не має на меті досягнення максимального результату щодо резидуальної хвороби.
Сьогодні для оцінювання залишкової пухлини після циторедукції застосовують різні шкали. Оптимальна шкала оцінювання залишкової пухлини після циторедукції запропонована P.H. Sugarbaker (2005) – Completeness of cytoreduction (СC) Score, за якою СС‑0 – це відсутність макроскопічних ознак пухлини, СС‑1 – розмір найбільшої залишкової пухлини <0,25 см, СС‑2 – 0,25-2,5 см, СС‑3 – понад 2,5 см.
Ще у 2001 р. S.M. Eisenkop і N.M. Spirtos представили основні фактори неоптимальної циторедукції, до яких належать нестабільність інтраопераційної фізіології (у 2,3% хворих), похилий вік і наявність супутньої патології (у 11,2%), нерезектабельні метастази у верхніх відділах живота (у 84,7%) та в порожнині таза (у 1,8%).
Перед початком лікування пацієнтки з РЯ необхідно оцінити резектабельність, загальний стан (шкала ECOG або індекс Карновського), нутритивний статус хворої (маса тіла, рівень альбуміну та преальбуміну), анестезіологічний ризик (шкала ASA) та лабораторні показники, зокрема тестів на визначення маркерів СА‑125, СА 19‑9 при муцинозному раку. Так, у пацієнток похилого віку та/або з тяжкою коморбідною патологією слід розглянути можливість проведення неоад’ювантної терапії з наступною інтервальною циторедукцією. Первинна циторедукція у цієї категорії пацієнток може призвести до виникнення хірургічних ускладнень і пролонгації післяопераційного та реабілітаційного періодів з наступним відтермінуванням ХТ. В аспекті комплексного хіміотерапевтичного та хірургічного лікування РЯ такий сценарій несприятливий. Тому рішення про тактику лікування хворої слід приймати мультидисциплінарною командою із врахуванням усіх наявних факторів.
Оцінювання резектабельності пухлини може проводитися на основі даних комп’ютерної томографії (КТ) органів грудної клітки, черевної порожнини і таза. Магнітно-резонансна томографія не рекомендується як стандарт обстеження таких хворих. Позитронно-емісійну комп’ютерну томографію слід розглядати як можливий варіант обстеження хворих на РЯ ІV стадії, але не рекомендується використовувати при ІІІ стадії хвороби. Однак найкращим методом оцінювання первинної резектабельності залишається лапароскопія (рівень доказовості 2А) із подальшим застосуванням шкали Fagotti (2008), яка включає такі параметри: ураження чепця, перитонеальний карциноматоз, діафрагмальний карциноматоз, ураження брижі, шлунка, метастази в печінці. Кожен параметр оцінюється від 0 до 2 балів. За спостереженнями А. Fagotti та співавт. (2008), у 100% пацієнток із сумою балів ≥8 не можна досягти оптимальної циторедукції, що на сьогодні є дискусійним питанням.
При виконанні серединної лапаротомії резектабельність оцінюють за шкалою Sugarbaker’s (перитонеальний раковий індекс – PCI), визначають відсутність/наявність пухлин та їх діаметр у 13 умовних зонах (від 0 до 3 балів). При сумі балів ≥15 досягти повної циторедукції дуже складно.
Циторедуктивне оперативне втручання при РЯ має включати як мінімум тотальну гістеректомію з придатками, тотальну оментектомію нижче шлунка, апендектомію, тазову та/або парааортальну лімфодисекцію (у разі збільшення лімфатичних вузлів на КТ).
За наявності у пацієнтки з РЯ ІІІ стадії медичних та/або анестезіологічних протипоказань і неможливості виконання первинної повної циторедукції досвідченою мультидисциплінарною командою через поширеність ракового процесу рекомендовано проведення неоад’ювантної ХТ (рівень доказовості 1А).
Таким чином, сьогодні доступні шкали для оцінювання первинної резектабельності при поширеному РЯ, однак вони потребують науково обґрунтованого доопрацювання. Лапароскопічна хірургія дозволяє виконати будь-який об’єм циторедукції з добрими результатами операцій.
Підготувала Ілона Цюпа
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...




