Імуносупресія після трансплантації у рутинній медичній практиці Франції
Застосування гранул такролімусу для приготування пероральної суспензії: дослідження OPTIMOD
Сучасна опорна схема імуносупресії після трансплантації солідних органів включає потрійну терапію інгібіторами кальциневрину, мофетилу мікофенолатом або мікофеноловою кислотою та кортикостероїдами. Стандартом лікування пацієнтів після трансплантації є такролімус – інгібітор кальциневрину, який призначають 80% таких хворих. За даними австралійського дослідження, частота призначення такролімусу зросла у 2,2 раза протягом 2007-2013 рр. (Gardiner K.M. et al., 2015). Проте вузький терапевтичний індекс інгібіторів кальциневрину потребує частого визначення концентрації препарату у крові для досягнення бажаної системної експозиції та мінімізації асоційованої з лікуванням токсичності (Kahan B.D. et al., 2002). Для оптимізації імуносупресії можуть бути застосовані різноманітні терапевтичні комбінації з модифікацією дозування, що є звичною практикою у разі потенційної фармакокінетичної взаємодії лікарських препаратів.
Доступні різні форми такролімусу для перорального застосування, у тому числі капсули з негайним вивільненням активного компонента для прийому 2 рази на добу, капсули пролонгованої дії для прийому 1 раз на добу та гранули з негайним вивільненням діючої речовини для прийому 2 рази на добу (Modigraf™, Astellas Pharma, Японія). Спостереження 9 дорослих пацієнтів у стабільному стані після трансплантації нирки, яким капсули з негайним вивільненням такролімусу замінили на гранули такролімусу, дало змогу стверджувати, що обидві форми препарату забезпечували аналогічні показники максимальної концентрації такролімусу, часу її досягнення та площі під кривою «концентрація – час» (AUC) протягом 12 год (Takahara S. et al., 1998). Дослідження, у яких безпосередньо порівнювали б фармакокінетику такролімусу у гранулах і капсулах пролонгованої дії, відсутні. Відомо, що капсули негайної та пролонгованої дії характеризуються аналогічною AUC при нижчій максимальній концентрації для пролонгованої форми, що пов’язано з подовженим часом абсорбції у шлунково-кишковому тракті (Alloway R. et al., 2005; Tsunashima D. et al., 2014, 2016).
Найменшим дозуванням капсул такролімусу негайної та пролонгованої дії є 0,5 мг. Гранули такролімусу доступні у дозі 0,2 мг, перед пероральним прийомом їх розчиняють у воді. Дозування по 0,2 мг дозволяє точніше титрувати дозу, ніж при застосуванні капсул, з урахуванням таких параметрів, як маса тіла пацієнта, потенційна взаємодія з іншими препаратами (наприклад, противірусними при гепатиті С чи вірусі імунодефіциту людини або протигрибковими; European Medicines Agency. European public assessment report: Modigraf, 2009). Гранули такролімусу також є альтернативою для пацієнтів, які не можуть або не хочуть перорально приймати тверді лікарські форми.
OPTIMOD – проспективне неінтервенційне дослідження, що проводилося протягом 6 міс у пацієнтів після трансплантації, які отримували гранули такролімусу для запобігання відторгненню органів, у рутинній клінічній практиці у Франції. Метою дослідження була характеристика контингенту хворих, ефективності та безпеки гранул такролімусу, прихильності пацієнтів до лікування.
Матеріали та методи
Імуносупресивна терапія визначалась при включенні у дослідження та через 6 міс (контрольний візит). Концентрація препарату у крові оцінювалась протягом 6 міс спостереження. Досягнення цільового показника концентрації такролімусу оцінювалося дослідником як «так» або «ні». Про випадки гострого клінічного відторгнення або втрати органа, смерті або побічних явищ (у тому числі тяжких) повідомляли протягом дослідження. Для з’ясування дотримання курсу терапії використовували опитувальник Girerd. Загальне задоволення лікуванням, простоту та частоту застосування препарату оцінювали за допомогою опитувальника. Для пацієнтів-дітей опитувальник заповнювали батьки або законні опікуни.
Результати
Протягом березня 2013 р. – червня 2014 р. у дослідженні OPTIMOD взяли участь 18 центрів із залученням 66 хворих. П’ять хворих не підлягали критеріям включення, тому виконували аналіз даних 61 пацієнта, з яких 34 (55,7%) були діти та 27 (44,3%) – дорослі. Більшість пацієнтів були чоловічої статі (72,1%) як серед дітей (79,4%), так і серед дорослих (63%). Середній вік у дитячій групі становив 8±4 роки (від 1 до 16 років), а у дорослій – 48±15 років (від 18 до 70 років). Характеристики пацієнтів наведені у табл. 1. Всі пацієнти при включенні у дослідження отримували супровідну імуносупресивну терапію, частіше мікофеноловою кислотою (75,4%) та кортикостероїдами (59%). Серед препаратів, що, ймовірно, могли взаємодіяти з такролімусом, до початку лікування пацієнти приймали протигрибкові (13,1%), противірусні засоби (6,6%), інгібітори протонної помпи (3,3%) та аспірин (1,6%).
Характеристики лікування. Терапію гранулами такролімусу призначили всім хворим після включення у дослідження. У 15 (24,6%) пацієнтів це відбулося відразу після трансплантації (перша лінія) та було продовженням у 46 (75,4%) хворих (конверсія). Усі пацієнти, які отримували терапію першої лінії, були дітьми, натомість як конверсія проводилася переважно у дорослих. Медіана часу від трансплантації до призначення гранул такролімусу становила 1 день (від 0 до 10 днів) у пацієнтів, які отримували гранули такролімусу в першій лінії, та 16 (від 1 до 168) міс при конверсії. Конверсія передбачала перехід від застосування іншої форми такролімусу (негайної або пролонгованої дії) до прийому гранул із негайним вивільненням діючої речовини в 41 (89,1%) хворого та циклоспорину у 4 (8,7%) хворих. У 14 (23%) пацієнтів (13 з яких були діти, котрі отримували першу лінію терапії) основними причинами призначення такролімусу у гранулах були потреба в регулюванні дози та застосуванні специфічної лікарської форми препарату. Медіана дози, яку призначали пацієнтам при включенні в дослідження, становила 2,4 мг/добу для першої лінії терапії та 0,8 мг/добу для конверсії. Протягом періоду спостереження доза була модифікована у 48 (78,7%) хворих, у середньому – 3,1 коригування на пацієнта (4,7 для першої лінії та 2,4 для конверсії), переважно це було зниження дози. Пацієнти, яким була виконана трансплантація нирки, були дітьми, за винятком одного. Медіана дози гранул такролімусу, яку отримували пацієнти при включенні в дослідження, після трансплантації нирки становила 2 мг/добу, після трансплантації легені – 0,8 мг/добу. За період спостереження лікування було модифіковано у 76% пацієнтів з трансплантацією нирки та у 81% реципієнтів легені з середньою кількістю коригувань 4,6 та 2,2 відповідно. П’ятнадцять (13,3%) пацієнтів не закінчили лікування, зокрема через неналежну таргетну концентрацію препарату у крові (n=10), додаткові призначення лікарських засобів, що потенційно супроводжувалися лікарською взаємодією (n=3), тяжкі побічні явища (кардіотоксичність, n=1) та відмову хворого від прийому засобу, оскільки його смак не подобався (n=1). Лікування припинили 2 (10,5%) пацієнти після трансплантації нирки, 10 (58,8%) – легені, 2 (22,2%) – печінки, 1 (50%) – серця. Інформація щодо характеристик лікування гранулами такролімусу наведена в табл. 2.
Концентрація такролімусу у крові (С0). Протягом 6-місячного спостереження кожному пацієнту у середньому 8 разів проводилося дослідження концентрації такролімусу у крові. Медіана часу для досягнення таргетного рівня С0 становила 20 днів (27,5 дня при першій лінії терапії та 20 днів при конверсії). У 3 хворих С0 становила <5 нг/мл або >20 нг/мл, що розцінювалося як побічне явище. Одразу після призначення такролімусу С0 була вищою, ніж через 1 міс спостереження (11,5±10,3 нг/мл після 1-го тижня проти 6,5±2,3 нг/мл після 1-2-го місяця відповідно). Відмічено, що С0 була стабільною з 1-го місяця до кінця спостереження (6-го місяця). Варіабельність С0 була вищою протягом 1-го місяця лікування, ніж у наступні місяці. У пацієнтів після конверсії терапії С0 була стабільною. Діти мали вищу середню С0, ніж дорослі пацієнти, протягом 1-го місяця лікування такролімусом, після чого середня С0 у дітей до кінця дослідження була нижчою. Динаміка зміни С0 у різних популяціях представлена на рис. 1, 2.
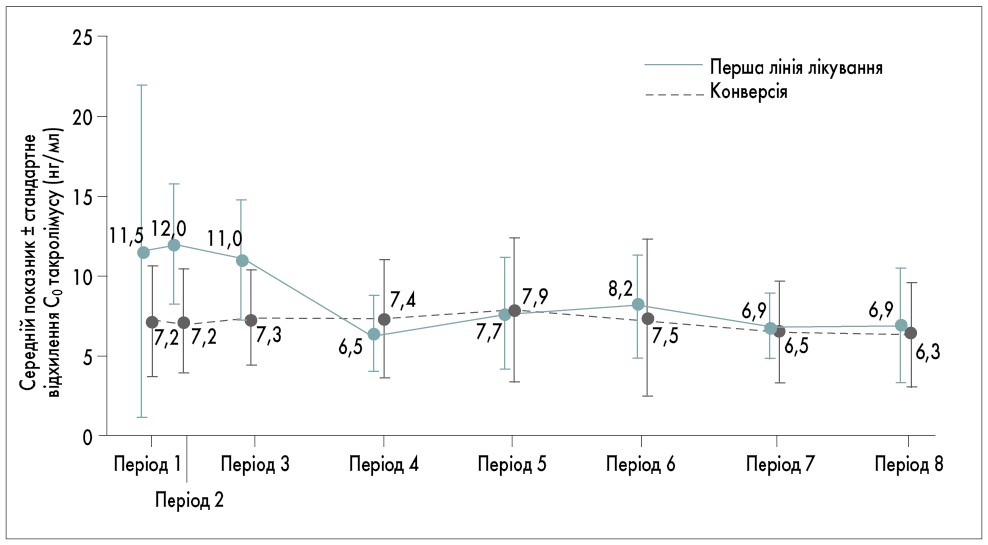 Рис. 1. Динаміка зміни середньої С0 залежно від типу терапії такролімусом
Рис. 1. Динаміка зміни середньої С0 залежно від типу терапії такролімусом
Період 1 – 1-й тиждень від початку першої лінії терапії; період 2 – 2 тижні від початку першої лінії терапії; період 3 – 2 тижні – 1-й місяць від початку першої лінії терапії; період 4 – 1‑2-й місяці від початку першої лінії терапії; період 5 – 2-3-й місяці від початку першої лінії терапії; період 6 – 3‑4-й місяці від початку першої лінії терапії; період 7 – 4-5-й місяці від початку першої лінії терапії; період 8 – 5-6-й місяці від початку першої лінії терапії
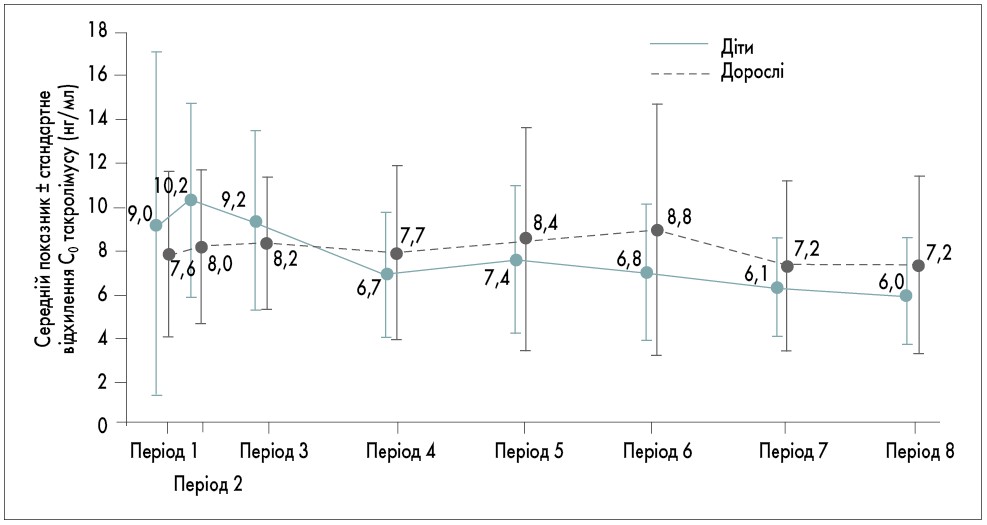 Рис. 2. Динаміка зміни середньої С0 у пацієнтів залежно від вікової групи
Рис. 2. Динаміка зміни середньої С0 у пацієнтів залежно від вікової групи
Ефективність та безпека. За період спостереження відмічено 10 епізодів відторгнення трансплантата: у 5 (14,7%) дітей (4 реципієнти печінки та 1 реципієнт нирки) та у 5 (18,5%) дорослих (всі реципієнти легені). Одна дитина, яка була реципієнтом печінки, мала 2 епізоди відторгнення з інтервалом 26 днів. У 10 з 11 епізодів відторгнення шляхом біопсії було підтверджено гостре клітинне відторгнення, а в одному – відторгнення у реципієнта легені було опосередковане антитілами. П’ять епізодів виникли на тлі першої лінії терапії, шість – після конверсії. У 9 з 10 епізодів відторгнення були наявні дані спостереження; середній час від трансплантації до відторгнення становив 6,55±6 міс (медіана 6,7 міс, діапазон від 0,2 до 18 міс). Жоден епізод відторгнення протягом дослідження не закінчився втратою трансплантата. У період спостереження померла одна жінка віком 40 років, яка була реципієнткою легені (через 15 міс після трансплантації та через 3,5 міс лікування гранулами такролімусу). Причина смерті – хронічна дихальна недостатність, яка не була пов’язана з прийомом гранул.
Побічні реакції. Протягом дослідження було зафіксовано 30 випадків побічних реакцій у 16 (26,2%) пацієнтів. Сім побічних реакцій у 3 (4,9%) хворих були розцінені як пов’язані з лікуванням: чотири інфекційних ускладнення (три з них – в одного пацієнта), асоційований з вірусом Епштейна – Барр лімфопроліферативний розлад, діабет і гостре клітинне відторгнення. Всі випадки пов’язаних із лікуванням ускладнень були розцінені як серйозні, за винятком гострого клітинного відторгнення. За період спостереження на фоні прийому гранул такролімусу істотних змін у метаболічному профілі (включаючи рівень печінкових ензимів, сироваткового креатиніну та протеїнурії) не зафіксовано.
Дотримання режиму лікування та задоволення пацієнтів. При візиті через 6 міс лікування опитувальник заповнили 47 (77%) хворих, з них 25 (53,2%) були діти та 22 (46,8%) – дорослі. Всі респонденти повідомляли про добре дотримання режиму чи незначні порушення, що були пов’язані з частим прийомом гранул такролімусу. Шістнадцять (34%) хворих були дуже задоволені лікуванням, 21 (44,7%) – задоволені, 10 (21,3%) – помірно задоволені або незадоволені.
Обговорення
У цьому обсерваційному дослідженні були представлені більшість варіантів трансплантації солідних органів (за винятком підшлункової залози та кишечника), проте залучення хворих було на 40% меншим від запланованого. Контингент реципієнтів загалом відповідав загальній популяції пацієнтів, яким було виконано трансплантацію. Більшість пацієнтів – це реципієнти нирки, проте частка реципієнтів легені (34,4%) була більшою за загальний показник у популяції (6% у 2013 р. за даними Agence de la biomedecine. Le rapport medical et scientifique du prelevement et de la greffe en France, 2013). Останнє може бути пов’язане з тим, що ця категорія хворих потребує особливо точного підбору дози, це можливо завдяки використанню такролімусу у формі гранул та прицільному моніторингу з огляду на потенційну взаємодію лікарських препаратів (Bhorade S.M. et al., 2009; Scheffert J.L. et al., 2014).
У цьому неінтервенційному дослідженні режим дозування такролімусу та його адаптацію визначав лікар. Дітям необхідне призначення малих доз такролімусу, проте, зважаючи на гетерогенність педіатричної популяції, необхідно індивідуально підбирати дозу з урахуванням віку, маси тіла, генетичних варіацій у метаболічних ензимах (поліморфізм цитохрому Р450 3А5 – CYP3A5), що можливо з використанням гранул такролімусу (Kausman J.Y. et al., 2008; De Wildt S.N. et al., 2011). Лікування такролімусом у першій лінії було розпочато негайно після трансплантації у 15 із 34 дітей.
У дорослій популяції, де у всіх пацієнтів відбувалася конверсія на гранули такролімусу, на початку лікування необхідно було підібрати дозу препарату. Як було зазначено вище, велику частку цих хворих складали реципієнти легені, які мають специфічні потреби. Наприклад, існують значні взаємодії між такролімусом та індукторами або інгібіторами CYP450 (Bhorade S.M. et al., 2009; Scheffert J.L. et al., 2014; наприклад, протигрибковими засобами, які часто призначають реципієнтам легені для профілактики чи лікування інфекцій; Schaenman J.M., 2013). Троє пацієнтів, які були включені у це дослідження, одночасно отримували терапію з приводу гепатиту С і потребували коригування доз через взаємодію між боцепревіром/телапревіром і такролімусом (Schaenman J.M., 2013).
Середня концентрація такролімусу протягом 1-го місяця після призначення його у формі гранул у першій лінії була вищою порівняно з наступними місяцями. Оскільки всі пацієнти, які отримували такролімус у першій лінії, були дітьми, клініцисти неохоче ризикували недостатньою імуносупресією у цій вразливій когорті хворих. Натомість середня концентрація такролімусу у крові в пацієнтів після переведення на лікування гранулами такролімусу була загалом стабільною. Під час спостереження у більшості хворих підвищували або знижували дози такролімусу, переважно з метою досягнення таргетної С0. Це узгоджується з вимогами до реципієнтів через вузький терапевтичний індекс інгібіторів кальциневрину (Schiff J. et al., 2007; Sommerer C. et al., 2009; Marquet P., 2010). У цьому дослідженні лише 3 хворих мали С0 <5 нг/мл або >20 нг/мл.
Протягом 6-місячного спостереження показники виживаності трансплантатів і пацієнтів становили 100 та 98,4% відповідно. Смерть 40-річної реципієнтки легені, у якої був кістозний фіброз, була спричинена хронічною дихальною недостатністю. Пацієнти з легеневим фіброзом або скомпрометованими дихальними шляхами мають вищий ризик смерті після повторної трансплантації легені (Kawut S.M., 2011), тому ця смерть вважалася не пов’язаною з лікуванням. Високі показники виживаності трансплантатів і пацієнтів у цьому дослідженні зіставні з показниками 12-місячного відкритого рандомізованого дослідження III фази за участю дітей після трансплантації печінки із призначенням гранул такролімусу у першій лінії, в якому 12-місячна виживаність трансплантата та пацієнтів складала 92,3 і 93,4% відповідно (Kelly D. et al., 2004). Подібні високі показники виживаності також були зареєстровані для педіатричних і дорослих реципієнтів протягом 1 року після введення капсул такролімусу негайного або тривалого вивільнення de novo чи після конверсії терапії такролімусом із капсул негайної дії на пролонговану форму.
Відомо, що при конверсії терапії такролімусом із капсул негайного вивільнення на гранули не було випадків відторгнення або дисфункції трансплантата. Частота відторгнення у цьому 6-місячному дослідженні також була низькою: лише 11 епізодів відторгнення спостерігались у 10 (16,4%) пацієнтів: 5 дітей та 5 дорослих, жоден з них не призвів до втрати трансплантата. Крім того, лише 1 епізод відторгнення лікар оцінив як, імовірно, пов’язаний з лікуванням такролімусом. Це було гостре пограничне клітинне відторгнення через 3,5 міс після трансплантації нирки та початку лікування у дитини, яка отримувала гранули такролімусу як першу лінію терапії, однак подробиці зв’язку з лікуванням такролімусом відсутні.
Під час подальшого спостереження у цьому дослідженні у 2 пацієнтів було зареєстровано інфекційні ускладнення, пов’язані з лікуванням. Інші побічні явища, пов’язані з лікуванням, були поодинокими.
Дотримання імуносупресивної терапії є важливою умовою уникнення відторгнення трансплантата, проте порушення режиму прийому препаратів є частим явищем серед реципієнтів, що спостерігається у від 2 до 68% випадків. Гранули такролімусу потребують більшої підготовки перед прийомом, ніж інші лікарські форми, що могло вплинути на результат. Прихильність до лікування, про яку повідомляли досліджувані, була хорошою з незначними відхиленнями та затримкою. Загалом пацієнти були задоволені лікуванням, менше 1/4 пацієнтів, які перейшли на прийом гранул такролімусу, повідомили про низький рівень задоволення лікуванням. Можливо, пацієнти після конвертованої терапії повідомляли про нижчий рівень задоволення, оскільки були задоволені початковою схемою, а незнайомий новий режим міг негативно вплинути на рівень їх задоволення лікуванням.
Це дослідження має деякі обмеження, такі як відбір пацієнтів, що притаманне обсерваційним дослідженням. Менший за очікуваний розмір вибірки може вплинути на екстраполяцію результатів на загальну популяцію пацієнтів, які отримували гранули такролімусу. Однак його результати мають важливе значення, оскільки це перше когортне дослідження використання такролімусу у формі гранул у пацієнтів після трансплантації солідних органів у Франції. Шестимісячний період спостереження – це малий термін для оцінювання довгострокових результатів щодо ефективності та безпеки препарату. Тим не менше результати, отримані протягом цього періоду, істотно не відрізняються від опублікованих результатів попередніх клінічних досліджень (Takahara S. et al., 1998; Kelly D. et al., 2004).
Висновки
Результати дослідження OPTIMOD показали, що при використанні у рутинній практиці такролімусу у формі гранул для приготування пероральної суспензії має прийнятний профіль переносимості та є ефективним у запобіганні відторгненню трансплантата. Гранули такролімусу можуть бути альтернативою у лікуванні дітей і пацієнтів із затрудненим ковтанням, а також за необхідності точного коригування дози у зв’язку із взаємодією з іншими лікарськими препаратами.
Переклала з англ. Олена Поступаленко
Тематичний номер «Урологія. Нефрологія. Андрологія» № 4 (21), 2020 р.
СТАТТІ ЗА ТЕМОЮ Урологія та андрологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...