Психобіотики: роль у психічному здоров’ї, при нейродегенеративних і нейророзвиткових розладах
 У кишечнику людини міститься 1014 мікроорганізмів, що в 100 разів перевищує кількість клітин у її організмі [1, 2]. Відомо, що мікробіота кишечнику бере участь у різних фізіологічних процесах, включаючи імуномодуляцію, енергетичний баланс та активацію кишкової нервової системи (КНС) [3-7]. Профіль мікробіому кожної людини регулюється багатьма факторами, зокрема дієтою, генетикою, статтю та віком [5, 8]. Мікробіота має важливу роль у здоров’ї людини. Зокрема, дисбіоз кишечнику корелює з різними захворюваннями центральної нервової системи (ЦНС). Наприклад, нижчий рівень біфідобактерій та/або лактобактерій спостерігався в осіб із депресивними розладами [9-11]. Крім того, простежується зменшена кількість Bifidobacterium у кишечнику пацієнтів із хворобою Альцгеймера (ХА) [12].
У кишечнику людини міститься 1014 мікроорганізмів, що в 100 разів перевищує кількість клітин у її організмі [1, 2]. Відомо, що мікробіота кишечнику бере участь у різних фізіологічних процесах, включаючи імуномодуляцію, енергетичний баланс та активацію кишкової нервової системи (КНС) [3-7]. Профіль мікробіому кожної людини регулюється багатьма факторами, зокрема дієтою, генетикою, статтю та віком [5, 8]. Мікробіота має важливу роль у здоров’ї людини. Зокрема, дисбіоз кишечнику корелює з різними захворюваннями центральної нервової системи (ЦНС). Наприклад, нижчий рівень біфідобактерій та/або лактобактерій спостерігався в осіб із депресивними розладами [9-11]. Крім того, простежується зменшена кількість Bifidobacterium у кишечнику пацієнтів із хворобою Альцгеймера (ХА) [12].
Згідно з нещодавнім дослідженням, відносна кількість протизапальних бактерій, включаючи роди Blautia, Roseburia та Coprococcus, була значно нижчою в зразках калу в пацієнтів із хворобою Паркінсона (ХП) [13]. У дітей із розладами аутистичного спектра (РАС) було виявлено меншу відносну кількість мікробіому та зменшене загальне різноманіття бактерій [14]. Окрім того, за даними науковців, порушення регуляції мікробіоти кишечнику збільшує ризик розвитку синдрому дефіциту уваги з гіперактивністю (СДУГ) [15, 16].
Докази комунікації складових осі мікробіом – кишечник – мозок (МКМ) можна знайти зі взаємозв’язку між дисбіозом кишечнику та функціональними шлунково-кишковими розладами й розладами ЦНС [17]. Ученими виявлено зв’язок між кишечником і мозком, а також значний вплив функції шлунково-кишкового тракту (ШКТ) на емоційний стан людини [18, 19]. Відомо, що порушення регуляції осі МКМ корелює з нейропсихологічними, шлунково-кишковими та метаболічними розладами [19]. Згідно з оглядовою статтею Burokas і співавт., мозок і мікробіом кишечнику можуть двоспрямовано комунікувати за допомогою нейромедіаторів, імуномодуляції, КНС, а також коротколанцюгових жирних кислот (SCFA) [20]. Зниження соціальної взаємодії безмікробних тварин із контрольними підтвердило функціонування концепції осі МКМ [21]. Трансплантація стандартної мікробіоти мишам зменшувала соціальний дефіцит, що підтверджує важливість мікробіоти кишечнику для функції ЦНС [22].
Психофізіологічні ефекти психобіотиків
У 2013 році Дінан і його колеги визначили термін «психобіотики» як новий клас пробіотиків, застосування яких можливе при лікуванні психічних захворювань [23]. До більшості досліджень, які вивчають це питання, залучають тварин, у котрих зумовлюють стрес, а також проводять поведінкові тести на гризунах для оцінки мотивації, тривоги та депресії [3].
Психофізіологічні ефекти психобіотиків розподіляються на три категорії:
- психологічний вплив на емоційні та когнітивні процеси;
- системний вплив на вісь гіпоталамус – гіпофіз – надниркові залози (ГГН);
- відповідь на глюкокортикоїдні стреси та запалення, що часто характеризується аберантною концентрацією цитокінів.
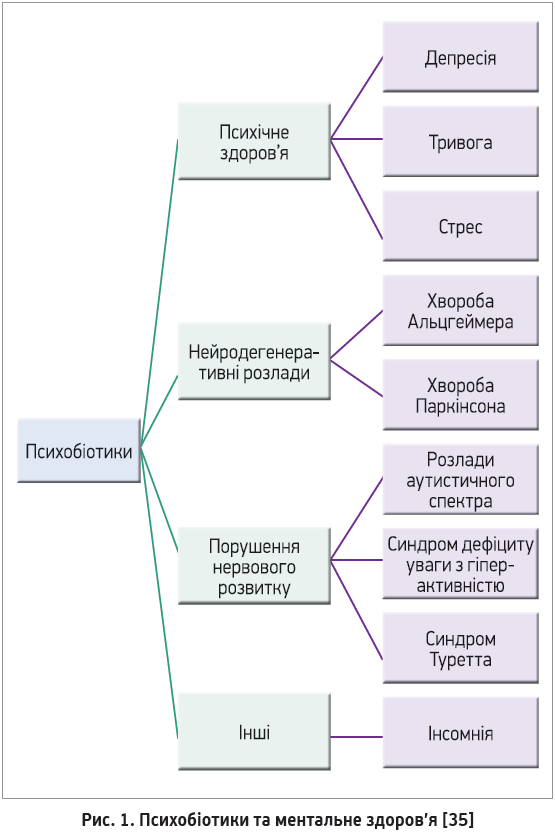
Психобіотики можуть регулювати нейромедіатори та білки, включаючи гамма-аміномасляну кислоту (ГАМК), серотонін, глутамат і мозковий нейротрофічний фактор (BDNF), які мають важливу роль у контролі нервово-збудливо-гальмівного балансу, настрою, когнітивних функцій, навчання та процесів пам’яті [24-26]. Судо та співавт. описали вирішальну роль мікробіоти й осі ГГН. Незначний стриманий стрес у безмікробних мишей спричиняє надмірне вивільнення кортикостерону й адренокортикотропного гормона [27]. Крім того, підвищені прозапальні цитокіни активують вісь ГГН, підвищують проникність гематоенцефалічного бар’єра (ГЕБ) і знижують рівень серотоніну, що може зумовити таке психічне захворювання, як депресія [28, 29]. Деякі штами Lactobacillus spp. і Bifidobacterium spp., як-от Lactobacillus brevis, Bifidobacterium dentium і Lactobacillus plantarum, продукують ГАМК і серотонін [30-32]. Окрім того, штами Lactobacillus, як-от L. plantarum і Lactobacillus odontolyticus, продукують ацетилхолін [33]. Нещодавно було встановлено, що синтез серотоніну в кишечнику може регулюватися мікробами. Наприклад, установлено, що спороутворювальні бактерії з мікробіому кишечнику індукують біосинтез серотоніну ентерохромафінними клітинами кишечнику [34]. Ці пробіотики вивчаються щодо їхнього психобіотичного потенціалу, особливо при психічних розладах (рис. 1).
Психобіотики та психічне здоров’я
Належне психічне здоров’я являє собою стан психічного та психологічного добробуту. Запропоноване Дінаном і співавт. застосування психобіотиків може потребувати точної стратегії для впливу на поведінку за тривоги та депресії [23]. За допомогою дедалі більшої кількості доказів продемонстровано, що психобіотики мають психотропний вплив за депресії, тривоги та стресу. Кілька штамів пробіотиків були зареєстровані як психобіотики з досліджень на тваринах. Уведення Lactobacillus plantarum PS128 (PS128) знижувало тривожність і депресію в мишей. PS128 значно зменшував запалення та рівень кортикостерону. Слід зауважити, що введення PS128 значно підвищувало рівень дофаміну та серотоніну в префронтальній корі, а також смугастому тілі порівняно з контрольними мишами [36, 37]. Введення одного штаму Lactobacillus helveticus NS8 зменшувало тривожність, депресію та когнітивні дисфункції. Крім того, L. helveticus NS8 підвищував рівень серотоніну, норадреналіну (NE) та BDNF у гіпокампі [38]. Використання одного штаму B. longum 1714 зменшило стресову, депресивну та тривожну поведінку [39]. Введення Lactobacillus rhamnosus (JB‑1) теж може зменшити тривогу та депресію. Зокрема, прийом JB‑1 спричиняє регіональнозалежні зміни експресії рецепторів ГАМК у мозку та знижує рівень кортикостерону в плазмі [40]. Введення одного штаму Bifidobacterium longum NCC3001 виявилося ефективним для лікування тривоги. Крім того, експресія BDNF у гіпокампі посилюється після введення B. longum NCC3001 [41]. Використання сигнального штаму Bacterium infantis 35624 є ефективним для депресивної поведінки [42].
На додаток до перспективних досліджень на тваринах декілька досліджень виявили позитивний вплив пробіотиків на психічне здоров’я людини. Здорові добровольці, котрим уводили Bifidobacterium longum 1714 протягом 4 тиж, демонструють зниження показників рівня стресу та покращення пам’яті [43]. У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні вивчали ефекти пробіотичного йогурту (Lactobacillus acidophilus LA5 і Bifidobacterium lactis BB12), а також пробіотичних капсул (Lactobacillus casei, L. acidophilus, L. rhamnosus, B. breve, B. longum, S. thermophilus) у працівників нафтохімічного виробництва [44]. Реципієнти, котрі приймали як пробіотичний йогурт, так і пробіотичні капсули, демонстрували кращі показники психічного здоров’я. Пробіотична комбінація L. helveticus R0052 та B. longum R0175 зменшувала рівень тривоги й депресії в здорових осіб порівняно з контролем [45]. Окрім того, рівень вільного кортизолу в сечі значно знижувався в групі, що вживала L. helveticus R0052 та B. longum R0175 [46].
Деякі поточні клінічні дослідження вивчають вплив пробіотичних добавок (L. plantarum PS128, L. plantarum 299v, L. rhamnosus GG, Bifihappy, Vivomixx®, Probio’Stick тощо) на депресію та тривогу [47-53]. Ці дослідження дадуть можливість оцінити стан запалення, стрес і настрій учасників випробувань.
Можливими шляхами зв’язку між мозком і мікробіомом кишечнику були імунорегуляторні, нейроендокринні шляхи та n. vagus (рис. 2) [54]. Застосування пробіотиків, як-от Lactobacillus, Bifidobacterium та Enterococcus, може знизити рівень запальних цитокінів [55]. Повідомлялося, що антиімунорегуляторні ефекти пробіотиків активують популяцію Т-регуляторних клітин, а також секрецію інтерлейкіну-10 (IL‑10) [23]. Окрім того, пробіотики контактують з ентероендокринними клітинами епітелію кишечнику, продукуючи нейропептиди та нейромедіатори, як-от пептид YY (PYY), нейропептид Y (NPY), речовина Р, серотонін, глюкагоноподібний пептид‑1 і 2 (GLP‑1, GLP‑2) і холецистокінін (ССК) [56, 57]. Приблизно 95% серотоніну продукують ентерохромафінні клітини кишечнику та нейрони КНС, що пов’язано з регуляцією секреції та рухливості ШКТ [58]. Окрім того, серотонінові шляхи мозку беруть участь у регулюванні функції пізнання та настрою [59]. Отже, серотонінова дисфункція може спричиняти супутню патологію ШКТ і розлади настрою.
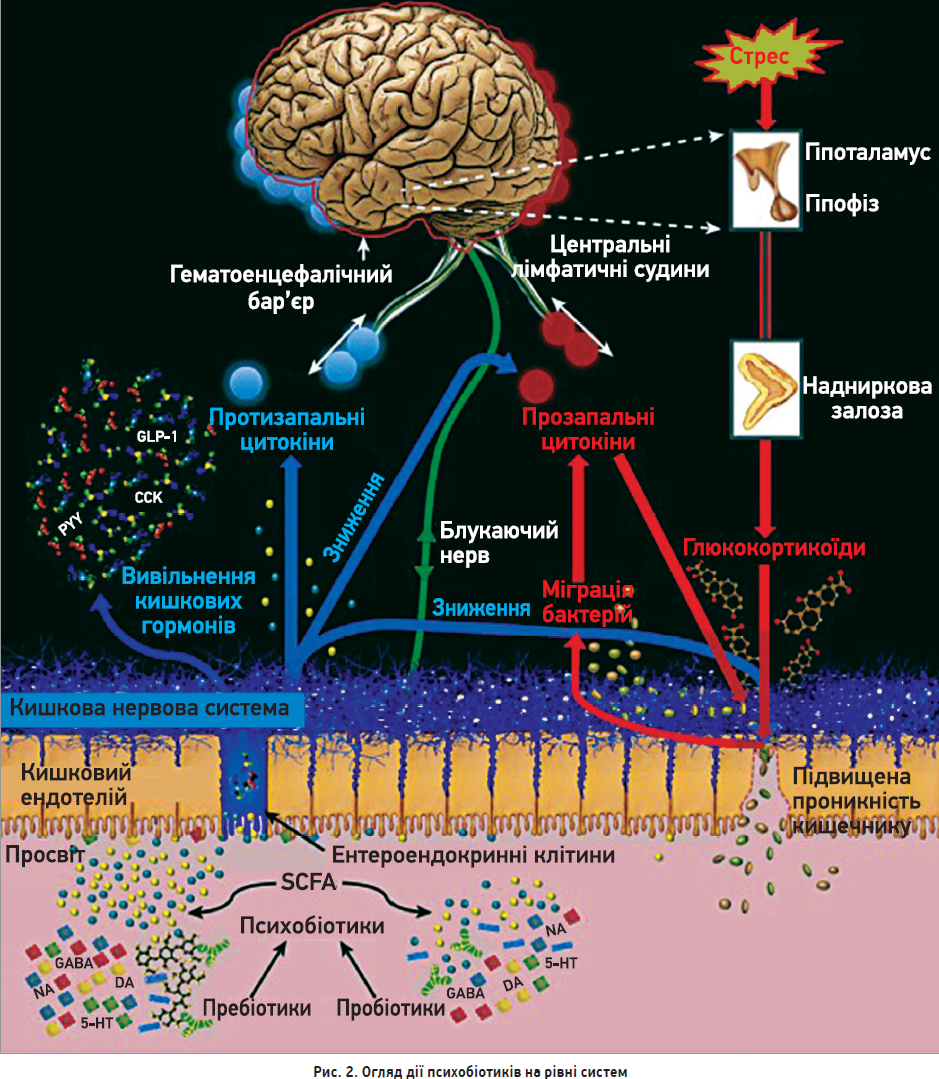 Сині стрілки демонструють психобіотичні процеси та наслідки, червоні – вказують на процеси, пов’язані з порушенням цілісності кишкового бар’єра та запаленням. Як пробіотики, так і пребіотики збільшують вироблення SCFA, котрі взаємодіють з ентероендокринними клітинами слизової оболонки кишки та каталізують вивільнення таких гормонів кишечнику, як CCK, PYY та GLP‑1. Пребіотики можуть мати сильніші ефекти в цьому сенсі порівняно з пробіотиками. SCFA та гормони кишечнику потрапляють у кровообіг і можуть мігрувати в ЦНС. Психобіотики посилюють вироблення нейромедіаторів у кишечнику, включаючи дофамін, серотонін, норадреналін і ГАМК, які, ймовірно, модулюють нейротрансмісію в проксимальних синапсах КНС. Блукальний нерв синапсує на кишкових нейронах і забезпечує комунікацію кишечник – мозок. Бар’єрна дисфункція посилюється під впливом стресового впливу глюкокортикоїдів, що забезпечує міграцію бактерій із прозапальними компонентами, безпосередньо посилюючи запалення, а також зумовлюючи зростання прозапальних цитокінів через імунну відповідь. Ці цитокіни порушують цілісність ГЕБ і надають доступ потенційно патогенним або запальним елементам. Прозапальні цитокіни (червоні кола) також знижують цілісність кишкового бар’єра. Психобіотики відновлюють бар’єрну функцію кишечнику та зменшують концентрацію циркулювальних глюкокортикоїдів і прозапальних цитокінів; вони також підвищують концентрацію протизапальних цитокінів (сині кола), котрі підвищують цілісність ГЕБ, кишкового бар’єра та зменшують запалення загалом. Кластеризація цитокінів у мозку являє собою взаємодію цитокінів із ГЕБ. Цитокіни можуть взаємодіяти безпосередньо з мозком через центральні лімфатичні судини [60].
Сині стрілки демонструють психобіотичні процеси та наслідки, червоні – вказують на процеси, пов’язані з порушенням цілісності кишкового бар’єра та запаленням. Як пробіотики, так і пребіотики збільшують вироблення SCFA, котрі взаємодіють з ентероендокринними клітинами слизової оболонки кишки та каталізують вивільнення таких гормонів кишечнику, як CCK, PYY та GLP‑1. Пребіотики можуть мати сильніші ефекти в цьому сенсі порівняно з пробіотиками. SCFA та гормони кишечнику потрапляють у кровообіг і можуть мігрувати в ЦНС. Психобіотики посилюють вироблення нейромедіаторів у кишечнику, включаючи дофамін, серотонін, норадреналін і ГАМК, які, ймовірно, модулюють нейротрансмісію в проксимальних синапсах КНС. Блукальний нерв синапсує на кишкових нейронах і забезпечує комунікацію кишечник – мозок. Бар’єрна дисфункція посилюється під впливом стресового впливу глюкокортикоїдів, що забезпечує міграцію бактерій із прозапальними компонентами, безпосередньо посилюючи запалення, а також зумовлюючи зростання прозапальних цитокінів через імунну відповідь. Ці цитокіни порушують цілісність ГЕБ і надають доступ потенційно патогенним або запальним елементам. Прозапальні цитокіни (червоні кола) також знижують цілісність кишкового бар’єра. Психобіотики відновлюють бар’єрну функцію кишечнику та зменшують концентрацію циркулювальних глюкокортикоїдів і прозапальних цитокінів; вони також підвищують концентрацію протизапальних цитокінів (сині кола), котрі підвищують цілісність ГЕБ, кишкового бар’єра та зменшують запалення загалом. Кластеризація цитокінів у мозку являє собою взаємодію цитокінів із ГЕБ. Цитокіни можуть взаємодіяти безпосередньо з мозком через центральні лімфатичні судини [60].
Психобіотики та нейродегенеративні захворювання
Хвороба Альцгеймера
ХА – це хронічний нейродегенеративний розлад, який характеризується порушеннями когнітивних функцій і пам’яті [61]. Докази щодо впливу пробіотиків на полегшення когнітивних розладів обмежені. У нещодавній роботі Agahi та співавт. досліджували вплив уведення пробіотиків на пацієнтів із тяжким перебігом ХА [62]. Результати довели, що пацієнти з тяжким перебігом ХА не є чутливими до пробіотичних добавок. В іншому випробуванні використовували відразу декілька штамів – L. casei W56, Lactococcus lactis W19, L. acidophilus W22, B. lactis W52, L. paracasei W20, L. plantarum W62, B. lactis W51, B. bifidum W23 та L. salivarius W24 в пацієнтів із ХА [63]. Ця комбінація пробіотиків впливала на склад бактерій кишечнику та метаболізм триптофану в сироватці крові. Нещодавно Бонфілі та співавт. виявили, що введення пробіотиків (SLAB51) трансгенним мишам із ХА значно зменшує окислювальний стрес шляхом індукції SIRT‑1-залежних механізмів (сиртуїн-1 має ключову роль у виживанні клітин та апоптозі) [64]. У двох дослідженнях вивчали вплив множинних штамів, L. acidophilus, Lactobacillus fermentum, B. lactis і B. longum на тваринній моделі ХА. Загальна кількість Bifidobacterium spp. і Lactobacillus spp. була збільшена, а коліформ – знижена (в калі після прийому пробіотиків). Окрім того, пробіотики покращували навчальний процес і пам’ять у щурів із ХА порівняно зі щурами з групи контролю. Зниження кількості амілоїдних бляшок, рівнів запалення й окислювального стресу спостерігалося в групі, що приймала пробіотики [65]. Вживання пробіотиків знижувало рівень інсуліну й інсулінорезистентність. Однак істотної різниці в рівнях тригліцеридів (ТГ) у сироватці крові не спостерігалося між щурами з ХА, котрі приймали пробіотики, та групою контролю [66]. Крім того, лікування коров’ячим молоком, ферментованим L. fermentum (LAB9, LAB10, CM-LAB9) або L. casei (LABPC), покращувало навчання, пам’ять і рівень антиоксидантів (SOD, GSH і GPx). Рівні прозапальних цитокінів, малонового діальдегіду (MDA) й AChE були знижені в групі з пробіотиками порівняно з контрольною групою [67]. Один штам L. plantarum MTCC1325 не тільки покращував когнітивну функцію та поведінкову діяльність, а й відновлював рівень ацетилхоліну в щурів із ХА [68]. Одне рандомізоване подвійне сліпе контрольоване клінічне дослідження продемонструвало, що споживання молока з пробіотиками (L. acidophilus, L. casei, B. bifidum і L. fermentum) знижує плазмовий MDA та високочутливий C-реактивний білок (CRP) у сироватці крові. Слід зазначити, що оцінка Mini-Mental State Examination (MMSE) була значно кращою після призначення пробіотиків [69].
На основі результатів досліджень на тваринах можна зробити висновок, що використання пробіотиків покращує дефіцит когнітивних функцій і пам’яті [65, 67, 68]. Ознаки системного запалення зменшилися після застосування пробіотиків. Один із можливих механізмів може бути опосередкований через шлях SIRT1 [64]. Окрім того, показано, що пробіотики покращують процес пізнання у хворих на ХА [69].
Хвороба Паркінсона
ХП є нервово-психічним розладом, який уражає приблизно 2% літнього населення [70]. Закреп – звичний симптом у пацієнтів із ХП [71-73]. У рандомізованому подвійному сліпому плацебо-контрольованому клінічному дослідженні пацієнти з ХП протягом 12 тиж уживали пробіотичні добавки, що містили L. acidophilus, B. bifidum, Lactobacillus reuteri та L. fermentum. Група, котра отримувала пробіотики, продемонструвала нижчий бал за уніфікованою шкалою оцінки ХП (UPDRS) порівняно з групою плацебо. Крім того, вживання пробіотиків не лише суттєво знизило рівень CRP і MDA, а й збільшило рівень глутатіону (GSH). Важливим є також те, що споживання пробіотиків значно покращило функцію інсуліну порівняно з плацебо [74]. У рандомізованому контрольованому дослідженні вивчали запалення та гени, пов’язані з інсуліном і ліпідами, в мононуклеарних клітинах периферичної крові в осіб із ХП. Після 12-тижневого прийому пробіотиків у пацієнтів із ХП спостерігалося значне зниження експресії IL‑1, IL‑8, фактора некрозу пухлини (TNF), а також підвищення трансформувального фактора росту-β (TGF-β) й гамма-рецептора, що активується проліфератором пероксисом (PPAR-γ), порівняно з контролем. Однак не було виявлено впливу на експресію судинного ендотеліального фактора росту (VEGF), рецепторів ліпопротеїнів низької щільності (LDLR) або маркерів запалення й окислювального стресу [75]. Три дослідження довели, що в пацієнтів із ХП, які застосовували пробіотики, покращилися функції ШКТ. У групі ХП, яка вживала ферментоване молоко, що містило декілька штамів пробіотиків, покращилася клінічна картина із закрепами [76]. Лікування комбінацією пробіотиків L. acidophilus і B. infantis значно зменшило біль і здуття живота [77]. Крім того, в пацієнтів із ХП покращилися консистенція та частота випорожнень після 5 тиж лікування ферментованим молоком, яке містить L. casei Shirota [78].
Поточне відкрите пілотне випробування досліджує вплив PS128 на пацієнтів із ХП. Первинний результат вимірюватиметься за допомогою моторного бала UPDRS (частина III) після введення 60 млрд КУО PS128 протягом 12 тиж. Вторинний результат вимірюватиметься за оцінкою немоторних симптомів (NMS-Quest) та оцінкою Patient Global Impression of Chang (PGIC) [79].
Більшість клінічних досліджень пробіотиків у пацієнтів із ХП були зосереджені на функції ШКТ [76-78, 80]. Лише в одному випробуванні повідомлялося, що пробіотики покращують рух у пацієнтів із ХП [74]. Вищезазначені дослідження продемонстрували перспективну дію психобіотиків за рахунок зменшення окислювального стресу та запалення в пацієнтів із ХП. Однією з найважливіших патологічних особливостей ХП є утворення тілець Леві в дофамінергічних нейронах, які спричиняють накопичення неправильно складеного білка α-синуклеїну [81]. Нещодавно Чандра та співавт. повідомили, що α-синуклеїн експресується в ентероендокринних клітинах [82, 83]. Можливо, аномальний α-синуклеїн спочатку виробляється в ентероендокринних клітинах, а тоді поширюється в нервовій системі.
Психобіотики та порушення нервового розвитку
Розлади аутистичного спектра
РАС – це розлад нейророзвитку, котрий характеризується дефіцитом соціальної комунікації та соціальних взаємодій у різних контекстах, що супроводжується обмеженими й повторюваними патернами поведінки, інтересів та/або діяльності [84].
Загальна поширеність РАС оцінюється як 1 випадок на 160 дітей. У пацієнтів із РАС часто спостерігаються симптоми з боку ШКТ, діарея та закреп [85].
Досліджували вплив мультипробіотиків на пацієнтів із РАС. Visbiome extra strength – це пробіотичний продукт, який містить 8 штамів пробіотиків, включаючи L. acidophilus DSM24735™, L. plantarum DSM24730™, Lactobacillus paracasei DSM24733™, L. helveticus DSM24734™, Streptococcus thermophilus DSM24731™, B. lactis DSM24, B. lactis DSM24, В. breve DSM24732™ та B. lactis DSM24737™. У 2016-2017 рр. досліджували вплив Visbiome на симптоми з боку ШКТ у дітей із РАС [86]. Інший продукт, який містить декілька пробіотичних штамів, Vivomixx, використовується у двох поточних випробуваннях у пацієнтів із РАС. Основним результатом випробування, проведеного в Італії, є зміна тяжкості РАС, виміряної за допомогою ADOS‑2 [87]. Пацієнти були розподілені на дві групи: із симптомами з боку ШКТ, особи без симптомів із боку ШКТ. Хворі приймали 2 пакети/день протягом 1 міс і 1 пакет/день протягом подальших 5 міс. Іншим випробуванням, проведеним у Великій Британії, було перехресне дослідження [88]. Суб’єкти належали до групи пробіотиків або групи плацебо протягом 4 тиж, подальші 4 тиж нічого не приймали; після цього переходили до іншої групи на подальші 4 тиж. Це дослідження використовувало ATEC для вимірювання змін симптомів РАС. Vivomixx містить 450 млрд ліофілізованих бактеріальних клітин, які належали до 8 пробіотичних штамів: S. thermophiles DSM 24731, B. breve DSM 24732, B. longum DSM 24736, B. infantis DSM 24737, L. acidophilus DSM 24735, L. plantarum DSM 24730, L. paracasei DSM 24733 та Lactobacillus delbrueckii subsp. bulgaricus DSM 24734.
У відкритому дослідженні, проведеному в Єгипті, використано три штами пробіотиків – L. acidophilus, L. rhamnosus і B. longum [89]. Згідно з нещодавно опублікованими результатами випробування, тяжкість симптомів РАС та інтестинальних симптомів, оцінена за допомогою ATEC й 6-GSI відповідно, покращилася після 3-місячного використання пробіотиків [89]. За допомогою іншого плацебо-контрольованого дослідження вивчали безпеку двох доз пробіотичного препарату (1010 та 1011 КУО) BB‑12 + LGG. Це дослідження передбачало 56-денне використання пробіотиків або плацебо, а також подальший 28-денний етап спостереження без застосування препарату; випробування наразі триває [90]. Пробіотичний продукт (Gastrus), який містить два штами L. reuteri (DSM 17938 та ATCC PTA 6475), досліджуватиметься щодо його впливу на симптоми РАС у Японії (UMIN000033113) [91]. Основними результатами цього випробування є VABS (Vineland Adaptive Behavior Scales) та ABC (Autism Behavior Checklist) для клінічної психіатричної оцінки РАС.
Також досліджувалося використання одного пробіотичного штаму в осіб із РАС. L. plantarum WCFS1 був використаний у плацебо-контрольованому випробуванні, проведеному у Великій Британії у 2012 р. [92]. До цього дослідження залучили пацієнтів із РАС, які мали проблеми з боку ШКТ, для 6-тижневого випробування з пробіотиками чи плацебо. Доза пробіотиків не зазначена, а результати дослідження відсутні. Проте Паррачо та співавт. повідомили результати вивчення впливу L. plantarum WCFS1 на дітей із РАС у 2010 р. у подвійному сліпому плацебо-контрольованому перехресному дослідженні [93], що проводилося у Великій Британії без реєстрації; первинні його результати не були представлені. Згідно з доповіддю, 17 дітей завершили випробування, а L. plantarum WCFS1 покращив проблеми, пов’язані з поведінкою та спілкуванням, які оцінювали за допомогою Development Behaviour Checklist (DBC). Продемонстровано, що введення L. plantarum WCFS1 протягом 3 тиж змінило склад мікробіому кишечнику. У 2016 р. L. plantarum PS128 (PS128) використано в подвійному сліпому плацебо-контрольованому дослідженні, проведеному в Тайвані, для вивчення впливу PS128 на хлопчиків із РАС (ACTRN12616001002471) [94]. Було залучено 80 хворих; їх рандомізували на групи PS128 (3×1010 КУО/капсула, 2 капсули/день) або плацебо (мікрокристалічна целюлоза, 2 капсули/добу) для 28-денного дослідження. Результати випробування наразі відсутні. Вплив окремого штаму пробіотиків у поєднанні з окситоциновим спреєм досліджуватиметься в дітей із РАС у США [95]. Учасники отримуватимуть або пробіотики, L. reuteri, або плацебо, вітамін С (протягом двох фаз першого 12-тижневого спостереження). На 2-й фазі всі особи отримуватимуть спрей окситоцину разом із застосуванням пробіотиків/плацебо протягом подальших 12 тиж. Основними результатами цього випробування є оцінка соціального спілкування та поведінки. Рівень окситоцину в крові буде проаналізовано як вторинний результат.
Повідомляється, що численні чи окремі штами пробіотиків виявляють сприятливий вплив на дітей із РАС [89, 93]. Оцінка безпеки була основним результатом для введення BB‑12 + LGG дітям із РАС. Можна очікувати, що пробіотичні продукти з однаковим складом, але з різними назвами (Vivomixx і Visbiome) нададуть схожі результати в дослідженнях із РАС.
Синдром дефіциту уваги з гіперактивністю
СДУГ – це розлад нервової системи, найпоширенішими симптомами якого є неуважність, гіперактивність та імпульсивність. За даними Pärtty та співавт., немовлята, котрі отримували L. rhamnosus GG, мали знижений ризик розвитку СДУГ [96]. Як продемонстровано в одному клінічному дослідженні, Truehope GreenBAC покращує настрій і рівень енергії в пацієнтів зі СДУГ [97]. Окрім того, лікування харчовими добавками, що містять L. acidophilus, покращує самоконтроль та увагу в дітей зі СДУГ [98].
Наразі триває подвійне сліпе плацебо-контрольоване дослідження, що проводиться з метою дослідити вплив пробіотичних добавок на студентів зі СДУГ. Первинний результат буде оцінений за симптомами дефіциту уваги (тест MOXO) через 6 міс прийому пробіотиків [99].
Синдром Туретта (СТ)
СТ – спадковий нейропсихічний розлад, який розпочинається в дитинстві та характеризується численними фізичними (моторними) тиками м’язів плечового поясу, шиї й обличчя та хоча б одним вокальним (голосовим) тиком [100]. Лікування СТ включає поведінкові методи, α2-адренергічні агоністи, антипсихотики та глибоку стимуляцію мозку (DBS) [101, 102]. Нещодавно повідомлялося, що трансплантація фекального мікробіому покращує перебіг СТ через 8 тиж після лікування [103].
Задля іншого рандомізованого подвійного сліпого плацебо-контрольованого клінічного випробування проводиться набір пацієнтів для з’ясування ефекту PS128 на СТ [104]. Первинний результат вимірюватиметься за допомогою Єльської глобальної шкали тяжкості тику (YGTSS) через 2 міс втручання.
Безсоння
Встановлено, що дефіцит сну спричиняє депресію, погіршення пам’яті й алергію [105-107]. Лише декілька досліджень виявили, що використання ферментованих продуктів покращує сон [108]. Два дослідження оцінювали вплив L. brevis SBC8803 (SBL88™) на поліпшення сну в мишей і людей. Miyazaki та співавт. повідомили про зменшення нешвидких рухів очей (NREM) під час активної фази сну та посилення NREM під час фази спокою після прийому психобіотиків. Окрім того, L. brevis SBC8803 збільшила тривалість неспання та нічну активність [109]. Одне дослідження було зосереджене на впливі ферментованого молока, що містить L. helveticus CM4, на сон у здорових людей похилого віку [110]. Прийом ферментованого молока значно покращив ефективність сну й епізоди пробудження. Після застосування психобіотиків не спостерігалося значних змін у стані здоров’я та самопочутті в досліджуваних (коротка форма 36 (SF‑36) оцінки стану здоров’я).
Висновки
З’являється дедалі більше досліджень, які надають докази впливу психобіотиків на психічні розлади. Деякі штами можуть покращити функції ЦНС, включаючи настрій, тривожність, депресію та реакцію на стрес, які опосередковуються ГГН і нейромедіаторами. Крім того, лікування психобіотиками продемонструвало перспективний ефект на нейродегенеративні та нервово-психічні порушення шляхом зміни мікробіому калу, зменшення запалення, окислювального стану й нормалізації функції інсуліну. Пробіотики можуть відігравати вирішальну роль у регулюванні агрегації α-синуклеїну в ентероендокринних клітинах, виробленні мікробних метаболітів та активації блукального нерва при нейродегенеративних захворюваннях і порушеннях нейророзвитку.
Отже, лікування з використанням психобіотиків може бути перспективною стратегією покращення якості життя людей, які страждають на нейродегенеративні та нервово-психічні розлади.
На ринку України є мультиштамний пробіотик Лактіалє Мульті, що містить 14 штамів: L. casei, L. plantarum, L. rhamnosus, B. subtilis, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis ssp. lactis, S. thermophilus, B. infantis, L. delbrueckii ssp. bulgaricus, L. helveticus, Lactobacillus salivarius. Пробіотичні штами, що входять до його складу, згідно з результатами згаданих досліджень, здатні знижувати тривожність, депресію та когнітивні дисфункції, зменшувати запалення й рівень кортизолу, збільшувати рівень дофаміну, серотоніну та BDNF, виробляти ГАМК й ацетилхолін, що дає змогу віднести цю дієтичну добавку до класу психобіотиків.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 4 (497), 2021 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....