Вплив дефіциту селену на несприятливий перебіг вагітності: існуючі проблеми та невирішені питання
Нещодавні дослідження змінили уявлення про роль та функції селену в організмі людини. Даний огляд має на меті узагальнити сучасні знання щодо дефіциту та надлишку селену в період вагітності, а також коротко описати існуючі проблеми та контраверсійні погляди щодо призначення селену вагітним жінкам із його дефіцитом та супутньою патологією щитоподібної залози.
Ключові слова: селен, вагітність, трофобласт, викидень, передчасні пологи, прееклампсія, аутоімунітет щитоподібної залози.
Селен (Selenium, Se) є важливим мікроелементом, що входить до складу функціональних білків у вигляді селеноцистеїну й утворює ядро різних ферментів, які відіграють основну роль у механізмах антиоксидантного захисту, в окисно-відновній регуляції та метаболізмі гормонів щитоподібної залози. Коливання рівня селену у плазмі крові зумовлені харчовими звичками, географічними та етнічними відмінностями, а також генетичними поліморфізмами.
Як повідомлялося британськими дослідниками, концентрація селену в організмі жінок репродуктивного віку у Великій Британії є нижчою від норми. Крім того, його рівень невпинно зменшується під час вагітності, що призводить до зниження активності антиоксидантних ферментів у плазмі крові та плаценті. Оскільки низький рівень селену в сироватці крові був виявлений у жінок із прееклампсією, то гіпотетично можна сказати, що низька концентрація селену в матері у ранньому гестаційному періоді є маркером передчасних пологів. Більше того, задокументовано тенденційне зниження маркерів аутоімунних процесів щитоподібної залози та частоти материнського гіпотиреозу в післяпологовому періоді після введення селену під час вагітності.
Важливим є те, що низький рівень селену у вагітних впливає на ріст плода й збільшує ризик народження дитини з малою для гестаційного віку вагою через зменшення антиоксидантного захисту плаценти, тоді як низький рівень селену у ІІІ триместрі свідчить про підвищену потребу плаценти, що є проблемою, яка потребує подальшого дослідження. Очевидно, потрібні подвійні сліпі плацебо-контрольовані дослідження для кращого визначення ефективності та безпеки призначення селену під час вагітності з високим ризиком ускладнень, а також для вимірювання рівня селену або селенопротеїну P – найбільш надійного показника рівня цього мікроелемента, особливо в регіонах із його нестачею в населення.
Селен у формі 21-ї протеїногенної амінокислоти – селеноцистеїну (selenocysteine, SeCyS) входить до складу специфічних білків – селенопротеїнів, найважливішими з яких є [1, 2]:
- дейодинази (deiodinases, DIOs);
- глутатіонпероксидази (glutathione peroxidases, GPXs);
- тіоредоксинредуктази (thioredoxin reductases, TRXRs);
- SeCyS-інсерційний білок 2 (SeCyS insertion binding protein 2, SECISBP2);
- транспортний білок для селену (Se transport protein, SELENOP).
Дейодинази, регулюючи перетворення тироксину (Т4) на трийодтиронін (Т3) та зворотний трийодтиронін (rT3), контролюють обмін гормонів щитоподібної залози [3].
Одночасно з тим селен-залежні GPXs та TRXRs сприяють захисту щитоподібної залози за допомогою модуляції окисно-відновних процесів, зображених на рис. 1 [4].
Дефіцит селену асоціюється з аутоімунними захворюваннями щитоподібної залози, сепсисом, атеросклерозом, серцево-судинними захворюваннями, злоякісними новоутвореннями, когнітивним спадом, збільшенням смертності серед літніх людей та хворих, які знаходились на гемодіалізі [5, 6].
Важливо, що низький рівень селену асоціюється із несприятливими наслідками вагітності, такими як [7‑10]:
- викидні;
- дефекти нервової трубки;
- передчасні пологи;
- низька вага при народженні;
- прееклампсія;
- непереносимість глюкози;
- гестаційний діабет;
- грижа діафрагми.
Також слід зазначити, що дефіцит селену був пов’язаний із несприятливими наслідками у вагітних жінок із вірусом імунодефіциту людини та у їхніх дітей [11]. Нарешті, жінки з дефіцитом селену порівняно із жінками з нормальною його концентрацією мають приблизно у вісім разів вищий ризик розвитку передчасних пологів та народження дітей із недостатньою вагою [12].
Взаємозв’язок між рівнями селену, заліза, цинку й міді та перебігом І триместру вагітності нещодавно вивчався у польській проспективній когорті з 563 жінок [14]. Зазначалося, що підвищення рівня селену до 1 мг/л призводило до зменшення ризику гестаційної гіпертензії при багатоваріантній логістичній регресії на 6% (p=0,004), ризику затримки внутрішньоутробного розвитку – на 11% (p=0,013) і ризику передчасних пологів – на 7% (p=0,061). Таким чином, селен відіграє багатоваріантну роль під час вагітності.
Біохімія та біодоступність метаболізму селену
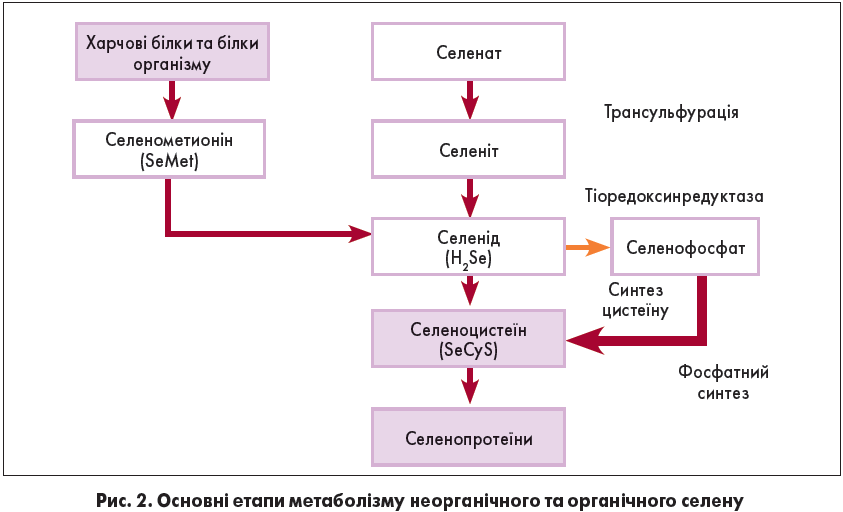
Хоча селен надходить із харчовими продуктами (злаки, хліб, горіхи, риба, птиця та м’ясо), його концентрація у плазмі може відрізнятися залежно від місця проживання та складу ґрунту в даній місцевості [15]. Селен надходить в організм у вигляді неорганічних селенідів або селенатів, основним джерелом яких є ґрунт, і відновлюється до селеніту, який метаболізується до селеніду (H2Se) через селенодіглутатіон та глутатіон селеноперсульфід. Схема утворення селеніду з неорганічного селеніту та органічного селенометионіну за допомогою цистеїнсинтази, а також подальші перетворення H2Se до утворення селеноцистеїну (SeCyS) та його вставки в біоактивні селенопротеїни представлена на рис. 2.
Цікаво, що SeCyS ефективно метилюється деякими рослинами, як-от: капуста (Brassica oleracea capitata), гірчиця салатна (Brassica juncea) та рамп (Allium tricoccum), що накопичують високі концентрації селену у формі селенометионіну (SeMet).
Важливо зазначити, що неорганічні й органічні форми спершу перетворюються на неорганічний H2Se перед синтезом SeCyS, що остаточно сприяє утворенню селенопротеїдів (рис. 2).
Після всмоктування SeMet із кишкового тракту амінокислота може бути включена у структуру білків замість метіоніну шляхом ацилювання метионін-трансляційної рибонуклеїнової кислоти (Met-тРНК) [16]. SeMet поглинається й утримується ефективніше, ніж неорганічні форми. У разі недостатнього споживання органічний селен у формі SeMet є кращим порівняно з неорганічним, оскільки зв’язується з білками й утримується в організмі більш ефективно [22].
Вплив селену на плід та дитину
Найбільш важливим для пролонгування здорової вагітності є забезпечення нормально функціонуючого метаболізму, що забезпечується за рахунок збалансованого харчування, включаючи достатню кількість макро- та мікроелементів. Літературні дані свідчать про те, що субоптимальний рівень селену під час вагітності є поширеним явищем [24], а недостатнє споживання мікроелементів у період вагітності може стати причиною порушення росту та розвитку плода й призвести до несприятливого перебігу вагітності [25].
Польське популяційне дослідження, що включало 539 пар матерів і дітей, визначало кількісно рівень селену в кожному триместрі вагітності, у пологах, а також у пуповинній крові та його вплив на психомоторний розвиток дітей, що оцінювався у віці 1 і 2 роки. Рівень селену у плазмі крові знижувався протягом усієї вагітності – з 48,3±10,6 мг/л у І триместрі до 38,4±11,8 мг/л під час пологів. При цьому спостерігався статистично значущий позитивний зв’язок між рівнями селену у І триместрі вагітності та руховим розвитком дітей у віці 1 року, а також мовним розвитком у віці 2 років [29].
Інше дослідження хорватських науковців, що включало 205 пар матерів і дітей, було спрямоване на оцінку взаємозв’язку рівнів селену в материнській та пуповинній крові зі структурою мозочка в неонатальному періоді та розвитком нервової системи дитини у віці 18 міс [30]. Середні рівні селену в материнській та пуповинній крові становили 92,6 та 97,0 нг/г відповідно. Хоча спостерігалася помірна негативна кореляція (r=-0,372; p=0,008) між рівнем селену та довжиною мозочка, у групі дітей жіночої статі рівень селену в пуповинній крові позитивно корелював із шириною мозочка, виміряною за допомогою УЗД черепа. Крім того, існувала слабка, але позитивна кореляція (r=0,176; p=0,029) між рівнем селену в материнській крові та когнітивними здібностями дітей. Дане дослідження встановило кореляцію між внутрішньоутробним споживання селену та довжиною й шириною мозочка. Дослідники припускають використання мозочка як потенційного біомаркера для виявлення несприятливих порушень внаслідок нестачі мікроелементів, особливо таких, як селен.
На відміну від цього в комбінованому дослідженні, проведеному в Бостоні та Нью-Йорку (1068 пар матерів і дітей), де вагітні жінки споживали рибні продукти в кількості 1,7 порції на тиждень і середній рівень селену становив 205,6 нг/мл, не було отримано жодних доказів асоціації споживання риби, ртуті та селену жінками у період вагітності з вербальними або невербальними здібностями, зоровою моторною функцією, зоровою пам’яттю дітей у віці 7,7 року [31]. Дані результати були отримані за допомогою багатоваріантного лінійного регресійного аналізу з урахуванням особливостей матерів і дітей, включаючи оточуюче середовище та інтелектуальні здібності матерів.
Однак слід зазначити, що у вищезгаданому дослідженні пренатальні рівні селену були набагато вищими, ніж ті, про які повідомляли європейські дослідження й які, крім того, значно різнилися – починаючи від дуже низьких рівнів селену у Польщі до гранично низьких рівнів в Іспанії та нормальних у Хорватії. Втім збільшення концентрації селену супроводжувалося покращенням когнітивних та рухових показників у потомства. Отримані результати потрібно також оцінити з точки зору гендерної різниці та географічних особливостей регіону дослідження, з урахуванням початкового рівня селену під час вагітності.
Вплив селену на розвиток трофобласта
Трофобласт – сукупність клітин, що утворюють зовнішній шар бластоцисти, сприяють імплантації, розвитку плаценти, обміну кисню та метаболітів між ембріоном і материнським організмом, забезпечуючи нормальний розвиток плода [32]. Нормально функціонуючий трофобласт є обов’язковою умовою для сприятливого перебігу вагітності. Слід зазначити, що трофобласт починає проникнення в ендометрій (ендогландулярний трофобласт) вже під час імплантації, забезпечуючи живлення ембріона перед перфузією плаценти материнською кров’ю [33]. Згодом відбувається проникнення ендовенозного трофобласта в маточні вени, що дозволяє протягом усього періоду вагітності виводити рідини, які надходять із плаценти, назад у материнський кровообіг. У цей момент ендоартеріальний трофобласт проникає у спіральні артерії, забезпечуючи таким чином гемотрофічне харчування плода з ІІ триместру вагітності [34]. З огляду на вищезазначене можна пояснити зміни, що мають місце при патологічному перебігу гестаційного процесу – починаючи від трубної вагітності й закінчуючи спонтанним абортом. Нормальний рівень селену відіграє фундаментальну роль у цьому природному процесі.
Дослідження 2017 року показало пригнічення міграційної та інвазивної здатності трофобласта з одночасним зниженням рівнів деяких селенопротеїнів, включаючи DIO2, GPX1 і селенопротеїн K (SELENOK), та підвищенням рівня малондіальдегіду, індексу оксидативного стресу (ОС) у разі зниження SECISBP2 [35]. Цей ефект, опосередкований інактивацією фосфоїнозитид‑3-кіназної активації та сигнальних шляхів позаклітинної сигнал-регульованої кінази, дає уявлення про складні механізми розвитку викидня та прееклампсії в умовах дефіциту селену.
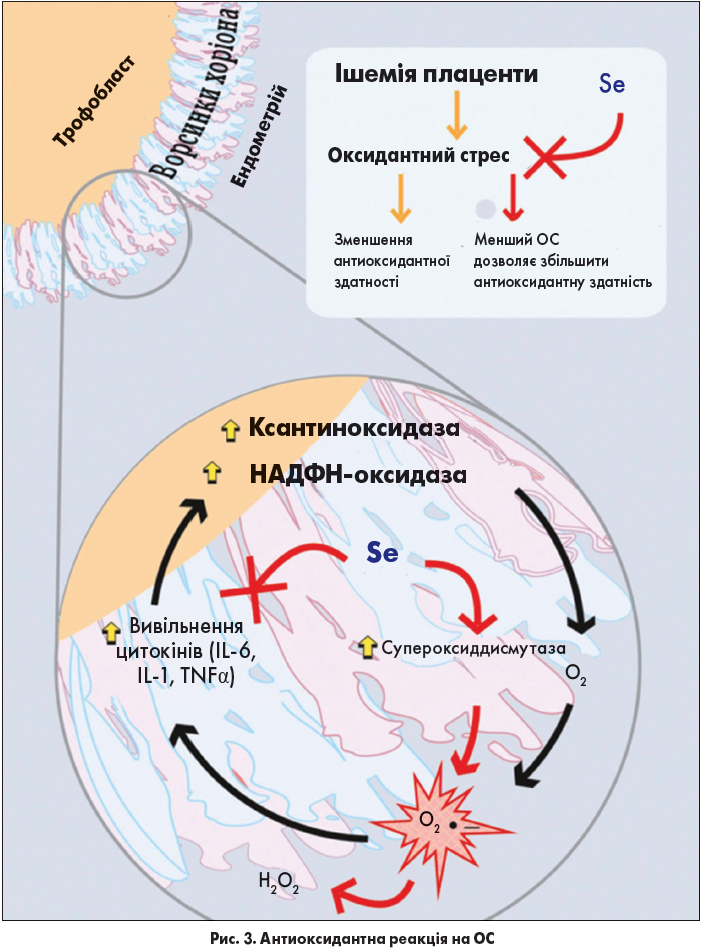
Трофобласт у процесі з’єднання з материнськими кровоносними судинами прискорює утворення ворсинок, одночасно розширюючи їхню поверхню, що веде до посилення міжворсинчастої перфузії. Таким чином, рівень ОС підвищується, викликаючи експресію білка теплового шоку (hsp60 і hsp70), що, у свою чергу, призводить до затримки розвитку плода [36]. ОС, що визначає дисбаланс між утворенням вільнорадикальних форм кисню та антиоксидантним захистом, розглядається як ключовий фактор патогенезу несприятливого перебігу вагітності [37]. Антиоксидантна реакція на ОС, що відбувається через регуляцію експресії генів супероксиддисмутази та гемоксигенази‑1, посилює мітохондріальну активність (рис. 3) [38].
Селен, будучи кофактором GPX, який захищає клітини організму від ушкодження вільними радикалами, має важливе значення для зменшення запалення та підтримання цілісності клітинної системи, натомість як дефіцит цього мікроелемента сприяє розвитку запальних реакцій.
Вплив селену на розвиток викидня
Дефіцит селену часто спостерігався на фоні несприятливого перебігу вагітності, включаючи викидень, прееклампсію та передчасні пологи [41]. Зокрема, коли збільшення рівня ОС внаслідок надмірної продукції вільнорадикальних форм кисню, який виникає під час нормального розвитку плаценти, поєднується зі зменшенням антиоксидантних мікроелементів у плаценті та материнській крові, підвищується ризик несприятливого перебігу вагітності [41].
Уельськими науковцями 2001 року було проведено новаторське дослідження за участю 40 жінок із нерецидивуючим викиднем у І триместрі, яким вимірювали рівень селену, альбуміну та загальну концентрацію протеїну [42]. Результати порівнювали із даними 40 невагітних жінок з урахуванням віку, а також із 40 вагітними, які відвідували клініку для взяття на облік у І триместрі вагітності. Відзначалося статистично значуще зниження (p<0,0001) сироваткового селену у жінок із викиднем в анамнезі, що чітко вказує на біологічний зв’язок зниження рівня селену із розвитком викидня [42]. Автори також висунули гіпотезу про руйнування та фрагментацію основ дезоксирибонуклеїнової кислоти (ДНК) у результаті низької антиоксидантної здатності, зумовленої дефіцитом селену та супутнім високим рівнем вільнорадикальних форм кисню.
У дослідженні, проведеному у Польщі 2001 року, концентрацію селену вимірювали у цільній крові та плазмі жінок, що мали викидень в анамнезі. Хоча рівні селену у цих жінок суттєво не відрізнялися від рівнів у жінок із життєздатною вагітністю у той самий період, вони були значно нижчими порівняно з контрольною групою здорових невагітних жінок такого ж віку [43].
У нещодавньому дослідженні, проведеному в Індонезії, у 46 пацієнток із спонтанними викиднями рівень селену в сироватці крові був значно нижчим, ніж у жінок із нормальною вагітністю.
Незважаючи на недостатність великих рандомізованих контрольованих досліджень, призначення селену у І триместрі вагітності, особливо у тих жінок, які проживають в ендемічних районах із низьким рівнем селену і/або мають високий ризик викидня, слід розглядати в індивідуальному порядку.
Вплив селену на розвиток прееклампсії
Гіпертонічні патології часто супроводжують вагітність, особливо наприкінці ІІ та ІІІ триместрів, і дефіцит селену має суттєвий вплив на розвиток цих патологічних станів [46].
Прееклампсія – мультисистемний розлад, що має руйнівний вплив на організм матері та плода й є основною причиною летальності серед вагітних та приблизно 15% передчасних пологів [47]. ОС виступає як головний патогенетичний фактор прееклампсії й виникає внаслідок зменшення антиоксидантних захисних шляхів, особливо за участю GPXs, що потенційно пов’язано зі зниженням рівня селену [48]. Знижений рівень GPXs може спричинити підвищене утворення токсичних пероксидів ліпідів і сприяє дисфункції ендотелію та розвитку прееклампсії.
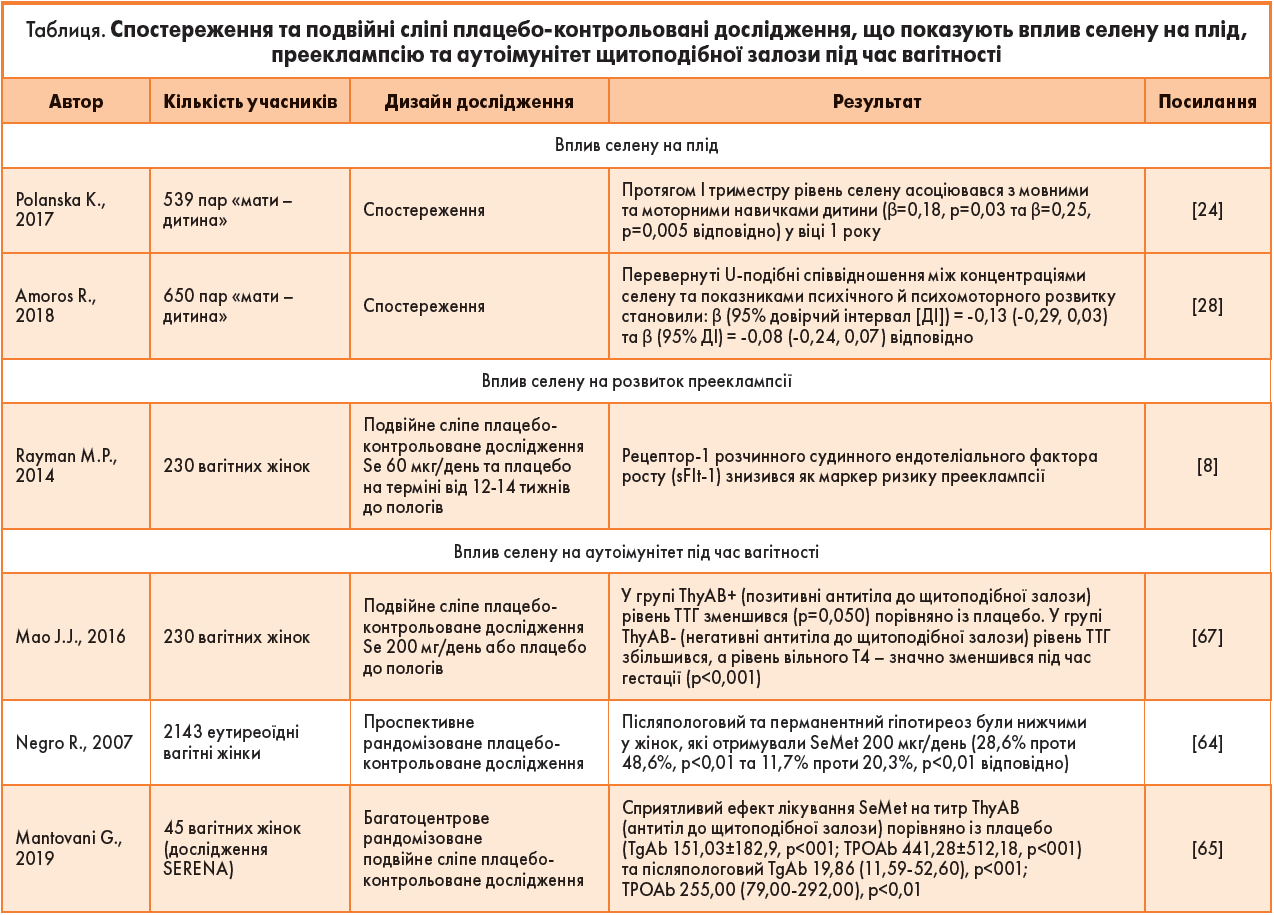
Проте 2014 року було проведено подвійне сліпе плацебо-контрольоване дослідження за участю 230 першовагітних жінок, які отримували селен у дозі 60 мг/добу у вигляді дріжджів або вживали плацебо на терміні вагітності 12‑14 тижнів й до пологів [8]. Метою дослідження було вивчити вплив невисоких доз споживання селену вагітними з низьким його рівнем на запобігання розвитку прееклампсії. Концентрацію селену у цільній крові вимірювали на початковому етапі та через 35 тижнів, тоді як концентрацію SELENOP у плазмі крові визначали лише на 35-му тижні. Значно вищі концентрації селену в цільній крові та SELENOP у плазмі спостерігались у групі, яка отримувала селен на 35-му тижні, порівняно із групою плацебо, де обидва параметри постійно суттєво знижувалися. Слід зазначити, що розчинний у сироватці крові рецептор‑1 фактора росту ендотеліального судинного фактора (sFlt1), антиангіогенний фактор, пов’язаний із ризиком розвитку прееклампсії, був знижений у групі, яка отримувала селен до 35-го тижня, порівняно із групою плацебо [8]. Таким чином, добавка селену може потенційно знизити ризик розвитку гестозу у вагітних із низьким рівнем цього мікроелемента.
У дослідженні 2018 року рівні й активність кількох ключових антиоксидантів та окисників/прооксидантів вивчали у саудівських пацієнток із рецидивуючою прееклампсією. Рівні ферментативних антиоксидантів (GPX, GSR, SOD, CAT) та неферментативних антиоксидантних мікроелементів (селен, цинк, марганець) були значно знижені, натомість як значне підвищення OС-маркерів спостерігалось у плазмі пацієнток із рецидивуючою прееклампсією порівняно зі здоровими вагітними [50]. Результати дослідження вказують на зміни ОС у плацентарній тканині жінок із прееклампсією порівняно зі здоровими вагітними/невагітними особами й можуть означати, що введення селену та цинку може врівноважити вплив ОС.
Для дослідження потенційних асоціацій між поліморфізмом промотору G‑105A запального медіатора селенопротеїну S (SELENOS1) та прееклампсією проведено великий норвезький когортний генетичний аналіз. За його результатами повідомлялося, що жінки із прееклампсією в 1,34 раза частіше мали генотип GА або АА і в 1,22 раза частіше – алель генотипу А. Отже, алель А поліморфізму SELENOSI‑105G> A було визначено як суттєвий фактор ризику розвитку прееклампсії [51].
Селен також негативно корелював із міддю у жінок із проведеним у ІІ триместрі абортом, оскільки плід мав дефект нервової трубки [54]. Зниження рівня селену та міді може збільшити ОС, що призводить до підвищення ризику розвитку прееклампсії. Тому можна стверджувати, що індукція та наслідки ОС зумовлені не просто єдиним механізмом, а взаємодією між мікроелементами та вітамінами, а також етнічними та генетичними факторами.
В іншому дослідженні було продемонстровано, що рівні селену в найнижчому квартилі (<58 мг/л), визначені кількісно через 10‑14 тижнів у 121 вагітної жінки з гіпертонічною хворобою, можуть розглядатися як фактор високого ризику (p=0,002) розвитку гіпертонії, спричиненої вагітністю, порівняно з найвищим квартилем (>67 мг/л) [55]. Ризик був розрахований за допомогою багатовимірного логістичного регресійного аналізу, а також з урахуванням таких факторів, як високий індекс маси тіла та куріння.
Вплив селену на передчасні пологи
Передчасні пологи, що трапляються у 5‑13% вагітностей і є основною причиною перинатальної захворюваності та смертності, були пов’язані з дефіцитом селену.
Проведено голландське дослідження за участю 1197 першовагітних жінок, за якими спостерігали проспективно від терміну 12 тижнів вагітності до пологів із вимірюванням рівня селену [56]. Загалом, у 60 жінок (5,3%) мали місце передчасні пологи, у 21 – передчасний розрив плодових оболонок, тоді як у 13 – прееклампсія. Концентрація селену у сироватці крові на терміні 12 тижнів вагітності була значно нижчою серед жінок із передчасними пологами порівняно з тими, які народили у строк. Жінки були згруповані за квартилями концентрацій селену у сироватці крові на 12-му тижні вагітності. Вагітні з найнижчим квартилем селену у сироватці мали подвійний ризик передчасних пологів порівняно з тими, рівень селену в яких знаходився у верхніх трьох квартилях. Однак низькі рівні селену наприкінці І триместру, хоча й були пов’язані з передчасними пологами, не залежали від виникнення прееклампсії [56]. Останні результати досліджень вказують на етіологічний взаємозв’язок між низькими концентраціями селену та несприятливим перебігом вагітності, особливо протягом І триместру – зокрема, високим ризиком як передчасних пологів, так і прееклампсії.
Метою проспективного когортного дослідження за участю 750 жінок із одноплідною вагітністю, за якими спостерігали протягом 10‑14-го тижнів, було дослідити, чи може рівень селену у сироватці материнської крові на ранніх термінах вагітності вказувати на ризики народження малого для гестаційного терміну плода [59]. Концентрація селену була нижчою в матерів у групі малого для гестаційного терміну плода порівняно із групою, де вага немовлят відповідала гестаційному віку (59,60 мг/л проти 62,54 мг/л, р=0,020). Разом із тим жінки у найнижчому квартилі селену (<56,60 мг/л) мали приблизно втричі більший ризик пологів із малим для гестаційного терміну плодом порівняно із жінками у вищих квартилях (відношення шансів [ВШ] 3,02; р=0,019). Отже, хоч результати дослідження потребують підтвердження, вони вказують на те, що рівні селену в сироватці материнської крові на ранніх термінах вагітності можуть бути маркером ризику народження малого для гестаційного терміну плода.
Вплив селену на аутоімунітет щитоподібної залози під час вагітності
Три стадії синтезу гормонів щитоподібної залози, тобто окиснення йодиду, йодування залишків тирозину в молекулі тиреоглобуліну (thyroglobulin, Tg) та окисне зв’язування йодованих залишків тирозину з утворенням Tg-зв’язаного гормона щитоподібної залози, каталізуються ферментом тиреоїдної пероксидази (thyroid peroxidase, ТPО), що знаходиться в апікальній мембрані тироциту, утворюючи пероксид водню (H2O2) як субстрат [61, 62]. H2O2 продукується у високих концентраціях нікотинамідаденіндинуклеотидфосфатом (NADPH), залежним від флавопротеїдів, тиреоїдної подвійної оксидази (dual oxidases, DUOX) 1 і 2, та забезпечує еквіваленти окисників для активності TPO [63]. Щитоподібна залоза постійно зазнає змінних концентрацій радикальних форм кисню, похідних H2O2, які, швидше за все, виникають як побічні продукти вищезазначених процесів. H2O2 може легко диспергуватися в цитоплазмі та ядрі, що призводить до аномального окиснення, йодування білків і ліпідів, одночасно викликаючи апоптоз та ушкодження ДНК [63].
У цьому контексті, згідно з даними італійського дослідження, призначення селену під час вагітності у пацієнток із аутоімунним тиреоїдитом (АІТ) призводить до значного зниження антитіл до пероксидази щитоподібної залози (thyroid peroxidase antibodies, TPOAb) і запобігає виникненню післяпологового гіпотиреозу [64]. Однак не було помічено більш вираженого ефекту після додавання селену порівняно із групою плацебо у відновленні концентрації TPOAb або переважанні останніх під час вагітності. У жінок із позитивним показником TPOAb на початковому етапі було відзначено тенденцію до зниження рівня тиреотропного гормона (ТТГ) та вільного тироксину (Т4), тоді як на 35-му тижні їх концентрації були нижчими, ніж у групі плацебо (р=0,050 та р=0,029 відповідно).
Багатоцентрове рандомізоване подвійне сліпе плацебо-контрольоване дослідження SERENA, організоване Групою молодих італійських ендокринологів (Young Italian Endocrinologists Group, EnGioI) Італійського товариства ендокринологів, мало на меті оцінити вплив додавання селену на АІТ під час вагітності та після пологів [65]. У пацієнток, які отримували SeMet у дозі 83 мг/ добу, спостерігалося значне зниження титру TPOAb (TPOAb 255,00 МО/мл (79,00‑292,00); р<0,01) та тиреоглобулінових антитіл (TgAb) (після пологів: TgAb 20 МО/ мл (11,59‑52,60), р<0,01), тоді як у групі плацебо повідомлялося про відновлення титру антитіл. Дані результати підтвердили дослідження R. Negro [64], продемонструвавши безпечність та ефективність додавання селену в дозі 83 мкг/день під час вагітності та у післяпологовому періоді при зменшенні титрів аутоантитіл, тоді як жодного впливу на гормони щитоподібної залози виявлено не було. Розгорнуті результати дослідження представлені у таблиці.
Отже, значний дефіцит селену, який розвивався незалежно від ступеня тяжкості АІТ у значної частини вагітних жінок (28,6% при АІТ проти 35,5% у здорового населення) може розглядатися як додатковий фактор ризику розвитку ускладнень під час вагітності.
Вторинний аналіз селену у подвійному сліпому рандомізованому плацебо-контрольованому дослідженні «Інтервенція вагітності» (PRegnancy INTervention, SPRINT) за участю 230 жінок з одноплідною вагітністю на 12-му тижні гестації представляє особливий інтерес [67]. Жінок рандомізували до низького рівня селену (60 мг/день) або плацебо до пологів. Статистично значущих змін титрів TPOAb або TgAb не було виявлено, тоді як рівень ТТГ підвищувався, а T4 – знижувався у жінок із негативними антитілами до щитоподібної залози впродовж гестації (р<0,001). У жінок із позитивним TPOAb і/або TgAb рівень ТТГ знижувався й був нижчим, ніж у групі плацебо (р=0,050). Результати дозволяють припустити, що введення малих доз селену жінкам із низьким та середнім ступенем дефіциту йоду не впливає на показники АІТ, але, як правило, покращує функцію щитоподібної залози у таких жінок.
Таким чином, дефіцит селену під час вагітності був пов’язаний із низкою несприятливих наслідків для плода й матері та збільшенням біомаркерів ОС. Попри надійні докази того, що додавання селену зменшує прояви ускладнень вагітності й ризик розвитку ускладнень AIT та запобігає гіпотиреозу в післяпологовому періоді, відсутність натепер чітких граничних рівнів для прийому селену зумовлює відмову від його призначення при отологічних станах через ризик передозування [68].
Висновки
Даний огляд заснований на низці досліджень, які наголошують на важливості підтримання належного рівня селену під час вагітності. Це особливо стосується вагітностей групи ризику, оскільки численні докази вказують на те, що дефіцит селену може спричинити викидень, прееклампсію, відставання внутрішньоутробного росту плода та передчасні пологи. Крім того, неадекватний рівень селену може прискорити плацентарний ОС і негативно впливати на життєздатність трофобласта під впливом гіпоксії. Вагітні жінки з АІТ у поєднанні з низькою концентрацією селену мають підвищений ризик несприятливого перебігу вагітності та післяпологового гіпотиреозу, тому потребують постійного контролю АІТ.
Таким чином, для досягнення оптимального результату вагітності лікар має індивідуально підходити до призначення селену відповідно до норм збалансованого харчування, включаючи необхідний рівень мікроелементів, особливо коли це стосується вагітностей із високим ризиком.
Підготувала Вероніка Яремчук
За матеріалами Duntas L.H. Selenium and at-risk pregnancy: challenges and controversies. Thyroid Res. 2020;13:16.
Тематичний номер «Акушерство, Гінекологія, Репродуктологія» № 5 (41) 2020 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...
Хронічний тазовий біль (ХТБ) є поширеним патологічним станом, який відзначається у жінок будь-якого віку і супроводжується сексуальною дисфункцією, емоційною лабільністю, аномальними матковими кровотечами, порушенням сечовипускання, розладами з боку кишечника тощо. Пацієнтки, які страждають на ХТБ, часто скаржаться на симптоми тривоги та депресії, що негативно позначається на їхній повсякденній активності, включаючи зниження працездатності та погіршення якості життя [1]. Сьогодні проблема ХТБ є економічним тягарем, пов’язаним із прямими або непрямими медичними витратами, які в середньому в різних країнах світу оцінюються у 4,9 млрд доларів на рік [2]. Раціональна фармакотерапія,спрямована на полегшення та контроль симптомів болю, є ключовою стратегією боротьби із ХТБ...
Дефіцит заліза є найпоширенішим патологічним станом у світі та однією з п’яти основних причин інвалідності. У той час як низький показник феритину у сироватці крові є діагностичною ознакою залізодефіциту, підвищений його рівень визначається як гострофазовий маркер, що може реєструватися при запальних станах уже в І триместрі вагітності. Відповідно до сучасних настанов, проведення рутинного скринінгу на залізодефіцит у невагітних та вагітних жінок за відсутності ознак анемії не рекомендоване. З огляду на останні літературні дані ця рекомендація має бути переглянута...
Наказ Міністерства охорони здоров’я України від 25.08.2023 № 1533 ...