Бригатиніб при рефрактерному до кризотинібу ALK+ недрібноклітинному раку легені
Результати дворічного спостереження у рамках дослідження II фази ALTA
Приблизно у 3-5% хворих на недрібноклітинний рак легені (НДРЛ) спостерігаються онкогенні перебудови гена кінази анапластичної лімфоми (ALK) [1, 2]. Кризотиніб ефективний при ALK-позитивному (ALK+) НДРЛ [3], але у більшості пацієнтів спостерігається прогресування захворювання, спричинене набутими мутаціями резистентності до ALK, активацією вторинних драйверів або слабким проникненням лікарських препаратів у центральну нервову систему (ЦНС) [4-6]. Після застосування кризотинібу наступна лінія терапії інгібіторами ALK другого покоління церитинібом та алектинібом, а також інгібітором третього покоління лорлатинібом асоціюється із середньою виживаністю без прогресування (ВБП) менше 1 року [7-14].
Бригатиніб – пероральний інгібітор ALK другого покоління, схвалений у США та Європейському Союзі для лікування хворих на метастатичний ALK+ НДРЛ з прогресуванням на тлі застосування кризотинібу або з його непереносимістю [15, 16]. У первинному аналізі дослідження II фази АLТА із 8-місячною медіаною періоду спостереження ВБП становила 9,2 міс у пацієнтів, які отримували бригатиніб у дозі 90 мг на добу, та 12,9 міс – 180 мг на добу з 7-денним введенням по 90 мг [17].
Представляємо оновлений аналіз результатів застосування двох дозувань бригатинібу у пацієнтів із резистентним до кризотинібу поширеним ALK+ НДРЛ в дослідженні ALTA [17] з приблизно 2-річним періодом спостереження з моменту останнього включення пацієнта.
Матеріали та методи
Дослідження ALTA (ідентифікатор ClinicalTrials.gov: NCT02094573) – відкрите рандомізоване багатоцентрове міжнародне дослідження II фази, яке ще триває. Повний протокол дослідження ALTA опубліковано раніше [17]. Його учасники (≥18 років) мали місцево-поширений або метастатичний ALK+ НДРЛ із прогресуванням захворювання на тлі прийому кризотинібу, без жодної попередньої ALK-спрямованої терапії, з принаймні одним вимірюваним вогнищем відповідно до критеріїв оцінювання відповіді твердих пухлин у версії 1.1 (RECIST, версія 1.1) [18] та показником загального стану за шкалою Східної об’єднаної онкологічної групи (ECOG) ≤2. Пацієнти не повинні були отримувати: 1) кризотинібу протягом 3 днів після першої дози бригатинібу; 2) цитотоксичної хіміотерапії або променевої терапії (крім стереотаксичних радіохірургічних втручань) протягом 14 днів; 3) моноклональних антитіл протягом 30 днів. Пацієнтів виключали із дослідження, якщо в анамнезі вони мали інтерстиційне захворювання легень або пов’язаний із лікуванням пневмоніт, або симптомні метастази в ЦНС, які були неврологічно нестабільними або потребували збільшення дози кортикостероїдів. Протокол був схвалений інституційною комісією або комісією з питань етики у кожному центрі. Дослідження проводилось відповідно до Гельсінської декларації та Міжнародної ради з питань гармонізації настанов належної клінічної практики. Усі пацієнти надали письмову інформовану згоду.
Процедури
Пацієнтів стратифікували за наявністю або відсутністю на базовому етапі метастазів у мозку та наявністю найкращої відповіді на кризотиніб (повна або часткова відповідь, оцінена дослідником порівняно з іншими або невідомими). Учасників рандомізували у співвідношенні 1:1 у групу А (бригатиніб у дозі 90 мг 1 раз на день) або групу В (бригатиніб 180 мг 1 раз на день із 7-денним введенням 90 мг). Пацієнти продовжували отримувати бригатиніб до прогресування захворювання, що вимагало альтернативної системної терапії, розвитку непереносної токсичності або відкликання згоди. Після прогресування захворювання лікування можна було продовжувати у будь-якій групі на розсуд дослідника. Пацієнти групи А після прогресування захворювання на тлі застосування бригатинібу в дозі 90 мг 1 раз на день могли переходити на 180 мг 1 раз на день. Терапію переривали або знижували дозу у разі виникнення небажаних явищ, пов’язаних із лікуванням. Ступінь тяжкості небажаних явищ оцінювали за Загальними термінологічними критеріями Національного інституту раку для небажаних явищ (версія 4.0).
Захворювання оцінювали за критеріями RECIST (версія 1.1), використовуючи знімки грудної клітки та живота, отримані за допомогою контрастної комп’ютерної томографії або магнітно-резонансної томографії на етапі скринінгу та через кожні 8 тижнів протягом 15 циклів (28 днів на цикл), а потім – через кожні 12 тижнів до прогресування. Візуалізація ЦНС потрібна всім пацієнтам на базовому рівні; для пацієнтів з метастазами в ЦНС також необхідно було через кожні 8 тижнів проводити контрастну магнітно-резонансну томографію головного мозку. Центральний незалежний комітет розглянув усі отримані зображення під час дослідження. Об’єктивну відповідь було підтверджено принаймні через 4 тижні після первинної відповіді. Спостереження за виживаністю та подальшою терапією продовжували через кожні 3 місяці після припинення лікування.
Ефекти лікування
Первинною кінцевою точкою був підтверджений об’єктивний рівень відповіді на лікування (ОРВ) за RECIST версії 1.1. Вторинні кінцеві точки включали тривалість відповіді, загальну виживаність (ЗВ), оцінену незалежним комітетом (ОРВ), ВБП, зокрема і без прогресування інтракраніальних метастазів, відповідь з боку ЦНС, безпеку та переносимість. Активні метастази в мозку визначали як ураження, з приводу яких раніше не призначали променевої терапії або які прогресували за оцінкою дослідника після променевої терапії. Відповідь внутрішньочерепних метастазів визначалася як ≥30% зменшення вимірюваних (≥10 мм) уражень або як повне зникнення уражень у пацієнтів без вимірюваних уражень [17]. Визначали відповідь мішеневих уражень, оцінену дослідником, за місцем розташування та кореляцію зменшення мішеневих вогнищ з оціненою дослідником ВБП і ЗВ та з оціненими незалежним комітетом зменшенням мішеневих вогнищ і ВБП. Для аналізу зменшення мішеневих вогнищ і виживаності пацієнтів груп А і В з принаймні однією оцінюваною відповіддю на лікування було об’єднано та розподілено на п’ять категорій (відсутність зменшення, зменшення на 1-25; 26-50; 51-75 та 76-100%) на основі найбільшого зменшення від базового рівня за RECIST версії 1.1 [18]. Багатофакторний аналіз проводили з використанням моделі регресії пропорційних ризиків Кокса, яка включала змінні найкращої категорії зменшення мішеневих вогнищ, групи лікування, початкового стану за ECOG (0-1 проти 2) та статусу курця (ніколи або невідомий проти нинішнього чи колишнього).
Статистичний аналіз
До аналізу ефективності включено усіх рандомізованих пацієнтів. До аналізу ефективності впливу на інтракраніальні метастази були включені лише пацієнти з оціненими незалежним комітетом метастазами у головному мозку. Популяція для аналізу безпеки включала всіх пацієнтів, які отримали принаймні одну дозу бригатинібу. Точний біноміальний метод був використаний для розрахунку довірчих інтервалів (ДІ); 97,5% ДІ оцінювали для ОРВ (первинна кінцева точка), а 95% ДІ – для інших кінцевих точок [17]. Середні значення та двосторонні 95% ДІ для аналізу часу до події (тривалості відповіді, ВБП та ЗВ) аналізували за методом Каплана – Меєра. Дані щодо ефективності системного впливу та впливу на інтракраніальні метастази, оцінені незалежним комітетом, включали останнє сканування 18 вересня 2017 р. Клінічні дані повідомлялися станом на 29 вересня 2017 р. Статистичний аналіз проводили за допомогою програмного забезпечення SAS (SAS Institute, USA; версія 9.4) [17].
Результати
Пацієнти
Із 222 рандомізованих пацієнтів (112 і 110 у групах А та В відповідно) 59 (27%) залишились у дослідженні (27 (24%) у групі А та 32 (29%) у групі В) станом на 29 вересня 2017 р. Медіана спостереження становила 19,6 міс (діапазон 0,1-35,2) у групі А та 24,3 міс (0,1-39,2) у групі В. Медіана тривалості лікування становила 13,2 міс (діапазон 0,03-35,00) та 17,1 міс (0,07-39,20) відповідно. Демографічні показники та базові характеристики опубліковані раніше [17]. На початку у більшості пацієнтів були ураження головного мозку (у 80 (71%) зі 112 у групі А та 74 (67%) зі 110 в групі В) і приблизно половина мали активне ураження (тобто ураження, з приводу якого раніше не призначали променевої терапії, або визначене дослідником прогресування після попередньої променевої терапії) головного мозку (54 (48%) із 112 в групі А та 55 (50%) зі 110 в групі В). Приблизно 16% (70 з 451) усіх мішеневих вогнищ були розташовані в ЦНС (38 (15%) з 247 у пацієнтів групи А, 32 (16%) з 204 – групи В). Загалом у 51 (23%) пацієнта було принаймні одне мішеневе ураження ЦНС (28 (25%) у групі A, 23 (21%) у групі B). Із 44 пацієнтів з вимірюваними вогнищами у головному мозку, виявленими незалежним комітетом на базовому етапі, у 34 було принаймні одне активне ураження головного мозку, визначене дослідником.
Загалом 96 (43%) пацієнтів отримували попередню променеву терапію на ділянку головного мозку (50 (45%) у групі А, 46 (42%) у групі В). Трохи більше половини (54 (56%) із 96) востаннє отримували променеву терапію на ділянку головного мозку більше ніж за 6 міс до першої дози бригатинібу (23 (46%) із 50 в групі А, 31 (67%) із 46 в групі В). Серед пацієнтів з ураженнями головного мозку на початку 94 (61%) отримували попередню променеву терапію на ділянку головного мозку (49 (61%) у групі А, 45 (61%) в групі В).
Ефективність
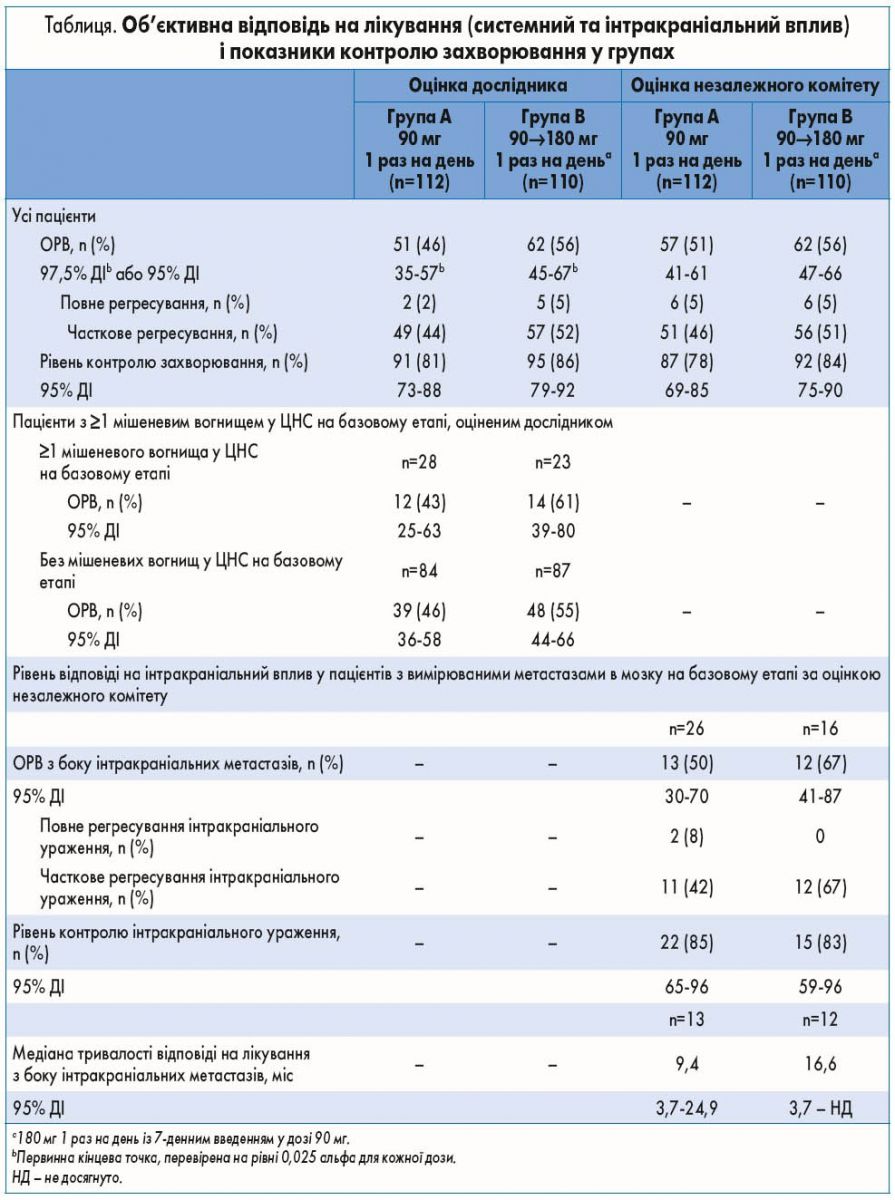
Ефективність системного впливу. ОРВ (97,5% ДІ) за оцінкою дослідника становив 46% (35-57%) у групі А та 56% (45-67%) у групі В (табл.), середня тривалість відповіді – 12,0 міс (95% ДІ 9,2-17,7) та 13,8 міс (95% ДІ 10,2-19,3) відповідно. За оцінками незалежного комітету ОРВ дорівнював 51% (95% ДІ 41-61) та 56% (95% ДІ 47-66) для груп A та B відповідно.
Середня ВБП за оцінкою незалежного комітету становила 9,2 міс (95% ДІ 7,4-12,8) у групі А та 16,7 міс (95% ДІ 11,6-21,4) у групі В (рис. 1А). Медіана ВБП за оцінкою дослідника дорівнювала 9,2 міс (95% ДІ 7,4-11,1) у групі А та 15,6 міс (95% ДІ 11,1-21,0) у групі В. Медіана ЗВ становила 29,5 міс (95% ДІ 18,2 – не досягнута – НД) в групі A та 34,1 міс (95% ДІ 27,7 – НД) в групі B (рис. 1Б). Імовірність виживання через 1 рік та 2 роки становила 70 та 55% у групі А та 80 та 66% у групі В відповідно.
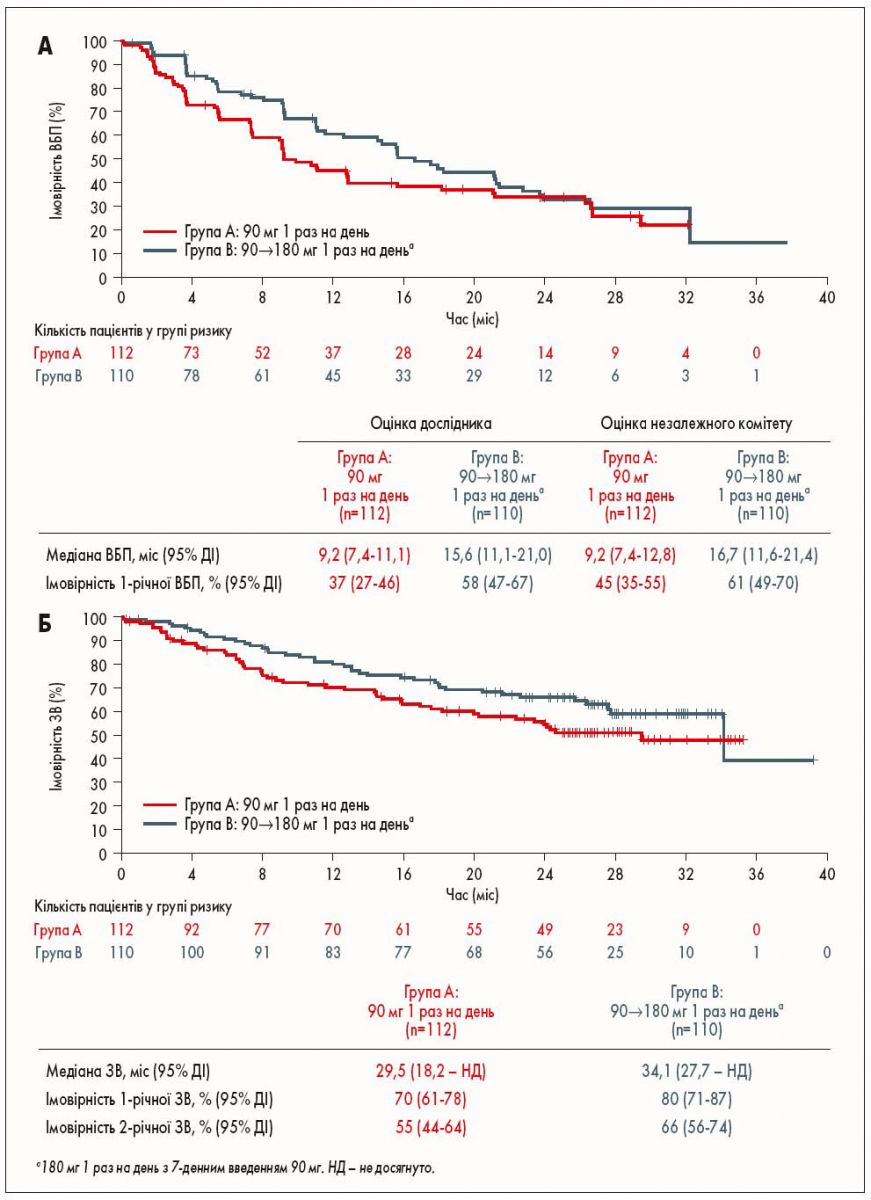 Рис. 1. Ефективність системного впливу бригатинібу при резистентному до кризотинібу ALK+ НДРЛ. А – ВБП, оцінена незалежним комітетом. Б – ЗВ
Рис. 1. Ефективність системного впливу бригатинібу при резистентному до кризотинібу ALK+ НДРЛ. А – ВБП, оцінена незалежним комітетом. Б – ЗВ
Ефективність інтра- та екстракраніального впливу. Незалежний комітет оцінив підтверджену частоту об’єктивної відповіді (OРВ) з боку інтракраніальних метастазів у пацієнтів з вимірюваними ураженнями ЦНС на базовому етапі в 50% (13 з 26) у групі A та 67% (12 з 18) у групі B. Середня тривалість підтвердженої відповіді з боку інтракраніальних метастазів дорівнювала 9,4 міс (95% ДІ 3,7-24,9) та 16,6 міс (95% ДІ 3,7 – НД) відповідно (табл.).
Аналіз оцінених дослідником найкращих змін від базового рівня у мішеневих ураженнях за їх локалізацією (інтра- проти екстракраніального та загального) у пацієнтів із мішеневими ураженнями мозку на базовому етапі або без них представлений на рисунку 2А-В. У пацієнтів з принаймні одним інтракраніальним вогнищем на базовому етапі у 68% (17 з 25) у групі А та 82% (18 із 22) у групі В виявлено ≥30% зменшення інтракраніальних мішеневих вогнищ; 59% (10 із 17) хворих у групі А та 67% (6 із 9) у групі В мали ≥30% зменшення екстракраніальних мішеневих вогнищ. У пацієнтів без інтракраніальних мішеневих вогнищ на початку у 64% (49 із 76) у групі А та 68% (53 із 78) у групі В спостерігалося ≥30% зменшення екстракраніальних мішеневих вогнищ.
Для осіб з будь-якими ураженнями головного мозку на базовому етапі (81 та 74 пацієнти в групах А та В відповідно) оцінена незалежним комітетом медіана ВБП з боку інтракраніального ураження становила 12,8 міс (95% ДІ 9,2-18,3; події – 49%) у групі А та 18,4 міс (95% ДІ 12,6-23,9; події – 41%) в групі В (рис. 2Г).
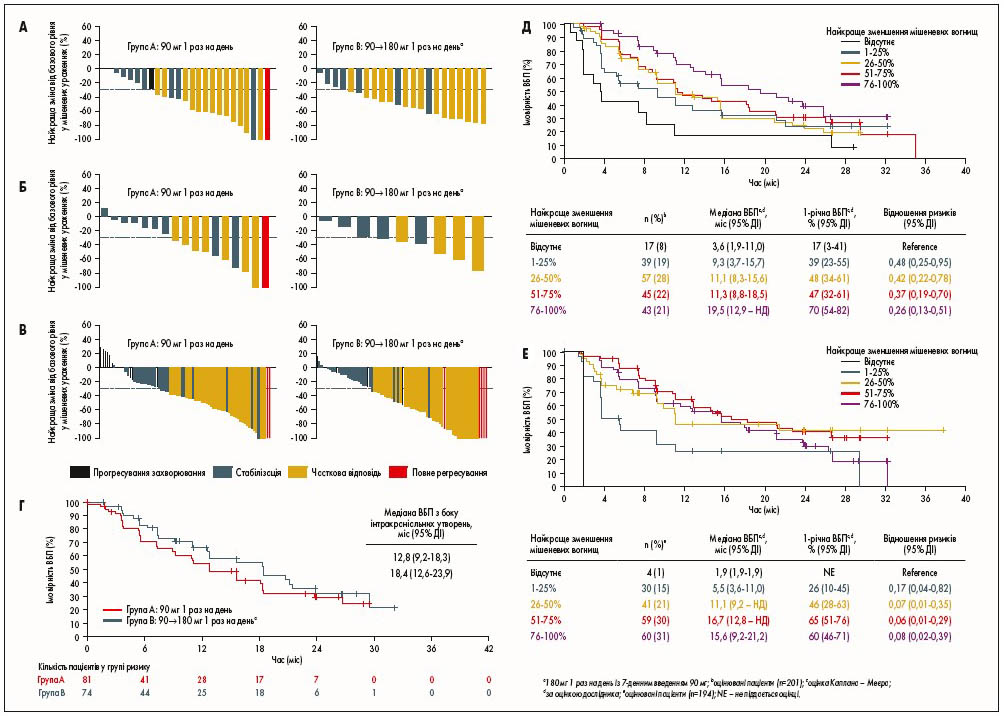 Рис. 2. Ефективність впливу бригатинібу на метастази та найкраща відповідь мішеневих вогнищ при резистентному до кризотинібу ALK+ НДРЛ. A – відповідь інтракраніальних мішеневих утворень у пацієнтів з ≥1 ураженням ЦНС на базовому етапі. Про найкращий відсоток змін від базового рівня у сумі найдовших діаметрів інтра- та екстракраніальних мішеневих вогнищ повідомляється у пацієнтів, які мали принаймні одне мішеневе вогнище на базовому етапі, як оцінили дослідники. Пунктирна лінія на рівні -30% вказує на поріг часткової відповіді за RECIST версії 1.1. Б – відповідь екстракраніальних мішеневих утворень у пацієнтів з ≥1 ураженням ЦНС на базовому етапі. В – відповідь мішеневих утворень у пацієнтів без ураження ЦНС на базовому етапі. Г – ВБП з боку інтракраніальних утворень у пацієнтів з будь-якими метастазами в мозку на базовому рівні за оцінкою незалежного комітету (n=81, група A; n=74, група B). Д – оцінена дослідником ВБП за найкращим зменшенням мішеневих вогнищ. Е – ВБП, оцінена незалежним комітетом за найкращим зменшенням мішеневих вогнищ у пацієнтів з однією або кількома вимірюваними оцінками відповіді
Рис. 2. Ефективність впливу бригатинібу на метастази та найкраща відповідь мішеневих вогнищ при резистентному до кризотинібу ALK+ НДРЛ. A – відповідь інтракраніальних мішеневих утворень у пацієнтів з ≥1 ураженням ЦНС на базовому етапі. Про найкращий відсоток змін від базового рівня у сумі найдовших діаметрів інтра- та екстракраніальних мішеневих вогнищ повідомляється у пацієнтів, які мали принаймні одне мішеневе вогнище на базовому етапі, як оцінили дослідники. Пунктирна лінія на рівні -30% вказує на поріг часткової відповіді за RECIST версії 1.1. Б – відповідь екстракраніальних мішеневих утворень у пацієнтів з ≥1 ураженням ЦНС на базовому етапі. В – відповідь мішеневих утворень у пацієнтів без ураження ЦНС на базовому етапі. Г – ВБП з боку інтракраніальних утворень у пацієнтів з будь-якими метастазами в мозку на базовому рівні за оцінкою незалежного комітету (n=81, група A; n=74, група B). Д – оцінена дослідником ВБП за найкращим зменшенням мішеневих вогнищ. Е – ВБП, оцінена незалежним комітетом за найкращим зменшенням мішеневих вогнищ у пацієнтів з однією або кількома вимірюваними оцінками відповіді
Оцінка дослідником відповіді мішеневих вогнищ на лікування та виживаності. Дослідники оцінили відповідь на лікування мішеневих вогнищ у 201 пацієнта, який мав принаймні одну оцінювану відповідь на лікування (101 та 100 пацієнтів у групах А та В відповідно). У 17 пацієнтів з обох груп не виявлено зменшення мішеневого вогнища, тоді як у 39; 57; 45 та 43 пацієнтів найкраще зменшення мішеневого вогнища становило 1-25; 26-50; 51-75 та 76-100% відповідно. У 7 із 43 пацієнтів з 76-100% зменшенням було підтверджено повну відповідь на лікування, у 34 – часткову відповідь, а у 2 – стабілізацію захворювання.
Медіана ВБП за оцінкою дослідника становила 3,6 міс (95% ДІ 1,9-11,0) у пацієнтів без зменшення пухлини; 9,3 міс (діапазон 3,7-15,7) у пацієнтів зі зменшенням на 1-25% (відношення ризиків – ВР – 0,48; 95% ДІ 0,25-0,95 порівняно з відсутністю зменшення); 11,1 міс (діапазон 8,3-15,6) – із 26-50% зменшенням (ВР 0,42; 95% ДІ 0,22-0,78); 11,3 міс (діапазон 8,8-18,5) – із 51-75% зменшенням (ВР 0,37; 95% ДІ 0,19-0,70) та 19,5 міс (12,9 – НД) – із 76-100% зменшенням (ВР 0,26; 95% ДІ 0,13-0,51; рис. 2Д). Медіана ЗВ становила 8,3 міс (95% ДІ 4,7 – НД) у пацієнтів без зменшення вогнищ, НД (14,5 – НД) у пацієнтів з 1-25% зменшенням (ВР 0,47; 95% ДІ 0,21-1,02 порівняно без зменшення), НД (24,6 – НД) – з 26-50% зменшенням (ВР 0,33; 95% ДІ 0,15-0,72), 34,1 міс (26,3 – НД) – із 51-75% зменшенням (ВР 0,37; 95% ДІ 0,17-0,80) та НД (22,6 – НД) у пацієнтів із 76-100% зменшенням (ВР 0,27; 95% ДІ 0,12-0,60).
Оцінка незалежним комітетом відповіді мішеневих вогнищ на лікування та виживаності. Незалежний комітет оцінив відповідь мішеневих вогнищ на лікування у 194 пацієнтів, які мали принаймні одну оцінювану відповідь на лікування (97 та 94 в групах А та В відповідно). У 4 з усіх пацієнтів, які отримували лікування, не було зменшення мішеневого ураження, тоді як у 30; 41; 59 та 60 хворих найкраще зменшення мішеневого ураження становило 1-25; 26-50; 51-75 та 76-100% відповідно. У 12 із 60 пацієнтів з 76-100% зменшенням було підтверджено повне регресування, у 40 – часткове регресування, а у 6 – стабілізацію захворювання; у 2 учасників дослідження відбулося прогресування захворювання через прогресування немішеневих вогнищ, незважаючи на значне зменшення мішеневого ураження.
Медіана ВБП, оцінена незалежним комітетом, становила 1,9 міс (95% ДІ 1,9-1,9) у пацієнтів без зменшення пухлини; 5,5 міс (діапазон 3,6-11,0) у пацієнтів з 1-25% зменшенням (ВР 0,17; 95% ДІ 0,04-0,82); 11,1 міс (діапазон 9,2 – НД) – із 26-50% зменшенням (ВР 0,07; 95% ДІ 0,01-0,35) 16,7 міс (діапазон 12,8 – НД) – із 51-75% зменшенням (ВР 0,06; 95% ДІ 0,01-0,29) та 15,6 міс (діапазон 9,2-21,2) при 76-100% зменшенні (ВР 0,08; 0,02-0,39; рис. 2Е).
Багатофакторний аналіз на основі результатів, оцінених дослідником і незалежним комітетом, свідчив, що 26-50; 51-75 та 76-100% зменшення мішеневих вогнищ порівняно з відсутністю ефекту були незалежно пов’язані з більшими ВБП та ЗВ.
Попередня відповідь на кризотиніб. ОРВ, оцінений дослідниками, був вищим у пацієнтів, у яких досягнута повна або часткова відповідь на лікування або часткова відповідь як найкраща відповідь на попереднє лікування кризотинібом (у 51% (36 з 71) в групі A та 67% (49 з 73) в групі B), ніж у пацієнтів з іншою або невідомою відповіддю на попереднє лікування кризотинібом (37% (15 з 41) в групі A та 35% (13 із 37) у групі B). Медіана ВБП за оцінкою дослідника була більшою у пацієнтів з частковою або повною відповіддю чи повною відповіддю на попереднє лікування кризотинібом (11,0 міс; 95% ДІ 7,4-15,6 в групі А; 15,6 міс; 95% ДІ 11,1-21,1 у групі В) порівняно з особами, у яких зафіксована інша відповідь на попереднє лікування кризотинібом або вона невідома (7,4 міс; 95% ДІ 3,7-9,3 у групі А; 12,9 міс; 95% ДІ 5,2-22,8 у групі В).
Безпека
Найпоширенішими небажаними явищами будь-якого ступеня, пов’язаними з лікуванням, за оцінкою дослідника були діарея (16 та 35% у групах А та В відповідно), нудота (26 та 33%) та підвищення рівня креатинфосфокінази в крові (14 та 32%). Найбільш типовими небажаними явищами 3 ступеня або вище, які дослідник вважав пов’язаними з лікуванням, були підвищення рівня креатинфосфокінази в крові (4 та 13%); гіпертензія (по 5%) і підвищення вмісту ліпази (4 та 5%). Зниження дози препарату, асоційоване з будь-яким небажаним явищем, було необхідне у 7 (8 із 109) та 29% (32 із 110) пацієнтів у групах А та В відповідно. Найпоширенішим небажаним явищем, що призводило до зменшення дози, було підвищення рівня креатинфосфокінази в крові (2 та 6%). Переривання прийому препарату внаслідок будь-якого небажаного явища відбулося у 41 (45 із 109) та 62% (68 із 110) пацієнтів у групах А та В відповідно. Припинення лікування через будь-яке небажане явище необхідне було у 4 (4 із 109) та 11% (12 із 110) пацієнтів у групах А та В відповідно. Середня інтенсивність дози становила 90 мг на добу в групі А та 169 мг на добу в групі В.
Як повідомлялося раніше, 17 підгруп легеневих небажаних явищ з раннім початком (медіана – день 2; діапазон – дні 1-9), включаючи задишку, гіпоксію, кашель, пневмонію та пневмоніт, спостерігалися у 14 (6%) з 219 пролікованих пацієнтів (7 (3%) мали явища ≥3 ступеня). Усі небажані явища розвивалися у разі прийому препарату в дозі 90 мг в обох групах; такого не відбулося після ескалації дози до 180 мг. Лікування з приводу цих явищ включало переривання або припинення прийому та емпіричну терапію (наприклад, кортикостероїди та антибіотики).
Обговорення
При середньому періоді спостереження 24 міс затверджений режим дозування бригатинібу 180 мг 1 раз на день (із 7-денним введенням 90 мг) після кризотинібу асоціювався з високим ОРВ за оцінкою незалежного комітету (56%), порівнянним із об’єктивною відповіддю на затверджені Управлінням з контролю якості харчових продуктів і лікарських препаратів США інгібітори ALK – церитиніб (33-58%) [7-10] та алектиніб (46-50%) [11, 12]. Порівнянні показники відповіді на лікування цілком можуть відображати спільну активність щодо найпоширеніших механізмів резистентності до кризотинібу в організмі (поза ЦНС) або в ЦНС. Однак оцінена незалежним комітетом медіана ВБП, зумовленої прийомом бригатинібу (16,7 міс), здається більшою порівняно з іншими препаратами в тій самій клінічній ситуації. Так, медіана ВБП у разі застосування церитинібу дорівнює 5-7 міс [7-10], алектинібу – 8-9 міс [11, 12], лорлатинібу 11,1 міс [14, 19]. Крім того, медіана ВБП, асоційована з прийомом бригатинібу, була зіставна з такою для тієї ж дози в тій самій клінічній ситуації, яка вивчалася у I фазі дослідження бригатинібу (16,3 міс) [20].
Чому застосування бригатинібу асоціюється з найбільшою зафіксованою на сьогодні медіаною ВБП порівняно з будь-яким іншим інгібітором ALK другого або третього покоління, що використовується після кризотинібу, зрозуміло лише частково. За даними доклінічних досліджень, він має ширший спектр дії проти мутацій резистентності ALK, що виникають після використання кризотинібу, ніж церитиніб або алектиніб, але не такий, як лорлатиніб [21, 22].
Режим дозування бригатинібу 180 мг (із 7-денним введенням у дозі 90 мг) забезпечував стійку інтракраніальну активність у пацієнтів із метастазами в мозку на базовому етапі. При цьому підтверджений незалежним комітетом ОРВ інтракраніальних утворень становив 67% у пацієнтів із вимірюваними ураженнями ЦНС, середня тривалість їх відповіді – 16,6 міс, а медіана ВБП з боку інтракраніальних метастазів – 18,4 міс. Хоча порівняння результатів лікування у ЦНС з іншими інгібіторами АLK обмежене невеликими розмірами вибірки, різними характеристиками пацієнтів та методами оцінки, «інтракраніальні результати» бригатинібу перевершують такі церитинібу [23-25]. Імовірно, лорлатиніб проявляє принаймні порівнянну активність у ЦНС [13].
У представленому аналізі з використанням даних, оцінених дослідниками, в обох групах була великою частка пацієнтів, які отримували бригатиніб 180 мг (із 7-денним введенням 90 мг) та у яких виявляли принаймні 30% зменшення мішеневих інтракраніальних уражень проти екстракраніальних. Незважаючи на занадто малий масив даних, щоб виявити статистичну значущість, чисельна різниця (82 проти 67% на користь інтракраніальних результатів) продовжує підтверджувати важливість окремої оцінки інтра- та екстракраніальних даних, а також загального ОРВ та ВБП [26, 27].
Вищу ефективність бригатинібу порівняно з попереднім лікуванням кризотинібом можна пояснити або базовою активністю суміжних факторів у пацієнтів, у яких не досягнута відповідь на кризотиніб, або наявністю хибнопозитивного результату ALK-тестування. Ці спостереження дозволяють припустити, що при порівнянні результатів досліджень препаратів, які застосовуються після кризотинібу, слід враховувати частку пацієнтів без попередньої відповіді на лікування кризотинібом.
Аналіз виживаності щодо зменшення мішеневих вогнищ показав, що пацієнти, у яких мішеневе вогнище зменшувалося за оцінкою незалежного комітету або оцінкою дослідника, включаючи хворих, які не досягли підтвердженої часткової відповіді, мали більші ВБП та ЗВ, ніж пацієнти без зменшення пухлини. Значення зменшення пухлини як відповідного результату при НДРЛ оцінювали в інших ретроспективних аналізах у пацієнтів із поширеним ALK+ або EGFR-мутантним НДРЛ [29‑31].
Багатофакторний аналіз двох досліджень кризотинібу (n=305) виявив, що ЗВ зростала зі збільшенням квартиля зростання відповіді мішеневих вогнищ. Однак ступінь відповіді не виявився важливим предиктором ЗВ або ВБП при прогресуючому EGFR-мутантному раку легені у знаковому багатовимірному аналізі даних 5 рандомізованих досліджень (n=1081) EGFR-TKI як першої лінії лікування порівняно з хіміотерапією [32].
Профіль безпеки бригатинібу відповідав такому у попередніх дослідженнях, про нові небажані явища не повідомлялося [17, 33]. Клінічно виражені легеневі небажані явища, що виникали протягом декількох днів прийому бригатинібу, спостерігались у 6% учасників дослідження ALTA.
Таким чином, рекомендований режим дозування бригатинібу (180 мг 1 раз на день із 7-денним введенням 90 мг) після застосування кризотинібу асоційований зі значною інтра-, екстракраніальною та системною активністю препарату, а також найбільшою на сьогодні медіаною ВБП серед ALK TKI другого та третього покоління. Припущення про різницю ефективності доз 90 і 180 мг доводить мету збільшити частку пацієнтів з ескалацією дози до 180 мг (група В цього дослідження) [34]. Ефективність впливу препарату на інтра- й екстракраніальні метастази та ступінь відповіді на лікування можуть бути важливими кінцевими точками для майбутніх досліджень мішеневої терапії, а відповідь на попереднє лікування кризотинібом – важливою при порівнянні даних між дослідженнями.
Список літератури знаходиться в редакції.
Huber R.M., Hansen K.H., Rodriguez L.P.-A. et al. Brigatinib in Crizotinib-Refractory ALK. NSCLC: 2-Year Follow-up on Systemic and Intracranial Outcomes in the Phase 2 ALTA Trial. Journal of Thoracic Oncology. Vol. 15, No. 3. https://doi. org/10.1016/j.jtho.2019.11.004.
Переклав з англ. Назар Лукавецький
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 1 (68) 2021 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...