Вікова макулярна дегенерація: сучасні аспекти патогенезу, діагностики та лікування
 Вікова макулярна дегенерація (ВМД) – хронічне прогресуюче захворювання, за якого уражається центральна ділянка сітківки (макула). В пацієнтів із ВМД погіршується центральний зір; периферичний зір не змінюється. Згідно з даними Європейської асоціації ретинологів (2017), найбільша частка випадків сліпоти та значного зниження зору в Європі спричинена саме ВМД. У подальших десятиліттях очікується зростання рівня захворюваності на ВМД у зв’язку зі збільшенням тривалості життя та старінням популяції.
Вікова макулярна дегенерація (ВМД) – хронічне прогресуюче захворювання, за якого уражається центральна ділянка сітківки (макула). В пацієнтів із ВМД погіршується центральний зір; периферичний зір не змінюється. Згідно з даними Європейської асоціації ретинологів (2017), найбільша частка випадків сліпоти та значного зниження зору в Європі спричинена саме ВМД. У подальших десятиліттях очікується зростання рівня захворюваності на ВМД у зв’язку зі збільшенням тривалості життя та старінням популяції.
Сьогодні 1 із 4 європейців віком >60 років хворіє на ВМД. Ураховуючи поширеність захворювання та дані статистики, йдеться про 34 млн хворих із ВМД у Європі. Вчені оцінюють, що до 2050 р. поширеність цього захворювання зросте на 20%. Значне зниження зору, спричинене пізньою стадією ВМД, суттєво погіршує якість життя та функціональні можливості пацієнта. Збільшення поширеності ВМД у майбутньому може стати серйозним медичним і соціально-економічним викликом для країн Європи.
Фактори ризику
Головними факторами ризику виникнення ВМД є вік, етнічність та генетичні фактори (втричі вищий ризик появи, якщо родич першої лінії хворіє на ВМД). Молекулярні генетичні дослідження визначили деякі генетичні фактори ризику, як-от CFH‑ген регуляції системи комплементу, ARMS2-ген, гени, асоційовані з метаболізмом ліпідів. Куріння значно збільшує ризик появи ВМД (приблизно вдвічі). Згідно з даними J. C. Khan, D. A. Thurlby та співавт. (2006), ризик розвитку ВМД в осіб, які не курили протягом останніх 20 років, прирівнюється до ризику розвитку в осіб, котрі ніколи не курили. Пацієнтам із ВМД рекомендується відмовитися від куріння сигарет як ключового фактора ризику. Гіпертонічна хвороба та серцево-судинні захворювання також можуть бути асоційовані з підвищеним ризиком появи ВМД, але результати клінічних досліджень є достатньо суперечливими. Додатковим фактором ризику може бути низький системний рівень антиоксидантів в організмі. Clemons і співавт. (2005) довели факт вищого ризику виникнення ВМД в осіб з вищим рівнем споживання холестерину та жирів. Певний час прийом аспірину пов’язували з ризиком появи ВМД, але метааналіз 10 наукових досліджень (Zhu W. et al., 2013) спростував зв’язок між прийомом аспірину та розвитком ВМД. Отже, етіологія захворювання є багатофакторною.
Класифікація ВМД
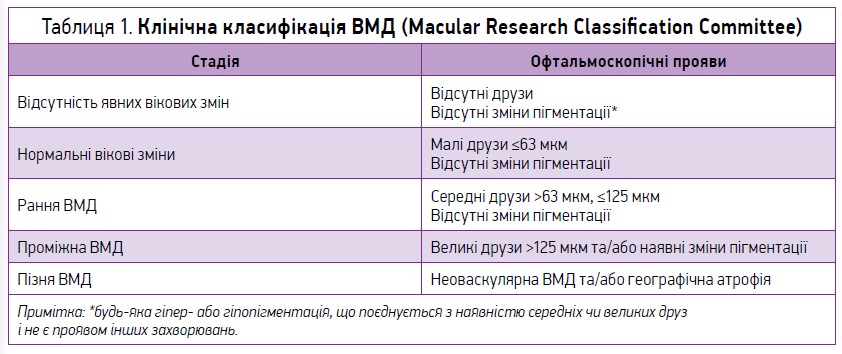
У практичній офтальмології ВМД традиційно розподіляють на суху (неексудативну) та вологу (ексудативну) форми. В 2013 р. Macular Research Classification Committee було запропоновано клінічну класифікацію ВМД, що базується на оцінці змін сітківки (при проведенні офтальмоскопії) у межах 2 діаметрів диска зорового нерва (DD) від центру fovea centralis в осіб віком >55 років (табл. 1).
Гістопатологія та патогенез ВМД
Гістопатологія та патогенез ВМД залишаються не цілком дослідженими. За вологої форми ВМД дисфункція та втрата хоріокапілярів спричиняють гіпоксію пігментного епітелію сітківки (ПЕС). Клітини ПЕС у стані гіпоксії продукують ангіогенні речовини, схожі на VEGF, що зумовлює формування хоріоїдальної неоваскуляризації (ХНВ) (Bhutto I., Lutty G., 2012). Суха форма ВМД супроводжується накопиченням токсичних продуктів у клітинах ПЕС, що спричиняє активацію системи комплементу. Згодом спостерігаються атрофія клітин ПЕС і вторинна втрата хоріокапілярів.
Роль системи комплементу в патогенезі ВМД
Система комплементу є частиною імунної системи, що захищає око від збудників інфекцій, бере участь у запальних реакціях, спричиняючи дегрануляцію мастоцитів, а також виконує цитотоксичну функцію. Рівень активності системи комплементу контролюється білками-регуляторами, які забезпечують її постійну готовність до імунної відповіді. Патологічну роль система комплементу має у разі порушення її регуляції, що підтверджено підвищеною концентрацією компонентів комплементу в крові та в складі друз у пацієнтів із ВМД.
Суха форма ВМД
Суха форма ВМД зустрічається у 80-90% випадків; офтальмоскопічно виявляються наявність друз, перерозподіл пігменту в макулярній ділянці, атрофія ПЕС і хоріокапілярів. Пацієнти з неексудативною ВМД скаржаться на поступове зниження зору протягом кількох місяців або років.
Друзи – позаклітинні відкладення еозинофільного матеріалу, що локалізуються між мембраною Бруха та ПЕС. Усі друзи можна класифікувати на тверді, м’які та зливні. Тверді друзи – дрібні, жовтого кольору, з чіткими межами осередку, у великій кількості створюють передумови для появи м’яких друз і тяжчих проявів ВМД. М’які друзи мають більший розмір і нечіткі межі (порівняно із твердими). Якщо вони зливаються між собою, то зазвичай зумовлюють друзоїдне відшарування ПЕС, атрофію шарів сітківки та хоріокапілярного шару. Зливні друзи спричиняють географічну атрофію ПЕС і можуть бути передумовою появи субретинальної неоваскуляризації. Залежно від розміру друзи розподіляють на малі (<63 мкм – тверді), середні (63-125 мкм), великі (>125 мкм – м’які). Друзи в кількості >5 (розміром >63 мкм) з наявністю осередків гіперплазії та ушкодження ПЕС пов’язані з високим ризиком прогресування захворювання до вологої форми (Kucharczuk J., Sikorski B., 2017).
Оптична когерентна томографія (ОКТ) сітківки виявляє локалізацію та характер патологічних змін у шарах сітківки. На ОКТ макулярної ділянки друзи виглядають як хвилястість або підвищення гіперрефлективного ПЕС з менш рефлективним матеріалом під ним. ОКТ дозволяє виявити стоншення сітківки, а у випадку географічної атрофії ПЕС – високо рефлективний сигнал хоріоїдеї, спричинений стоншенням шарів сітківки та гіпопігментацією ПЕС, що дає змогу сканувальним променям краще проникати в хоріоїдею.
Автофлюоресценція очного дна дає змогу отримати інформацію про метаболічний статус сітківки, що є індикатором стану ПЕС. Цей метод базується на здатності тканин флюоресціювати залежно від кількості накопиченого ліпофусцину (пігментні гранули), який збуджується при поглинанні хвиль певної довжини. Поєднання цих методів діагностики дозволяє отримати найповнішу інформацію щодо стану макулярної ділянки для моніторингу та прогнозування перебігу захворювання.
Автофлюоресценція очного дна корелює з гістопатологічною картиною захворювання. При географічній атрофії ПЕС втрачається ліпофусцин як основний флюорофор. Отже, під час проведення обстеження в ділянках атрофії ПЕС буде отримано знижену автофлюоресценцію. На відміну від фотографій очного дна автофлюоресценція очного дна дає змогу чіткіше окреслити межі атрофічних ділянок. Дослідження є неінвазивним і не потребує значних затрат часу.
Навколо ділянок атрофії ПЕС нерідко виявляється підвищена автофлюоресценція. The Fundus Autofluorescence in Age-Related Macular Degeneration Study Group (FAM-Study Group, 2007) запропонували класифікацію патернів аномально підвищеної автофлюоресценції навколо ділянок атрофії ПЕС. Дослідження продемонстрували, що в пацієнтів з географічною атрофією ПЕС за ВМД спостерігалися поява нових атрофічних ділянок або збільшення вже існуючої атрофії у зонах з підвищеною автофлюоресценцією. Запропоновано, що підвищена автофлюоресценція передує загибелі клітин і появі абсолютної скотоми.
Певні патерни підвищеної автофлюоресценції пов’язані з високим ризиком прогресування географічної атрофії ПЕС. Темпи прогресування географічної атрофії в очах зі стрічкоподібним і дифузним патернами були найвищими – 1,81 та 1,77 мм²/рік відповідно. В разі відсутності підвищеної автофлюоресценції темпи прогресування географічної атрофії становлять у середньому 0,38 мм²/рік.
Неексудативну форму ВМД необхідно диференціювати зі спадковими макулярними дистрофіями. Дистрофія Штаргардта успадковується за автосомно-рецесивним типом, маніфестує у першій-другій декаді життя; на пізніх стадіях характеризується фовеальною атрофією ПЕС, хоріокапілярів і нейросенсорного епітелію, оточених блідо-жовтими осередками. Вітеліформна дистрофія дорослих маніфестує у віці 30-50 років. При офтальмоскопії виявляються двобічні симетричні субфовеальні осередки жовтого кольору розміром ½-1 DD зорового нерва округлої або овальної форми. Захворювання прогресує, спричиняє розрив жовтого осередку, згодом – атрофію ПЕС.
Волога форма ВМД
Волога форма ВМД характеризується проростанням новоутворених судин із внутрішніх шарів хоріоїдеї крізь мембрану Бруха під ПЕС (тип 1, окультна неоваскуляризація) або в простір між ПЕС і нейросенсорним епітелієм сітківки (тип 2, класична неоваскуляризація). ХНВ супроводжується серозним відшаруванням нейросенсорного чи пігментного епітелію, набряком і крововиливами (субретинальними або інтраретинальними). Рецидивуючі субретинальні крововиливи зумовлюють формування фіброзу (дископодібного рубця). Варіантом вологої форми ВМД є ретинальна ангіоматозна проліферація. Пацієнт з вологою формою ВМД зазвичай скаржиться на гострий початок захворювання, різке зниження зору чи повну втрату центрального зору (спричинену раптовим виникненням субретинального крововиливу). Прямі лінії стають викривленими (метаморфопсії).
ОКТ‑ангіографія – новий неінвазивний метод дослідження в офтальмології, важливою перевагою якого є відсутність потреби вводити внутрішньовенно контрастні речовини. Завдяки збільшенню швидкості сканування та появі алгоритму декореляції амплітуди з розподіленням спектра (split-spectrum amplitude-decorrelation angiography, SSADA) на томограмах можна візуалізувати судини очного дна. Апарат оцінює кровоток у судинах завдяки реєстрації амплітуди оптичних променів, відбитих від еритроцитів. ОКТ‑ангіографія дозволяє віддиференціювати кровоносні судини від оточуючих тканин на всій глибині сканування, провести тривимірний аналіз судин сітківки, хоріоїдеї та сегментацію різних шарів для оцінки кожного судинного сплетення окремо.
За допомогою ОКТ‑ангіографії у пацієнта з вологою формою ВМД можна візуалізувати неоваскулярну мембрану, оцінити її мікросудинні властивості, локалізацію, визначити тип ХНВ. Також це обстеження дозволяє моніторувати зміну цих особливостей із часом або у відповідь на проведене лікування, зіставити активність захворювання та функціональні параметри.
Вологу форму ВМД необхідно диференціювати з міопічною ХНВ, неоваскуляризацією при ангіоїдних смугах, розривах хоріоїдеї, хронічною центральною серозною хоріоретинопатією.
Раннє виявлення та скерування до офтальмолога є критичним для збереження зорових функцій, оскільки швидкий початок лікування при вологій ВМД супроводжується успішнішими результатами.
Стратегія ведення пацієнта із сухою формою ВМД
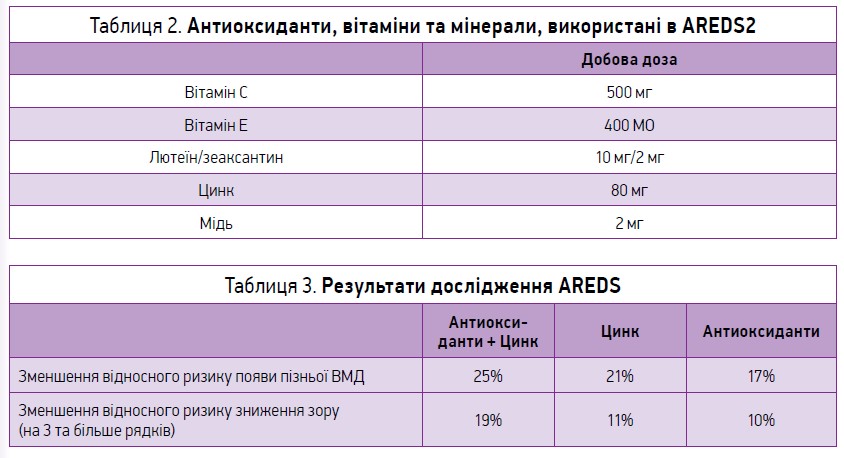
З 1992 по 2001 р. у США проведено масштабне рандомізоване плацебо-контрольоване подвійне сліпе випробування Age-Related Eye Disease Study (AREDS), в якому взяли участь 3640 осіб. У результаті цього дослідження виведено т. зв. формулу AREDS (вітамін С 500 мг, вітамін Е 400 МО, цинк 80 мг, каротиноїди 15 мг, мідь 2 мг), яка надавала змогу знизити ризик прогресування ВМД з подальшою втратою зору. Подальші дослідження продемонстрували, що бета-каротиноїди та куріння негативно впливають на організм, збільшуючи ризик появи раку легень. Нове дослідження AREDS2 було спрямоване на уточнення результатів AREDS, заміну каротиноїдів на лютеїн і зеаксантин, додавання омега‑3 поліненасичених жирних кислот (табл. 2). Використання комбінації антиоксидантів і мінералів не зменшувало прогресування ранньої ВМД до наступних стадій. Проте в AREDS та AREDS2 у пацієнтів з проміжною чи пізньою ВМД в одному оці відзначалося зниження прогресування захворювання на 25% при застосуванні формули на 5-му році дослідження (табл. 3). Також необхідно акцентувати увагу пацієнта на потребі модифікації факторів ризику, рекомендувати йому відмовитися від куріння, вживати в їжу зелені листові овочі (салат, шпинат), рибу (збагачену омега‑3 поліненасиченими жирними кислотами), зменшити споживання трансжирів; важливим є самоконтроль зору сіткою Амслера.
Збалансований склад, який відповідає сучасним стандартам, міститься у вітамінно-мінеральному комплексі СлезаВіт® (World Medicine Ophthalmics). До складу цього комплексу також входять антоціани чорниці – розчинні у воді рослинні пігменти, котрі мають антиоксидантні та протизапальні властивості, здатні протидіяти окислювальному стресу й стабілізувати вільні радикали. Дослідження довели, що антоціани сприяють регенерації, синтезу родопсину, покращують кровопостачання сітківки за рахунок корекції мікроциркуляції, а також транскапілярного обміну.
Стратегія ведення пацієнта з вологою формою ВМД
Першою лінією лікування пацієнта з вологою формою ВМД є інтравітреальні ін’єкції анти-VEGF‑препаратів. Лікування має бути розпочате якнайшвидше при встановленні наявності неоваскуляризації. Стандартними препаратами, що використовуються для лікування вологої форми ВМД та продемонстрували свою ефективність у клінічних дослідженнях, є афліберсепт, бевацизумаб і ранібізумаб. Лікування може здійснюватися за режимом pro re nata («на вимогу» – після виконання 3 завантажувальних ін’єкцій проводяться щомісячні моніторингові візити для визначення потреби інтравітреального введення) або за режимом treat and extend («лікуй та подовжуй» – після завантажувальної фази інтервали між оглядами, на кожному з яких проводиться ін’єкція, збільшують на 2 тиж).
Своєчасне виявлення ВМД
Американська асоціація офтальмологів рекомендує офтальмологічні огляди пацієнтів без факторів ризику й ознак ВМД з такою періодичністю:
- до 40 років: кожні 5-10 років;
- від 40-54 років: кожні 2-4 роки;
- від 55 до 64 років: кожні 1-3 роки;
- від 65 років: кожні 1-2 роки.
Якщо пацієнт раніше не обстежувався в офтальмолога, обов’язково необхідно пройти огляд у віці 40 років. Дуже часто пацієнти не помічають зниження зору одного ока, якщо на парному оці гострота зору все ще є високою. Проведення перевірки гостроти зору надасть змогу виявити такі випадки та своєчасно скерувати пацієнта до офтальмолога. Якщо в хворого вже виявлено ВМД або встановлено наявність факторів ризику цього захворювання, рішення щодо періодичності візитів ухвалюються офтальмологом індивідуально.
Висновки
Прогресування ВМД може значно погіршити якість життя пацієнта. Втрата центрального зору може спричинити неможливість керувати автомобілем, читати, розрізняти обличчя людей, а також зумовити травмування. Саме лікар загальної практики може першим розпізнати симптоми цього небезпечного захворювання та скерувати пацієнта до лікаря-офтальмолога. Раннє виявлення симптомів, скоординована діяльність лікаря загальної практики й офтальмолога дозволить своєчасно виявити та розпочати лікування, що може знизити ризик незворотної втрати зору, спричиненої ВМД.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 6 (499), 2021 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....