Саграда® – перший препарат прасугрелю в Україні
Подвійна антитромбоцитарна терапія (ПАТТ) є основою фармакотерапії, спрямованої на профілактику атеротромботичних ускладнень у пацієнтів із гострими коронарними синдромами (ГКС). ПАТТ також є стандартом лікування пацієнтів із ГКС, яким проводять черезшкірне коронарне втручання (ЧКВ).
ПАТТ складається з ацетилсаліцилової кислоти (АСК) й одного з інгібіторів тромбоцитарних рецепторів P2Y12 – клопідогрелю, тикагрелору чи прасугрелю. Донедавна українські лікарі мали змогу використовувати лише клопідогрель і тикагрелор. На початку 2021 року корпорація «Артеріум» представила перший в Україні препарат із молекулою прасугрель – Саграда® таблетки, вкриті плівковою оболонкою, по 10 мг. У клінічних дослідженнях у пацієнтів із ГКС, яким виконують ЧКВ, прасугрель продемонстрував кращі результати порівняно з клопідогрелем, тому в сучасних настановах таким хворим рекомендований саме прасугрель. Окрім того, останні дані, отримані в умовах реальної клінічної практики, свідчать про переваги прасугрелю і над тикагрелором. Важливо, що Саграда® має доведену біоеквівалентність оригінальному прасугрелю Efient®/Effient® і виготовляється в Європейському Союзі.
Дослідження TRITON-TIMI 38
Наразі зареєстрованим показанням до призначення Сагради є комбінована терапія з АСК для запобігання атеротромботичним подіям у дорослих пацієнтів із ГКС – нестабільною стенокардією, інфарктом міокарда (ІМ) з елевацією (STEMI) та без елевації сегмента ST (NSTEMI), яким проводиться первинне чи відстрочене ЧКВ.
Ефективність і безпеку прасугрелю в цієї категорії хворих вивчали в багатоцентровому рандомізованому подвійному сліпому дослідженні III фази TRITON-TIMI 38 (TRial to assess Improvement in Therapeutic Outcomes by optimizing platelet InhibitioN with Prasugrel-Thrombolysis In Myocardial Infarction). Із-поміж включених у дослідження 13 608 пацієнтів 3534 становили хворі зi STEMI, 10 074 пацієнти мали нестабільну стенокардію чи NSTEMI. Пацієнтів зі STEMI включали в дослідження протягом 12 год від появи симптомів (первинне ЧКВ) або в інтервалі від 12 год до 14 днів від початку симптомів (відстрочене ЧКВ). У пацієнтів із нестабільною стенокардією чи NSTEMI симптоми ішемії мали зберігатися ≥10 хв за умови їх виникнення протягом 72 год до рандомізації. Також умовою включення хворих із NSTEMI була оцінка ≥3 балів за шкалою TIMI (Thrombolysis In Myocardial Infarction), або наявність відхилення сегмента ST на ≥1 мм, або підвищені біомаркери некрозу міокарда в периферичній крові. Отже, включені в дослідження пацієнти з ГКС без елевації сегмента ST належали до категорії помірного та високого ризику.
Оскільки TRITON-TIMI 38 було сплановано як дослідження пацієнтів із ГКС, у яких виконували ЧКВ, обов’язковою була наявність інформації про коронарну анатомію (а отже, про те, чи є пацієнт кандидатом на лікування методом ЧКВ). Основними критеріями виключення були лікування будь-яким тієнопіридином у період до 5 днів перед рандомізацією, кардіогенний шок, нещодавня фібринолітична терапія, геморагічний діатез, ішемічний інсульт у попередні 3 міс.
Перед виконанням ЧКВ пацієнтів рандомізували на групи з навантажувальними дозами прасугрелю 60 мг або клопідогрелю 300 мг. Прасугрель призначали пацієнтам, які раніше не приймали інгібіторів рецепторів P2Y12. Після стентування пацієнти отримували підтримувальні дози препаратів: прасугрель 10 мг або клопідогрель 75 мг/добу протягом 6-15 міс. Усі пацієнти також отримували АСК у дозі 75-162 мг/добу.
Ефективність
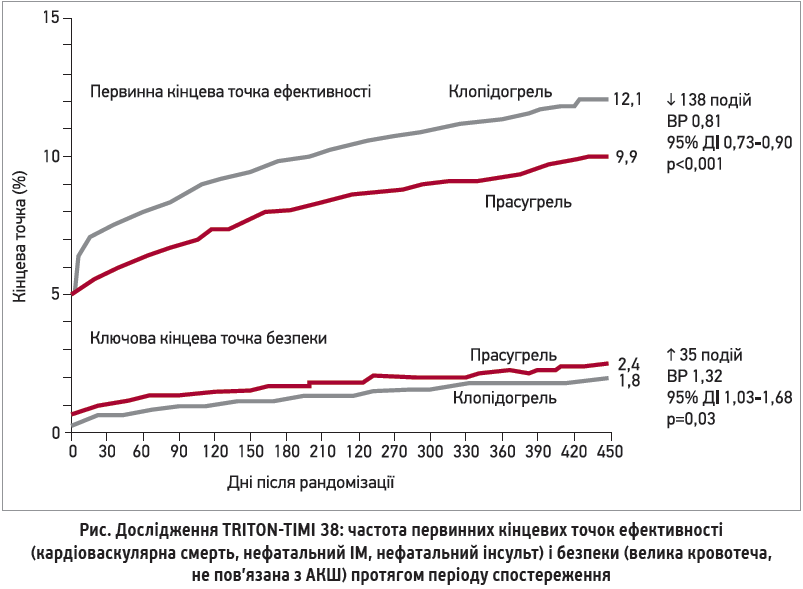
Первинною кінцевою точкою для оцінки ефективності був час до розвитку будь-якої з таких подій: кардіоваскулярна смерть, нефатальний ІМ або нефатальний інсульт. Серед вторинних кінцевих точок варто виділити оцінку частоти екстреної реваскуляризації та розвитку тромбозу стента за весь період спостереження. Результати показали, що після ЧКВ прийом прасугрелю статистично значущо зменшував частоту первинної комбінованої кінцевої точки на 19% порівняно з клопідогрелем (відносний ризик (ВР) 0,81; p<0,001) (рис.). У пацієнтів із нестабільною стенокардією чи NSTEMI прасугрель знижував частоту первинної точки на 18% (ВР 0,82; p=0,002), у пацієнтів зі STEMI – на 21% (ВР 0,79; p=0,022).
Важливо, що зниження первинної кінцевої точки при лікуванні прасугрелем досягалося вже на 3-й день і зберігалося протягом усього періоду спостереження.
Перевага прасугрелю над клопідогрелем спостерігалася в усіх підгрупах: у чоловіків і жінок, у хворих віком <65 і ≥65 років, у пацієнтів із цукровим діабетом (ЦД) і без ЦД, за використання цільнометалевих стентів і стентів із лікарських покриттям, в осіб із кліренсом креатиніну >60 і ≥60 мл/хв, за супутнього застосування інгібіторів глікопротеїнових рецепторів IIb/IIIa та без них. При цьому найбільше зниження частоти первинної кінцевої точки при лікуванні прасугрелем – на 30% – було досягнуто в пацієнтів із ЦД.
Безпека
Безпеку в дослідженні TRITON-TIMI 38 оцінювали за частотою великих, малих і загрозливих для життя (за класифікацією TIMI) кровотеч, не пов’язаних з аортокоронарним шунтуванням (АКШ).
У загальній популяції пацієнтів із ГКС ризик кровотеч у групі прасугрелю був вищим, аніж у групі клопідогрелю (великі кровотечі – 2,4 vs 1,8%; загрозливі для життя – 1,4 vs 0,9%; великі + малі – 5,0 vs 3,8%). З огляду на потужнішу антитромбоцитарну дію прасугрелю цей результат був очікуваним. Утім, за даними 15-місячного спостереження, співвідношення ефективності та безпеки терапії прасугрелем суттєво відрізнялося в окремих підгрупах пацієнтів. Так, ризик кровотеч був найвищим у трьох підгрупах: у хворих з інсультом або транзиторною ішемічною атакою (ТІА) в анамнезі, в пацієнтів віком ≥75 років і в осіб із масою тіла <60 кг. При виключенні з аналізу пацієнтів цих трьох підгруп у решти – переважної більшості учасників (80%) – статистично значуща різниця за частотою великих кровотеч між групами прасугрелю та клопідогрелю була відсутня (p=0,17). У цих 80% пацієнтів терапія прасугрелем асоціювалася зі зниженням комбінованої кінцевої точки (кардіоваскулярна смерть, нефатальний ІМ, нефатальний інсульт, нефатальна велика кровотеча) на 20% (p<0,001).
Прасугрель у реальній клінічній практиці
Важливу інформацію, що допомагає лікарям під час прийняття клінічних рішень, надають дані повсякденної практики.
У 2018 році I. Olier і співавт. опублікували результати аналізу великого реєстру, що включив дані 89 067 пацієнтів зі STEMI, котрим у 2007-2014 роках виконували первинне ЧКВ у різних медичних центрах Англії й Уельсу. Головною метою дослідження була оцінка 30-денної й однорічної смертності після ЧКВ у 3 групах пацієнтів – лікування клопідогрелем, тикагрелором або прасугрелем. Результати показали, що призначення прасугрелю асоціювалося зі значно нижчою смертністю, ніж застосування клопідогрелю, як через 30 днів (ВР 0,87; р=0,014), так і через рік після процедури (ВР 0,89; p=0,011). Тикагрелор порівняно з клопідогрелем не продемонстрував статистично значущих відмінностей за показником 30-денної (ВР 1,07; p=0,237) й однорічної смертності (ВР 1,058; p=0,247). При цьому призначення тикагрелору порівняно з прасугрелем асоціювалося зі статистично значущо вищими показниками смертності через 30 днів (ВР 1,22; p=0,020) і через рік після ЧКВ (ВР 1,19; p=0,01).
Заслуговують на увагу також дані одноцентрового реєстру зі США, результати якого були опубліковані M. Khayata та співавт. у 2017 році. Дослідники виконали ретроспективний аналіз даних усіх пацієнтів, госпіталізованих до клініки Cleveland Clinic Akron General у 2011-2016 роках, які ввійшли в Національну кардіоваскулярну базу даних. Усім пацієнтам було встановлено діагноз ГКС, проведено ЧКВ і призначена ПАТТ, другим компонентом якої був клопідогрель, тикагрелор або прасугрель. Через 24 год після призначення інгібітора P2Y12-рецепторів оцінювали частоту несприятливих подій (кардіогенний шок, фібриляція передсердь, фібриляція шлуночків, шлуночкова тахікардія, серцева недостатність, кровотеча, необхідність у штучній вентиляції легенів). Разом до остаточного аналізу ввійшли 1388 хворих. У групі пацієнтів, які отримували прасугрель (n=244), протягом 24 год після прийому препарату спостерігалася найнижча загальна частота несприятливих подій (р=0,049), а також нижча частота кровотеч (p=0,028) і серцевої недостатності (p=0,002). Найвищу частоту кровотеч і серцевої недостатності відзначили в групі клопідогрелю (n=1012).
У дослідженні A. Krishnamurthy та співавт. (2019) порівняли ефективність клопідогрелю, тикагрелору та прасугрелю в пацієнтів зі STEMI, котрим виконували первинне ЧКВ у м. Лідс (Велика Британія) в періоди із січня 2009 по грудень 2011 року та протягом 2013 року. Прасугрель (n=1244) асоціювався з нижчими показниками 30-денної смертності (ВР 0,53), 12-місячної смертності (ВР 0,55) та 12-місячного ризику ІМ (ВР 0,63) порівняно з клопідогрелем (n=1648). Як зазначають автори, ще важливішим є те, що прасугрель забезпечував нижчу 30-денну смертність (ВР 0,51) порівняно з тикагрелором (n=811). Тикагрелор знижував частоту ІМ порівняно з клопідогрелем, але не з прасугрелем. За частотою кровотеч, розрахованою з поправкою на супутні фактори, групи статистично не відрізнялися.
Прасугрель у клінічних рекомендаціях
У рекомендаціях із ведення пацієнтів із гострим STEMI Європейського товариства кардіологів (ESC, 2017) зазначено, що при виконанні первинної ЧКВ інгібіторами P2Y12, яким варто віддавати перевагу, є прасугрель і тикагрелор. Ці препарати мають швидший початок дії, потужніший антитромбоцитарний ефект і значніше покращують клінічні результати порівняно з клопідогрелем. Прасугрель протипоказаний пацієнтам з інсультом/ТІА в анамнезі та загалом не рекомендований хворим віком ≥75 років або з масою тіла <60 кг (але може використовуватися в цих категорій пацієнтів у підтримувальній дозі 5 мг). Прасугрель, як і тикагрелор, не варто призначати пацієнтам із геморагічним інсультом в анамнезі, хворим на пероральних антикоагулянтах і пацієнтам із помірною чи тяжкою хворобою печінки. Тривалість ПАТТ (АСК + прасугрель) після ЧКВ має становити до 12 міс.
Для пацієнтів із ГКС без елевації сегмента ST рекомендованим стандартом лікування є ПАТТ, яка включає АСК і потужний інгібітор рецепторів Р2Y12 – тикагрелор або прасугрель (ESC, 2020) (табл.). Клопідогрель характеризується менш потужним і варіабельним антитромбоцитарним ефектом і має використовуватися лише у випадках, коли тикагрелор або прасугрель недоступні, не переносяться чи протипоказані.
Дані щодо прямого порівняння тикагрелору та прасугрелю отримано у відкритому рандомізованому дослідженні ISAR-REACT 5. У випробуванні взяли участь 4018 пацієнтів із ГКС (STEMI та ГКС без елевації сегмента ST), яких обстежували для подальшого проведення ЧКВ. Результати показали, що лікування прасугрелем порівняно з тикагрелором значно знижує частоту комбінованої кінцевої точки, котра включала смерть, ІМ та інсульт (6,9 vs 9,3%; р=0,006), без підвищення геморагічних ускладнень (4,8 vs 5,4%, р=0,46). Також у групі тикагрелору більше пацієнтів припинили лікування через побічні ефекти. Оскільки в дослідженні ISAR-REACT 5 ЧКВ було виконано >80% пацієнтів, прасугрель варто вважати кращим інгібітором рецепторів P2Y12 у пацієнтів із ГКС без елевації сегмента ST, яким проводять ЧКВ (ESC, 2020). У настановах ESC зазначено, що перевага прасугрелю над тикагрелором і клопідогрелем може бути пов’язана з покращенням ендотеліальної функції.
Отже, прасугрель є важливим компонентом сучасної антитромбоцитарної терапії, здатним зробити суттєвий внесок у зниження частоти таких кардіоваскулярних подій, як кардіоваскулярна смерть, ІМ та інсульт. Порівняно із застосуванням клопідогрелю та тикагрелору лікування прасугрелем у складі ПАТТ асоціюється з кращими результатами в пацієнтів із ГКС, яким виконують ЧКВ. Дані, отримані в умовах реальної практики, свідчать, що прасугрель має оптимальну ефективність, безпеку і навіть більший позитивний вплив на прогноз, аніж у клінічних дослідженнях.
Експертна думка
О. Й. Жарінов, д.м.н., професор, завідувач кафедри функціональної діагностики Національного університету охорони здоров’я України ім. П. Л. Шупика (м. Київ)
 – ПАТТ є одним із ключових і водночас суперечливих аспектів ведення пацієнтів із ГКС. Ера ПАТТ у випадку ГКС розпочалася ще 20 років тому з отриманням результатів дослідження CURE, в якому додавання клопідогрелю до стандартної терапії (котра включала АСК) значно знижувало ризик розвитку ішемічних ускладнень у пацієнтів із ГКС без елевації сегмента ST. Потім стало зрозумілим, що терапія, випробувана в дослідженні CURE (АСК + клопідогрель), поступається лікуванню, котре включає АСК у поєднанні з новітніми й потужнішими антиагрегантами, як-от прасугрель. У прямому порівняльному дослідженні TRITON-TIMI 38 із залученням понад 13 тис. пацієнтів із ГКС, яким проводили планове ЧКВ, використання потужнішого другого (на додаток до АСК) антиагреганта прасугрелю дало змогу знизити ризик кінцевих точок (кардіоваскулярна смерть, ІМ, інсульт) на 19% порівняно з традиційним на тоді клопідогрелем. Важливим аспектом, який вплинув на подальшу історію ведення пацієнтів, стали дані про те, що використання прасугрелю замість клопідогрелю більш ніж удвічі знижувало ризик тромбозу стента за тривалого спостереження. Це особливо важливо для пацієнтів із перенесеними раніше тромбозами стента, а також для хворих зі «злоякісним» перебігом атеросклерозу та потребою в нових реваскуляризаційних втручаннях. Заслуговують на увагу нещодавно оприлюднені дані німецького дослідження ISAR-REACT 5, у якому безпосередньо порівнювали тикагрелор і прасугрель при ГКС. Виявилося, що прасугрель забезпечує значно більше зниження ризику первинної кінцевої точки – смерті, ІМ та інсульту, не підвищуючи частоти кровотеч.
– ПАТТ є одним із ключових і водночас суперечливих аспектів ведення пацієнтів із ГКС. Ера ПАТТ у випадку ГКС розпочалася ще 20 років тому з отриманням результатів дослідження CURE, в якому додавання клопідогрелю до стандартної терапії (котра включала АСК) значно знижувало ризик розвитку ішемічних ускладнень у пацієнтів із ГКС без елевації сегмента ST. Потім стало зрозумілим, що терапія, випробувана в дослідженні CURE (АСК + клопідогрель), поступається лікуванню, котре включає АСК у поєднанні з новітніми й потужнішими антиагрегантами, як-от прасугрель. У прямому порівняльному дослідженні TRITON-TIMI 38 із залученням понад 13 тис. пацієнтів із ГКС, яким проводили планове ЧКВ, використання потужнішого другого (на додаток до АСК) антиагреганта прасугрелю дало змогу знизити ризик кінцевих точок (кардіоваскулярна смерть, ІМ, інсульт) на 19% порівняно з традиційним на тоді клопідогрелем. Важливим аспектом, який вплинув на подальшу історію ведення пацієнтів, стали дані про те, що використання прасугрелю замість клопідогрелю більш ніж удвічі знижувало ризик тромбозу стента за тривалого спостереження. Це особливо важливо для пацієнтів із перенесеними раніше тромбозами стента, а також для хворих зі «злоякісним» перебігом атеросклерозу та потребою в нових реваскуляризаційних втручаннях. Заслуговують на увагу нещодавно оприлюднені дані німецького дослідження ISAR-REACT 5, у якому безпосередньо порівнювали тикагрелор і прасугрель при ГКС. Виявилося, що прасугрель забезпечує значно більше зниження ризику первинної кінцевої точки – смерті, ІМ та інсульту, не підвищуючи частоти кровотеч.
Отже, з появою на фармацевтичному ринку України прасугрелю пацієнти з ГКС, у яких здійснюються реваскуляризаційні втручання, отримують додаткові можливості захисту від майбутніх судинних подій.
А. В. Хохлов, к.м.н., завідувач відділення ендоваскулярної хірургії та ангіографії ДУ «Інститут серця МОЗ України» (м. Київ)
 – Світовий досвід свідчить, що рання госпіталізація та реваскуляризація міокарда істотно зменшують смертність і частоту ускладнень у хворих на ГКС. Останніми роками результати коронарного стентування вдалося покращити завдяки FFR (fractional flow resereve – фракційний резерв кровотоку) – методу, що застосовується при коронарографії для вимірювання різниці тиску в стенозованій коронарній артерії з метою визначення ймовірності ішемії міокарда. Порівняно зі стентуванням на основі візуальної оцінки ангіографії використання FFR значно знижує ризик виникнення великих несприятливих кардіоваскулярних подій.
– Світовий досвід свідчить, що рання госпіталізація та реваскуляризація міокарда істотно зменшують смертність і частоту ускладнень у хворих на ГКС. Останніми роками результати коронарного стентування вдалося покращити завдяки FFR (fractional flow resereve – фракційний резерв кровотоку) – методу, що застосовується при коронарографії для вимірювання різниці тиску в стенозованій коронарній артерії з метою визначення ймовірності ішемії міокарда. Порівняно зі стентуванням на основі візуальної оцінки ангіографії використання FFR значно знижує ризик виникнення великих несприятливих кардіоваскулярних подій.
До обов’язкового медичного супроводу стентування коронарних артерій, окрім гепарину, входить ПАТТ (АСК + клопідогрель, тикагрелор або прасугрель). Сьогодні у фармакологічному арсеналі українських ендоваскулярних хірургів з’явився потужний антитромбоцитарний препарат, тієнопіридин третього покоління прасугрель, який має чіткі клінічні переваги. Після прийому першої дози прасугрель забезпечує швидкий антиагрегантний ефект (пригнічення активності >50% тромбоцитів уже за 1 год порівняно з 2-6 год для клопідогрелю), і його ефективність не залежить від генетичних поліморфізмів (які впливають на абсорбцію й метаболізм клопідогрелю). На відміну від тикагрелору важливою перевагою прасугрелю є низький потенціал лікарських взаємодій; зокрема, він може застосовуватися з інгібіторами протонної помпи без зменшення антитромбоцитарного ефекту. Слід зазначити, що навантажувальна доза тикагрелору підвищує плазмові рівні аденозину, що може впливати на оцінку FFR, оскільки останній ґрунтується на аденозин-індукованій гіперемії. У цьому аспекті прасугрель також має переваги, оскільки він практично не змінює FFR.
Загалом поява прасугрелю в Україні була довгоочікуваною, цей препарат, безперечно, займе свою нішу у веденні пацієнтів із ГКС, яким проводять коронарне стентування.
Список літератури знаходиться в редакції.
Підготував Олександр Гладкий
Медична газета «Здоров’я України 21 сторіччя» № 7 (500), 2021 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Однією із найвагоміших знахідок із часу відкриття дигіталісу Нобелівський комітет назвав синтез і дослідження β-блокаторів, які зараз мають провідні стабільні позиції у лікуванні більшості серцево-судинних хвороб (ішемічна хвороба серця – стенокардія, гострий коронарний синдром, інфаркт міокарда, артеріальна гіпертензія, серцева недостатність, тахіаритмії) (Радченко О.М., 2010). Це епохальне відкриття зроблено під керівництвом британського фармаколога Джеймса Блека (James Whyte Black), який отримав за нього Нобелівську премію в 1988 році. ...