Ведення пацієнтів із гострим коронарним синдромом
Торік вийшли у світ рекомендації Національного інституту охорони здоров’я та вдосконалення медичної допомоги Великої Британії (NICE) щодо ведення пацієнтів із гострим коронарним синдромом (ГКС). Настанова охоплює раннє та довгострокове (реабілітаційне) лікування ГКС, що включає інфаркт міокарда з підйомом сегмента ST (STEMI), інфаркт міокарда без підйому сегмента ST (NSTEMI) та нестабільну стенокардію. Мета розробки рекомендацій – допомогти лікарям при прийнятті клінічних рішень з огляду на індивідуальні особливості, потреби й уподобання хворих, а також поліпшити виживання та якість їхнього життя.
Раннє лікування пацієнтів зі STEMI
Клінічна оцінка
В осіб після перенесеного STEMI, незалежно від віку, етнічної належності та статі, необхідно негайно оцінити можливість проведення реперфузійної терапії, первинного черезшкірного коронарного втручання (ЧКВ) або фібринолізу (NICE, 2013). В осіб зі STEMI потрібно якомога швидше провести реперфузійну терапію (чи первинне ЧКВ / фібриноліз) за наявності такої можливості (NICE, 2013).
Початкова медикаментозна терапія
Пацієнтам зі STEMI рекомендоване застосування ацетилсаліцилової кислоти (АСК) у навантажувальній дозі 300 мг якомога швидше, якщо немає підтвердженої алергічної реакції на препарат (NICE, 2010). Хворим на STEMI, у котрих заплановане проведення первинного ЧКВ, рутинне використання інгібіторів глікопротеїну IIb/IIIa або фібринолітичних засобів недоцільне (NICE, 2013).
Проведення КАГ із подальшим первинним ЧКВ
У пацієнтів зі STEMI рекомендоване виконання КАГ із подальшим первинним ЧКВ у разі наявності показань, якщо (NICE, 2013):
- хворий госпіталізований протягом 12 год із часу появи симптомів та
- первинне ЧКВ проводять упродовж 120 хв із моменту, коли було можливе виконання фібринолізу.
В осіб із перенесеним STEMI та кардіогенним шоком, яких госпіталізовано протягом 12 год із моменту появи симптомів STEMI, слід розглянути проведення КАГ із подальшим первинним ЧКВ, якщо є показання (NICE, 2013). У хворих на STEMI, що поступили до лікарні через більш ніж 12 год після появи симптомів, за наявності доказів, які підтверджують збереження ішемії міокарда, можливе виконання КАГ із подальшим первинним ЧКВ, якщо є показання (NICE, 2013). Окрім того, слід розглянути доцільність проведення КАГ із метою коронарної реваскуляризації, якщо таку показано, у пацієнтів зі STEMI, госпіталізованих більш ніж через 12 год після виникнення симптомів, у котрих мав місце кардіогенний шок або були наявні ознаки його розвитку (NICE, 2013).
Потрібно розглянути можливість проведення КАГ через радіальний (а не стегновий) доступ (із подальшим первинним ЧКВ, якщо є показання) (NICE, 2013).
Подвійна антитромбоцитарна терапія в осіб зі STEMI після первинного ЧКВ
Згідно з настановою NICE (2020), пацієнтам зі STEMI, що перенесли первинне ЧКВ, рекомендовано призначити прасугрел (у підтримувальній дозі) як частину подвійної антитромбоцитарної терапії (ПАТТ) з АСК, якщо вони не приймають пероральний антикоагулянт. Якщо в осіб віком ≥75 років ризик кровотечі, пов’язаний із лікуванням прасугрелем, перевищує його ефективність, слід розглянути застосування тікагрелору або клопідогрелю як альтернативних препаратів. Клопідогрель рекомендований у складі ПАТТ з АСК, якщо хворі STEMI вже приймають пероральний антикоагулянт.
Антитромбінова терапія у пацієнтів при проведенні первинного ЧКВ
В осіб зі STEMI при виконанні первинного ЧКВ через радіальний доступ рекомендований нефракціонований гепарин (НФГ) з ургентним використанням інгібітора глікопротеїну IIb/IIIa у поєднанні з ПАТТ (NICE, 2020). Питання щодо застосування бівалірудину з інгібітором глікопротеїну IIb/IIIa у комбінації з ПАТТ слід розглянути у пацієнтів зі STEMI при проведенні первинного ЧКВ, коли необхідний стегновий доступ. Згідно з настановою NICE (2020), використання бівалірудину із прасугрелем та АСК не рекомендоване.
Первинне ЧКВ із повною реваскуляризацією або лише судини-винуватця у пацієнтів зі STEMI
В осіб зі STEMI та ішемічною хворобою серця із багатосудинним ураженням коронарних артерій без кардіогенного шоку варто розглянути проведення повної реваскуляризації за допомогою ЧКВ; бажано зробити це під час першої госпіталізації (NICE, 2020). У пацієнтів зі STEMI, ішемічною хворобою серця із багатосудинним ураженням коронарного русла та кардіогенним шоком доцільною може виявитися реваскуляризація лише судини-винуватця під час первинного ЧКВ (NICE, 2020).
Видалення тромбу та використання елютинг-стентів при первинному ЧКВ
Необхідно розглянути екстракцію тромбу при виконанні первинного ЧКВ в осіб зі STEMI (NICE, 2013). При проведенні процедури не рекомендовано використовувати механічне видалення тромбу (NICE, 2013).
За наявності показань для проведення стентування хворим на STEMI, у котрих виконують реваскуляризацію шляхом первинного ЧКВ, рекомендоване застосування стенту з лікарським покриттям (NICE, 2020).
Фібриноліз
У пацієнтів зі STEMI, госпіталізованих протягом 12 год із моменту появи симптомів, слід розглянути проведення фібринолізу, якщо первинне ЧКВ неможливе впродовж 120 хв із часу, коли міг бути виконаний фібриноліз (NICE, 2013). Під час процедури фібринолізу доцільним є одночасне застосування антитромбінової терапії (NICE, 2013).
Хворим на STEMI через 60‑90 хв після фібринолізу необхідно провести електрокардіографію (ЕКГ). Для осіб, які мають резидуальну ішемію з підйомом сегмента ST, що свідчить про невдалу коронарну реперфузію, рекомендовано (NICE, 2013):
- провести негайну КАГ із подальшим проведенням ЧКВ за наявності показань;
- не повторювати фібринолітичну терапію.
Якщо у пацієнтів зі STEMI після фібринолізу спостерігається рецидив ішемії міокарда, потрібно негайно звернутися по допомогу до фахівця-кардіолога та, у разі необхідності, провести КАГ із подальшим ЧКВ за наявності показань (NICE, 2013). У хворих на STEMI, які є клінічно стабільними після успішного фібринолізу, варто розглянути можливість виконання КАГ під час тієї самої госпіталізації (NICE, 2013).
Лікування осіб зі STEMI, які не отримують ЧКВ
У пацієнтів зі STEMI, що отримують ЧКВ та не мають високого ризику кровотечі, рекомендоване застосування тікагрелору як частини ПАТТ із АСК (NICE, 2020). Використання клопідогрелю у складі ПАТТ із АСК або лише АСК слід розглянути в осіб зі STEMI, які не отримують ЧКВ, за наявності в них високої імовірності кровотечі (NICE, 2020). Хворим на STEMI за відсутності показань для проведення реперфузійної терапії доцільно призначити медикаментозне лікування (NICE, 2013).
Рання терапія пацієнтів із NSTEMI та нестабільною стенокардією
Початкова фармакотерапія
Усім хворим на нестабільну стенокардію або NSTEMI доцільно якомога швидше призначити АСК на необмежений час, якщо немає протипоказань, пов’язаних із ризиком кровотечі або гіперчутливістю до АСК (NICE, 2010). У даній когорті пацієнтів рекомендовано якомога швидше прийняти АСК в одноразовій навантажувальній дозі 300 мг, якщо немає підтвердженої алергічної реакції на препарат (NICE, 2010).
Фондапаринукс слід використовувати особам із нестабільною стенокардією або NSTEMI без високого ризику кровотечі, якщо вони не отримують ургентної КАГ (NICE, 2020). НФГ із корегуванням дози під контролем функції згортання крові необхідно розглянути як альтернативу фондапаринуксу в пацієнтів із нестабільною стенокардією або NSTEMI та значним порушенням функції нирок (рівень сироваткового креатиніну >265 мкмоль/л) (NICE, 2010). Клінічне рішення при виборі антитромбінової терапії та дозування має бути ретельно зваженим у хворих на нестабільну стенокардію чи NSTEMI з високим ризиком кровотеч, пов’язаних із будь-якою з цих ознак (NICE, 2010):
- похилий вік;
- відомі кровотечі;
- порушення функції нирок;
- низька вага.
ПАТТ не рекомендовано особам із болем за грудиною до встановлення діагнозу нестабільної стенокардії або NSTEMI (NICE, 2020).
Оцінка ризику
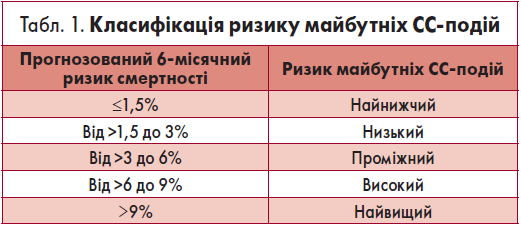
Щойно буде встановлений діагноз нестабільної стенокардії чи NSTEMI та призначено АСК й антитромбінову терапію, необхідно оцінити індивідуальний ризик майбутніх серцево-судинних (СС) ускладнень. Для цього використовують спеціальну систему оцінки, яка дозволяє прогнозувати 6-місячний ризик смертності, наприклад Глобальний реєстр гострих коронарних подій (GRACE) (NICE, 2010).
Оцінка ризику передбачає (NICE, 2010):
- вивчення повного клінічного анамнезу, включно з віком, перенесеним інфарктом міокарда (ІМ) та попереднім ЧКВ або аортокоронарним шунтуванням (АКШ);
- медичний огляд: вимірювання артеріального тиску, частоти серцевих скорочень тощо;
- ЕКГ у 12 відведеннях у спокої, особливо для виявлення динамічних або нестабільних патернів, що вказують на ішемію міокарда;
- аналізи крові (рівень тропоніну I або Т, креатиніну, глюкози та гемоглобіну).
Отримані дані необхідно занести до медичної картки хворого (NICE, 2010). Ці результати слід використовувати при прийнятті клінічних рішень і врівноважувати користь від лікування та ризики, пов’язані з несприятливими явищами, на основі проведеної оцінки (NICE, 2010). Показники прогнозованого 6-місячного ризику смертності стануть у пригоді для класифікації ризику майбутніх СС-подій (табл. 1) (NICE, 2010). Категорії ризику наведені відповідно до бази даних Національного аудиторського проєкту ішемії міокарда (MINAP).
Виконання КАГ із подальшим ЧКВ
Особам із нестабільною стенокардією або NSTEMI, клінічний стан яких нестабільний, рекомендовано провести ургентну КАГ (NICE, 2020). Варто розглянути можливість КАГ (із подальшим ЧКВ за наявності показань) протягом 72 год після першої госпіталізації у пацієнтів із нестабільною стенокардією чи NSTEMI та проміжним або високим ризиком розвитку СС-подій (прогнозованим 6-місячним ризиком смертності >3%), у котрих немає протипоказань для виконання КАГ, як-от активна кровотеча або супутня патологія.
Переваги та ризики раннього інвазивного лікування порівняно з консервативним зазначені у таблиці 2 (NICE, 2020).
Можливість проведення КАГ (із подальшим ЧКВ за наявності показань) доцільно розглянути у хворих на нестабільну стенокардію або NSTEMI, яких спершу оцінюють як тих, що мають низький ризик СС-ускладнень (прогнозований 6-місячний ризик смертності ≤3%), якщо згодом виникла ішемія (NICE, 2020). Слід враховувати той факт, що у деяких молодих осіб із низьким ризиком смерті через шість місяців імовірність розвитку СС-подій досі лишатиметься високою, та вони можуть отримати користь від ранньої КАГ (NICE, 2020).
Пацієнтам із нестабільною стенокардією або NSTEMI, які перенесли ЧКВ, рекомендоване системне застосування НФГ незалежно від того, чи отримували вони фондапаринукс.
Особам із нестабільною стенокардією або NSTEMI, яким проводять КАГ, рекомендовано (NICE, 2020):
- Використання прасугрелу або тікагрелору як частини ПАТТ з АСК за відсутності окремих показань для продовження пероральної антикоагулянтної терапії; прасугрел можна застосовувати у підтримувальній дозі лише після визначення анатомії коронарних артерій та призначення ЧКВ. В осіб віком ≥75 років слід зважити, чи не перевищує ризик кровотечі, пов’язаний із лікуванням прасугрелем, його ефективність.
- Призначення клопідогрелю у складі ПАТТ з АСК за наявності окремих показань для продовження пероральної антикоагулянтної терапії.
Якщо особам із нестабільною стенокардією або NSTEMI, яким проводять реваскуляризацію за допомогою ЧКВ, показане стентування, доцільно розглянути застосування елютинг-стенту (NICE, 2020).
Терапія за відсутності показань для проведення ЧКВ
Необхідно розглянути можливість консервативного лікування без ранньої КАГ у пацієнтів із нестабільною стенокардією або NSTEMI, які мають низький ризик розвитку СС-подій (прогнозований 6-місячний ризик смертності ≤3%) (NICE, 2020). Використання тікагрелору як частини ПАТТ з АСК може виявитися доцільним у даній когорті хворих без високого ризику кровотечі, якщо показання для проведення ЧКВ відсутні (NICE, 2020). В осіб із нестабільною стенокардією чи NSTEMI та високим ризиком кровотечі, в яких немає показань для виконання ЧКВ, рекомендоване лікування клопідогрелем у межах ПАТТ з АСК або АСК окремо (NICE, 2020).
Рекомендації щодо вибору стратегій лікування
Пацієнти із нестабільною стенокардією або NSTEMI мають бути обізнані щодо переваг та ризиків пропонованого лікування, щоб зробити обґрунтований вибір. Інформація повинна відповідати індивідуальному ризику щодо майбутніх СС-подій та супутніх захворювань (NICE, 2020).
Під час консультування хворих цієї категорії щодо визначення стратегії реваскуляризації (ЧКВ або АКШ) слід враховувати дані КАГ, коморбідні стани, а також користь та ризики, пов’язані з кожним втручанням (NICE, 2010). Якщо роль реваскуляризації або стратегія процедури незрозуміла, має бути прийняте спільне клінічне рішення із залученням пацієнта, інтервенційного кардіолога, кардіохірурга та інших фахівців (NICE, 2010).
Контроль гіперглікемії у пацієнтів із ГКС
Лікування гіперглікемії у стаціонарних хворих протягом 48 год після ГКС
В осіб, госпіталізованих із приводу ГКС, контроль гіперглікемії слід здійснювати шляхом підтримання рівня глюкози у крові <11,0 ммоль/л, уникаючи гіпоглікемії. Насамперед необхідно розглянути можливість застосування інфузії інсуліну з корегуванням дози та регулярним контролем концентрації глюкози у крові (NICE, 2011). У хворих, які потрапили до лікарні з приводу ГКС, рутинна інтенсивна інсулінотерапія (внутрішньовенна інфузія інсуліну та глюкози з/без калію) не рекомендована для контролю гіперглікемії (рівень глюкози >11,0 ммоль/л), якщо немає клінічних показань (NICE, 2011).
Виявлення осіб із гіперглікемією після ГКС за наявності високого ризику цукрового діабету
В усіх пацієнтів із гіперглікемією після перенесеного ГКС потрібно визначити рівень глікованого гемоглобіну (HbA1С) перед випискою та глюкози крові натще не раніше ніж через чотири дні після розвитку ГКС. Ці тести не повинні затримувати виписку з лікарні (NICE, 2011). Не рекомендовано проводити регулярне пероральне тестування на толерантність до глюкози в осіб із гіперглікемією після ГКС та без встановленого цукрового діабету, якщо показники HbA1С і глюкози крові натще у межах норми (NICE, 2011).
Рекомендації та постійний контроль осіб із гіперглікемією після ГКС та без ЦД
Пацієнтам із гіперглікемією, які перенесли ГКС та не мають встановленого ЦД, слід надати такі рекомендації щодо модифікації способу життя (NICE, 2011): дотримуватися здорового харчування, підтримувати належну фізичну активність, контролювати вагу, відмовитися від куріння, не зловживати алкоголем. Особам, які мали гіперглікемію після ГКС без встановленого ЦД, варто повідомити, що вони мають підвищений ризик розвитку ЦД 2-го типу. Також їм слід проконсультуватися з лікарем за наявності таких симптомів, як часте сечовипускання, надмірна спрага, втрата ваги, слабкість. Такі пацієнти повинні проходити тестування із приводу ЦД, а також моніторинг рівня HbA1С та глюкози крові натще принаймні щороку (NICE, 2011).
Медикаментозна терапія у межах вторинної профілактики
Пацієнтам після лікування із приводу ІМ рекомендовані такі терапевтичні заходи у межах вторинної профілактики, як (NICE, 2020):
- застосування інгібітора ангіотензинперетворювального ферменту (іАПФ);
- ПАТТ (АСК + інший антиагрегант), якщо немає окремих показань для проведення антикоагулянтної терапії;
- призначення β-адреноміметиків;
- статинотерапія.
Хворий, який переніс ІМ, повинен мати чіткий план лікування та бути детально поінформований щодо подальшого титрування ліків, моніторингу артеріального тиску та функції нирок (NICE, 2013). Також у таких пацієнтів слід оцінювати ризик кровотечі при повторних оглядах (NICE, 2013).
Інгібітори АПФ
Особам після гострого ІМ, щойно вони стали гемодинамічно стабільними, рекомендовано продовжувати приймати іАПФ без обмеження в часі (NICE, 2013). Поки хворий перебуває в лікарні, дозу іАПФ потрібно збільшувати з короткими інтервалами (наприклад, кожні 12‑24 год) до максимально переносимої або досягнення цільової. Якщо до виписки з лікарні неможливо завершити титрування, це слід зробити протягом 4‑6 тижнів після неї (NICE, 2013). Хворим, які перенесли ІМ, комбіноване використання іАПФ та блокатора рецепторів ангіотензину II (БРА) не рекомендоване, якщо немає інших причин призначити таке лікування (NICE, 2013). За непереносимості іАПФ у таких пацієнтів варто розглянути застосування БРА (NICE, 2013).
Перш ніж розпочинати терапію іАПФ або БРА, у хворих необхідно перевірити функцію нирок, рівень електролітів у сироватці крові й артеріальний тиск, зокрема повторно протягом 1‑2 тижнів після початку лікування. Потрібен моніторинг стану пацієнтів у міру титрування дози вгору до досягнення максимально переносимої або цільової, а потім принаймні щороку. Ретельніший нагляд може знадобитися за особами з підвищеним ризиком погіршення функції нирок. Пацієнтів із хронічною серцевою недостатністю (СН) слід контролювати згідно з відповідними рекомендаціями NICE (NICE, 2007).
Хворим, які перенесли ІМ більш ніж 12 місяців тому, рекомендоване лікування іАПФ. Дозу слід титрувати до максимально переносимої або цільової (протягом 4‑6 тижнів) і продовжувати необмежений час (NICE, 2013). За непереносимості у таких пацієнтів варто розглянути застосування БРА замість іАПФ (NICE, 2013).
Антитромбоцитарна терапія
Усім пацієнтам після перенесеного ІМ рекомендовано використовувати АСК та продовжувати необмежений час, за виключенням випадків непереносимості препарату або відсутності показань для проведення антикоагулянтної терапії (NICE, 2013). В осіб, які перенесли ІМ більш як 12 місяців тому, доцільно розглянути приймання АСК і продовжувати без обмеження в часі (NICE, 2013). Також необхідно і далі застосовувати ПАТТ протягом 12 місяців після ІМ, якщо немає протипоказань (NICE, 2020). У хворих із перенесеним ІМ, що мають гіперчутливість до АСК, монотерапія клопідогрелем може бути альтернативним варіантом лікування (NICE, 2007).
У пацієнтів із диспепсією в анамнезі слід розглянути терапію згідно з рекомендаціями NICE щодо гастроезофагеальної рефлюксної хвороби та диспепсії у дорослих (NICE, 2013). Після відповідного лікування у хворих із виразковими кровотечами в анамнезі, спричиненими АСК, у разі нормалізації стану та негативного результату на Helicobacter pylori доцільною може виявитися терапія за вищевказаними рекомендаціями (NICE, 2013).
Слід рекомендувати клопідогрель замість АСК згідно з відповідними рекомендаціями NICE особам з іншими супутніми судинними захворюваннями, а також які (NICE, 2013):
- перенесли ІМ і припинили ПАТТ або
- перенесли ІМ більш ніж 12 місяців тому.
Антитромбоцитарна терапія за наявності окремих показань для застосування антикоагулянтів
Для пацієнтів, яким окремо показане призначення антикоагулянтної терапії, при виборі тривалості й типу антитромбоцитарного лікування (моно- чи подвійне) впродовж 12 місяців після ГКС необхідно враховувати ймовірність кровотечі, тромбоемболічний, СС-ризик, вподобання пацієнта. Слід мати на увазі, що оптимальну тривалість застосування АСК не встановлено, до того ж довгострокове продовження приймання АСК, клопідогрелю та пероральних антикоагулянтів (потрійна терапія) значно збільшує імовірність кровотечі (NICE, 2020).
Особам, які вже отримують антикоагулянтну терапію та перенесли ЧКВ, варто продовжувати приймати антикоагулянти та клопідогрель до 12 місяців. Якщо пацієнт застосовує пероральний антикоагулянт прямої дії, дозу слід відрегулювати відповідно до ризику розвитку кровотечі, тромбоемболії та СС-подій (NICE, 2020). Хворим після перенесеного ЧКВ із новим показанням щодо проведення антикоагулянтної терапії рекомендовано клопідогрель (замість прасугрелу або тікагрелору) строком на 12 місяців та пероральний антикоагулянт відповідно до тромбоемболічного, СС-ризику та вподобань пацієнта (NICE, 2020).
У пацієнтів, які вже отримують антикоагулянтну терапію або мають нові показання, але не перенесли ЧКВ (або АКШ), не варто припиняти лікування, а за відсутності високого ризику кровотечі розглянути можливість продовження застосування АСК (або клопідогрелю за наявності протипоказань щодо АСК) терміном до 12 місяців (NICE, 2020).
Не рекомендовано приймати прасугрел або тікагрелор у поєднанні з антикоагулянтом, який використовують за наявності окремого показання для антикоагуляції (NICE, 2020). В осіб, яким показане проведення антикоагулянтної терапії через 12 місяців після ІМ, з огляду на необхідність продовжувати використання антиагрегантів, слід враховувати такі фактори, як показання для антикоагуляції, ризик кровотеч, тромбоемболії, СС-ускладнень, вподобання хворого людини (NICE, 2013).
Бета-блокатори
Якщо пацієнти після ІМ є гемодинамічно стабільними, рекомендовано якомога швидше призначити їм β-блокатори (NICE, 2013). Схема титрування препаратів до максимально переносимої або цільової дози має бути зазначена у документах при виписці хворого з лікарні (NICE, 2013). Слід розглянути можливість продовження приймання β-блокаторів протягом 12 місяців після ІМ в осіб без зниженої фракції викиду (ФВ) лівого шлуночка (ЛШ) (NICE, 2020).
Із хворими без зниженої ФВ ЛШ доцільно обговорити потенційні переваги та ризики припинення або продовження застосування β-блокаторів через 12 місяців після ІМ, зокрема (NICE, 2020):
- відсутність доказів щодо відносної користі та шкоди від продовження лікування через 12 місяців;
- наявність несприятливих ефектів.
Пацієнтам зі зниженою ФВ ЛШ рекомендовано продовжувати приймати β-блокатори необмежений час (NICE, 2013). Всім хворим, які перенесли ІМ більш ніж 12 місяців тому, зі зниженою ФВ ЛШ, доцільно призначити β-блокатори незалежно від того, чи мають вони симптоми. В осіб із СН та зниженою ФВ ЛШ необхідний моніторинг стану відповідно до рекомендацій NICE щодо терапії хронічної СН у дорослих (NICE, 2013).
Для хворих без зниженої ФВ ЛШ або СН, які перенесли ІМ понад 12 місяців тому, лікування β-блокаторами не рекомендоване, якщо тільки немає додаткових клінічних показань для їх застосування (NICE, 2013).
Блокатори кальцієвих каналів
Не рекомендовано використовувати блокатори кальцієвих каналів (БКК) на регулярній основі для зниження СС-ризику після ІМ (NICE, 2007). Якщо β-блокатори протипоказані або їх потрібно відмінити, дилтіазем чи верапаміл можуть бути розглянуті для вторинної профілактики в осіб без застійних явищ у легенях або зниженої ФВ ЛШ (NICE, 2007).
Пацієнтам після ІМ у стабільному стані БКК можна застосовувати для лікування гіпертонії та/або стенокардії. Для осіб із СН зі зниженою ФВ ЛШ необхідно призначити амлодипін та уникати використання верапамілу, дилтіазему й дигідропіридинових препаратів короткої дії відповідно до рекомендацій NICE щодо терапії хронічної СН у дорослих (NICE, 2020).
Активатори калієвих каналів
Не рекомендовано призначати нікорандил для зниження ризику розвитку СС-ускладнень після ІМ (NICE, 2007).
Антагоністи альдостерону при СН та зниженій ФВ ЛШ
У пацієнтів, які перенесли гострий ІМ, мають симптоми та/або ознаки СН і знижену ФВ ЛШ, слід розпочати лікування антагоністом альдостеронових рецепторів, затвердженим для лікування після ІМ, протягом 3‑14 днів після епізоду, а також бажано після терапії іАПФ (NICE, 2007). Особам, які нещодавно перенесли гострий ІМ та мають СН і знижену ФВ ЛШ, але вже отримують антагоніст альдостеронових рецепторів із приводу супутніх захворювань (наприклад, хронічної СН), слід продовжувати терапію або ж розглянути альтернативний препарат, затверджений для лікування хворих після ІМ (NICE, 2007).
Для осіб із підтвердженим раніше ІМ та СН зі зниженою ФВ ЛШ лікування антагоністом альдостеронових рецепторів має відповідати рекомендаціям NICE щодо терапії хронічної СН у дорослих (NICE, 2007). Окрім того, необхідний моніторинг функції нирок та рівня калію у сироватці крові до й під час терапії. Якщо наявна виразна гіперкаліємія, варто зменшити дозу вдвічі або припинити приймання препарату (NICE, 2007).
Статини та інші гіполіпідемічні засоби
Застосування статинотерапії рекомендоване дорослим пацієнтам із клінічними ознаками кардіоваскулярних захворювань згідно з відповідними рекомендаціями NICE (NICE, 2007).
Коронарна реваскуляризація після ІМ
Усім хворим після ІМ, яким не проводили коронарної реваскуляризації, рекомендоване кардіологічне обстеження, аби прийняти рішення стосовно необхідності даної процедури. При цьому слід враховувати наявність супутніх патологій у пацієнта (NICE, 2020).
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.nice.org.uk
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 2 (75) 2021 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Інколи саме з цього перерізу вдається візуалізувати тромбоемболи в основних гілках легеневої артерії або вегетації на стулках легеневого клапана (що трапляється надзвичайно рідко). Нахиливши датчик до самої верхівки серця, можна отримати її переріз по короткій осі, на якому, знову ж таки, порожнина лівого шлуночка має круглясту форму, а правого шлуночка – близьку до трикутника із виразною трабекулярністю (рис. 22.9). Розглядаючи зображення, також звертають увагу на те, що в нормі всі сегменти ЛШ скорочуються синхронно, не випереджаючи інші і не відстаючи. ...
Застосування статинів середньої інтенсивності в комбінації з езетимібом порівняно зі статинами високої інтенсивності окремо може забезпечити більше зниження рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) у пацієнтів із нещодавнім ішемічним інсультом. Пропонуємо до вашої уваги огляд статті Keun-Sik Hong et al. «Moderate-Intensity Rosuvastatin Plus Ezetimibe Versus High-Intensity Rosuvastatin for Target Low-Density Lipoprotein Cholesterol Goal Achievement in Patients With Recent Ischemic Stroke: A Randomized Controlled Trial», опублікованої у виданні Journal of Stroke (2023; 25(2): 242‑250). ...
Артеріальна гіпертензія (АГ) сьогодні є одним із найпоширеніших серцево-судинних захворювань (ССЗ), що асоціюється з високим кардіоваскулярним ризиком, особливо в коморбідних пацієнтів. Навіть помірне підвищення артеріального тиску (АТ) пов’язане зі зменшенням очікуваної тривалості життя. До 40% хворих на АГ не підозрюють у себе недугу, бо це захворювання на початку може мати безсимптомний перебіг. Оптимальний контроль АТ є вагомим чинником профілактики фатальних серцево-судинних подій (ССП) для забезпечення якісного та повноцінного життя таких хворих. ...