Синдром обструктивного апное сну та артеріальна гіпертензія
 Розлади дихання під час сну часті й недостатньо діагностовані серед осіб середнього та похилого віку, а їх поширеність залежить від раси / етнічної належності, статі та ожиріння. Одним із розладів дихання під час сну є синдром обструктивного апное сну (СОАС), який у ХХІ ст. через ріст ожиріння визнаний поширеною патологією. Окрім впливу на здоров’я, СОАС асоційований зі значущими несприятливими наслідками. За даними багатьох досліджень, виявлено потужний зв’язок між СОАС і серцево-судинною (СС) захворюваністю та смертністю, включно з артеріальною гіпертензією (АГ), ішемічною хворобою серця (ІХС), серцевою недостатністю (СН), порушеннями ритму серця, легеневою АГ, патологією судин великого калібру та цереброваскулярними захворюваннями.
Розлади дихання під час сну часті й недостатньо діагностовані серед осіб середнього та похилого віку, а їх поширеність залежить від раси / етнічної належності, статі та ожиріння. Одним із розладів дихання під час сну є синдром обструктивного апное сну (СОАС), який у ХХІ ст. через ріст ожиріння визнаний поширеною патологією. Окрім впливу на здоров’я, СОАС асоційований зі значущими несприятливими наслідками. За даними багатьох досліджень, виявлено потужний зв’язок між СОАС і серцево-судинною (СС) захворюваністю та смертністю, включно з артеріальною гіпертензією (АГ), ішемічною хворобою серця (ІХС), серцевою недостатністю (СН), порушеннями ритму серця, легеневою АГ, патологією судин великого калібру та цереброваскулярними захворюваннями.
Згідно з даними the Wisconsin Sleep Cohort Study, поширеність помірних і тяжких розладів під час сну при індексі апное/гіпопное (ІАГ) ≥15 епізодів становила 10 та 17% серед чоловіків віком 30‑49 і 50‑70 років відповідно (95% довірчий інтервал [ДІ] 7‑12 і 15‑21 відповідно), а також 3 і 9% у жінок 30‑49 та 50‑70 років відповідно (95% ДІ 2‑4 та 7‑11 відповідно). Загальна поширеність розладів під час сну від легкого до тяжкого ступеня (ІАГ ≥5) серед осіб 30‑70 років за період 2007‑2010 рр. дорівнювала 26% (95% ДІ 24‑28) [106].
У 730 млн осіб віком 30‑69 років у світі встановлений СОАС при ІАГ ≥5 епізодів/год [17]. Діагностичним критеріям СОАС відповідають приблизно 34% чоловіків та 17% жінок середнього віку [106]. Необхідно зазначити, що більш ніж у 85% пацієнтів із клінічно значущим СОАС цю патологію не було діагностовано, а частина хворих, яких направляють на обстеження, є лише «верхівкою айсберга» поширеності СОАС [130].
Хворі на СОАС тяжкого ступеня мали істотно вищі показники фатальних та нефатальних СС-подій, зокрема СС-летальності й раптової серцевої смерті, порівняно з легким та помірним СОАС, звичним хропінням і здоровими особами [18, 20, 87]. Поширеність СOАС сягає від 40 до 80% в осіб з АГ, СН, ІХС, легеневою гіпертензією, фібриляцією передсердь (ФП) та інсультом [106, 133]. За даними дослідження L.C. Correia et al., пацієнти, госпіталізовані з гострим коронарним синдромом без елевації сегмента ST та високою ймовірністю СОАС, мали вищу частоту несприятливих СС-подій, як-то смерть, нефатальний інфаркт міокарда (ІМ), рефрактерна стенокардія [35]. У 2019 р. Американська асоціація серця (АНА) повідомила результати метааналізу 27 когортних досліджень, за якими легкий (відносний ризик [ВР] 1,19; 95% ДІ 0,86‑1,65), помірний (ВР 1,28; 95% ДІ 0,96‑1,69) та тяжкий СОАС (ВР 2,13; 95% ДІ 1,68‑2,68) пов’язані зі смертю від усіх причин, а тяжкий СОАС (ІАГ ≥30), зокрема, – зі збільшенням СС-летальності (ВР 2,73; 95% ДІ 1,94‑3,85) [18].
СОАС асоційований з особливо високою частотою СС-подій вночі, однак удень вона теж досить значуща. Також СОАС часто корелює з раптовою смертю та ІМ у нічний час, а раптове підвищення АТ вночі, що виникає під час епізодів апное, може бути безпосередньо пов’язане із СС-ускладненнями [70].
На додачу, СОАС асоційований із порушеннями обміну речовин, які самі по собі тісно пов’язані з патологією СС-системи [9]. Зокрема, рівень інсулінорезистентності прямо корелює з нічною гіпоксією у пацієнтів з ожирінням, які страждають на СОАС [22].
Також в осіб із СОАС виявлені порушення обміну ліпідів, що характеризуються [5]:
- гіперхолестеринемією;
- підвищенням рівня тригліцеридів;
- збільшенням концентрації вільнорадикального окислення ліпідів;
- зниженням ліпопротеїнів високої щільності.
Метааналіз шести проспективних когортних досліджень показав, що помірний/тяжкий СОАС зумовлює більшу ймовірність розвитку цукрового діабету (ЦД) 2-го типу (ВР 1,63; 95% ДІ 1,09‑2,45), ніж за відсутності СОАС [127]. Окрім того, при СОАС має місце підвищений ризик нещасних випадків, пов’язаних із роботою та автотранспортом, частішими пропусками робочих днів, пов’язаними зі здоров’ям та зниженням якості життя і когнітивними порушеннями [87, 115]. Необхідно зазначити, що СОАС – це стан із потенційним негативним зворотним зв’язком, який погіршує перебіг інших захворювань. Останні, своєю чергою, можуть ускладнити перебіг СОАС (наприклад, СОАС → АГ → погіршення СОАС) [133].
Велика кількість доказів підтверджує причинно-наслідковий, двоспрямований зв’язок між СОАС і АГ [6, 70, 94, 103]. Як відомо, АГ – найпоширеніше серцево-судинне захворювання (ССЗ) у дорослих, а підвищений артеріальний тиск (АТ) у 2015 р. був провідним глобальним фактором передчасної смерті, що призвів до майже 10 млн смертей [50, 72].
Як офісний, так і позаофісний АТ має незалежну і безперервну кореляцію із термінальною нирковою недостатністю та частотою СС-ускладнень, як-от [79]:
- геморагічний/ішемічний інсульти;
- ІМ;
- раптова смерть;
- СН;
- захворювання периферичних артерій.
Своєю чергою зниження АТ приводить до значного зменшення ймовірності ССЗ, зокрема інсульту та пов’язаних із ними летальних випадків [36, 130].
У 2003 р. Об’єднаний національний комітет із профілактики, діагностики, оцінки та лікування підвищеного АТ США (JNC 7) визнав СОАС найчастішою причиною вторинної АГ [78]. Окрім того, що СОАС може бути причиною розвитку вторинної АГ, також він часто спостерігається у хворих на АГ [6, 77, 97, 103]. За даними досліджень, поширеність вторинної АГ становить 5‑15% серед осіб з АГ, а у 5‑10% пацієнтів з АГ СОАС є причиною розвитку вторинної АГ [111, 130]. До того ж СОАС пов’язаний із резистентною АГ. У хворих з ІАГ >15 епізодів/год у 64% випадків СОАС асоційований із резистентною АГ (рис. 1) [103]. Водночас лікування СРАР (методом постійного позитивного тиску в дихальних шляхах) значно знижує добовий АТ в осіб із резистентною АГ [82].
Рис. 1. Поширеність причин вторинної АГ, асоційованих із резистентною АГ
Примітки: Кругову діаграму створено A.R. Patel et al. [101] та адаптовано за R.P. Pedrosa et al. [103].
Незважаючи на високу поширеність СОАС в осіб із ССЗ, його часто недостатньо діагностують та не лікують у серцево-судинній практиці [133]. Клініцисти мають звертати увагу на будь-які відхилення при обстеженні СС-системи, органів дихання і ознаки, що можуть свідчити про захворювання, пов’язані зі зростанням частоти СОАС, наприклад СН, інсульт, ФП, АГ, ЦД [133]. СОАС і АГ потребують своєчасної діагностики й терапії з метою зниження СС-захворюваності та смертності унаслідок цих двох станів [6].
Збільшення поширеності АГ у загальній популяції потребує глибокого аналізу асоціації АГ з іншими можливими станами, такими як СОАС. Це допоможе покращити діагностику СОАС та призначити відповідне лікування, що сприятиме запобіганню розвитку даних тісно взаємопов’язаних захворювань [12].
Визначення та фактори ризику СОАС
СОАС – порушення дихання під час сну, що характеризується періодичними епізодами повної або часткової обструкції верхніх дихальних шляхів. Це призводить до періодичної гіпоксії, гіперкапнії, дисбалансу вегетативної нервової системи та фрагментації сну [120, 133]. Епізодичні цикли порушення дихання викликають гострі та хронічні розлади [133].
Апное – це повне спадання верхніх дихальних шляхів із 10-секундним або тривалішим припиненням вентиляції. Гіпопное – часткове звуження просвіту верхніх дихальних шляхів із 10-секундним або тривалішим зниженням вентиляції на ≥50%. Епізоди апное/гіпопное вважають обструктивними, якщо під час них зберігаються дихальні зусилля. За їх відсутності епізоди апное/гіпопное розглядають як центральні [4].
Етіологія СОАС багатофакторна, що передбачає складну взаємодію між анатомічними, нервово-м’язовими чинниками та генетичною схильністю [39]. Встановленими факторами ризику (ФР) СОАС є:
- чоловіча стать;
- старший вік;
- ожиріння.
Із додатковим ризиком асоційовані расова/етнічна належність, сімейний анамнез і черепно-лицьові дисморфізми, ендокринні порушення, зокрема гіпотиреоз, клімакс у жінок, синдром Дауна та деякі неврологічні розлади [8, 32]. Морфологічні аномалії є найпоширенішими факторами, що зумовлюють обструкцію верхніх дихальних шляхів, такі як ретрогнатія, збільшення мигдаликів і м’яких тканин на шиї тощо. Черепно-лицьові анатомічні аномалії можуть звузити верхні дихальні шляхи та є важливими ФР розвитку СОАС, які кількісно оцінюють за допомогою модифікованої класифікації Маллампаті. Додатковими ФР виникнення СОАС є куріння, сімейний анамнез СОАС та нічна закладеність носа. Окрім того, деякі речовини/препарати погіршують наявний раніше СОАС, наприклад алкоголь, бензодіазепіни, опіати [133].
Ризик СОАС корелює з індексом маси тіла (ІМТ), а ожиріння залишається одним з основних ФР СОАС, який можна модифікувати [133]. У популяційному когортному дослідженні збільшення маси тіла на 10% було пов’язане зі збільшенням ІАГ майже на 32%, і навіть помірний її контроль був ефективним щодо зменшення нових випадків порушень дихання під час сну [107].
Між СОАС і збільшенням окружності талії та розміром шиї існує ще потужніша кореляція. Розміри шиї, що асоційовані з СОАС, становлять >17 і 16 дюймів для чоловіків та жінок відповідно. Виявлено, що окружність шиї є незалежним предиктором СОАС навіть після врахування ІМТ та у пацієнтів із СОАС має сильнішу кореляцію з окремими показниками тяжкості захворювання, такими як сатурація й ІАГ, ніж ІМТ [133].
Патофізіологія СОАС складна та багатофакторна з багатьма невстановленими та недостатньо вивченими аспектами. Загалом розвиток СОАС є результатом взаємодії між змінами анатомії верхніх дихальних шляхів та пов’язаних зі сном порушень функції верхніх дихальних шляхів [126]. Апное та гіпопное при порушенні дихання під час сну мають значні шкідливі наслідки для здоров’я. Гострі ефекти включають інтермітуючу гіпоксію, фрагментацію сну, значні коливання серцевого ритму, АТ та внутрішньогруднього тиску [120].
Своєю чергою ці гострі порушення призводять до таких наслідків, як ССЗ, зокрема АГ [108, 120]. Дані дослідження A. Azarbarzin et al. показали, що тягар гіпоксії є предиктором СС-смертності [10].
Клінічні прояви СОАС
Слід зазначити, що клінічно СОАС проявляється наявністю хропіння, зниженням рівня кисню у крові, грубою фрагментацією сну з частими пробудженнями, надмірною денною сонливістю та підвищенням АТ, особливо у нічний час, епізодами задишки, задухи або апное [120, 133].
Симптоми і клінічні ознаки, асоційовані з СОАС
Нічний час
- Підтвердження близькими наявності епізодів апное
- Гучне, часте і переривчасте хропіння
- Сухість у роті
- Спрага вночі
- Ніктурія
- Задуха, задишка
- Порушений сон
- Пітливість
- Закладеність носа (переважно вночі)
- Сімейний анамнез хропіння та апное сну
Денний час
- Підвищена денна сонливість
- Денна втома
- Труднощі з концентрацією уваги
- Ранковий біль у горлі
- Головний біль (частіше в ранкові години)
Часті клінічні характеристики
- Чоловіча стать
- Жінки після менопаузи
- Надмірна маса тіла, переважно центральне ожиріння* (зв’язок між анамнезом ожиріння і хропінням / очевидним апное / сонливістю)
- ССЗ в анамнезі (ІХС, інсульт або СН, ймовірність СОАС від 30 до >50%)
- Анатомічні аномалії верхніх дихальних шляхів (збільшення мигдалин і язичка, аденоїди та макроглосія відповідно до класифікації Фрідмана III стадії)
- Ретрогнатія
Об’єктивні результати оцінки серцево-судинного/ метаболічного ризику в гіпертензивних хворих
- Рефрактерна АГ (ймовірність СОАС від 50 до >80%)
- Відсутність нічного зниження АТ
- Гіпертрофія лівого шлуночка
- Генералізований атеросклероз
- Холтерівський моніторинг ЕКГ (нічна брадикардія/тахікардія, синоатріальна і атріовентрикулярна блокади під час сну, збільшення випадків суправентикулярних і вентрикулярних екстрасистолій під час сну, ФП, пароксизмальна ФП вночі)
- Метаболічні захворювання, такі як ЦД
Примітка: * Наприклад, ІМТ >30 кг/м2 вказує на 50% ймовірність СОАС й окружність шиї >17 та 16 дюймів у чоловіків і жінок відповідно.
Тяжкість СОАС визначають кількісно відповідно до результатів тестування під час сну за ІАГ, індексом дихальних розладів (ІДР) [102]. ІАГ є часто використовуваним індексом для оцінки тяжкості СОАС, який розраховують як кількість обструктивних дихальних подій (епізодів апное/гіпопное) за годину сну і отримують шляхом нічного кардіореспіраторного моніторингу [19]. За ІАГ розрізняють такі ступені тяжкості СОАС, як легкий (≥5), помірний (≥15) і тяжкий (≥30) [69]. Слід зазначити, що якщо брати до уваги тільки частоту подій, це не враховує інші важливі аспекти патофізіології СОАС, такі як ступінь гіпоксемії, тривалість і часовий розподіл подій протягом циклу сну, ступінь фрагментації сну та наявність надмірної денної сонливості.
Зв’язок між АГ та СОАС
Як було зазначено вище, АГ та СОАС – стани, що часто зустрічаються у загальній популяції [60]. Звертає на себе увагу те, що як СОАС, так і АГ є станами з багатофакторними причинами і часто співіснують, навіть незважаючи на те, що АГ не обов’язково може бути наслідком СОАС [64]. Багато чинників можуть впливати на зв’язок між АТ та СОАС, які включають, зокрема, ожиріння, вік і стать [6, 100].
Існує численна кількість досліджень, що підтверджують кореляцію між СОАС та АГ, яка є двонаправленою [6, 77, 86, 94, 101, 108]. Встановлено, що СОАС не тільки являє собою причину вторинної АГ, – також спостерігається вища частота СОАС у пацієнтів з АГ [77, 134]. Поширеність СОАС серед осіб з АГ становить 30‑56% [6, 44, 119]. На жаль, СОАС часто не діагностується [133]. Це підтверджують результати багатоцентрового крос-секційного дослідження, проведеного у Японії, відповідно до яких 64,5% хворих на АГ, що зверталися по первинну медичну допомогу, мали ІАГ ≥22 [60].
Серед пацієнтів із резистентною АГ поширеність СОАС надзвичайно висока і коливається від 70 до 83% [57, 81]. Своєю чергою АГ з-поміж пацієнтів із СОАС спостерігається у 30‑80% та залежить від тяжкості СОАС [6, 86, 100, 117, 120]. За даними роботи Ю.М. Сіренко та співавт., СОАС виявлено у 78% хворих на АГ. Така висока поширеність СОАС у цій категорії пацієнтів визначає доцільність широкого впровадження скринінгової діагностики обструктивних порушень сну в гіпертензивних хворих. Це дозволить підвищити ефективність антигіпертензивної терапії, суттєво покращити якість і подовжити тривалість життя пацієнтів [3]. Згідно з даними дослідження S. Khamsai et al., у 57,69% осіб із гіпертензивними кризами діагностований СОАС [73].
За результатами випробування встановлено, що близько 50% усіх пацієнтів з есенціальною АГ мають СОАС, а ще 40% хворих – звичне хропіння [117]. Як свідчать дані проспективного когортного дослідження, проведеного в Іспанії, скорегований ВР АГ був вищий серед осіб із СОАС, що не підходять для терапії СРАР (1,33; 95% ДІ 1,01‑1,75), тих, хто відмовився від такого лікування (1,96; 95% ДІ 1,44‑2,66), і пацієнтів, не прихильних до терапії СРАР (1,78; 95% ДІ 1,23‑2,58), порівняно з контролем. У хворих, які отримували лікування СРАР, ВР АГ був нижчим (0,71; 95% ДІ 0,53-0,94), ніж у контролі. На рисунку 2 показано частоту епізодів АГ в осіб із різним ступенем СОАС (які не отримували лікування), що зростала із тяжкістю СОАС, та контрольній групі [86].
Рис. 2. Кумулятивна частота АГ в осіб без СОАС і хворих на СОАС, які не отримували лікування
Примітки: Тяжкість СОАС встановлено за ІАГ: легкий (ІАГ – 5,0‑14,9), помірний (ІАГ – 15,0‑29,9), тяжкий (ІАГ ≥30).
Адаптовано за J.M. Marin et al. [86].
Як вказано вище, СОАС є причиною вторинної АГ, і ризик АГ зростає із тяжкістю СОАС. Деякі дослідники виявили асоціацію доза/відповідь між порушеннями дихання під час сну на вихідному рівні та АГ наприкінці спостереження [108]. За даними роботи J.P. Baguet et al., встановлено лінійну кореляцію між ІАГ та підвищенням АТ незалежно від асоційованих ФР [11].
Результати дослідження The Wisconsin Sleep Cohort Study підтвердили асоціацію між СОАС та розвитком АГ. Показано, що відношення шансів (ВШ) розвитку АГ за чотири роки спостереження у пацієнтів із СОАС порівняно з особами без порушень дихання під час сну становило:
- 1,4 (95% ДІ 1,1‑1,8) для осіб із вихідним ІАГ 0,1‑4,9 події/год;
- 2,0 (95% ДІ 1,3‑3,2) з ІАГ 5,0‑14,9 події/год;
- 2,9 (95% ДІ 1,5‑5,6) з ІАГ ≥15 подій/год.
Це вказує на те, що ризик розвитку АГ тісно пов’язаний із тяжкістю СОАС [108].
За даними роботи P.H. Gjørup et al., в осіб із СОАС встановлено вищу концентрацію ендотеліну‑1 у плазмі крові порівняно зі здоровими особами. Середній нічний рівень ендотеліну‑1 суттєво корелював із ІАГ як мірою тяжкості СОАС. Хворі з ІАГ >30 подій/год мали значно підвищений систолічний (САТ) і діастолічний АТ (ДАТ) порівняно зі здоровими особами. До того ж середні добові САТ і ДАТ позитивно корелювали з ІАГ у пацієнтів із СОАС (r=0,488; р=0,005 і r=0,437; р=0,012 відповідно) [56].
У дослідженні F.J. Nieto et al. (n=6132) показано, що порушення дихання під час сну асоційоване з АГ в осіб середнього та старшого віку незалежно від статі та етнічного походження. Середні САТ/ДАТ і поширеність АГ значно зростали зі збільшенням показників порушення дихання під час сну, хоча деякі з цих кореляцій пояснювалися значеннями ІМТ. Після корегування демографічних та антропометричних змінних (включно з ІМТ, окружністю шиї, співвідношенням талії/стегон) та споживання алкоголю й куріння, ВШ АГ при порівнянні найвищої категорії ІАГ (≥30/год) із найнижчою (<1,5/год) був 1,37 (95% ДІ 1,03‑1,83; р=0,005). Відповідна оцінка при зіставленні найвищої та найнижчої категорій відсотка часу сну при насиченні киснем <90% (≥12 vs <0,05%) склала 1,46 (95% ДІ 1,12‑1,88; р<0,001). У стратифікованому аналізі асоціацію АГ із будь-яким порушенням дихання під час сну виявлено в осіб обох статей, старшого та молодшого віку, усіх етнічних груп, а також за нормальної та надмірної маси тіла [97].
Цікаві дані отримані при проведенні аналізу випробувань, які стосуються зв’язку короткої тривалості сну, змінної роботи та СОАС із ризиком АГ і рівня АТ. Обсерваційні дослідження показали, що суб’єктивно оцінений короткий сон збільшує імовірність АГ, хоча суперечливі результати спостерігаються у дослідженнях щодо об’єктивної оцінки короткого сну. В інтервенційних дослідженнях виявлено, що легке і тяжке зменшення тривалості сну пов’язане з підвищенням АТ. Окрім того, продемонстровано, що робота по змінах може зумовлювати підвищення АТ уночі та зниження контролю АТ у пацієнтів з АГ. Також встановлено, що помірний або тяжкий СОАС асоційований з АГ, особливо резистентною. СОАС пов’язаний із несприятливим добовим профілем АТ, включно з вищим денним та нічним (профіль non-dipping) і вищим підйомом АТ вранці [85].
Однак в інших роботах, таких як проспективне когортне дослідження the Sleep Heart Health Study та поздовжнє дослідження the Vitoria Sleep Cohort, після корегування ФР не було знайдено зв’язку між СОАС та захворюваністю на АГ у загальній популяції середніх років [28, 99]. З-поміж людей середнього і старшого віку без АГ кореляція між ІАГ та ризиком розвитку АГ переважно пояснюється ожирінням, хоча не слід виключати помірний вплив ІАГ >30 на АГ [99]. G.T. O’Connor et al. зазначають, що для кращого встановлення цієї асоціації потрібні додаткові довгострокові дослідження [99].
СОАС, зокрема, корелює зі змінами геометрії та функції лівого шлуночка (ЛШ), як-от гіпертрофія й діастолічна дисфункція, судин (артеріальна жорсткість), потовщенням комплексу інтима-медіа сонних артерій та ендотеліальною дисфункцією [21, 39, 42, 43, 51, 107]. За даними роботи L.F. Drager et al., встановлений зв’язок між тяжкістю СОАС та жорсткістю артерій [42]. Швидкість поширення пульсової хвилі становила (всі р<0,01) [43]:
- в осіб із СОАС – 9,4±1,0 м/с;
- пацієнтів із маскованою АГ – 10,6±1,1 м/с;
- у групі контролю – 8,7±0,7 м/с.
Пацієнти з АГ та СОАС мали вищу швидкість поширення пульсової хвилі, ніж без СОАС на вихідному рівні (10,3±1,9 vs 9,2±1,7 м/с; р=0,024), але в обох групах спостерігалося подібне її зниження під час наступного періоду спостереження. Через чотири роки у хворих на дихальні розлади під час сну (після корегування за габітусом, віком, статтю, вживанням алкоголю та курінням) ВШ розвитку АГ при вихідному ІАГ 0,1‑4,9 подій/год становило 1,42 (95% ДІ 1,13‑1,78), 2,03 (95% ДІ 1,29‑3,17) з ІАГ 5,0‑14,9 подій/год та 2,89 (95% ДІ 1,46‑5,64) з ІАГ ≥15,0 подій/год порівняно з контрольною групою (ІАГ – 0 подій/год) [107].
За результатами ретроспективного когортного аналізу M.A. Khan et al. (501 хворий віком 13‑21 рік), встановлений взаємозв’язок СОАС та АГ / підвищеного АТ у підлітків, який найбільшою мірою корелював зі ступенем ожиріння [74]. У пацієнтів із СОАС було виявлено вищу частоту маскованої АГ порівняно із групою контролю (без СОАС): 30,2 vs 11,1% відповідно (р<0,05) [43]. АТ та кількість осіб з АГ лінійно зростали із тяжкістю апное сну (згідно з ІАГ). За допомогою множинної логістичної регресії показано, що кожна додаткова подія апное за годину сну збільшувала ймовірність АГ приблизно на 1%, тоді як кожне зниження насичення крові киснем на 10% вночі – на 13% [77].
Характерними ознаками АГ при СОАС є:
- Резистентна АГ [71, 85].
- Несприятливий добовий профіль АТ, зокрема вищий денний та нічний АТ, відсутність зниження або підвищення в нічний час ДАТ унаслідок посилення симпатичної активності вночі [62, 71, 85, 88, 94, 120]. Кумулятивний ефект надмірної симпатичної активації, асоційованої з іншими вазоактивними факторами, що виділяються у відповідь на гіпоксію, ймовірно, зумовлює стійку денну АГ. Несприятливий нічний профіль АТ (non-dipping, midnight BP surge) підвищує СС-ризик та розвиток основних СС-подій у нічні години [71, 85, 88]. Це підтверджують результати роботи, відповідно до яких профіль АТ non-dipping пов’язаний із СС-подіями, зокрема коронарними, інсультами, СС-смертністю та від загальних причин (ВР 1,57‑1,89) порівняно з пацієнтами зі зниженням нічного АТ [112].
- Маскована АГ [71].
- Ранкова АГ (раптовий підйом АТ уранці) [71, 85, 88].
- АГ зі зростанням частоти серцевих скорочень [71].
- Діастолічна (переважно) АГ у молодих [71].
- Підвищена варіабельність АТ під час сну: дуже короткочасна (між скороченнями серця) та короткочасна варіабельність АТ (протягом доби) [71, 88].
Окрім того, СОАС може бути асоційований із частішою або тяжкою АГ унаслідок збільшення вивільнення альдостерону, принаймні у пацієнтів із резистентною АГ, адже у цих хворих спостерігали значущу кореляцію між концентрацією альдостерону в сироватці крові та ступенем тяжкості СОАС [58]. Для оцінки даного зв’язку в осіб із резистентною АГ і СОАС до та через вісім тижнів після додавання спіронолактону (до постійної антигіпертензивної терапії) було проведено полісомнографію. Після лікування спостерігалося значне зменшення ІАГ, маси тіла та АТ [53].
Резистентна АГ
У низці досліджень було встановлено, що СОАС є важливим ФР розвитку резистентної АГ [37, 81, 116]. У роботі S.L. Daugherty et al. продемонстровано, що хворі на резистентну АГ та СОАС мають значно вищу частоту СС-подій (як-то смерть чи випадки ІМ, СН, інсульту або хронічної хвороби нирок) порівняно з такими без резистентної АГ (некорегована, 18 vs 13,5%; p<0,001). Після корегування за клінічними характеристиками резистентна АГ асоціювалася з вищим ризиком СС-подій (ВР 1,47; 95% ДІ 1,33‑1,62) [37]. За допомогою мультиваріантної моделі виявлено, що велика окружність шиї, хропіння та вік >50 років були незалежними предикторами СОАС серед пацієнтів із резистентною АГ [103].
A.G. Logan et al. встановили, що у пацієнтів із резистентною АГ наявність СОАС (діагностовано при ІАГ ≥10 подій/год) становить 83%. Хворі мали ожиріння (ІМТ – 34,0+0,9 кг/м2; середній вік – 57,2±1,6 року) та в середньому приймали 3,6±0,1 різних антигіпертензивних препаратів щодня. Виявлено, що СОАС [81]:
- частіше спостерігався серед чоловіків, ніж жінок (96 vs 65%; р=0,014);
- був тяжчим у чоловіків, ніж жінок (середній ІАГ – 32,2±4,5 vs 14,0±3,1 подій/год; р=0,004).
В іншому дослідженні продемонстровано на 22,7% вищу частоту СОАС у групі хворих на резистентну АГ, яка становила 88,9% порівняно з 66,1% у групі з медикаментозно контрольованою АГ (р<0,005), вищі показники жорсткості артерій та достовірно більшу (на 15,8%; р<0,005) поширеність тяжкого СОАС [1].
Патофізіологія АГ при СОАС
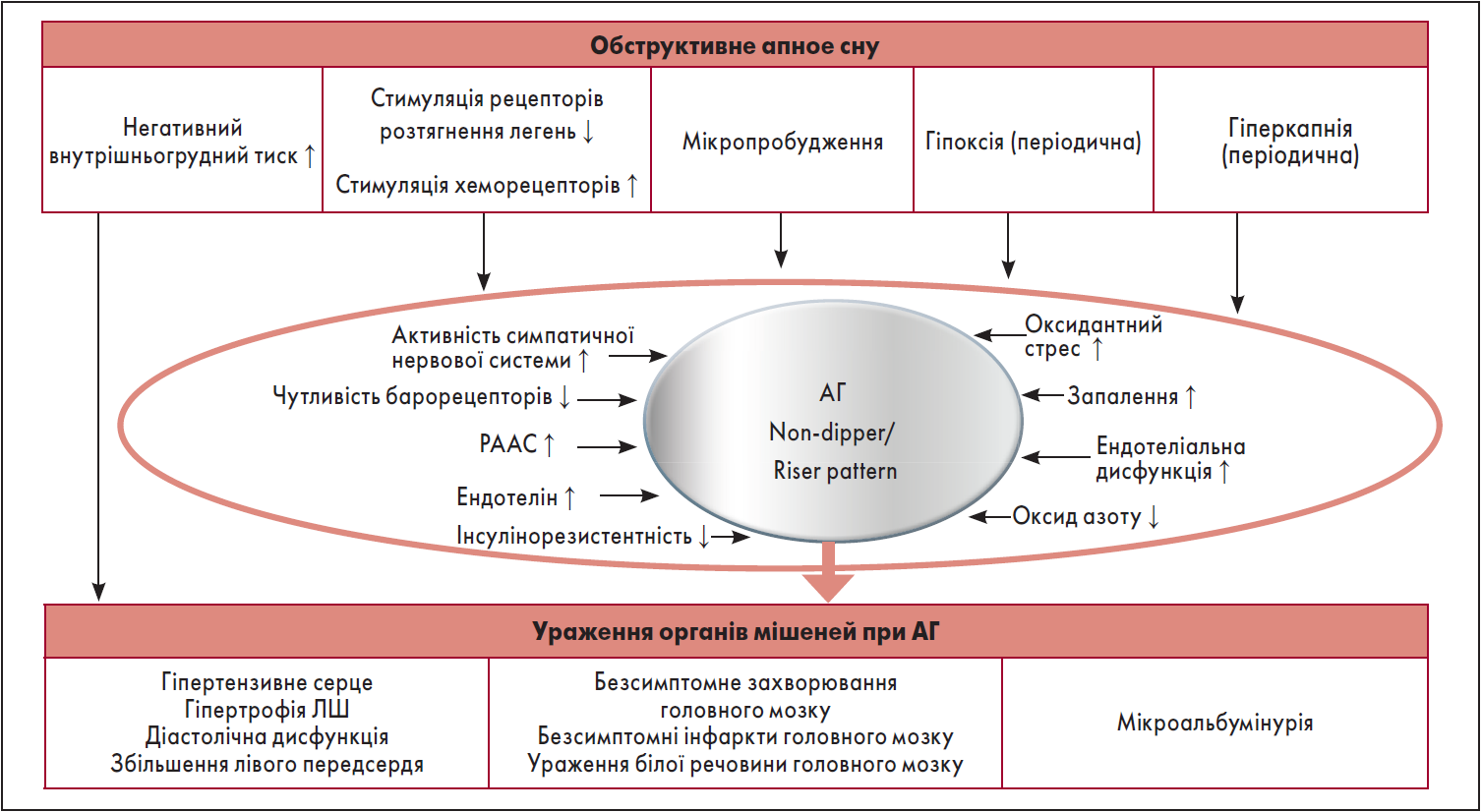
СОАС і АГ є багатофакторними захворюваннями, що мають спільні ФР (ожиріння, чоловіча стать, вік) та багато патофізіологічних механізмів, які їх пов’язують (рис. 3) [70, 76, 103, 134].
Рис. 3. Механізми АГ та ураження органів-мішеней при СОАС
Примітки: РААС – ренін-ангіотензин-альдостеронова система.
Адаптовано за K. Kario [70].
Відповідно до зазначених вище даних, СОАС – широко поширене порушення дихання під час сну, що характеризується періодичними змінами дихання протягом сну, пов’язаними з колапсом верхніх дихальних шляхів та розвитком апное/гіпопное і персистувальними дихальними зусиллями [54]. Кінець обструкції та відновлення вентиляції легень асоційовані з короткими пробудженнями від сну, інтермітуючою гіпоксією/гіперкапнією, підвищенням АТ та змінами серцевого ритму [83].
СОАС безпосередньо індукує негативний внутрішньогрудний тиск, зменшує стимуляцію легеневих рецепторів розтягування, підвищує стимуляцію хеморецепторів і спричиняє гіпоксемію, гіперкапнію та мікропробудження, а вони, своєю чергою, – активацію симпатичної нервової системи, оксидантний стрес, запалення, підвищення активності ренін-ангіотензин-альдостеронової системи (РААС), ендотеліальну дисфункцію, зниження чутливості барорепторів [6, 12, 70, 83]. У кінці обструктивної дихальної події зазвичай виникає мікропробудження, яке збільшує симпатичну активність, що разом із десатурацією зумовлює фрагментарний сон, унаслідок чого АТ підвищується [98].
Зміни внутрішньогрудного тиску
Періодичний негативний внутрішньогрудний тиск (максимум -80 мм рт. ст.) на додаток до раптового підвищення АТ уночі призводить до змін гемодинаміки та збільшення навантаження на шлуночки і передсердя. Як наслідок, розвиваються гіпертрофія ЛШ та ремоделювання лівого передсердя, що підвищує ризик розвитку СН та ФП [70, 83].
Інтермітуюча гіпоксія
За даними досліджень, проведених на моделях тварин, інтермітуюча гіпоксія, яка призводить до повторюваних циклів сатурації/десатурації, є основним механізмом, що відповідає за пов’язані з СОАС серцево-судинні та метаболічні ускладнення [9]. Роль інтермітуючої гіпоксії у розвитку АГ було продемонстровано на моделях тварин, а також у здорових добровольців [16, 122]. Автори вважають, що активація симпатичної нервової системи внаслідок інтермітуючої гіпоксії зумовлює підвищення АТ [122]. Інтермітуюча гіпоксемія спричиняє оксидантний стрес, а він, своєю чергою, – запальні реакції та пошкодження ендотелію [70]. Система ендотеліну також відіграє роль у розвитку АГ, спричиненої інтермітуючою гіпоксією [56]. Встановлено, що концентрація гіпоксія-індукованого фактора‑1α (HIF‑1α) значно підвищена у сироватці крові пацієнтів із СОАС порівняно зі здоровою контрольною групою [52]. HIF‑1α збільшує експресію мРНК НАДФН-оксидази 2 (NOX2), що призводить до зростання кількості активних форм кисню [13].
Роль вегетативної нервової системи
При СОАС відзначають зміни регуляції СС-системи вегетативною нервовою системою внаслідок активації симпатичної та зниження активності парасимпатичної нервової системи в результаті змін рівня CO2 та O2 (збільшення СO2 та зменшення O2) через епізоди апное/гіпопное [12, 83, 100]. Під час нічних епізодів гіпоксії раптове зростання активності симпатичної нервової системи призводить до підвищення АТ і частоти серцевих скорочень [70]. Окрім того, при СОАС відзначають зниження функції рецепторів розтягування легень, які пригнічують активацію симпатичної нервової системи [70]. Зміни вегетативної нервової системи (особливо надмірна активність симпатичної нервової системи, виявлена також у денні години) зменшуються при лікуванні СPAP [26, 113].
РААС
Як зазначено вище, повторні епізоди обструкції верхніх дихальних шляхів призводять до гіпоксії, що спричиняє активацію симпатичної нервової системи, а вона, своєю чергою, активує РААС [6, 12, 46, 70]. За даними дослідження D.S. Møller et al., у хворих на СОАС виявлене підвищення рівня альдостерону і ангіотензину II у плазмі крові, а концентрація останнього позитивно корелювала із рівнем денного АТ (САТ: r=0,49; р<0,01 та ДАТ: r=0,52; р<0,01) [94]. Це зумовлює спазм периферичних судин і підвищення АТ [6].
За результатами метааналізу 13 досліджень показано, що пацієнти з СОАС мають вищі рівні ангіотензину II та альдостерону, особливо у разі одночасно наявної АГ [67]. Надлишок альдостерону може спричиняти розвиток набряку тканин носоглотки і верхніх дихальних шляхів, що призводить до обструкції дихальних шляхів та прогресування СОАС [46]. Встановлено, що CPAP-терапія пов’язана зі зменшенням активності РААС та АТ, яке корелювало зі зниженням рівня реніну й ангіотензину II у плазмі крові [94, 96].
Цитокін-опосередкований ефект гіпоксемії
Гіпоксія стимулює периферичні хеморецептори; як наслідок, відбувається вивільнення маркерів запалення [66]. Встановлено, що СОАС корелює з підвищенням показників системного запалення: спостерігається більший вміст високочутливого С-реактивного білка, інтерлейкіну (ІЛ)-1, IЛ‑2, IЛ‑6, IЛ‑8, фактора некрозу пухлини альфа (TNF-α), гамма-інтерферону (IFNγ), RANTES та розчинних форм молекул міжклітинної адгезії (sICAM) [66, 123]. Ці маркери прямо й опосередковано пошкоджують ендотелій судин, а також викликають підвищену агрегацію тромбоцитів і призводять до оксидантного стресу та подальшого пошкодження ендотелію судин [66].
У низці досліджень було показано підвищену концентрацію cудинозвужувального ендотеліну‑1 у плазмі крові осіб із СОАС, середній нічний рівень якого корелював з ІАГ [18, 56, 66]. Окрім того, при СОАС відзначають активацію ядерного фактору каппа (NF-κB) [66]. Підвищення артеріальної жорсткості й тонусу судин є наслідками дії цих запальних маркерів [66]. Всі перераховані вище фактори вносять вклад у підвищення АТ у хворих на СОАС [6, 56].
Ремоделювання судин і ендотеліальна дисфункція
СОАС асоційований із ремоделюванням судин і ендотеліальною дисфункцією [9, 65]. В осіб із СОАС виявлено зниження рівня циркулювального оксид азоту і негативну кореляцію між нітритами/нітратами сироватки крові й такими параметрами: ІАГ (r= -0,389; p=0,001), часом десатурації (r= -0,346; p=0,004) і САТ (r = -0,335; р=0,005). Зменшення кількості продукції оксиду азоту та оксидантний стрес відіграють певну роль у розвитку АГ при СОАС [65].
До того ж встановлено, що СОАС й інтермітуюча гіпоксія асоційовані не тільки з ремоделюванням судин та АГ, але й атеросклерозом [9]. Це підтверджують результати роботи L.F. Drager et al., відповідно до яких у пацієнтів із СОАС, окрім судинного ремоделювання, виявлені ранні ознаки розвитку атеросклерозу [42].
Нічний перерозподіл рідини
Вночі рідина з нижніх кінцівок перерозподіляється у верхню частину тіла (зокрема, на шию), що викликає подальшу обструкцію дихальних шляхів і підвищення АТ [12, 118]. Окрім того, підвищений рівень альдостерону посилює затримку рідини, тим самим збільшуючи обструкцію верхніх дихальних шляхів [118].
Порушення якості сну
СОАС є однією з найважливіших причин погіршення якості сну [12, 76, 83]. Порушення або дефіцит сну також потенційно впливає на АГ [12]. За даними дослідження виявлено, що при хронічному безсонні з короткою тривалістю сну виявлений підвищений ризик розвитку АГ. Однак цей ефект багато в чому пояснювався ожирінням. В інших же роботах показано позитивну кореляцію між недосипанням та різними несприятливими факторами СС-ризику, такими як жорсткість артерій, ендотеліальна дисфункція, симпатична активність, нічний профіль АТ non-dipping та інсулінорезистентність [25, 29, 41, 49, 121].
Діагностика
Як було зазначено, СОАС часто не діагностується: 86‑95% осіб, виявлених при опитуванні населення із клінічно значущим СОАС, не повідомляли про попередній діагноз СОАС [32].
Метою первинного обстеження хворих, що страждають на АГ та СОАС, є [30]:
- визначення базового рівня пацієнта;
- аналіз наявності ФР;
- оцінка ураження органів-мішеней та потенційно виліковних причин СОАС;
- призначення індивідуалізованої терапії;
- визначення прогнозу.
Згідно з науковою позицією АНА, рекомендовано проводити скринінг на СОАС в осіб із резистентною / погано контрольованою АГ, легеневою гіпертензією та рецидивною ФП після кардіоверсії або абляції. У хворих на СН II‑IV функціонального класу за критеріями Нью-Йоркської асоціації серця (NYHA) із підозрою на розлади дихання під час сну або надмірною денною сонливістю доцільною є оцінка сну. У пацієнтів із тахі-бради-синдромом або шлуночковою тахікардією чи у хворих, які перенесли раптову серцеву смерть, та в них підозрюється СОАС, слід також розглянути можливість аналізу апное сну [133].
Відповідно до Уніфікованого клінічного протоколу первинної, екстреної та вторинної (спеціалізованої) медичної допомоги «Артеріальна гіпертензія» (2012), хворі на резистентну АГ підлягають обстеженню з метою виявлення вторинних причин АГ, зокрема виключення/підтвердження СОАС за наявності скарг на хропіння, апное уві сні та надмірну денну сонливість [2]. СОАС підозрюють на підставі симптомів (рис. 4), а підтверджують шляхом діагностичного тестування [133].
Рис. 4. Симптоми та діагноз СОАС
Примітка: Адаптовано за Y. Yeghiazarians et al. [133].
Висока поширеність та коморбідність СОАС у пацієнтів із ССЗ при поєднанні з доказами покращення результатів, настрою і продуктивності роботи під час лікування СОАС є обґрунтуванням для проведення скринінгу СОАС [92, 133]. Доступні підходи включають цілеспрямоване виявлення симптомів СОАС за допомогою анамнезу та використання відповідних опитувальників або приладів для скринінгу [133].
Загальновживані скринінгові опитувальники включають такі, як [34, 68]:
- берлінська анкета;
- опитувальник STOP-BANG;
- опитувальник STOP;
- шкала сонливості Епворта.
Слід звернути увагу на результати дослідження, згідно з якими у пацієнтів із тяжким перебігом СОАС (ІАГ ≥30) оцінка за шкалою сонливості Епворта була нижчою в осіб з АГ, ніж із нормотензією. Ця невідповідність може призвести до недооцінки тяжкого ступеня СОАС у хворих на АГ [116].
Тож запідозрити СОАС можна за допомогою простого опитувальника (шкалою сонливості Епворта), а діагноз СОАС встановлюють на основі нічного моніторингу дихання, параметрів сну і серця (з використанням полісомнографії або нічної серцево-респіраторної поліграфії), спрямованих на виявлення обструктивних подій та наступних змін насичення крові киснем [8, 19, 133].
Полісомнографічне дослідження є золотим стандартом діагностики СОАС [69]. Упродовж ночі проводять реєстрацію електроенцефалограми, електрокардіограми, електроокулограми, підборідної електроміограми, хропіння, вимірювання носового та ротового повітряного потоку, дихальних рухів грудної клітки, живота, рухів верхніх кінцівок, насичення крові киснем (пульсоксиметрія), а також відеозапис сну [133].
Діагностичні критерії СОАС
Діагностичне тестування можна проводити за допомогою нічних лабораторних, багатоканальних полісомнографій або домашніх тестів на апное. Згідно з науковою позицією АНА, діагноз встановлюють на основі таких аспектів, як [133]:
1. Наявність у пацієнта нічних порушень дихання (хропіння, сопіння, задишки, пауз у диханні під час сну) чи симптомів денної сонливості/втоми, що виникають незважаючи на достатню можливість для сну, за відсутності інших захворювань та якщо ІАГ або індекс дихальних розладів ≥5.
2. СОАС може бути діагностований за відсутності симптомів, якщо ІАГ або індекс дихальних розладів становить ≥15 епізодів/год.
Лікування СОАС
До методів лікування СОАС відносять такі, як CPAP, автотитрувальний АPAP (зміна тиску повітря відповідно до характеру дихання), BPAP (подача повітря із різним тиском для вдиху та видиху), адаптивна сервовентиляція, модифікація способу життя, зменшення маси тіла, позиційна терапія, внутрішньоротові пристрої, хірургія/нейростимуляція верхніх дихальних шляхів та баріатрична хірургія [6, 15, 38, 64, 109, 133].
Зміна способу життя і навчання хворих
Особам з ожирінням слід рекомендувати зменшити масу тіла, уникати вживання алкоголю, відмовитись від тютюнокуріння [33, 38, 102, 109, 133]. У рандомізованому контрольованому дослідженні (РКД) при оцінці впливу CPAP і зменшення маси тіла у пацієнтів із СОАС та ожирінням було встановлено, що втрата ваги у поєднанні зі CPAP-терапією приводили до зменшення інсулінорезистентності, вмісту тригліцеридів у сироватці крові, а також суттєвішого зниження САТ і середнього добового АТ [33].
Позиційна терапія
Хворим на СОАС не рекомендовано спати на спині. У пацієнтів із позиційно-залежним апное необхідно розглянути застосування спеціального жилету або пристрою (наприклад, Sleep Position Trainer) [133].
Внутрішньоротові пристрої
Найчастіше застосовують ортодонтичні апарати, що висувають нижню щелепу чи утримувачі язика, пристрої, які утримують м’яке піднебіння, і різноманітні силіконові капи [38]. При легкому та помірному СОАС можна рекомендувати пероральні внутрішньоротові пристрої як альтернативу лікуванню CPAP за бажанням хворого або особам, які не переносять CPAP [64, 109, 133]. При використанні внутрішньоротових апаратів відзначено вищу прихильність пацієнтів, ніж на тлі CPAP. Окрім того, при їх застосуванні спостерігалися зменшення сонливості, маркерів запалення і зниження АТ [23, 64, 133].
У метааналізі семи досліджень I.H. Iftikhar et al. показано, що лікування за допомогою внутрішньоротових пристроїв (наприклад, підйомників м’якого піднебіння, апаратів для утримання язика, просування нижньої щелепи) було ефективним для зниження АТ. Так, об’єднана оцінка середнього зниження САТ становила 2,7 мм рт. ст. (95% ДІ від -0,8 до -4,6; р=0,04), ДАТ – 2,7 мм рт. ст. (95% ДІ від -0,9 до -4,6; р=0,004) та середнього АТ – 2,4 мм рт. ст. (95% ДІ від -4,01 до -0,80; р=0,003). Автори зазначають, що більшість досліджень були обсерваційними, тому для підтвердження впливу внутрішньоротових пристроїв на АТ необхідні більша кількість РКД із залученням ширшої когорти пацієнтів та триваліший період лікування [64].
За даними метааналізу 51 дослідження також продемонстровано, що застосування як CPAP, так і пристроїв просування нижньої щелепи пов’язане зі зниженням АТ. При використанні апаратів для просування нижньої щелепи у хворих на СОАС порівняно із групою контролю (відсутність лікування чи плацебо) спостерігалося [23]:
- зниження САТ на 2,1 мм рт. ст. (95% ДІ 0,8‑3,4; p=0,008):
- зниження ДАТ на 1,9 мм рт. ст. (95% ДІ 0,5‑3,2; р=0,008).
Однак, за даними дослідження T.L. Giles et al. виявлено, що CPAP-терапія ефективніша у зменшенні дихальних порушень порівняно із внутрішньоротовими пристроями. Так, CPAP-терапія приводила до значного зменшення ІАГ, поліпшення якості сну пацієнтів, сатурації та добового АТ [55].
Оперативне лікування
Проведення увулопалатофарингопластики, тонзилектомії або щелепно-лицьової хірургії покращує клінічні результати. Зокрема, знижується рівень смертності, СС-ризик, зменшуються симптоми, поліпшується якість життя хворих тощо [6, 38, 133].
Імплантація стимулятора під’язикового нерва та баріатрична хірургія
R.C. Dedhia et al. виявили, що стимуляція під’язикового нерва зумовлювала значне поліпшення об’єктивних та суб’єктивних ознак тяжкості СОАС [38].
Баріатричну хірургію використовують у пацієнтів з ІМТ ≥35 кг/м2 та СОАС, що асоційована з ожирінням [133].
Лікування CPAP
Відповідно до настанов щодо лікування СОАС Американської академії медицини сну (AASM) та Європейського респіраторного товариства (ERS), CPAP-терапія є золотим стандартом лікування [100, 102]. Для даного методу застосовують апарати, які створюють постійний позитивний тиск у дихальних шляхах, що дозволяє зберігати їх у відкритому стані та запобігає спадінню. Пацієнтам із діагнозом СОАС помірного й тяжкого ступеня рекомендоване лікування CPAP із метою зменшення сонливості, покращення якості життя, зниження АТ тощо [102, 133]. Згідно з настановою AASM (2019) щодо ведення дорослих із СОАС за допомогою позитивного тиску (PAP) у дихальних шляхах, клініцисти мають використовувати CPAP або APAP для постійного лікування СОАС і розглянути призначення PAP порівняно з відсутністю терапії в осіб із коморбідними СОАС та АГ [102].
CPAP наразі є ефективною терапевтичною стратегією у пацієнтів із СОАС, хоча прихильність досі неоптимальна, є вельми низькою і становить 30‑60% [38, 100, 129].
PAP/CPAP приводить до клінічно значущого зниження тяжкості СОАС, а саме [55, 66, 102, 104, 115, 132]:
- зменшує кількість обструктивних подій, індексу десатурацій та фрагментації сну;
- зменшує денну сонливість, депресію (за шкалою сонливості Епворта);
- покращує якість життя, когнітивні функції;
- знижує АТ;
- зменшує/уповільнює темпи погіршення когнітивних функцій та може знижувати ризик розвитку деменції;
- знижує частоту дорожньо-транспортних подій (ДТП).
Саме тому використання PAP/CPAP є надзвичайно важливим у пацієнтів із СОАС [13]. Ефекти CPAP-терапії наведені на рисунку 5 [66].
Рис. 5. CPAP-терапія та її сприятливі ефекти
Примітки: ГЕРХ – гастроезофагеальна рефлюксна хвороба, ХОЗЛ – хронічне обструктивне захворювання легень.
Адаптовано за S. Jehan et al. [66].
Вплив CPAP-терапії на АТ
У пацієнтів з АГ, яка є вторинною щодо СОАС, контроль АТ можна покращити, якщо апное сну ефективно лікується CPAP. При цьому слід враховувати причинно-наслідкові зв’язки між СОАС та АГ, а зниження тяжкості СОАС безпосередньо впливатиме на тяжкість або розвиток АГ [103, 113]. За даними досліджень здебільшого виявлено, що CPAP-терапія приводить до зниження АТ, частоти серцевих скорочень, ризику розвитку ССЗ, а також пов’язаної з цим смертності [66]. Лікування може впливати на АТ за допомогою декількох механізмів, зокрема зменшення активності симпатичної нервової системи [66, 113].
У всіх випадках СОАС CPAP залишається основною використовуваною терапією, але її вплив на зниження АТ у пацієнтів з АГ та СОАС суперечливий [6, 15, 55, 59, 85, 71, 95]. В одних дослідженнях продемонстовано позитивний ефект лікування на рівень АТ, в інших же виявлено відсутність впливу, або зміни рівня АТ були статистично незначущі [14, 15, 27, 40, 47, 61, 84, 95, 132]. У таблиці представлені результати досліджень щодо ефекту CPAP на АТ в осіб із СОАС та АГ.
Лікування CPAP знижує АТ і покращує його контроль у пацієнтів, які страждають на порушення дихання під час сну (при використанні CPAP ≥4 год/ніч) [48, 85]. За даними випробувань, CPAP-терапія зменшувала нічний викид катехоламінів і внаслідок цього – підйом АТ, але загальне зниження АТ було незначним (1,3‑3 мм рт. ст.) [59, 71]. Незважаючи на це, CPAP покращує серцево-судинні та цереброваскулярні наслідки шляхом зменшення смертності внаслідок інсульту на 6‑8% та ІХС – на 4‑5% [78, 125]. За результатами обсерваційного дослідження, лікування CPAP пов’язане з достовірним зниженням нефатальних (нефатальний ІМ та інсульт, аортокоронарне шунтування, перкутанна коронарна ангіопластика) та фатальних (смерть від ІМ чи інсульту) СС-подій у чоловіків із тяжким СОАС [87].
Однак, за даними роботи R.D. McEvoy et al., CPAP-терапія не запобігала розвитку СС-ускладнень у пацієнтів із помірним/тяжким СОАС та встановленими ССЗ [92]. В Іспанії F. Barbé et al. провели багатоцентрове РКД за участю 725 пацієнтів із СОАС (ІАГ ≥20 подій/год), в яких була відсутня денна сонливість. Було продемонстровано, що призначення CPAP порівняно із групою без даної терапії не привело до статистично значущого зниження частоти випадків АГ або СС-подій (як-от нефатальний ІМ та інсульт, транзиторна ішемічна атака, госпіталізація із приводу нестабільної стенокардії чи аритмії, СН та раптова серцева смерть) [15].
Цікаві результати отримані у дослідженні D.S. Møller et al., відповідно до яких тривале лікування CPAP (упродовж 14 місяців) зумовлювало зниження АТ, що корелювало зі зменшенням вмісту реніну (r=0,76 до 0,92; усі р<0,01) й ангіотензину II у плазмі крові (r=0,58 до 0,81; усі р<0,05) [94]. За наявними даними, при CPAP-терапії спостерігалися значне збільшення оксиду азоту в сироватці крові після застосування CPAP (p=0,01) та зменшення продукції активних форм кисню [65, 114]. У групі хворих на СОАС, які отримували лікування CPAP упродовж чотирьох місяців, мало місце зменшення каротидно-феморальної швидкості поширення пульсової хвилі, концентрації С-реактивного білка та катехоламінів, тоді як зміни у контрольній групі (без CPAP-терапії) не були значущими [42].
Результати випробування M.A. Martinez-Garcia et al. показали, що лікування CPAP в осіб із погано контрольованою АГ та СОАС суттєво знижувало САТ (на 5,2 мм рт. ст.), особливо нічні значення (на 6,1 мм рт. ст.), але не ДАТ. Окрім того, на CPAP-терапії значно збільшився відсоток пацієнтів із нормалізацією нічного профілю АТ (з 9,1 до 36,4%) [90]. Також доступні дані, що СОАС дещо зменшує середній добовий АТ та нічну варіабельність АТ (beat-by-beat) за рахунок відсутності нічного раптового підвищення. У деяких хворих лікування СОАС змінює профіль АТ non-dipping на dipping, а усунення варіабельності АТ знижує СС-ризик [88]. Однак метааналіз РКД M. Alajmi et al. показав, що ефекти CPAP на АТ були незначними і статистично незначущими [7].
За даними метааналізу 12 РКД, проведеного P. Haentjens et al., лікування CPAP приводило до зниження добового амбулаторного середнього АТ на 1,69 мм рт. ст. (95% ДІ від -2,69 до -0,69) за суттєвішого зниження середнього АТ у пацієнтів із тяжчим ступенем СОАС та кращим ефективним використанням CPAP вночі. При проведенні метарегресійного аналізу встановлено очікуване зниження добового середнього АТ на 1,39 мм рт. ст. за кожне збільшення на 1 год ефективного застосування CPAP (p=0,01), яке сприяє кращому прогнозу з точки зору несприятливих СС-подій [59].
Метааналіз випадкових ефектів (29 РКД) у групі CPAP порівняно із пасивним лікуванням (фіктивний CPAP, таблетки плацебо, консервативні заходи) продемонстрував середню різницю САТ та ДАТ 2,6±0,6 і 2,0±0,4 мм рт. ст. відповідно (р<0,001). Зниження САТ і ДАТ при добовому амбулаторному моніторингу спостерігали також C. Fava et al. Середня різниця САТ та ДАТ становила 2,2±0,7 і 1,9±0,6 мм рт. ст. вдень та 3,8±0,8 і 1,8±0,6 мм рт. ст. вночі відповідно. При проведенні метарегресійного аналізу вищий вихідний ІАГ був пов’язаний із більш значущим середнім зниженням САТ (beta±SE; 0,08±0,04) [48].
Згідно з результатами метааналізу 51 дослідження D.J. Bratton et al., лікування CPAP асоціювалося зі зниженням САТ на 2,5 мм рт. ст. (95% ДІ 1,5‑3,5; р<0,001) та ДАТ – на 2,0 мм рт. ст. (95% ДІ 1,3‑2,7; р<0,001) порівняно з контролем (відсутність лікування чи плацебо). Збільшення середнього використання CPAP на 1 год/ніч корелювало з додатковим зниженням САТ на 1,5 мм рт. ст. (95% ДІ 0,8‑2,3; р<0,001) і ДАТ – на 0,9 мм рт. ст. (95% ДІ 0,3‑1,4; р=0,001) [23]. При виконанні метааналізу 7 РКД у трьох мало місце зниження ДАТ у хворих на СОАС на тлі лікування CPAP, а у чотирьох не спостерігалося суттєвої різниці у впливі CPAP на АТ при порівнянні груп хворих, що отримували / не отримували CPAP [93].
За результатами метааналізу 16 РКД, проведеного A.S. Schein et al., застосування CPAP приводило до зниження:
- офісного САТ (на 3,20 мм рт. ст.; 95% ДІ від -4,67 до -1,72) та ДАТ (на 2,87 мм рт. ст.; 95% ДІ від -5,18 до -0,55);
- нічного САТ (на 4,92 мм рт. ст.; 95% ДІ від -8,70 до -1,14);
- середньодобового АТ (на 3,56 мм рт. ст.; 95% ДІ від -6,79 до -0,33);
- середньонічного АТ (на 2,56 мм рт. ст.; 95% ДІ від -4,43 до -0,68);
- середньодобового ДАТ (на 3,46 мм рт. ст.; 95% ДІ від -6,75 до -0,17).
Однак істотних змін денного САТ і ДАТ не спостерігалося [113].
Метааналіз 7 РКД X. Hu et al. показав, що лікування CPAP асоційоване зі зниженням добового амбулаторного САТ (на 2,32 мм рт. ст.; 95% ДІ від -2,82 до -1,14) і ДАТ (на 1,98 мм рт. ст.; 95% ДІ від -2,82 до -1,14). Терапія CPAP зумовлювала суттєвіше зниження нічного САТ, ніж денного АТ. Аналіз підгруп продемонстрував, що пацієнти з резистентною АГ або ті, хто отримував антигіпертензивні препарати, мали виразніший ефект СРАР. Згідно з метарегресійним аналізом, прихильність до CPAP, вік та вихідний рівень САТ позитивно корелювали зі зниженням добового ДАТ, але не САТ [62].
Відповідно до метааналізу, проведеного експертами AASM, терапія PAP в осіб із помірним/тяжким СОАС та АГ пов’язана із клінічно значущим зниженням нічного САТ та ДАТ на 3,9 мм рт. ст. (95% ДІ від -6,5 до -1,4) і 3,0 мм рт. ст. (95% ДІ від -5,3 до -0,8) відповідно та денного САТ/ДАТ – на 2,7 і 2,4 мм рт. ст. (95% ДІ від -4,9 до -0,5 та від -3,9 до -0,9) відповідно. Крім того, терапія PAP корелювала із клінічно значущим зниженням добового САТ і ДАТ на 2,5 мм рт. ст. (95% ДІ від -4,3 до -0,8) та 2,2 мм рт. ст. (95% ДІ від -3,4 до -1,0) відповідно та середньодобового АТ на 2,2 мм рт. ст. (95% ДІ від -3,6 до -0,7). Загалом аналіз показав, що використання PAP знижує АТ у хворих на СОАС і АГ [102].
При використанні CPAP-терапії відзначають індивідуальні відмінності у зниженні АТ. Виявлено сприятливий вплив лікування CPAP на зниження АТ залежно від особливостей гіпертензивних пацієнтів [70].
Детермінанти ефективного зниження АТ при застосуванні CPAP-терапії у гіпертензивних пацієнтів із СОАС [70]
Характеристика
- Ожиріння (збільшення ІМТ)
- АТ
- вищий рівень АТ перед лікуванням
- нелікована АГ
- нічна АГ
- резистентна АГ
Фактори СОАС
- Тяжкий СОАС (ІАГ >30)
- СОАС із денною сонливістю
Фактори CPAP
- Адекватна прихильність до CPAP,
- використання >3 год/ніч
- Тривале застосування CPAP
- Ефективність CPAP
(зниження ІАГ >50%)
Вплив CPAP на АТ при резистентній АГ
Використання CPAP протягом двох місяців в осіб із СОАС та резистентною АГ супроводжувалося зниженням середньодобового САТ та ДАТ на 11,0±4,4 і 5,7±2,5 мм рт. ст. відповідно. Крім того, як нічні, так і денні значення САТ суттєво знизилися (на 14,4±4,4 та 9,3±3,9 мм рт. ст. відповідно), а ДАТ вночі знизився на 7,8±3,0 мм рт. ст. [82]. У дослідженні T.A. Dernaika et al. встановлено, що при лікуванні CPAP середня різниця середнього АТ становила -5,6 мм рт. ст. (95% ДІ від -2,0 до -8,7; p=0,03) у групі хворих на резистентну АГ та -0,8 мм рт. ст. (95% ДІ від -2,9 до 3,3; p=0,53) у пацієнтів із контрольованим АТ наприкінці тримісячного періоду спостереження. Необхідно зазначити, що застосування CPAP-терапії дозволило зменшити кількість антигіпертензивних препаратів у 71% осіб із резистентною АГ, але істотно не змінило режиму терапії у контрольній групі [40].
Згідно з результатами метааналізу 5 РКД L. Liu et al., сукупні зміни після лікування CPAP у пацієнтів із СОАС та резистентною АГ, за даними 24-годинного амбулаторного моніторингу САТ та ДАТ, становили -4,78 мм рт. ст. (95% ДІ від -7,95 до -1,61) та -2,95 мм рт. ст. (95% ДІ від -5,37 до -0,53) на користь групи CPAP. CPAP-терапія також була пов’язана зі зниженням нічного ДАТ (середня різниця – 1,53 мм рт. ст., 95% ДІ від -3,07 до 0) [80]. Однак в іншому дослідженні було показано, що лікування CPAP упродовж п’яти місяців не мало значущого впливу на АТ в осіб із резистентною АГ та помірним/тяжким СОАС [95].
Метааналіз, проведений експертами AASM у хворих на СОАС (помірний/тяжкий) та резистентну АГ продемонстрував, що ефект терапії РАР був клінічно значущим. На тлі лікування СРАР спостерігалося зниження нічного САТ і ДАТ (на 3,3 мм рт. ст.; 95% ДІ від -6,1 до -0,4) та 2,2 мм рт. ст. (95% ДІ -4,4 до 0,0) відповідно, денного ДАТ (на 1,1 мм рт. ст.; 95% ДІ від -3,4 до +1,1) та добового САТ/ДАТ (на 2,2 мм рт. ст.; 95% ДІ від -5,1 до 0,8 і 2,1 мм рт. ст.; 95% ДІ від -4,1 до 0,0) відповідно, а також незначуще зниження денного САТ. Загалом аналіз показав, що використання PAP зменшує нічний і середній добовий АТ у дорослих переважно із помірним та тяжким СОАС і резистентною АГ [102].
Насамкінець, згідно з результатами РКД за участю 60 пацієнтів із резистентною АГ та помірним/тяжким СОАС, проведеного E. Warchol-Celinska et al., ниркова денервація значно знижувала офісний та амбулаторний АТ через 3 і 6 місяців після процедури, за помірного зменшення тяжкості СОАС [128].
Таким чином, результати РКД показали, що використання PAP-терапії знижує АТ у хворих на СОАС, особливо помірний і тяжкий [102]. Хоча загальна користь CPAP щодо зниження АТ є незначною, вигода на індивідуальній основі може бути суттєвою. Загалом АТ знижується більшою мірою у тих пацієнтів, які мають тяжчий СОАС, в осіб із резистентною АГ та при тривалішому використанні CPAP [15, 46, 84, 90]. Відповідно, слід застосовувати CPAP як для поліпшення денних симптомів СОАС, так і для зниження АТ, враховуючи той факт, що ступінь користі значно відрізнятиметься.
Відмінності у результатах досліджень слід тлумачити обережно, з огляду на відмінності у дизайні, включення гетерогенних груп хворих та характеристики СОАС (які можуть по-різному впливати на зниження АТ під впливом терапії РАР), різну тривалість терапії СРАР і комплаєнс хворих, варіації у режимі лікування РАР [102, 110].
Оскільки природа АГ є багатофакторною, ефект від CPAP ще має бути встановлено [6]. Покращення прихильності до лікування CPAP сприяє більш значущому зниженню АТ, проте залишається неясним, чи це відображає ефект від PAP-терапії чи дотримання пацієнтами терапії в цілому [62, 63, 102].
Антигіпертензивна фармакотерапія
Лікування АГ при СОАС зазвичай потребує як антигіпертензивної медикаментозної терапії, так і лікування СОАС [6, 88]. Початкові кроки при веденні хворих на АГ спрямовані на [30, 130]:
- визначення ФР;
- встановлення ураження органів-мішеней;
- оцінку наявності супутніх захворювань.
Вплив антигіпертензивних препаратів на тяжкість СОАС неоднозначний. Тільки у декількох дослідженнях порівнювали різні антигіпертензивні препарати, однак доказовість була низькою через невелику кількість пацієнтів [100]. Також у малій кількості випробувань порівнювали ефективність щодо зниження АТ CPAP та антигіпертензивних препаратів [105, 124].
J.L. Pépin et al. у РКД із перехресним дизайном вивчали дію валсартану та CPAP-терапії у хворих на СОАС та АГ, які раніше не лікувалися. Зміна середньодобового АТ становила -2,1±4,9 мм рт. ст. (р<0,01) при CPAP та -9,1±7,2 мм рт. ст. на тлі приймання валсартану (р<0,001), з різницею -7,0 мм рт. ст. (95% ДІ від -10,9 до -3,1; р<0,001). Відмінності були значущими не тільки вдень, але й уночі: зміна середнього АТ вночі при CPAP становила -1,3±4,6 мм рт. ст. (незначуще) та –-7,4±8,4 мм рт. ст. при застосуванні валсартану (р<0,001), різниця була -6,1 мм рт. ст. (95% ДІ від -10,8 до -1,4; р<0,05). Таким чином, хоча при лікуванні СРАР мало місце зниження АТ, застосування валсартану чинило у чотири рази вищий антигіпертензивний ефект, ніж CPAP [105].
За даними іншого дослідження, приймання лозартану значно знижувало САТ, ДАТ та середній АТ в обох групах (без СОАС на 12,6; 7,2 та 9,0 мм рт. ст.; із СОАС на 9,8; 5,7 та 6,1 мм рт. ст. відповідно). Додаткове лікування CPAP несуттєво змінило значення середньодобового АТ, але знизило нічний САТ на 4,7 мм рт. ст. Усі середньодобові показники АТ значно знизилися у пацієнтів із СОАС, які застосовували CPAP принаймні 4 год/ніч. Тож зниження АТ на тлі використання лозартану було меншим в осіб із СОАС, ніж без СОАС. Додаткова терапія CPAP не привела до значних змін у добових показниках АТ, за винятком пацієнтів, які ефективно використовували CPAP (>4 год/ніч) [124].
Таким чином, ці дослідження продемонстрували, що поєднання антигіпертензивних ліків та CPAP має додатковий позитивний вплив на АТ в осіб із СОАС, але ефект суттєвий тоді, коли пацієнт має високу прихильність до CPAP-терапії. Незважаючи на те, що CPAP знижує рівень АТ, антигіпертензивну фармакотерапію показано хворим на СОАС та АГ, оскільки вона значно знижує АТ порівняно з лікуванням СРАР [13]. До того ж проведений систематичний огляд і метааналіз 5 РКД та шести проспективних досліджень показав, що антигіпертензивні засоби чинять статистично значуще, хоча і несуттєве, зменшення тяжкості СОАС, яке може бути виразнішим при застосуванні діуретиків [75].
Лікування АГ включає поради щодо модифікації способу життя, як-то зменшення маси тіла при ожирінні, регулярні фізичні вправи, відмова від куріння, помірне вживання алкоголю та низькокалорійна дієта (зокрема, обмеження натрію, збільшення споживання фруктів і овочів), а також застосування антигіпертензивної фармакологічної терапії [66, 130]. Антигіпертензивні препарати призначають відповідно до рекомендацій ESC та ESH 2018 р. [130].
Існує точка зору, що оскільки АГ при СОАС може розвиватися, зокрема, внаслідок вивільнення катехоламінів у результаті активації симпатичної нервової системи та РААС, призначення β-блокаторів та антагоністів альдостерону може бути оптимальним варіантом лікування [6]. До того ж антагоніст альдостерону спіронолактон ефективний у зменшенні тяжкості СОАС та зниженні АТ у пацієнтів із резистентною АГ та СОАС [53, 131].
Висновки
Таким чином, СОАС асоційований із підвищенням загального рівня смерті та серцево-судинної захворюваності й летальності. СОАС і АГ – захворювання, що взаємопов’язані: СОАС часто діагностують у пацієнтів з АГ, а АГ своєю чергою поширена при СОАС, що потребує широкого впровадження скринінгу на наявність СОАС в осіб з АГ. Хворі на АГ, які мають ФР СОАС та симптоми чи ознаки, асоційовані зі збільшенням поширеності СОАС (наприклад, СН, перенесений інсульт, ФП, АГ, ЦД), мають проходити обстеження на предмет обструктивних дихальних подій під час сну. В осіб з АГ лікарі повинні звертати увагу на ознаки/симптоми, характерні для СОАС, проводити діагностику і призначати відповідне лікування для покращення контролю АТ, якості життя та прогнозу таких хворих.
Ефективнішим лікуванням АГ у хворих на СОАС є комбіноване застосування антигіпертензивних препаратів разом із CPAP-терапією, що продемонструвало значний адитивний вплив на АТ. Своєю чергою лікування CPAP чинить сприятливий ефект на ознаки і симптоми СОАС, тим самим покращуючи самопочуття пацієнтів із СОАС і АГ. Вплив CPAP-терапії на АТ помірний, але навіть незначне зниження АТ може впливати на запобігання розвитку СС-подій.
Насамкінець важливо підкреслити, що з пацієнтами необхідно проводити навчання щодо підвищення прихильності до призначеного лікування, зокрема CPAP-терапії, тривалість якої впливає на зниження АТ.
Список літератури знаходиться в редакції
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 4 (77) 2021 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Інколи саме з цього перерізу вдається візуалізувати тромбоемболи в основних гілках легеневої артерії або вегетації на стулках легеневого клапана (що трапляється надзвичайно рідко). Нахиливши датчик до самої верхівки серця, можна отримати її переріз по короткій осі, на якому, знову ж таки, порожнина лівого шлуночка має круглясту форму, а правого шлуночка – близьку до трикутника із виразною трабекулярністю (рис. 22.9). Розглядаючи зображення, також звертають увагу на те, що в нормі всі сегменти ЛШ скорочуються синхронно, не випереджаючи інші і не відстаючи. ...
Застосування статинів середньої інтенсивності в комбінації з езетимібом порівняно зі статинами високої інтенсивності окремо може забезпечити більше зниження рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) у пацієнтів із нещодавнім ішемічним інсультом. Пропонуємо до вашої уваги огляд статті Keun-Sik Hong et al. «Moderate-Intensity Rosuvastatin Plus Ezetimibe Versus High-Intensity Rosuvastatin for Target Low-Density Lipoprotein Cholesterol Goal Achievement in Patients With Recent Ischemic Stroke: A Randomized Controlled Trial», опублікованої у виданні Journal of Stroke (2023; 25(2): 242‑250). ...
Артеріальна гіпертензія (АГ) сьогодні є одним із найпоширеніших серцево-судинних захворювань (ССЗ), що асоціюється з високим кардіоваскулярним ризиком, особливо в коморбідних пацієнтів. Навіть помірне підвищення артеріального тиску (АТ) пов’язане зі зменшенням очікуваної тривалості життя. До 40% хворих на АГ не підозрюють у себе недугу, бо це захворювання на початку може мати безсимптомний перебіг. Оптимальний контроль АТ є вагомим чинником профілактики фатальних серцево-судинних подій (ССП) для забезпечення якісного та повноцінного життя таких хворих. ...