Аспекти лікування хворих на ревматичну поліміалгію
Ревматична поліміалгія (РПМ) – запальне захворювання, що супроводжується болем і скутістю м’язів шиї, плечового пояса та стегон. РПМ переважно вражає дорослих віком від 50 років, найчастіше жінок. Італійське товариство ревматологів (SIR) розробило настанову щодо ведення пацієнтів із ревматичною поліміалгією. Ключова мета – надання обґрунтованих та чітких рекомендацій на основі систематичного огляду літератури на допомогу лікарям різного фаху, як-то ревматологи, лікарі загальної практики, терапевти, геріатри, фізіотерапевти, реабілітологи тощо, для досягнення оптимального ведення дорослих пацієнтів із РПМ. Пропонуємо до вашої уваги основні положення цього документа.
Найвищу захворюваність на РПМ зареєстровано в осіб після 65 років, яка зростає у віці від 70 до 80 років. Серед населення країн Середземномор’я спостерігається нижча частота РПМ порівняно з мешканцями країн Північної Європи та особами скандинавського походження (Schaufelberger et al., 1995; González-Gay et al., 2017).
Для РПМ характерний швидкий початок, зустрічаються також форми із повільним («тліючим») та прогресувальним перебігом. Клінічні прояви РПМ включають біль і скутість у плечах, а також у проксимальних відділах рук, шиї, тазового пояса, стегон, які зазвичай двосторонні. Прояви скутості переважно неоднорідні й нерідко частково співпадають із болем (Mackie et al., 2015). Зазвичай біль триває більш ніж 45 хв в уражених ділянках, поступово зменшується від самого ранку і впродовж дня і погіршується після відпочинку. Окрім того, часто мають місце такі конституційні симптоми, як слабкість, втрата ваги та лихоманка (González-Gay et al., 2017).
Діагноз РПМ підозрюється, коли типові симптоми підтверджуються результатами лабораторних досліджень, як-то підвищена швидкість осідання еритроцитів (ШОЕ) та/або С-реактивний білок (СРБ). Ультразвукове дослідження (УЗД) або магнітно-резонансна томографія (МРТ) можуть бути корисними для оцінки наявності субдельтоподібного бурситу, теносиновіту двоголового м’яза плеча, синовіту плечового суглоба та/або тазостегнового бурситу, що підвищує точність діагностики (Dejaco et al., 2018).
Відповідні диференціальні діагнози включають ревматоїдний артрит у літньому віці, хворобу відкладення кристалів кальцію пірофосфату дигідрату, інфекції, злоякісні пухлини та, зокрема, гігантоклітинний артеріїт, який асоційований із РПМ у 10‑30% випадків (Michet, Matteson, 2008). У зв’язку з цим усіх пацієнтів із РПМ слід ретельно обстежувати на наявність симптомів та ознак гігантоклітинного артеріїту, що включають нещодавній головний біль, різке порушення зору (особливо монокулярну втрату зору), хронічний вивих нижньої щелепи, болючість або зменшення пульсації скроневої артерії (Salvarani et al., 2012).
Раннє виявлення, направлення до фахівців та лікування РПМ є дуже важливими аспектами ведення таких хворих (Sobrero et al., 2018). Клінічна відповідь на терапію, профілактика та моніторинг побічних ефектів – значущі складові комплексної програми лікування РПМ.
Матеріали й методи
Робоча група із залученням мультидисциплінарної команди виконала систематичний пошук літератури у базах даних Medline (через PubMed) та Embase із застосуванням структури запитань PICO (популяція, втручання, порівняння, результат). До аналізу були включені рекомендації з РПМ міжнародних наукових товариств, опубліковані з січня 2009 р. по січень 2019 р. Критерії виключення: неналежний дизайн дослідження, редакційні статті, коментарі, тезиси конференцій, описові/систематичні огляди; погана методологія та звітність; неоригінальні рекомендації (тобто дублювання або адаптація).
Кожну настанову було оцінено відповідно до рівня доказовості та сили рекомендацій за допомогою критеріїв Оксфордського центру доказової медицини 2009 р. (таблиця).
Результати
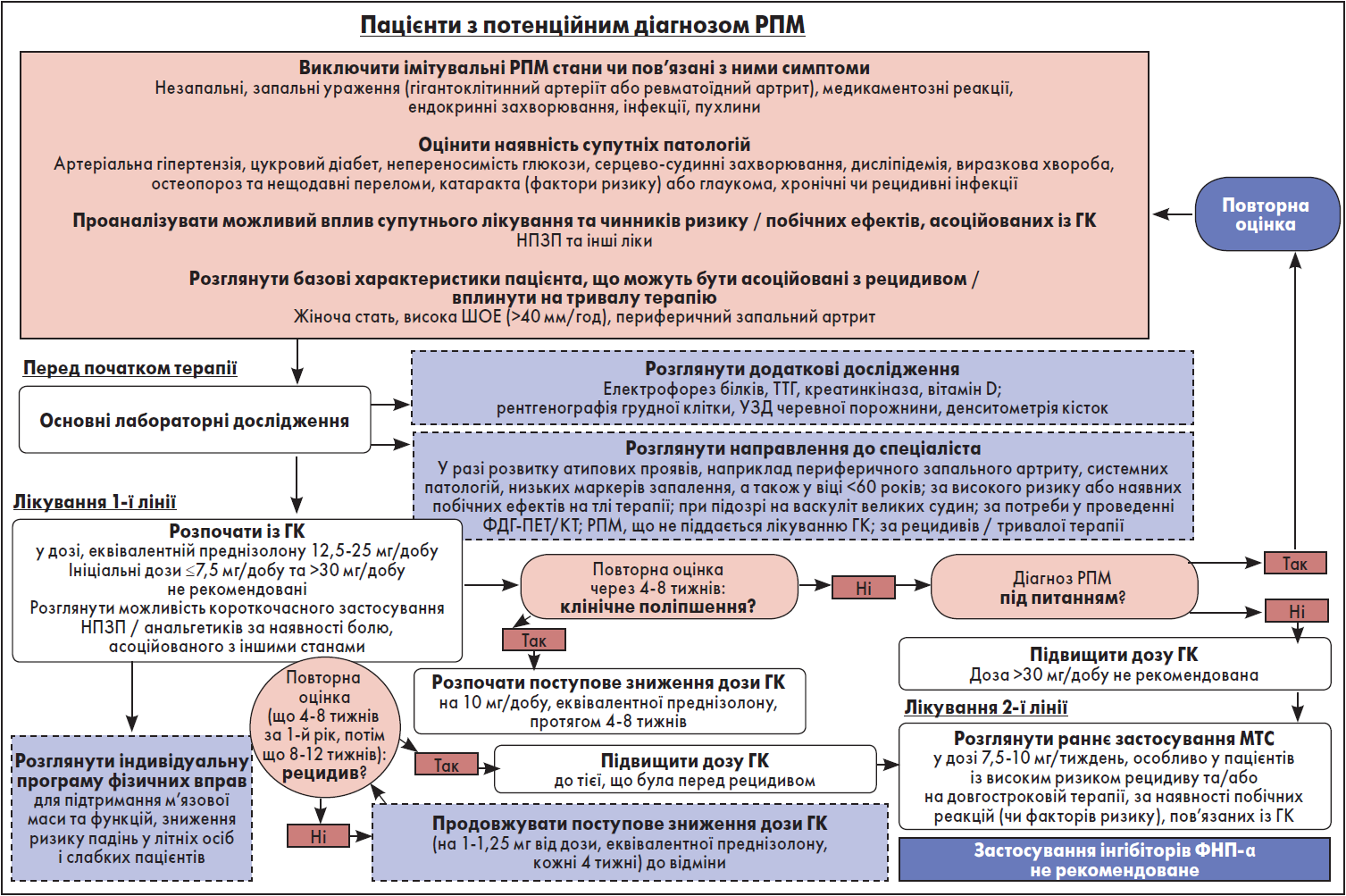
Усім критеріям відбору відповідали три оригінальні настанови, на основі яких були сформульовані рекомендації з лікування РПМ (Dejaco et al., 2015; Buttgereit et al., 2018; Slart et al., 2018). Алгоритм ведення пацієнтів із РПМ наведений на рисунку.
Рисунок. Терапія пацієнтів із РПМ
Примітки: РФ – ревматоїдний фактор, МТС – метотрексат, ФНП – фактор некрозу пухлин, АЦЦП – антитіла до циклічного цитрулінового пептиду, ТТГ – тиреотропний гормон, ФДГ-ПЕТ/КТ – позитронно-емісійна томографія із фтордезоксиглюкозою у поєднанні з комп’ютерною томографією.
Клінічна оцінка осіб із РПМ
За наявності достатньої кількості клінічних даних для встановлення діагнозу РПМ необхідний спеціальний підхід для виключення станів чи пов’язаних із ними симптомів, що можуть імітувати РПМ. Наприклад, це можуть бути незапальні, запальні ураження (гігантоклітинний артеріїт або ревматоїдний артрит), медикаментозні реакції, ендокринні захворювання, інфекції, пухлини (5, D).
При веденні пацієнта із РПМ слід враховувати такі моменти:
- Важливість визначення супутніх патологій, зокрема артеріальної гіпертензії, цукрового діабету, непереносимості глюкози, серцево-судинних захворювань, дисліпідемії, виразкової хвороби, остеопорозу (особливо нещодавніх переломів), катаракти (факторів ризику) або глаукоми, хронічних чи рецидивних інфекцій.
- Необхідність контролю сумісного застосування нестероїдних протизапальних препаратів (НПЗП), інших ліків та факторів ризику побічних ефектів, асоційованих із глюкокортикоїдами (5, D).
- Роль факторів ризику рецидиву / тривалої терапії поки неясна. Вихідними чинниками, які були пов’язані з вищою частотою повторних епізодів та/або могли вплинути на довгострокове лікування у дослідженнях РПМ, були: жіноча стать, висока ШОЕ (>40 мм/год) та периферичний запальний артрит (5, D).
Лабораторні обстеження
Кожен пацієнт із РПМ спершу має пройти низку обстежень, щоб виключити потенційні стани, що імітують РПМ, та призначити оптимальну терапію. Потрібно визначити рівень СРБ та/або ШОЕ, ревматоїдний фактор, антитіла до циклічного цитрулінового пептиду, виконати аналізи сечі, крові (вміст глюкози, креатиніну), функціональні проби печінки, оцінити характеристики кісток (включно з кальцієм, лужною фосфатазою). Також можна розглянути доцільність проведення електрофорезу білків, вимірювання тиреотропного гормону і креатинкінази (5, D).
На розсуд лікаря можуть бути розглянуті додаткові дослідження, такі як рентгенографія грудної клітки, ультразвукове дослідження черевної порожнини та денситометрія кісток (5, D). Позитронно-емісійна томографія із фтордезоксиглюкозою у поєднанні з комп’ютерною томографією (ФДГ-ПЕТ/КТ) продемонструвала високу діагностичну ефективність при РПМ (2, В).
Направлення до спеціаліста
Необхідність направлення до спеціаліста варто розглядати за розвитку атипових проявів, наприклад периферичного запального артриту, системних патологій, низьких маркерів запалення, а також у віці <60 років. Окрім того, хворому потрібно звернутися до фахівця у разі високого ризику або вже наявних побічних ефектів, пов’язаних із терапією, РПМ, що не піддається лікуванню глюкокортикоїдами (ГК), та/або виникнення рецидивів / тривалої терапії (5, D).
Лікування РПМ
Терапія першої лінії
Пацієнтам із РПМ рекомендоване призначення ГК на відміну від НПЗП, за винятком можливого короткочасного застосування НПЗП та/або анальгетиків у разі наявності болю, асоційованого з іншими станами (4, С). Терапію ГК слід розпочинати одразу ж після встановлення діагнозу РПМ (5, D).
Добову дозу ГК як ініціального лікування слід визначати відповідно до індивідуальних особливостей хворого, що має бути еквівалентною мінімальній ефективній дозі преднізолону 12,5‑25 мг/добу. Використання преднізолону у вищій початковій дозі доцільно розглядати у пацієнтів зі значною імовірністю рецидиву та низьким ризиком розвитку несприятливих явищ. Своєю чергою в осіб із супутніми захворюваннями (як-то цукровий діабет, остеопороз, глаукома тощо) та іншими факторами ризику побічних ефектів, пов’язаних із ГК, можливе застосування препарату в меншій дозі. Ініціальні дози ≤7,5 мг/добу та >30 мг/добу не рекомендовані (2, В).
Графік зниження дози повинен бути індивідуалізований та базуватися на регулярному моніторингу активності хвороби, лабораторних маркерів та побічних ефектів. При поліпшенні стану можна розглянути поступове зменшення дози ГК на 10 мг/добу, еквівалентної преднізолону, протягом 4‑8 тижнів. У разі рецидиву дозу слід підвищити до тієї, що була до зміни, і поступово знижувати (упродовж 4‑8 тижнів) до дози, за якої стався рецидив.
Після досягнення ремісії дозу преднізолону можна зменшувати на 1 мг кожні чотири тижні (або на 1,25 мг, наприклад за схемою приймання 10/7,5 мг через день) до відміни, якщо зберігається ремісія (5, D). При лікуванні пероральними ГК слід віддавати перевагу одноразовій дозі, а не декільком нижчим протягом дня (5, D).
Тривалість терапії ГК має бути індивідувалізованою у кожного пацієнта із РПМ та, за можливості, короткочасною у разі досягнення оптимальної ефективності (5, D).
Терапія другої лінії
Слід розглянути раннє введення метотрексату (МТС) на додаток до ГК, особливо у пацієнтів із високим ризиком рецидиву та/або на довгостроковій терапії, а також у разі наявності факторів ризику, коморбідних захворювань та/або супутнього лікування, коли ймовірний розвиток побічних реакцій, пов’язаних із ГК. Під час подальшого спостереження за хворим також можна розглядати доцільність застосування МТС в осіб із рецидивом або несприятливими явищами на тлі лікування ГС. У клінічних випробуваннях МТС використовувався перорально у дозі 7,5‑10 мг/тиждень (1, А).
Застосування інгібіторів фактора некрозу пухлини α (ФНП-α) для лікування РПМ не рекомендоване (1, А). Специфічні рекомендації щодо інших біологічних препаратів, включно з інгібіторами інтерлейкіну‑6, відсутні.
Нефармакологічні інтервенції
Для пацієнтів із РПМ слід розглянути індивідуальну програму фізичних вправ, спрямовану на підтримання м’язової маси та функцій, а також зниження ризику падінь, особливо у літніх осіб, які перебувають на тривалій терапії ГК, а також у слабких пацієнтів (5, D).
Мішені лікування та подальше спостереження
Метою лікування пацієнтів із РПМ є забезпечення найкращої медичної допомоги, що має ґрунтуватися на спільному рішенні, прийнятому пацієнтом та лікарем (5, D). Для хворих на РПМ слід розробити індивідуальний план терапії. При виборі початкової дози ГК та подальшому її зменшенні варто враховувати точку зору та вподобання пацієнта (5, D). Пацієнти повинні мати доступ до необхідної інформації з акцентом на впливі РПМ на якість життя та лікуванні (зокрема супутніх захворювань та їх предикторах), а також консультацій щодо індивідуальних програм фізичних навантажень (5, D).
Кожний хворий, який отримує лікування із приводу РПМ у межах первинної або вторинної медичної допомоги, має проходити обстеження з оцінкою таких чинників, як:
- фактори ризику та дані щодо побічних ефектів, пов’язаних із лікуванням ГК;
- супутні захворювання;
- приймання інших ліків;
- докази / фактори ризику рецидиву та асоційовані з довгостроковою терапією.
Контрольні візити до лікаря рекомендовані кожні 4‑8 тижнів за перший рік і 8‑12 тижнів – другий, а також у разі розвитку рецидиву чи зниження дози преднізолону / відміни (5, D). Пацієнтам необхідно забезпечити швидкий доступ до лікарів, медсестер або навченого медичного персоналу, щоб вони мали можливість повідомляти про будь-які зміни свого стану, такі як загострення та несприятливі явища, а також отримання відповідей на запитання та рекомендацій (5, D).
Обговорення
ГК визнані основою лікування РПМ першої лінії. За результатами клінічної практики, початкова доза ГК, еквівалентна такій преднізолону, становить від 12,5 до 25 мг/добу, хоча графік і тривалість терапії були вивчені недостатньо, і дані на підтвердження цієї рекомендації наразі обмежені (Dubost et al., 2019; Campbell et al., 2018). Показники, про які повідомляли пацієнти, такі як оцінка болю та стомлюваності за візуально-аналоговою шкалою (ВАШ), бали за модифікованою анкетою щодо стану здоров’я (HAQ) та коротким опитувальником щодо стану здоров’я за 36 пунктами на основі перебігу хвороби (MOS SF‑36), на додаток до маркерів запалення є корисною інформацією для клініцистів і можуть допомогти у складанні схеми лікування (Matteson et al., 2012).
Швидке досягнення контролю симптомів та поліпшення стану хворих на РПМ завдяки лікуванню дозволяють надавати їм допомогу зазвичай у межах первинної ланки, за винятком випадків відсутності відповіді на терапію, наявності атипових ознак, рецидивів та/або тривалого (>24 місяців) лікування (Giollo et al., 2019; Albrecht et al., 2018). У цій підгрупі пацієнтів після ретельної повторної оцінки діагнозу для виключення імітувальних станів настійно рекомендоване (раннє) введення МТС для досягнення ремісії (Quartuccio et al., 2018).
Роль біологічної терапії при РПМ досі невідома. Застосування інгібіторів ФНП-α не рекомендоване на основі рандомізованих контрольованих досліджень без доказів значного ефекту інфліксимабу та етанерцепту (Salvarani et al., 2007; Kreiner, Galbo, 2010). Перші результати клінічних випробувань тоцилізумабу – рекомбінантного гуманізованого моноклонального антитіла до людського рецептора інтерлейкіну‑6, видалися обнадійливими, але все ще недостатніми, щоб сформувати належну доказову базу для надання рекомендацій (Lally et al., 2016; Devauchelle-Pensec et al., 2016).
Роль нефармакологічних методів лікування розглядалася як частина комплексного підходу до ведення осіб із РПМ. Проте ця рекомендація була підтверджена лише експертним висновком через відсутність клінічних досліджень.
Супутні патології часто спостерігаються у пацієнтів із РПМ і можуть впливати на вибір лікування та перебіг захворювання (Partington et al., 2018). На тлі тривалої терапії можливий розвиток катаракти (Shbeeb et al., 2018). Рекомендовано проводити ретельну клінічну оцінку хворих через наявність низки імітувальних РПМ станів, таких як ревматоїдний артрит, інфекційні та неопластичні захворювання. Однак фактичну потребу в додаткових обстеженнях завжди має визначати лікар для уникнення зайвих аналізів, що мають сумнівну користь для конкретного пацієнта.
Роль ФДГ-ПЕТ/КТ щодо можливості виявлення васкуліту великих судин у пацієнтів із РПМ без явних клінічних ознак та вплив на моніторинг ефективності лікування достеменно не встановлено (Dejaco et al., 2018; Prieto-Peña et al., 2019).
Висновки
SIR розробила чіткі рекомендації щодо лікування пацієнтів із РПМ на основі актуальних наукових доказових даних, які покликані допомогти клініцистам у прийнятті правильних рішень та призначенні належного лікування. SIR зобов’язується переглядати та оновлювати рекомендації в майбутньому залежно від досягнень у лікуванні РПМ, вдосконалення наявних та розробки нових методів терапії.
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті
www.reumatismo.org
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (78) 2021 р.
СТАТТІ ЗА ТЕМОЮ Ревматологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Зв’язок між рівнем сироваткової сечової кислоти (ССК) і ризиком серцево-судинних захворювань (ССЗ) упродовж багатьох років є предметом вивчення дослідників. Установлено, що рівень ССК – незалежний предиктор смерті від усіх причин і серцево-судинної смерті, зокрема від гострого коронарного синдрому, інсульту та серцевої недостатності (СН). Також опубліковано багато робіт про зв’язок між ССК і функцією нирок. Попри значну кількість публікацій, деякі моменти, а саме: яким є оптимальний поріг ССК для визначення ризику ССЗ, чи необхідна корекція значень ССК для функції нирок, чи є ССК ключовим патологічним елементом метаболічної дисрегуляції, потребують прояснення....