Гепа-Мерц при хворобах печінки і печінковій енцефалопатії
Печінкова енцефалопатія (ПЕ) – потенційно зворотне порушення функції головного мозку, зумовлене печінковою недостатністю та/або портосистемним шунтуванням, що проявляється широким спектром неврологічних і психіатричних порушень – від субклінічних змін до коми. Дефіцит психомоторних функцій можна виявити вже на ранніх стадіях ПЕ; навіть на цьому етапі зазначені порушення несуть певні ризики в побуті, на роботі, під час кермування автомобілем. Спочатку з’являються легкі неспецифічні розладу сну, настрою та когнітивних функцій. У міру прогресування захворювання розвиваються симптоми психомоторної загальмованості, нервово-м’язові розлади (наприклад, астериксис), дезорієнтація, порушення пам’яті. На пізніших стадіях клінічна картина ПЕ характеризується наростаючими змінами рівня свідомості аж до печінкової коми. Рання діагностика ПЕ є дуже важливою, оскільки дозволяє своєчасно призначити патогенетичне лікування, запобігти незвортним змінам головного мозку та покращити віддалений прогноз пацієнтів.
Етіологія та патогенез
Найчастішою причиною ПЕ є цироз печінки (ЦП) – енцефалопатія розвивається в 70% пацієнтів із цирозом на тому чи іншому етапі хвороби. Своєю чергою, ЦП зазвичай є наслідком хронічної алкогольної інтоксикації (20-40% випадків), вірусного гепатиту В та С (30 та 27% відповідно), неалкогольної жирової хвороби печінки. До менш поширених причин належать первинний біліарний холангіт і первинний біліарний склероз, автоімунний гепатит і низка спадкових хвороб. Незалежно від етіологічного чинника прогресувальне структурне заміщення сполучною тканиною призводить до втрати функціональної паренхіми і зниження детоксикаційної функції печінки. Водночас розвиток портальної гіпертензії зумовлює формування колатералей, крізь які не очищена від токсинів кров в обхід печінки надходить у системний кровообіг (портосистемне шунтування). Обидва механізми призводять до того, що нейротоксини, присутні в портальній вені, досягають головного мозку. З-поміж цих токсинів особлива роль належить аміаку, який порушує функції нейронів й астроцитів із розвитком енцефалопатії. Отже, важливим завданням лікування ПЕ є зменшення рівнів аміаку в організмі шляхом зниження продукції і підвищення детоксикації цієї сполуки.
Метаболізм аміаку й детоксикаційна функція печінки
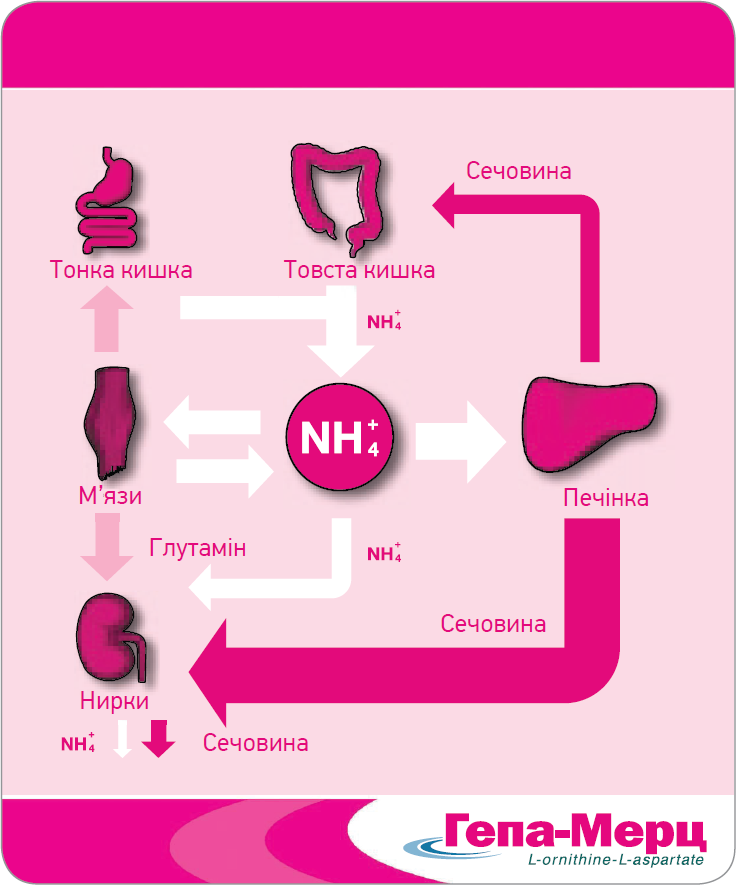
Аміак (NH4) утворюється ендогенно під час клітинного метаболізму азотвмісних сполук, як-от білки, амінокислоти, нуклеїнові кислоти й аміни, продукується в м’язах і нирках, а також синтезується кишковою мікрофлорою й утворюється в кишечнику шляхом небактеріальної деградації азотвмісних метаболітів із подальшим всмоктуванням в кровообіг. Синтез аміаку може підвищуватися за певних обставин, приміром при дотриманні дієти з високим умістом білка, під час інтенсивних фізичних навантажень, при лікуванні діуретиками, інфекціях, закрепах тощо. Метаболізм аміаку в організмі наведений на рисунку 1.
Рис. 1. Метаболізм аміаку в організмі
Печінка є головним органом, який знешкоджує аміак, утворений у товстій і тонкій кишках, м’язах і нирках. У перипортальних гепатоцитах аміак перетворюється на сечовину в циклі сечовини; перивенозні гепатоцити метаболізують аміак до глутаміну під дією глутамінсинтетази. Надалі сечовина виводиться нирками, невелика кількість екскретується через шлунково-кишковий тракт. Глутамін під дією глутамінази в нирках знову перетворюється на глутамат й аміак; глутамат потім конвертується в α-кетоглутарат шляхом від’єднання другої молекули аміаку, й останній виводиться із сечею.
Механізм дії і фармакодинаміка Гепа-Мерц
Активною речовиною препарату Гепа-Мерц, доступного у формі інфузії та гранул для перорального прийому, є L-орнітин-L-аспартат (LOLA) – сіль природних амінокислот орнітину й аспартату. За допомогою механізму субстратної активації ці дві молекули сприяють знешкодженню аміаку шляхом стимуляції порушеного синтезу сечовини та глутаміну.
Синтез сечовини є незворотним печінково-специфічним процесом, який відбувається переважно в перипортальних гепатоцитах. Орнітин активує фермент карбамілфосфатсинтетазу, необхідну цього процесу, а також є субстратом для синтезу сечовини.
Аспартат, як й орнітин, підтримує синтез глутаміну (приєднання аміаку до глутамату), який локалізується в перивенозних гепатоцитах. Зворотне знешкодження аміаку шляхом утворення глутаміну, крім печінки, відбувається в головному мозку та м’язах. Цей механізм є особливо важливим за портосистемного шунтування та печінкової недостатності, коли детоксикаційна функція печінки знижується.
Вплив Гепа-Мерц на метаболізм аміаку
В експериментальних дослідженнях на моделі ЦП призначення LOLA підвищувало активність ферментів циклу сечовини карбамілфосфатсинтетази й аргінази на 30 та 40% відповідно (практично до нормальних рівнів), що супроводжувалося значним зниженням рівнів аміаку в крові (Gebhardt et al., 1997). На моделі портосистемного шунтування було встановлено, що LOLA значно знижує рівні аміаку в крові (322±40 vs 500±32 ммоль; р<0,01) і головному мозку (2,06±0,2 vs 2,73 ммоль; р<0,05) (Vogels et al., 1995). Протекторні ефекти LOLA також були продемонстровані на моделях печінкової коми та гострої печінкової недостатності (Rose et al., 1998, 1999).
Загалом у цих та інших дослідженнях було продемонстровано, що Гепа-Мерц:
- підвищує утворення сечовини, нормалізує підвищені рівні аміаку в крові та головному мозку;
- зменшує або попереджує патологічне постпрандіальне підвищення аміаку в крові;
- протидіє амінокислотному дисбалансу (порушеному співвідношенню коротколанцюгових й ароматичних амінокислот);
- покращує синтез білка в м’язах (антикатаболічна дія);
- стабілізує психометричні функції та психічний стан в умовах білкового навантаження;
- знижує патологічні концентрації глутаміну й глутамату в головному мозку паралельно зі зниженням рівня аміаку в артеріальній крові;
- має дозозалежний ефект.
Клінічні дослідження Гепа-Мерц
Клінічна ефективність Гепа-Мерц при захворюваннях печінки широко вивчалась у багатьох ранніх дослідженнях (Schmidt, 1974; Müting, Reikowski, 1980; Hendricks, Hellweg, 1984; Müller-Kengelbach, 1986; Müting et al., 1988; Handschuh, 1990; Müting et al., 1992; Podymova, Nadinskaya,1998 та ін.). У цих роботах Гепа-Мерц застосовували в інфузійній або пероральній формі в пацієнтів із різним ступенем печінкової недостатності внаслідок ЦП та інших захворювань. Тривалість лікування становила від кількох днів до кількох років.
Нещодавно було проведено низку клінічних досліджень ефективності й безпеки Гепа-Мерц, які відповідають сучасним методологічним вимогам і критеріям доказової медицини. Останні, зокрема, включають контроль плацебо, подвійний сліпий дизайн, випадковий розподіл на групи терапії, достатню кількість пацієнтів, відповідність вимогам Належної клінічної практики (GCP) тощо.
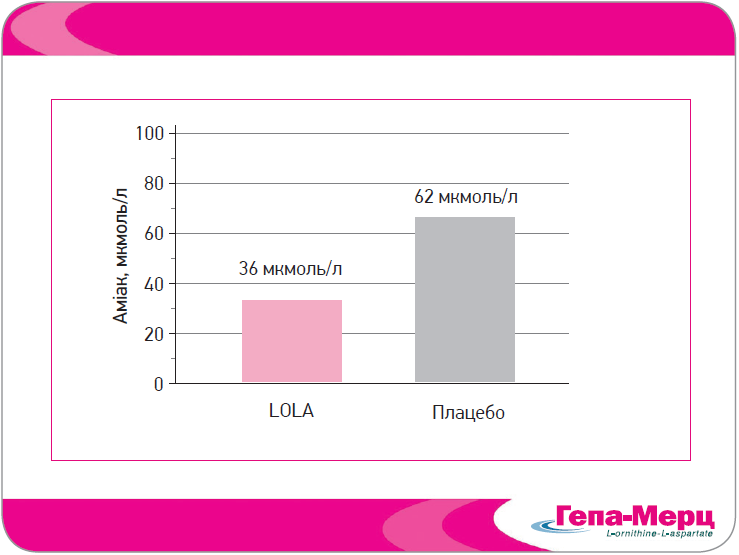
За печінкової недостатності концентрація аміаку в крові підвищується до нефізіологічних рівнів після білкової їжі. У контрольованому дослідженні Rees і співавт. (2000) вивчали здатність LOLA захищати від підвищення аміаку при білковому навантаженні, а отже, зменшувати психометрично виміряний функціональний дефіцит. Пацієнтів із ЦП після прийому 20 г глутаміну рандомізували на інфузію 5 г LOLA або плацебо. Як і очікувалося, навантаження глутаміном спричинило підвищення аміаку з вихідного рівня 27±6 мколь/л, проте в групі LOLA воно було значно меншим (рис. 2). Разом із пригніченням продукції аміаку призначення LOLA супроводжувалося стабілізацією психометричних функцій.
Рис. 2. Венозна концентрація аміаку після білкового навантаження (20 г глутаміну) при лікуванні Гепа-Мерц і плацебо в пацієнтів із ЦП (Rees et al., 2000)
Метааналіз 5 рандомізованих плацебо-контрольованих клінічних досліджень за участю. пацієнтів із ПЕ підтвердив, що 7-денна інфузійна терапія Гепа-Мерц забезпечує значне зниження рівнів аміаку в крові, покращення психічного стану і при цьому добре переноситься. Терапевтична різниця порівняно з плацебо була завжди статистично високодостовірною на користь Гепа-Мерц (Delcker et al., 2000).
У порівняльних дослідженнях Гепа-Мерц та лактулози, яка широко застосовувалася для лікування ПЕ, обидва препарати покращували час виконання тесту на з’єднаня цифр – NCT-A (з 58 до 47 в групі Гепа-Мерц та з 66 до 53 с в групі лактулози). Покращення стадії ПЕ також спостерігали в обох групах, при цьому симптоми ПЕ повністю зникли в 29% пацієнтів групи Гепа-Мерц і тільки в 5% хворих групи лактузоли. Гепа-Мерц переносився дуже добре, натомість 45% хворих, які приймали лактулозу, повідомляли про побічні ефекти (переважно діарею) (Liehr et al., 1992; Kircheis et al., 1993; Krüger et al., 1994).
Ефективність Гепа-Мерц у формі гранул порівняно з плацебо вивчали в багатоцентровому рандомізованому подвійному сліпому дослідженні за участю пацієнтів із ЦП і стабільною хронічною явною (ступінь І/ІІ) або субклінічною (ступінь 0) ПЕ (Stauch et al., 1998). Додатковими критеріями включення були гіперамоніємія (аміак венозної крові натще >50 мкмол/л) та час виконання тесту NCT-A >30 с.
Клінічний випадок 1 (Hass et al., 2006)
Жінка, 56 років, із підвищеними рівнями печінкових ферментів (ГГТ, АСТ), артралгіями, синдромом Рейно, порушеннями сну та концентрації.
Результати обстеження та діагноз. За даними серологічних досліджень і біопсії печінки діагностовано хронічний гепатит С і вірус-індукований ЦП зі збереженою синтезувальною функцією печінки. HCV-індуковану кріоглобінемію були виключено, проте відзначалися підвищені титри антинуклеарних антитіл (ANA) й антитіл проти білкових компонентів малого ядерного нуклеотиду (анти-RNP), а також типові серологічні параметри змішаного колагенозу (хвороби Шарпа). Для диференційної діагностики мозкового васкуліту і легкої ПЕ виконали магнітно-резонансну спектроскопію; специфічна картина мозкових метаболітів (міоінозитолу і холіну) свідчила на користь ПЕ.
Лікування. Пацієнтці призначили дієту з низьким умістом білка, противірусну терапію (інтерферон + рибавірин) та LOLA (Гепа-Мерц 6 г 3 р/добу перорально).
Після початку лікування артралгія та нейропсихіатричні симптоми швидко покращилися, ПЛР на HCV РНК – негативна. Після відміни противірусної терапії HCV спостерігали рецидив HCV-інфекції з погіршенням артралгії та проявів синдрому Рейно (HCV-індукована хороба Шарпа). Покращення когнітивних симптомів на тлі прийому LOLA зберігалося.
Цей клінічнй випадок свідчить, що навіть у пацієнтів із незначно порушеною функцією печінки і ЦП важливо виявляти початкові прояви ПЕ (за наявності нейропсихіатричних симптомів) і призначати відповідне лікування (LOLA).
Клінічний випадок 2 (Choi et al., 2013)
Чоловік, 55 років, з алкогольним ЦП, надійшов у status epilepticus. Терапію, спрямовану на зниження рівня аміаку в крові, раніше не отримував.
Результати обстеження та діагноз. Лабораторні дослідження показали значно підвищений рівень аміаку в крові. Магнітно-резонансна томографія (МРТ) головного мозку: поширені зміни сигналів кори з обмеженою дифузією, залученням темпорофронтопарієтальної кори з обох боків; при цьому були збережені перироландичні ділянки і потилична кора. МРТ головного мозку, виконана під час подальшого спостереження, продемонструвала дифузну атрофію кори з посиленими сигналами на Т1-зважених зображеннях в базальних гангліях і корі скроневої частки з обох боків. Діагноз: кортикальний ламінарний склероз.
Наведений клінічний випадок є прикладом того, до яких наслідків може призводити нелікована токсична гіперамоніємія. Запобігти таких ускладнень дозволяє вчасно призначена терапія LOLA.
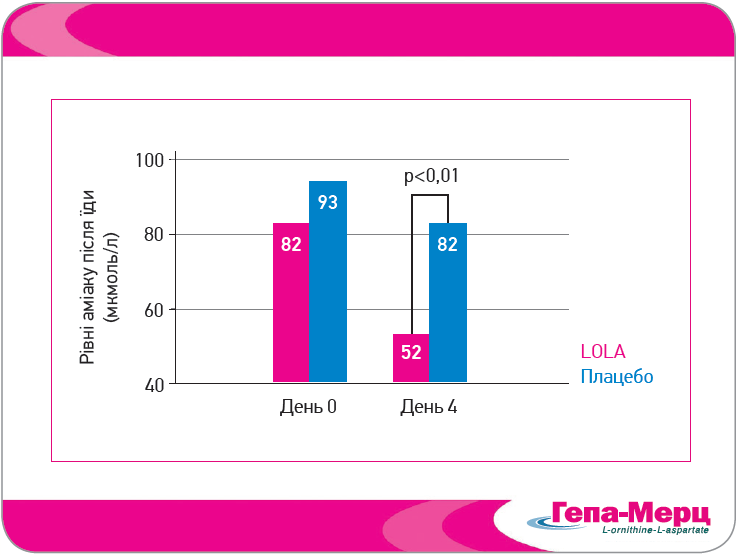
Пацієнти отримували по 2 пакети Гепа-Мерц (кожен містить 3 г LOLA; вміст розчиняли у воді) тричі на день або відповідне плацебо. Вже на 4-й день лікування постпрандіальні плазмові рівні аміаку (первинна кінцева точка) були значно нижчими в групі Гепа-Мерц (рис. 3). Після 14 днів лікування оцінка NCT-A і клінічний ступінь ПЕ були значно кращими в пацієнтів, які отримували Гепа-Мерц. В обох групах відзначили добру переносимість терапії (94% – LOLA, 81% – плацебо).
Рис. 3. Гепа-Мерц значно знижує плазмові рівні аміаку вже на 4-й день лікування
(Stauch et al., 1998)
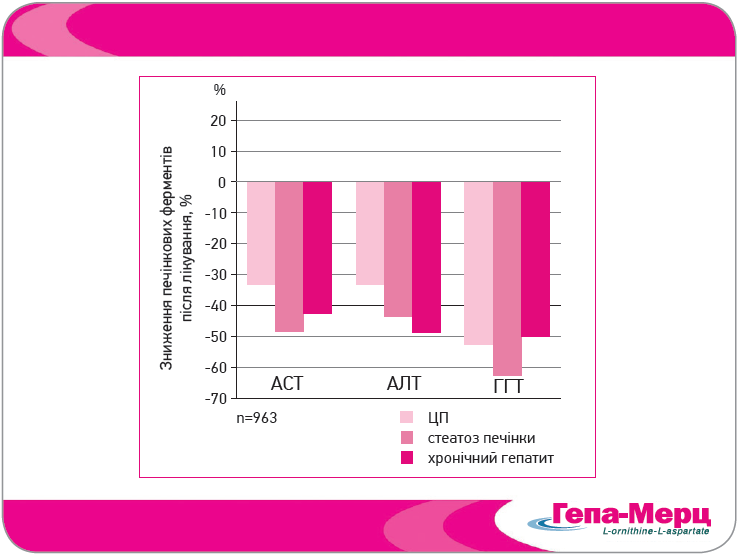
У спостережному дослідженні Grungreiff та Lambert-Baumann (2001) вивчали ефективність і переносимість лікування Гепа-Мерц у формі гранул в умовах загальнотерапевтичної практики. Участь взяли пацієнти з хронічними захворюваннями печінки, у яких нефармакологічні заходи виявилися неефективними і які мали показання до призначення LOLA. Вік хворих становив від 18 до 87 років, середня тривалість хвороби печінки – 4-5 років. Головними причинами печінкової недостатності були зловживання алкоголем (71%), а також вірусні інфекції, лікарські препарати, промислові хімікати та ін. У більшості пацієнтів було діагностовано неалкогольну жирову хворобу печінки (55,5%), далі за частотою йшли ЦП (32,4%) і хронічний гепатит (21,7%). Результати показали чітке зниження маркерів печінкової дисфункції – аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ) і гамма-глутамілтранспептидази (ГГТ) на тлі лікування Гепа-Мерц (рис. 4). Аналіз динаміки печінкових ферментів залежно від добової дози LOLA (<9, 9 і >9 г) і тривалості лікування (<30, 31-60 та 61-90 днів) засвідчив більш виражені корисні ефекти при збільшенням дози та тривалості прийому Гепа-Мерц. Подібні результати було отримано в плацебо-контрольованому дослідженні Chen і співавт. (2005), в якому застосування Гепа-Мерц у формі інфузії сприяло швидкому зниженню печінкових ферментів у пацієнтів із ЦП, ускладненим ПЕ (рис. 5).
Рис. 4. Зміни рівні АСТ, АЛТ та ГГТ при лікуванні Гепа-Мерц у формі гранул у 3 діагностичних групах
(Grungreiff, Lambert-Baumann, 2001)
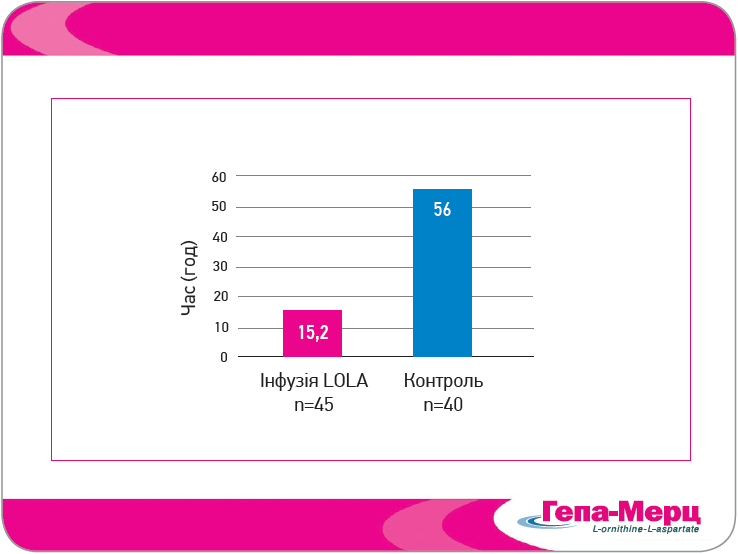
Рис. 5. Середній час повного відновлення свідомості (LOLA 1 р/добу, 40 мл у 250 мл фізіологічного розчину з 10% глюкозою (Chen et al., 2005)
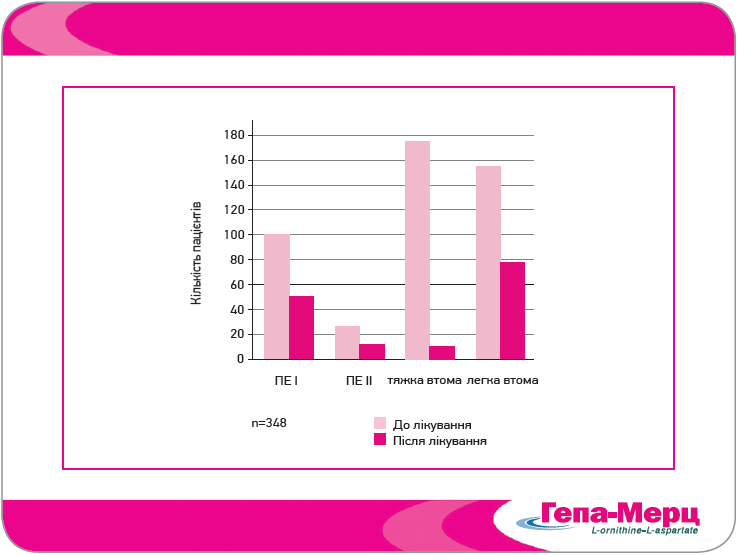
Патологічна втома є одним із важливих симптомів ПЕ, який значно порушує якість життя пацієнтів. У дослідженні Grungreiff та Lambert-Baumann (2001) у хворих на ЦП початково дуже виражена втома значно покращилася в 95% випадків після лікування Гепа-Мерц; у пацієнтів із легкою втомою вона повністю зникла в 53% випадків (рис. 6).
Рис. 6. Вплив лікування Гепа-Мерц у формі гранул на вираженість ПЕ і клінічний параметр «утома» (Grungreiff, Lambert-Baumann, 2001)
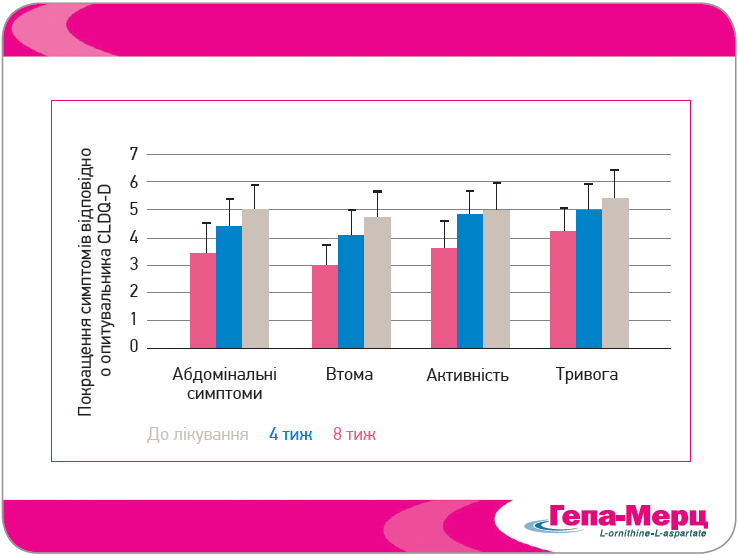
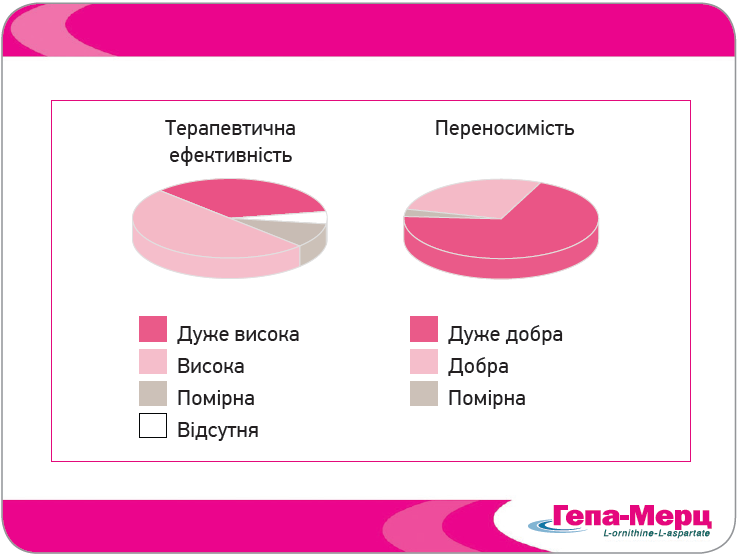
У відкритому проспективному багатоцентровому дослідженні Ong і співавт. (2011), оцінювали вплив Гепа-Мерц на інші показники якості життя пацієнтів із ЦП та ПЕ. Після 8 тиж перорального лікування Гепа-Мерц у добовій дозі 6 г спостерігали виражене покращення всіх доменів шкали HR-QOL, особливо втоми (на 67,5%) (рис. 7). Крім того, в пацієнтів значно зменшилася тяжкість абдомінальних симптомів, покращилися сон і когнітивна функція. Високу або дуже високу ефективність Гепа-Мерц у кінці лікування відзначили в 70% пацієнтів, добру або дуже добру переносимість – у 97,8% хворих. Ці результати узгоджуються з даними, отриманими раніше в дослідженні Grungreiff та Lambert-Baumann (2001) (рис. 8).
Рис. 7. Гепа-Мерц значно покращує когнітивні симптоми і якість життя (Ong et al., 2011)
Рис. 8. Загальна оцінки ефективності та переносимості Гепа-Мерц гранули в кінці лікування (Grungreiff, Lambert-Baumann, 2001)
Таким чином, L-орнітин-L-аспартат (LOLA) є патогенетично обґрунтованим засобом лікування ПЕ, який завдяки подвійному механізму дії зв’язує та знешкоджує надлишок аміаку, усуває його негативну дію на клітини печінки і головний мозок, зменшує клінічні прояви ПЕ й покращує якість життя пацієнтів. Своєчасне призначення LOLA дозволяє довше зберегти когнітивні функції й уникнути тяжких ускладнень. В Україні оригінальний L-орнітин-L-аспартат – препарат Гепа-Мерц виробництва Merz Pharma GmbH (Німеччина) – представляє швейцарська фармацевтична компанія Acino.
Список літератури знаходиться в редакції.
Підготував Олексій Терещенко
UA-HEME-PUB-112021-011
Медична газета «Здоров’я України 21 сторіччя» № 21 (514), 2021 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...