SARS-CoV-2, особистісна тривожність та мікробіом
Під час пандемії коронавірусної хвороби (COVID‑19), спричиненої коронавірусом тяжкого гострого респіраторного синдрому 2 типу (SARS-CoV‑2), розуміння складних взаємодій між вірусом та організмом-господарем стало критично важливим. Це розуміння необхідно для розробки цілісних і точних стратегій лікування. В цьому аспекті ретельно вивчаються мікробіом кишечнику та його вплив на фізіологію людини. Водночас збільшується масив літературних даних, присвячених впливу COVID‑19 на психічне здоров’я.
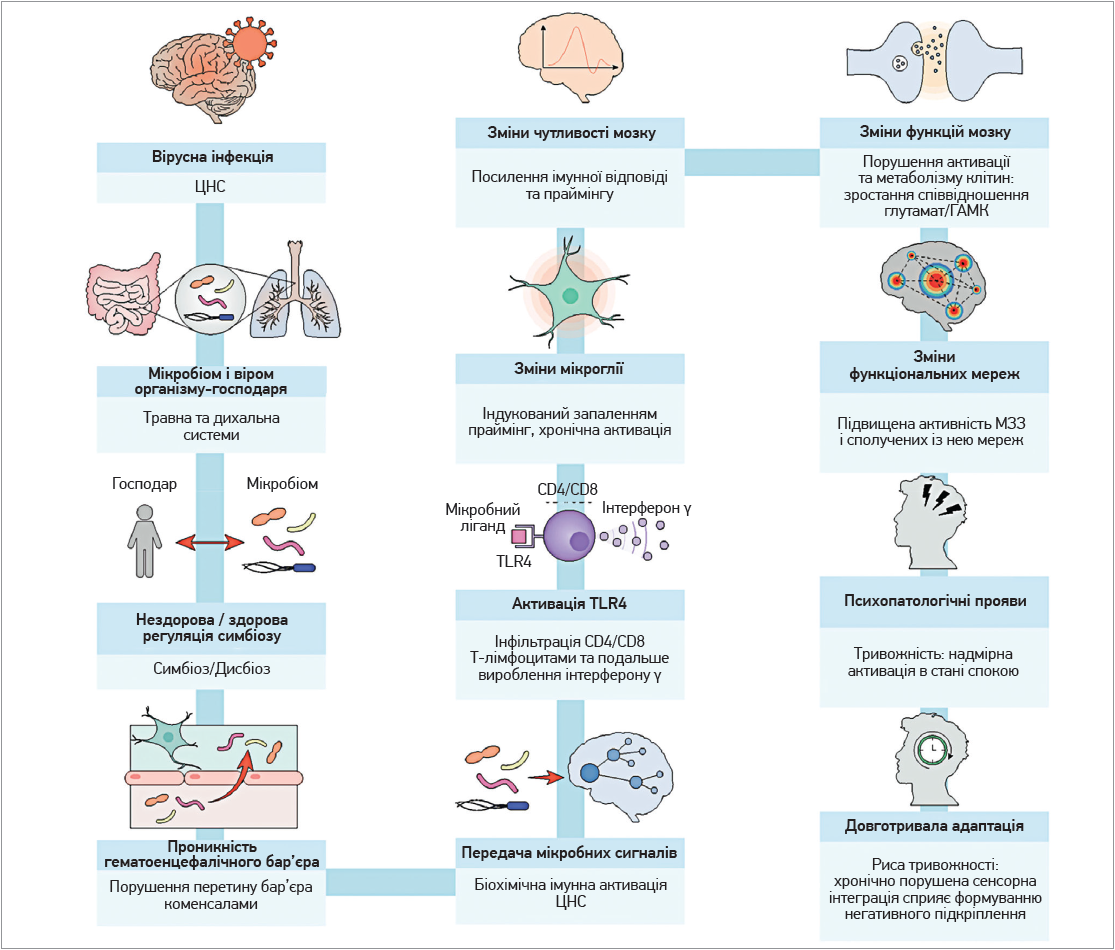
Вірус спричиняє фізичні зміни у внутрішньому середовищі організму людини та подає мальадаптивні нейронні сигнали до центральної нервової системи (ЦНС). Зміни мікроглії та метаболічна перебудова нейронних мереж можуть зумовлювати зміни патернів активації інтегративних систем мозку [1], згодом – рецидивуючу тривожність, здатну інтерналізуватися як особистісна тривожність (підвищена схильність до переживань тривоги і занепокоєння без достатніх підстав).
Мікробні сигнали: субстрат належного функціонування імунної системи
Мікробіом відіграє ключову роль у передачі сигналів, які опосередковують імунну відповідь на зовнішні патогени [2, 3]. Бактерії беруть участь у міжвидовому «спілкуванні» та ініціюють передачу нейрохімічних сигналів, обмінюючись інформацією у формі ферментативних і нейрохімічних процесів із грибками, а також вірусами [4, 5].
При вірусних інфекціях бактерії травної та дихальної систем відіграють важливу роль у належній відповіді організму-господаря на інфекцію [6]. Як безпосередньо, так і опосередковано ці бактерії можуть взаємодіяти з вірусом, впливати на проникність бар’єрів, які перешкоджають міграції патогенів до кровообігу, та подавати нейрохімічні сигнали до ЦНС. Залежно від мікрооточення мікробіота може як протидіяти реплікації вірусу, так і сприяти їй, тому дисбіоз є потенційно небезпечним для організму-господаря [4, 6-8].
Одним із механізмів взаємодії бактерій з вірусними патогенами є т. зв. імунний праймінг через сигнали тол-подібних рецепторів, однак точні сигнальні шляхи, якими інформація передається від мікробіоти до ЦНС, залишаються нез’ясованими [7]. В нормальних фізіологічних умовах епітеліальний бар’єр товстого кишечнику перешкоджає неконтрольованому надходженню бактерій до кровообігу [9, 10], однак дисбіоз може порушувати цей бар’єр за рахунок активації прозапальними бактеріями тол-подібних рецепторів TLR4 на дендритних клітинах, унаслідок чого коменсали кишечнику та продукти їхньої життєдіяльності надходять до кровообігу [11]. Метаболічні продукти мікробного походження можуть проходити крізь гематоенцефалічний бар’єр, безпосередньо впливаючи на фізіологію та функції мозку [1, 3]. Іншим шляхом, через який бактерії та їхні продукти життєдіяльності впливають на ЦНС, є передача сигналів через блукаючий нерв – основний шлях осі «кишечник – мозок» (з подальшим розвитком недостатньої або надмірної активації парасимпатичної нервової системи) [10]. Цей дисбаланс може спричиняти перебудову імунної відповіді, зміну проникності стінки кишечнику, розвиток порушень нейротрансмітерних систем та ендокринних органів. У зв’язку із цим мікробний дисбіоз здатен спричиняти психопатологічні симптоми на кшталт тривожності чи депресії [3].
Психопатологічні симптоми також можуть бути наслідком зміненої під впливом бактерій нейротрансмітерної активності, що передається аферентними волокнами блукаючого нерва [3, 10, 12]. Передачі сигналів до ЦНС сприяють і нейроподи ентероендокринних клітин [7]. Отже, потрапляння вірусу SARS-CoV-2 до ендотеліальних клітин кишечнику порушує нормальну передачу сигналів між різноманітними популяціями клітин організму-господаря та бактеріями-коменсалами, внаслідок чого зменшується секреція необхідних коротколанцюгових жирних кислот і посилюється продукція прозапальних молекул.
Інфекції та нейронна активність мозку
Експериментальні моделі інфекцій, спричинених нейроінвазивними / нейротропними вірусами, продемонстрували розвиток хронічних когнітивних та неврологічних дефіцитів [13]. Ці патологічні зміни асоціюються з підвищенням проникності гематоенцефалічного бар’єра та вивільненням інтерферону-γ, а також інших прозапальних цитокінів [14].
Багатогранний профіль несприятливих наслідків COVID-19 включає також і неврологічний, когнітивний та психіатричний дефіцит, що свідчить про нейротропний / нейроінвазивний потенціал вірусу [15]. Дослідження in vivo й in vitro підтверджують, що SARS-CoV-2 здатен до нейроінвазії та реплікації у нейронах ЦНС, а також в астроцитах з подальшим ушкодженням клітин і тканин [16-18]. Саме індукована вірусом SARS-CoV-2 втрата цілісності гематоенцефалічного бар’єра та приплив прозапальних молекул до ЦНС є причинами асоційованих із затяжним COVID-19 неврологічних, а також психічних розладів [15].
Вважається, що функціональні порушення у ЦНС насамперед уражають щільні нейронні мережі на кшталт первинної сенсорної кори [19]. В уражених нейронних мережах знижується точність сполучення з іншими нейронними системами мозку та погіршується надійність виконання належних функцій [20, 21], що може пояснювати психічні, а також фізичні симптоми хвороби [22, 23].
Метаболічні та нейрохімічні зміни у ЦНС є наслідком активації мікроглії в уражених ділянках мозку [3, 24]. Хронічна активація мікроглії унаслідок постійно підвищених рівнів прозапальних цитокінів зумовлює підвищену відповідь на імунну стимуляцію, тобто надмірну імунну відповідь. Цей феномен, покликаний підтримувати організм у стані підвищеної пильності стосовно інфекцій, супроводжується місцевим посиленням вивільнення глутамату. Отже, в уражених вірусом ділянках із праймінгом мікроглії спостерігається глутамат-індукована надмірна активація [24]. Надмірний приплив глутамату та розвиток ексайтотоксичності порушують співвідношення синаптичного й позаклітинного глутамату, а також гамма-аміномасляної кислоти (ГАМК). Домінування глутамату пригнічує синаптичні ефекти ГАМК, сприяючи надмірній збудливості та неправильній обробці сигналів у нейронних системах і мережах [25].
Під час інфекційних захворювань зсув співвідношення глутамат/ГАМК на користь глутамату є наслідком високого рівня прозапальних цитокінів і надмірного вивільнення глутамату, яке спричиняє вихід синаптичного глутамату в позасинаптичний простір. В умовах зниженої здатності до усунення позаклітинного глутамату ця речовина зв’язується з активованими іонотропними та метаботропними рецепторами мікроглії. Це додатково підсилює вироблення прозапальних цитокінів і вивільнення глутамату й оксиду азоту в позаклітинний простір, замикаючи хибне коло [24, 26]. Коливання синаптичних і позасинаптичних концентрацій глутамату та відповідні зміни активації іонотропних рецепторів спричиняють дисфункцію синапсів, а також нестабільність нейропередачі, порушуючи активність інгібіторних систем мозку. Саме ці механізми можуть лежати в основі психічних розладів, асоційованих з вірусними інфекціями [24, 25, 27]. В наш час зв’язок між індукованою вірусами чи бактеріями активацією мікроглії та розладами емоційно-настроєвої сфери не викликає сумнівів. Так, у пацієнтів з депресією спостерігається надмірна активація мікроглії передньої поясної кори [24].
Рис. Від вірусної інфекції до тривожності: імунна відповідь під контролем мікробіому
Примітки: TLR4 – тол-подібний рецептор-4; ІФНγ – інтерферон γ.
Мережа пасивного режиму роботи мозку: інфекції та тривожність
Мережа пасивного режиму роботи мозку (МПРРМ; англ. default mode network) являє собою функціонально та структурно сполучену мозкову нейронну мережу, яка бере участь у таких процесах, як обдумування, автобіографічна пам’ять, спонтанне мислення, а також деякі аспекти емоцій [28]. Аномальна активація МПРРМ і зміни її функціональної активності асоціюються із низкою нейропсихіатричних захворювань, включаючи шизофренію, тривожні та депресивні розлади [29-31]. Порушення нейрохімічної координації між збуджувальним нейротрансмітером глутаматом і гальмівним нейротрансмітером ГАМК може спричиняти недостатню деактивацію МПРРМ, отже, надмірну увагу до деяких стимулів, що зумовлює нав’язливі думки [29]. Підвищення активності головної топографічної ділянки МПРРМ (задньої поясної кори) асоціюється з депресією, тривожністю та занепокоєнням. За генералізованих тривожних розладів посилення функціональних зв’язків між різними відділами МПРРМ підсилює обробку сенсорних сигналів і порушує інтеграцію стимулів довкілля, спричиняючи в людини напругу та надмірну пильність навіть у стані спокою [22].
Загалом мікробні та вірусні інфекції зумовлюють хронічну (опосередковану праймінгом мікроглії) надмірну активацію глутамінергічних систем, а також спричинену запаленням деактивацію парасимпатичної системи й асоційовану зі стресом перебудову функції ендокринних органів. Ці патологічні зміни формують ідеальне середовище для порушень когнітивних процесів, наприклад, сприйняття та навчання.
На думку авторів, небезпека довготривалої персистенції вірусу в організмі може полягати в довготривалій нейроадаптації. За тривалої інфільтрації ЦНС вірусами внаслідок локального гіпоксичного апоптозу, зміненого в умовах запалення метаболізму нейронів, і порушених нейрохімічних процесів з’являються зміни нейрональної активності, які можуть спричиняти порушення сенсорного сприйняття та розлади поведінки [20, 27]. Хронічна висока чутливість до сенсорних сигналів, неадекватна фільтрація інформації та нав’язливе обдумування викривлених понятійних концепцій можуть сприяти формуванню негативного підкріплення, а також підсилювати відчуття непевності й емоційно неприйнятні очікування [32, 33]. Тривала активація імунних відповідей замикає хибне коло, спричиняючи хронічне запалення та мікробний дисбіоз. В таких умовах організм існує у стані тривожності, яка згодом інтерналізується і стає рисою характеру [20, 34, 35].
Мікробний симбіоз як основа схильності до хвороб і предиктор успішності лікування
Оскільки імунна відповідь суттєво залежить від мікрофлори, від симбіозу між різними мікроорганізмами й організмом-господарем може залежати імовірність розвитку хвороби. Отже, в різних людей спостерігаються різна чутливість до інфільтрації вірусом і різна тяжкість симптомів залежно від доінфекційного мікробного гомеостазу, стратегій імунного захисту та нейрофізіологічного фону.
В науковому світі широко точаться дискусії щодо застосування пробіотиків для профілактики, контролю та лікування вірусних інфекцій. З огляду на різноманітні імуномодулювальні ефекти бактерій цей спосіб втручання може бути природним методом профілактики інфекційних хвороб. Пробіотики можуть знижувати чутливість до вірусних інфекцій та тяжкість прогресування хвороби [36]. Ймовірно, ці ефекти опосередковані посиленою загальною активністю імунної системи, яка дозволяє рано виявити патоген і запобігти його поширенню, а також розмноженню за рахунок посиленої передачі сигналів до ЦНС. Для цього ключову важливість має підтримка здорового мікробного симбіозу [37, 38]. Експериментальні дані свідчать, що призначення лактобацил і біфідобактерій може зменшувати штучно спричинену глутаматну ексайтотоксичність за рахунок збільшення виснажених запасів ГАМК [25].
Висновки
1. За рахунок мікробної комунікації та змін внутрішнього середовища організму коменсали кишечнику можуть стимулювати чи обмежувати реплікацію вірусів в організмі людини.
2. Мікробні продукти запускають процеси праймінгу мікроглії шляхом передачі сигналів через тол-подібні рецептори, стимулюючи інфільтрацію патологічних вогнищ Т-лімфоцитами CD4+ та CD8+ і вироблення інтерферонів.
3. Праймінг мікроглії та хронічна активація можуть підвищувати вивільнення глутамату в нейронних структурах, впливаючи на когнітивну функцію та процеси інтеграції інформації.
4. Постійна активація імунологічних процесів і нейрохімічний дисбаланс у вигляді збільшення співвідношення глутамат/ГАМК можуть спричиняти формування негативних підкріплень та субоптимальне функціонування організму загалом, підтримуючи стан тривожності, який надалі може інтерналізуватися як особистісна тривожність.
5. Зазначені процеси можуть бути поясненням постінфекційних тривожних станів.
Довідка «ЗУ»
З огляду на тісний зв’язок між вірусними інфекціями, включаючи COVID-19, імунною відповіддю та розвитком тривожності, можна дійти висновку, що для поповнення пулу ГАМК в організмі та патогенетичного лікування постінфекційних депресій, а також астеній патогенетично обґрунтованим є застосування ГАМК-ергічних препаратів (Біфрен®, компанія Acino, Швейцарія). Роль Біфрену в цьому випадку полягає у відновленні фізіологічного балансу між глутаматом і ГАМК із нормалізацією співвідношення збуджувальних та гальмівних сигналів. Стабілізація гальмівних сигналів дозволяє запобігти тривожності, яка нерідко спостерігається під час і після інфекційних хвороб. Крім того, експериментальне дослідження J. Tian та співавт. (2021) виявило, що пероральне застосування ГАМК зменшує імовірність тяжкого пневмоніту та смерті в інфікованих мишачим коронавірусом мишей, що є свідченням потенціалу ГАМК як протекторного засобу при COVID-19 [39].
Недостатність ГАМК при вірусних хворобах зумовлена в тому числі й зменшенням продукції цього нейромедіатора мікробіотою, передусім кисломолочними бактеріями та біфідобактеріями. Тому для поповнення запасів ГАМК і відновлення співвідношення ГАМК/глутамат необхідне екзогенне надходження цієї речовини. Дослідження показують, що добавки ГАМК впливають на кількісний та якісний склад мікрофлори кишечнику, а також на метаболізм цих бактерій, розриваючи хибне коло дисбіозу та формування тривожності внаслідок дефіциту ГАМК. Крім того, добавки ГАМК підсилюють локальний імунітет слизових оболонок кишечнику за рахунок стимуляції вироблення секреторного імуноглобуліну А. ГАМК запропоновано застосовувати для покращення мікробно-метаболічних характеристик кишечнику з метою підсилення власного імунного захисту [40].
Таким чином, у період відновлення після вірусних інфекцій в організмі зростає потреба в ГАМК, яку можна задовольнити за допомогою відповідних сучасних ГАМК-ергічних препаратів. Біфрен® (фенібут) є похідним ГАМК та фенілетиламіну, який чинить виражений антигіпоксичний, антиамнестичний та транквілізуючий вплив. Біфрен® підвищує фізичну та розумову працездатність; усуває психоемоційне напруження, тривожність, страх; поліпшує сон; зменшує прояви астенії та вазовегетативні симптоми (головний біль, відчуття тяжкості в голові, порушення сну, дратівливість, емоційну лабільність). Важливо, що поліпшення самопочуття та підвищення мотивації до активної діяльності спостерігаються вже з перших днів терапії Біфреном.
Список літератури знаходиться в редакції.
Büttiker P., Weissenberger S., Stefano G.B., Kream R.M. and Ptacek R. (2021) SARS-CoV-2, Trait Anxiety, and the Microbiome. Front. Psychiatry 12:720082. doi: 10.3389/fpsyt.2021.720082.
Переклала з англ. Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 1 (518), 2022 р.
СТАТТІ ЗА ТЕМОЮ Неврологія
Як відомо, біль у спині ускладнює рух і чинить негативний вплив на якість життя та психічне благополуччя людини. За даними Всесвітньої організації охорони здоров’я (ВООЗ), від болю в нижній частині спини страждають близько 619 млн людей у всьому світі, і за прогнозом, до 2050 року переважно через збільшення чисельності населення та його старіння кількість таких випадків може зрости до 843 млн (WHO, 2020). Попри проведення численних досліджень причини дорсалгій досі лишаються суперечливими, а результат лікування – здебільшого незадовільним....
Полінейропатії – це захворювання всього організму з реалізацією патологічного процесу на рівні периферичної нервової системи як множинного ураження периферичних нервів із порушенням їх функції. Більшість полінейропатій є хронічними станами, що значно порушують якість життя пацієнтів. Це зумовлює актуальність пошуку ефективних підходів до лікування цих захворювань....
Головний біль (ГБ) як один із найчастіших неврологічних розладів є причиною стану, що характеризується порушенням повсякденної життєдіяльності людини. Поширеність цефалгій і значний їх вплив на якість життя свідчать про важливість проблеми діагностування та лікування ГБ. За даними Глобального дослідження тяжкості хвороб, оновленими 2019 р., ГБ посідає третє місце (після інсульту та деменції) серед неврологічних причин за загальним тягарем захворювань (виміряним роками життя з поправкою на інвалідність [DALY]) (WHO, 2014). При цьому лише незначна кількість осіб із ГБ у всьому світі проходять відповідну діагностику та отримують адекватне лікування....
Біль є однією з найчастіших причин звернення по медичну допомогу. На хронічний біль, який чинить негативний вплив на загальний стан здоров’я, страждають щонайменше четверо з п’яти хворих із хронічною патологією спинного мозку. Основними типами болю, на який скаржаться такі пацієнти, є ноцицептивний і нейропатичний (у 49 і 56% випадків відповідно) (Felix et al., 2021). Пропонуємо до вашої уваги огляд доповіді директорки Інституту медичних та фармацевтичних наук Міжрегіональної академії управління персоналом, д.мед.н., професорки Наталії Костянтинівни Свиридової, присвяченої особливостям ведення хворих із ноцицептивним і нейропатичним болем у практиці сімейного лікаря, яку вона представила у лютому цього року під час Науково-практичної конференції «Дискусійний клуб сімейного лікаря»....