Цитиколін для підтримки пам’яті в людей старшого віку
Старіння характеризується розвитком широкого спектра патологій, проте традиційно його розглядають як природний процес, а отже, не як хворобу. Коли старіння не ускладнюється неврологічними або психіатричними захворюваннями, когнітивні функції не порушуються, але сповільнюються. Зокрема, в осіб середнього та похилого віку помітно погіршується пам’ять та її складові, що вважаються фізіологічними. Майже кожен суб’єктивно відчуває певне погіршення пам’яті зі старінням, що проявляється, серед іншого, як подовження часу, необхідного для запам’ятовування нової інформації та пригадування інформації, яку згадували раніше. Частим аспектом вікової недостатності людської пам’яті є погіршення епізодичної пам’яті, тобто пам’яті щоденних подій, які можна чітко висловити або вигадати (наприклад, час, географічне розташування, пов’язані емоції та інша контекстна інформація). Підтримку або зменшення втрати одного чи кількох когнітивних процесів, пов’язаних із пам’яттю, вважають сприятливим фізіологічним ефектом.
Цитиколін – загальна назва речовини, ідентичної цитидин‑5’-дифосфохоліну (ЦДФ‑холіну), природному метаболіту, який присутній у невеликих кількостях у кожній живій клітині та відіграє вирішальну роль у синтезі клітинних фосфоліпідів. ЦДФ‑холін з екзогенного джерела, відомий як цитиколін, використовують в медицині з 1970-х років як рецептурний препарат із нейропротекторною дією, показаний при різних хронічних і гострих неврологічних захворюваннях (наприклад, хворобі Паркінсона, інсульті, травмах головного і спинного мозку, глаукомі).
У людини цитиколін після прийому всередину добре всмоктується і швидко розщеплюється на холін і цитидин. Це призводить до помітного підвищення рівня холіну в крові, тоді як цитидин швидко перетворюється на уридин. Далі холін й уридин потрапляють у клітини людського тіла та приєднуються до відповідних метаболічних шляхів. За аналогією з терміном «проліки», який використовують у фармації для опису сполуки, що метаболізується в організмі з утворенням активної речовини, цитиколін можна називати «пронутрієнтом», котрий в організмі людини виробляє холін і уридин як «активні нутрієнти».
Протягом десятиліть медичного використання стало очевидним, що застосування цитиколіну не пов’язане з будь-якими значними побічними ефектами і жодних протипоказань до його використання ніколи не було зазначено. Майже ідеальна переносимість цитиколіну, яку спостерігали в клінічних дослідженнях, була підтверджена результатами субхронічних токсикологічних експериментів. У різних дослідженнях пацієнти отримували щоденні дози цитиколіну до 2 г парентерально або перорально.
Клінічні дослідження з оцінки впливу цитиколіну на пам’ять у загалом здорових осіб середнього та старшого віку
Серед випробувань цитиколіну в осіб із початково нормальною когнітивною функцією вартують уваги проспективні інтервенційні дослідження, в яких оцінювали вплив препарату на показники пам’яті та відповідний радіологічний корелят пам’яті (лейкоареоз).
Плацебо-контрольоване дослідження P. A. Spiers і співавт. (1996) проводилося за участю загалом здорових чоловіків і жінок віком від 50 до 85 років. Критеріями виключення були, серед іншого, наявність активних медичних, неврологічних або психіатричних захворювань та оцінка за короткою шкалою психічних функцій (MMSE) >26 балів із можливих 30.
Дослідження складалося з двох етапів. Перший етап був рандомізованим, подвійним сліпим, плацебо-контрольованим, під час якого учасники приймали плацебо або цитиколін по 500 мг 2 р/день протягом 3 міс. Пацієнти, які отримували цитиколін, мали значно вищі середні концентрації холіну в плазмі крові, ніж суб’єкти, котрі отримували плацебо. Крім того, пацієнти групи цитиколіну з відносно неефективною пам’яттю продемонстрували тенденцію до покращення стандартизованого показника функції пам’яті. На другому етапі підгрупа учасників із відносно неефективною пам’яттю отримувала цитиколін 1000 мг 2 р/день або плацебо протягом 2 міс із 10-денним періодом «вимивання»; при цьому було чітко підтверджено покращення вербальної пам’яті після прийому цитиколіну.
У плацебо-контрольованому перехресному дослідженні X. A. Alvarez і співавт. (1997) пацієнтам старшого віку (середній вік – 66 років) без деменції цитиколін призначали в добовій дозі 500 або 1000 мг перорально протягом 4 тиж. Вплив лікування на продуктивність пам’яті оцінювали за допомогою нейропсихологічних тестів, які визначали наступні завдання пам’яті: пригадування слів, розпізнавання слів, негайне пригадування та відстрочене пригадування об’єктів, а також розпізнавання об’єктів. Після 4 тиж лікування цитиколіном було відмічено покращення у 2 із 5 завдань пам’яті, а саме у пригадуванні слів (р<0,02) і відстроченому пригадуванні об’єктів (р<0,001).
У дослідженні L. Feng і співавт. (2017) для дослідження впливу цитиколіну на показники роботи мозолистого тіла (з’єднує ліву і праву півкулі головного мозку) в пацієнтів з лейкоареозом використали дифузійну тензорну візуалізацію (ДТВ). Цей метод дозволяє кількісно описати патерни дифузії молекул води в білій речовині мозку, які пов’язані з мікродеталями архітектури тканин, як-от цілісність мієліну.
В основній групі пацієнти приймали цитиколін 600 мг/день протягом року, тоді як контрольна група препарат не отримувала. Кількісну ДТВ трьох частин мозолистого тіла проводили під час рекрутування та після одного року лікування цитиколіном. Порівняно з результатами, отриманими на початку випробування, через рік у хворих контрольної групи спостерігалося збільшення середньої дифузійності (MD) і зниження фракційної анізотропії (FA) в усіх трьох частинах, що свідчить про прогресування патології. У пацієнтів, які отримували цитиколін, також спостерігалося зниження FA, але в усіх трьох частинах воно було помітно меншим, ніж у контрольній групі. Прийом цитиколіну протягом одного року забезпечував стабільні значення MD, і цей ефект чітко відрізнявся від такого в контрольній групі.
Отримані дані свідчать про те, що в пацієнтів із лейкоареозом цитиколін може зменшувати пошкодження аксонів і мієліну та сприяти відновленню мозолистого тіла.
У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні E. Nakazaki і співавт. (2021) визначали вплив перорального прийому цитиколіну на пам’ять у загалом здорових людей із віковими порушеннями пам’яті. Чоловіків і жінок віком від 50 до 85 років рандомізували для прийому плацебо або цитиколіну 500 мг/день протягом 12 тиж. Когнітивні показники оцінювали на початку та в кінці втручання за допомогою комп’ютеризованих тестів, розроблених і валідованих Кембриджським університетом. Ці тести оцінюють оперативну пам’ять, короткочасну просторову пам’ять, короткочасну словесну пам’ять, епізодичну пам’ять, вибіркову увагу та стійку увагу.
Порівняно з тими, хто приймав плацебо, учасники групи цитиколіну продемонстрували значне покращення епізодичної пам’яті та загальної пам’яті. Автори дійшли висновку, що їхні результати збігаються з двома попередніми дослідженнями, які свідчать про позитивний вплив цитиколіну на пам’ять у людей середнього та старшого віку.
Вплив цитиколіну на пам’ять у пацієнтів з хронічними неврологічними захворюваннями
Цитиколін є добре вивченим як рецептурний препарат для лікування неврологічних захворювань – як гострих (ішемічний інсульт, черепно-мозкова травма), так і хронічних (деменція, хвороба Паркінсона).
Остання версія Кокранівського огляду цитиколіну для лікування когнітивних і поведінкових розладів, пов’язаних із хронічними церебральними захворюваннями у людей похилого віку, включила аналіз 14 рандомізованих плацебо-контрольованих досліджень у пацієнтів із симптомами починаючи від розладів пам’яті до легких судинних когнітивних порушень, судинної або сенільної деменції.
Результати продемонстрували користь цитиколіну для пам’яті та поведінки. Відношення шансів для загального покращення після активного лікування порівняно з плацебо становило 8,89 (р<0,001), що вказує на досить сильний ефект препарату. Важливо, що ефективність цитиколіну суттєво відрізнялася від ефекту плацебо незалежно від патогенезу церебрального розладу. Це свідчить, що позитивний вплив цитиколіну на пам’ять не залежить від типу основної патології головного мозку, а відповідальний механізм, ймовірно, є таким самим, як і в людей похилого віку без когнітивних порушень.
Окрім даних, розглянутих у вищезгаданому Кокранівському аналізі, у 2013 році були опубліковані результати італійського відкритого багатоцентрового дослідження IDEALE. Його метою було оцінити ефективність і безпеку перорального цитиколіну в людей старшого віку з легкими судинними когнітивними порушеннями. У дослідженні взяли участь 349 пацієнтів, з яких 265 (122 чоловіки та 143 жінки) приймали цитиколін, а решта 84 його не отримували (контрольна група). Критеріями включення були вік не менше 65 років, суб’єктивні скарги на пам’ять, кількість балів за MMSE не менше 21 (вказує на легкий ступінь когнітивних порушень) і нейрорадіологічні докази ураження судин головного мозку. Унікальність цього дослідження полягає в тому, що лікування проводилося протягом 9 міс – довше, ніж у більшості попередніх випробувань.
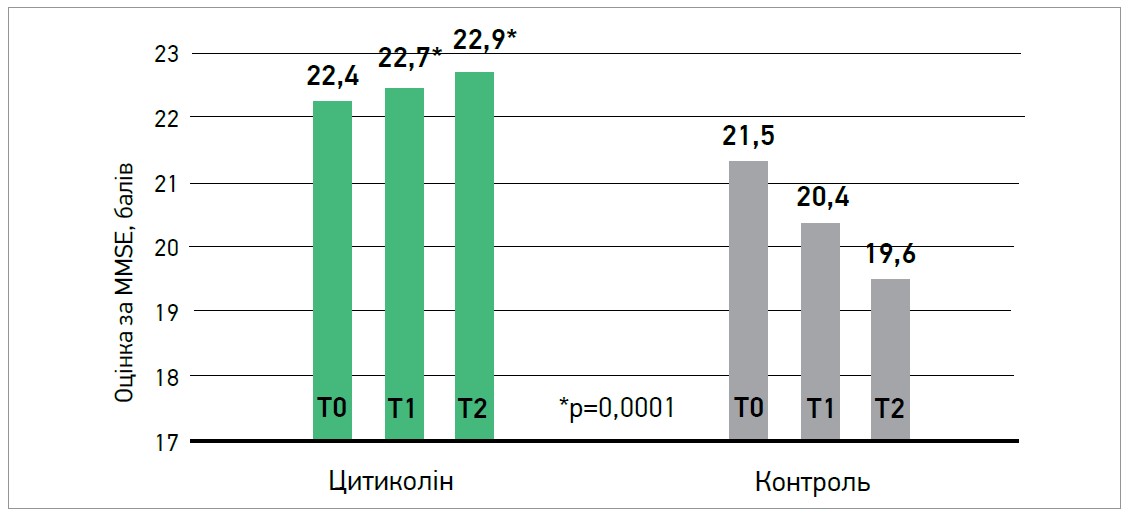
Результати показали, що пацієнти, які отримували цитиколін, мали незмінні показники MMSE (22,4±4 на початку; 22,7±4 через 3 міс та 22,9±4 через 9 міс), тоді як у контрольній групі спостерігалося погіршення показника MMSE (21,5±6,9 на початку; 20,4±6,6 через 3 міс та 19,6±6,3 через 9 міс) (рис.). Різниця між групами була статистично незначущою на початку дослідження, але досягла високої значущості як через 3, так і через 9 міс дослідження (р<0,0001).
Рис. Ефективність Цераксону при судинних когнітивних порушеннях: дослідження IDEALE
Примітки: Т0 – початково; Т1 – через 3 міс; Т2 – через 9 міс.
Висновки
Провідні світові ринки зараз переповнені сотнями дієтичних добавок, призначених для зміцнення здоров’я мозку та покращення когнітивних здібностей. Такі продукти призначені для людей похилого віку, які страждають від погіршення когнітивних функцій, а також для здорових дорослих, які прагнуть покращити чи підвищити продуктивність пам’яті або запобігти погіршенню когнітивних функцій. Багато авторів вказують на те, що цим «прискорювачам пам’яті» не варто довіряти, оскільки наукові докази, що стоять за ними, неадекватні, дослідження суперечливі та неточні, а багато досліджень мають методологічні недоліки.
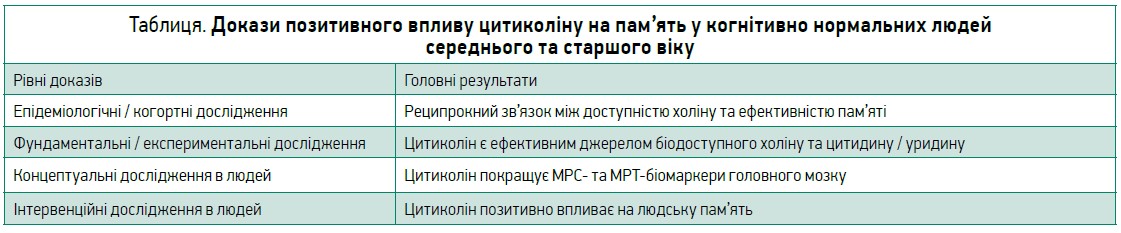
Водночас позитивний вплив цитиколіну на людську пам’ять є обґрунтованим на різних рівнях – від фундаментальних й експериментальних випробувань до епідеміологічних і клінічних досліджень (табл.), що дозволяє впевнено рекомендувати цей препарат для підтримки пам’яті в людей середнього і старшого віку як зі збереженою когнітивною функцією, так і з хронічними неврологічними захворюваннями.
Список літератури знаходиться в редакції.
Świątkiewicz M., Grieb P. Citicoline for Supporting Memory in Aging Humans. Aging and Disease. Early access date:
September 22, 2022. http://dx.doi.org/10.14336/AD.2022.0913
Переклав з англ. Олексій Терещенко
Коментар експерта
 Т. В. Юдіна, к. м. н., доцент кафедри неврології Дніпровського державного медичного університету
Т. В. Юдіна, к. м. н., доцент кафедри неврології Дніпровського державного медичного університету
За даними досліджень, всі, хто переносять стан війни, чи то бійці, чи то цивільні, біологічно старіють на 10 років або навіть більше. І цей процес відбувається на тлі загального постаріння населення. Так, станом на 2021 рік в Україні частка людей віком 60 років і старше становила 24% порівняно з 16% дітей віком до 16 років. Для протидії цій тенденції створена парадигма здорового старіння – розвиток і підтримка функціональних можливостей, необхідних людині для благополучного життя в літньому віці.
Біологічне старіння лише слабо пов’язане з віком людини в роках – не існує «типової» літньої людини. Хоча деякі варіації в стані здоров’я літніх людей відображають їхню генетичну спадковість, більшість із них пов’язана з їхнім фізичним та соціальним середовищем, а також впливом цього середовища на їхні можливості та поведінку щодо здоров’я. Важливо, що ці фактори починають впливати на старіння з дитинства. Це означає, що літня людина з неблагополучного середовища найімовірніше матиме погане здоров’я і рідше матиме доступ до послуг і догляду, які можуть їй знадобитися.
У осіб старшого віку формується особлива своєрідна структура психічного укладу за рахунок погіршення образного мислення, зниження сили, врівноваженості, концентрації та рухомості основних нервових процесів, уповільнення психомоторних реакцій. Утім, нові дані вчених із Нідерландів вказують на те, що люди, які досягають «сторічної вікової межі», можуть зберегти свої когнітивні процеси у здоровому стані, навіть якщо їхній мозок має ознаки хвороби Альцгеймера.
Ці перспективи випливають із дослідження, у якому взяли участь 340 людей, котрі досягли сторічного віку. Вчені оцінили їх всіх як «когнітивно здорових» – 79 учасників повернулися на повторне когнітивне тестування після 19 міс. Когнітивні процеси учасників виглядали так, ніби вони були на 30 років молодшими: здатність приймати рішення, будувати плани та виконувати їх, зосередження на конкретних завданнях – все це вони виконували успішно. Навіть ті, у кого була генетична схильність до підвищеного ризику розвитку хвороби Альцгеймера, змогли вдало пройти тести. Дослідники зробили висновок, що люди з когнітивною стійкістю здатні накопичувати високі рівні пошкодження мозку, уникаючи появи клінічних симптомів. Тобто вони мають когнітивний резерв, який дозволяє їм уникати шкідливих наслідків при потенційних патологічних змінах мозку.
Багато досліджень показали, що фактори способу життя можуть сприяти когнітивній стійкості. Серед них – отримання якісної освіти; вибір професій, що мають справу зі складними фактами і набором даних; правильне харчування, активне дозвілля та спілкування з іншими людьми, а також регулярні фізичні тренування. Останні не просто покращують приплив крові до центральної нервової системи, а й потовщують кору й збільшують об’єм головного мозку, включно із зонами, пов’язаними з когнітивними функціями.
Підраховано, що модифікація 12 факторів ризику може запобігти або відстрочити до 40% випадків деменції. Такими факторами є менша освіта, порушення слуху, депресія, обмежені соціальні контакти, артеріальна гіпертензія, ожиріння, гіподинамія, куріння, цукровий діабет, надмірне вживання алкоголю, травми голови і забруднення повітря.
Багато з цих факторів мають судинний характер, тобто підвищують ризик розвитку інсульту. Один епізод інсульту асоціюється з когнітивним зниженням, що відповідає приблизно 7,9 року когнітивного старіння. Відновлення функцій після інсульту залежить від адекватної нейрорегенерації, яка складається з нейрогенезу (утворення нових нейронів) та нейропластичності (розвиток нових відростків, утворення нових синапсів).
Вікове когнітивне зниження також пов’язане зі зміною синаптичної пластичності. Із віком загальне розгалуження дендритів не зменшується, проте значно знижується щільність дендритних шипиків. Водночас відхилення від норми в морфології дендритних шипиків тісно пов’язане з деякими психічними розладами, розумовою відсталістю, наркоманією, гіпоксією й ішемією, епілепсією. За деяких нейродегенеративних захворювань, особливо за когнітивних порушень, як-от хвороба Альцгеймера чи хвороба Паркінсона, кількість і форма дендритних шипиків змінюється до того, як спостерігають загибель нейронів.
На сьогодні наявні дослідження, які свідчать про можливість корегувати кількість дендритних шипиків при різноманітних патологічних станах. Зокрема, ці ефекти продемонстровані для цитиколіну (Цераксону), який складається з двох молекул: дисфосфохоліну та цитидину.
Дифосфохолін реалізує мембраностабілізувальний ефект цитиколіну: відновлює активність Na+/K+-АТФази клітинної мембрани, знижує активність фосфоліпази А2, бере участь у синтезі фосфатидилхоліну, впливає на утворення вільних жирних кислот, підтримує синтез ацетилхоліну, збільшує вміст норадреналіну й дофаміну в нервовій тканині.
Своєю чергою, головним ефектом цитидину є підвищення нейропластичності завдяки значному збільшенню розгалуженості дендритів і щільності шипиків пірамідальних нейронів. Крім того, він гальмує апоптоз, посилює ангіо-, нейро-, гліо- та синаптоґенез, підтримує модуляцію нейротрансмітерів.
Ефективність Цераксону при судинних когнітивних порушеннях підтверджена клінічно, зокрема в багатоцентровому італійському дослідженні IDEALE.
Іншим препаратом, який позитивно впливає на нейропластичність, є Актовегін. Дослідження in vivo показали, що при церебральній ішемії Актовегін збільшує кількість нейронів, що вижили, в зоні гіпокампа – частини головному мозку, яка відповідає за пам’ять і нейроґенез. Клінічні дослідження також показали значне покращення когнітивних функцій, які отримували Актовегін у гостру фазу ішемічного інсульту, зі стійким позитивним ефектом після припинення лікування.
Наявність експериментальних і клінічних досліджень Актовегіну й Цераксону стали підставою для включення цих препаратів у Канадські рекомендації з постінсультної реабілітації (2019) як засобів із доведеною ефективністю, котрі покращують когнітивну функцію й попереджають розвиток деменції.
Медична газета «Здоров’я України 21 сторіччя» № 12 (529), 2022 р.
СТАТТІ ЗА ТЕМОЮ Неврологія
Як відомо, біль у спині ускладнює рух і чинить негативний вплив на якість життя та психічне благополуччя людини. За даними Всесвітньої організації охорони здоров’я (ВООЗ), від болю в нижній частині спини страждають близько 619 млн людей у всьому світі, і за прогнозом, до 2050 року переважно через збільшення чисельності населення та його старіння кількість таких випадків може зрости до 843 млн (WHO, 2020). Попри проведення численних досліджень причини дорсалгій досі лишаються суперечливими, а результат лікування – здебільшого незадовільним....
Полінейропатії – це захворювання всього організму з реалізацією патологічного процесу на рівні периферичної нервової системи як множинного ураження периферичних нервів із порушенням їх функції. Більшість полінейропатій є хронічними станами, що значно порушують якість життя пацієнтів. Це зумовлює актуальність пошуку ефективних підходів до лікування цих захворювань....
Головний біль (ГБ) як один із найчастіших неврологічних розладів є причиною стану, що характеризується порушенням повсякденної життєдіяльності людини. Поширеність цефалгій і значний їх вплив на якість життя свідчать про важливість проблеми діагностування та лікування ГБ. За даними Глобального дослідження тяжкості хвороб, оновленими 2019 р., ГБ посідає третє місце (після інсульту та деменції) серед неврологічних причин за загальним тягарем захворювань (виміряним роками життя з поправкою на інвалідність [DALY]) (WHO, 2014). При цьому лише незначна кількість осіб із ГБ у всьому світі проходять відповідну діагностику та отримують адекватне лікування....
Біль є однією з найчастіших причин звернення по медичну допомогу. На хронічний біль, який чинить негативний вплив на загальний стан здоров’я, страждають щонайменше четверо з п’яти хворих із хронічною патологією спинного мозку. Основними типами болю, на який скаржаться такі пацієнти, є ноцицептивний і нейропатичний (у 49 і 56% випадків відповідно) (Felix et al., 2021). Пропонуємо до вашої уваги огляд доповіді директорки Інституту медичних та фармацевтичних наук Міжрегіональної академії управління персоналом, д.мед.н., професорки Наталії Костянтинівни Свиридової, присвяченої особливостям ведення хворих із ноцицептивним і нейропатичним болем у практиці сімейного лікаря, яку вона представила у лютому цього року під час Науково-практичної конференції «Дискусійний клуб сімейного лікаря»....