Характеристика лабораторних методів діагностики вовчакового антикоагулянту
Продовження. Початок у № 12 (529), 2022 р.
STACLOT-LA
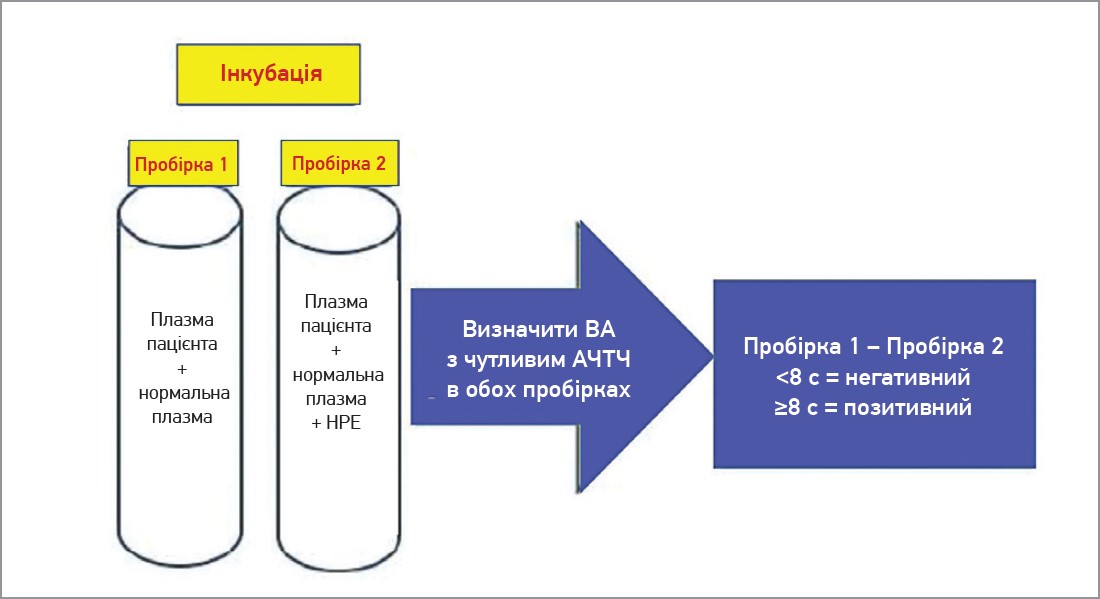
Набір STACLOT-LA (компанія STAGO, м. Аньєр-сюр-Сен, Франція) являє собою інтегрований аналіз, у якому плазму пацієнта змішують із нормальною контрольною плазмою й інкубують за наявності та за відсутності такого фосфоліпіду, як фосфатидилетаноламін (НРЕ) гексагональної фази (II). Згодом для обох зразків визначається АЧТЧ із використанням чутливого до ВА реагенту (низька концентрація фосфоліпідів). Якщо ВА наявний, його нейтралізує HPE, а це спричинить коротший час зсідання порівняно зі зразком, інкубованим без HPE. Призначення нормальної плазми, що використовується в суміші пацієнтів, полягає в корекції дефіциту факторів. Якщо не відбувається скорочення часу зсідання в пробірці, що містить HPE, слід запідозрити специфічний інгібітор фактора, а не ВА. Результати становлять різницю в часі зсідання між пробірками без HPE мінус пробірки, що містять HPE (рис. 6). Цей аналіз залежить від АВК [24]. Лабораторії мають визначити своє значення cut-off. Однак різниця ≥8 свідчить про наявність ВА [25].
Рис. 6. Виконання тесту STACLOT-LA. Плазму пацієнта + нормальну плазму інкубують за відсутності HPE (пробірка 1) та за наявності HPE (пробірка 2). АЧТЧ виконується з використанням реагенту, чутливого до ВА. Час зсідання пробірки 1 порівнюється з таким пробірки 2. Якщо ВА наявний, то результати, отримані обчисленням пробірка 1 – пробірка 2, мають бути ≥ встановленої порогової величини
Мікст-тест
Тест змішування АЧТЧ часто застосовується для виявлення наявності інгібітора чи дефіциту факторів за незрозумілого підвищеного АЧТЧ. Плазму пацієнта змішують із пулом нормальної плазми, зразок тестують одразу чи після інкубації протягом 60-120 хв за 37 °C на водяній бані. Існують різні співвідношення змішування пулу плазми та пулу нормальної плазми, які можна використовувати, проте найчастіше застосовують співвідношення 1:1. Якщо тест змішування не вдається скорегувати (як безпосередньої суміші, так й інкубованої), це передбачає наявність циркулювального інгібітора. У разі ВА інгібітор ідентифікується за допомогою спеціального аналізу ВА. При інтерпретації тестів на змішування слід бути обережним, оскільки слабкий інгібітор може бути замаскований при додаванні пулу нормальної плазми до пулу плазми. Корегування в тестах на змішування варіюється залежно від лабораторії. Деякі лабораторії можуть обрати вираження корекції щодо нормального еталонного інтервалу АЧТЧ (RI) (в межах від 2 до 3 стандартних відхилень RI) або заздалегідь певної кількості секунд вище за верхню межу RI. Лабораторії також можуть використовувати формулу для розрахунку відсотка корекції плазми часу зсідання пацієнта на основі ІЦА, також відомого як індекс Рознера [26]. Індекс ІЦА/Рознера – це локально певне значення з інтервалом зазвичай 10-20% (у середньому 15%). Має специфічність 98-100% і чутливість 55-68%.
ІЦА = АЧТЧс (розведена плазма 1:1) – АЧТЧс (нормальна плазма) × 100%
АЧТЧс (пацієнта)
Інтерпретація результатів:
– ІЦА <15% є корекцією (справжній дефіцит факторів);
– ІЦА >15% не є корекцією (інгібітор).
Слід зазначити, що для корекції АЧТЧ досить 30-50% активності факторів зсідання. CLSI (H60A) рекомендує подавати результати в тестах змішування як нормалізоване співвідношення, а не як час зсідання в секундах. Тест змішування може бути виконаний як окремий тест змішування (описано вище) або інтегрований до dRVVT чи SCT. Інтегрований тест змішування виконується лише для негайної суміші та ніколи не інкубується. Усі три експертні групи додали тест змішування до своїх настановчих принципів.
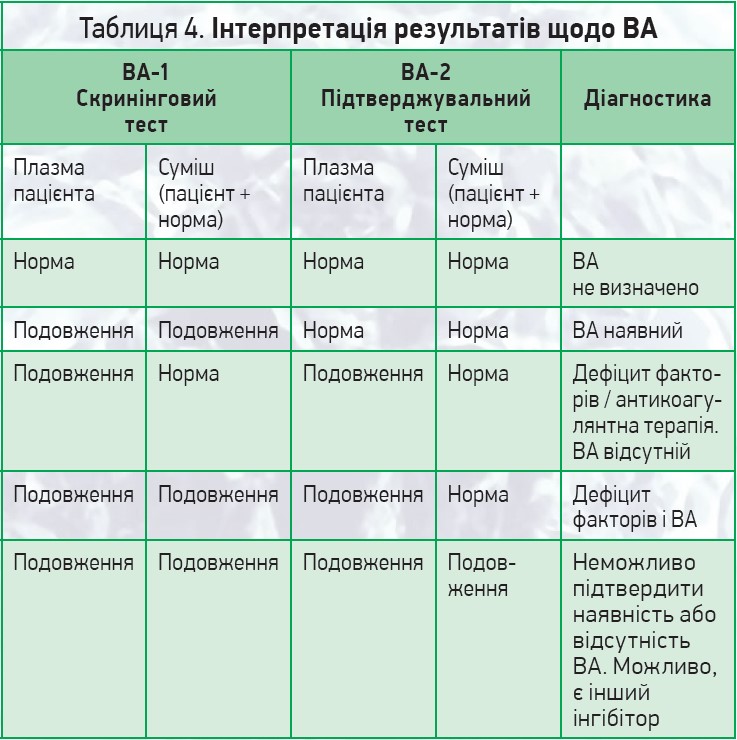
Приклад інтерпретації результатів щодо ВА наведено в таблиці 4.
Як розраховується нормалізований коефіцієнт скринінг/підтвердження?
Крок 1 Скринінговий коефіцієнт
Час зсідання пацієнта (с) / Час зсідання контрольної плазми (с)
<1,2 = норма. СТОП-тест – ВА негативний.
≥1,2 = подовження. Перейти до кроку 2.
Крок 2 Підтверджувальний коефіцієнт
Час зсідання пацієнта (с) / Час зсідання контрольної плазми (с)
<1,2 = норма. СТОП-тест – перейти до кроку 3.
≥1,2 = подовження. Перейти до кроку 4.
Крок 3 Розрахунок нормалізованого коефіцієнта скринінг/підтвердження
Скринінговий коефіцієнт має бути ≥1,2.
Підтверджувальний коефіцієнт має бути <1,2.
Скринінговий коефіцієнт / підтверджувальний коефіцієнт ≥1,2 – ВА позитивний;
• 1,2-1,5 = слабко позитивний;
• від >1,5 до <2 = помірно позитивний;
• >2 = виражений позитивний.
Крок 4 Тест змішування (1:1 плазма пацієнта до контрольної плазми)
Мікст скринінговий / контроль скриніговий
• <1,2 = норма. СТОП-тест – ВА негативний + дефіцит факторів;
• ≥1,2 = подовження. Проведення підтверджувального тесту. Мікст підтверджувальний / контроль підтверджувальний;
• ≥1,2 = подовження. Не можна підтвердити наявність або відсутність (можлива присутність альтернативного інгібітора);
• <1,2 = перейдіть до розрахунку нормалізованого коефіцієнта мікст-тесту. Мікст нормалізованого коефіцієнта;
• мікст-скринінговий коефіцієнт / мікст-підтверджувальний коефіцієнт;
• якщо ≥1,2 = ВА позитивний + дефіцит факторів.
Обмеження методів визначення ВА
Результати АЧТЧ-тесту, проведеного для одного й того самого пацієнта в різних лабораторіях, можуть значно відрізнятися. Дуже важливими чинниками є метод детекції, температура, рН, спосіб збирання крові, тип антикоагулянту, час і метод зберігання проб. Методика збирання крові та її зберігання мають бути стандартизовані, а несподівані результати – перевірені іншими методиками. Наявність у пробі пацієнтів фрагментів тромбоцитів може спричинити вивільнення фосфоліпідів, здатних нейтралізувати ВА (за їхньої наявності в пробі). Не рекомендується використання малих обсягів проб, оскільки рН у таких пробах менш стабільний. На тест АЧТЧ впливають різні лікарські препарати. Його подовження спостерігається при прийомі фенітоїну, гепарину, варфарину та препаратів, що застосовуються в рентгенографії. Зменшення АЧТЧ спостерігається за прийому пероральних контрацептивів (особливо естрогенів). Отже, лабораторія має сама встановлювати референсні значення для пацієнтів і стандартизувати умови проведення тестування.
Висновки
Щодо стратегій тестування ВА між групами експертів залишаються певні розбіжності. Існує низка важливих чинників, які слід ураховувати під час виконання тестування ВА. До таких чинників належать тип реагенту для скринінгу АЧТЧ, тип (-и) та кількість специфічних для ВА аналізів, які потрібно включити в панель, визначення відповідних порогових значень для ВА-специфічних аналізів, включення дослідження змішування як окремого аналізу або інтегрування до ВА-специфічного аналізу. Ретельне розуміння преаналітичних, аналітичних і постаналітичних змінних, які заважають тестуванню й інтерпретації ВА, має важливе значення для покращення тестування та діагностики. Жоден із тестів, що використовуються на сьогодні для виявлення ВА, не має рівної аналітичної чутливості щодо всіх різновидів антитіл, наявність яких зумовлює цей феномен. Цілком очевидно, що існує необхідність у покращеній гармонізації настановчих принципів між групами експертів для спрощення стратегій тестування та підвищення діагностичної точності аналізів. Ідеальною вважається розробка єдиного аналізу, який, можливо, використовуватиметься в майбутньому як альтернатива нинішнім методам тестування для розпізнавання неоднорідної природи ВА.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 13 (530), 2022 р.
СТАТТІ ЗА ТЕМОЮ Діагностика
Еритроцити, або червоні кров’яні тільця, є найпоширенішим компонентом клітин крові, які становлять 40-45% їхнього обсягу. Плазматична мембрана еритроцитів має унікальну будову, що надає їм біологічних і механічних властивостей, необхідних для виконання специфічних функцій. Основна функція еритроцитів в організмі – це транспорт кисню, опосередкований гемоглобіном. Вони активно беруть участь як в артеріальних, так і у венозних тромбозах [1]. Гемоглобін – висококонсервативний білок, який завдяки своїй здатності зворотно зв’язувати кисень бере участь у процесах, що лежать в основі аеробного життя на планеті Земля. Головна роль цього білка полягає у підтримці клітинного гомеостазу. Однак завдяки майже 200-річним дослідженням гемоглобіну тепер відомо, що цей білок також відіграє важливу роль в інших метаболічних процесах, як-от передача сигналів у клітинах, модуляція запальної реакції, за тромбозу при гемолізі еритроцитів тощо [2-4]....
У сучасному світі онкологічні захворювання становлять чи не найбільшу загрозу життю людини, поступаючись тільки серцево-судинній патології [1]. Більшість неінфекційних хвороб людини, зокрема й онкологічні захворювання, є багатофакторними, і їх розвиток пов’язаний у тому числі з генетичними чинниками. Це, з одного боку, підвищує з віком ризик виникнення хронічних захворювань, а з іншого – дає змогу разом з лікарем розробити заходи з їх профілактики, раннього виявлення й ефективного лікування [2]....
Власна патоморфологічна лабораторія – необхідність для всіх клінік ендоскопічного, хірургічного й онкологічного профілю. Одним із видів діяльності такої лабораторії є проведення інтраопераційних досліджень. Ці дослідження виконують для визначення тактики подальшого оперативного втручання під час операції. Тому створення лабораторії на колесах, що може надавати результати патоморфологічного дослідження в будь-якому місці та ще під час операційного втручання, стало логічним рішенням для Медичної лабораторії CSD LAB, найбільшої патоморфологічної лабораторії України та Східної Європи....
Нефракціоновані (НФГ) і низькомолекулярні гепарини (НМГ) є препаратами, що широко використовуються та запобігають артеріальним і венозним тромбозам. Однак їхнє застосування також пов’язано з парадоксальною реакцією, що зумовлює потенційно небезпечний для життя протромботичний стан, результатом чого є серйозні ускладнення (гангрена, ампутація кінцівок) або фатальні наслідки. Гепарин-індукована тромбоцитопенія (ГІТ) – це імуноопосередкована відповідь на введення гепарину, який спричиняє небезпечний для життя тромбоз і є клінічно значущим негеморагічним ускладненням. ГІТ вважається потенційно загрозливим для життя станом за терапії гепарином, що спричиняє утворення нових згустків крові, а не сприяє запобіганню утворення нових тромбів. Хоча при введенні гепарину імунна реакція зустрічається досить часто (від 8 до 50%), клінічні ускладнення у разі ГІТ виникають у ≈0,2-3% пацієнтів, які приймають гепарин протягом >4 дні; частіше спостерігаються в жінок [1-3]. У цьому стані тромбоцити різко знижуються до рівня ≥20×109/л. Смертність становить 10-20%....