Використання молнупіравіру в терапії COVID-19 серед імуноскомпрометованих пацієнтів: ефективність, безпечність та вірологічні результати подвійного сліпого рандомізованого плацебо-контрольованого дослідження III фази MOVe-OUT
Пацієнти з імунокомпрометувальними станами, як-от імуносупресія внаслідок лікування онкологічних, автоімунних захворювань чи перенесеної трансплантації гемопоетичних клітин та солідних органів, а також ВІЛ-позитивний статус, становлять групу підвищеного ризику щодо тяжкого перебігу COVID-19 і пролонгованої реплікації SARS-CoV-2. Затримка елімінації та тривале носійство інфекційно спроможного збудника імунодефіцитними особами є загрозливими з погляду інфекційного контролю, оскільки створюють можливості для підвищеної трансмісії, а також виникнення нових варіантів SARS-CoV-2. За даними літератури, в імуноскомпрометованих пацієнтів спостерігалися нижчі рівні антитіл, нейтралізувального спайк-протеїну, а також виникнення резистентних варіантів збудника внаслідок терапії моноклональними антитілами. У цьому матеріалі пропонується огляд ретроспективного аналізу вірологічних даних, а також клінічної ефективності та безпечності використання молнуправіру в когорті імуноскомпрометованих учасників дослідження III фази MOVe-OUT.
Імуноскомпрометовані пацієнти при інфікуванні SARS-CoV-2 є схильнішими до тяжкого перебігу COVID-19 та несприятливих клінічних наслідків [1-6]. Окрім того, особи з імунодефіцитом, як-от реципієнти трансплантованих гематопоетичних стовбурових клітин і солідних органів, а також ВІЛ-інфіковані пацієнти із кількістю CD4+ Т-лімфоцитів <200 клітин/мм3, можуть триваліший час бути носіями вірусу, а також виділяти вірусні частинки SARS-CoV-2 в навколишнє середовище після перенесеної коронавірусної хвороби, порівняно з індивідами без імуноскомпрометованого статусу [7-11]. До факторів, що негативно впливають на клінічні наслідки COVID-19 і запобігають елімінації SARS-CoV-2 в пацієнтів з імунною супресією, належать, зокрема, кількість CD4+ Т-лімфоцитів <200 клітин/мм3, тип злоякісного захворювання, тип алотранспланту, термін із моменту трансплантації, а також тип та дозування хіміотерапії, імунотерапії чи підтримувальної імуносупресивної терапії після індукції [3, 4, 6-11].
Молнупіравір - пероральний низькомолекулярний рибонуклеозидний препарат, активним метаболітом якого є β-D-N4-гідроксицитидин (NHC), що демонструє потужну противірусну активність стосовно всіх досліджених варіантів SARS-CoV-2 [12-14]. NHC інгібує SARS-CoV-2 упровадженням випадкових нуклеотидних змін на вірусній РНК збудника, що призводить до зниження його інфекційності [15, 16]. За результатами доклінічних досліджень та клінічних випробувань ІІ та ІІІ фази, молнупіравір знижує інфекційну спроможність SARS-CoV-2 [17-20]. Так, пацієнти з легким і середнім ступенями тяжкості COVID-19, у яких на початку дослідження був виявлений вірулентний збудник, після курсу лікування молнупіравіром у дозі 800 мг 2 р/добу протягом 5 днів не демонстрували носійства інфекційно спроможного SARS-CoV-2 [19, 20].
Ефективність молнупіравіру для лікування негоспіталізованих дорослих пацієнтів із легким та середньотяжким перебігами COVID-19, які належали до групи підвищеного ризику щодо прогресування коронавірусної хвороби до тяжкого стану, вивчали в клінічному дослідженні MOVe-OUT. Проміжний аналіз цього подвійного сліпого рандомізованого плацебо-контрольованого дослідження III фази із даними пацієнтів, що приєдналися до дослідження в часовий проміжок із 6 травня по серпень 2021 року, показав перевагу молнупіравіру порівняно із плацебо в зниженні ризиків госпіталізації та смерті з усіх причин на 29-ту добу захворювання (7,3 та 14,1% відповідно; різниця -6,8%; довірчий інтервал (ДІ) 95% від -11,3 до -2,4). За результатами фінального аналізу даних усіх рандомізованих пацієнтів, які приєдналися до дослідження із 6 травня до 2 жовтня 2021 року, молнупіравір продемонстрував зменшення ризиків госпіталізації та смерті з усіх причин (6,8 проти 9,7% у групі плацебо; різниця -3,0%; ДІ 95% від -5,9 до -0,1), а також зниження відносного ризику смертності від усіх причин на 89% порівняно із плацебо [21].
В цьому матеріалі представлені результати ретроспективного аналізу вірологічних даних, а також клінічної ефективності та безпечності використання молнупіравіру в когорті імуноскомпрометованих учасників дослідження MOVe-OUT. Було проведене порівняння частоти госпіталізації та смертності з усіх причин і виникнення небажаних явищ серед пацієнтів з ослабленим імунітетом і хворих із нормальним імунним статусом, які отримували молнупіравір або плацебо. Водночас досліджувалася вірусна РНК SARS-CoV-2 та інфекційна спроможність збудника, частоти виникнення нуклеотидних змін у вірусній РНК і змін амінокислотного складу, спричинених терапією молнупіравіром, а також вироблення антитіл до SARS-CoV-2 в групах імуноскомпрометованих та здорових осіб, які отримували молнупіравір або плацебо.
Результати
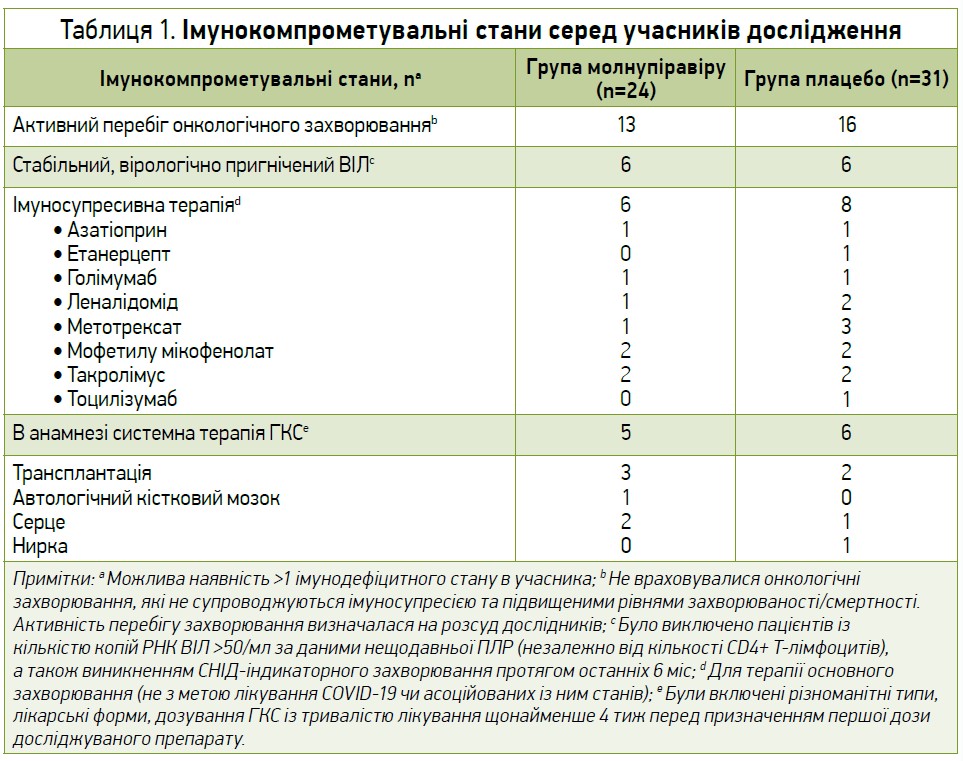
Серед усіх учасників, що потрапили до модифікованої вибірки залежно від призначеного лікування, 3,9% осіб (55/1408) були імуноскомпрометованими. 2 учасників з історією попереднього прийому ГКС (1 пацієнт із групи молнупіравіру, котрий отримував інгаляції флутиказону та сальметеролу, і 1 хворий з групи плацебо, який отримував бетаметазон/дексхлорфенірамін перорально, а також інгаляції флутиказону, сальметеролу) не були залучені до аналізу. Під час проведення дослідження дозування кортикостероїдів та інших імуносупресантів, що отримували учасники, не знижувалися. Найчастішими імунокомпрометувальними станами серед пацієнтів в обох групах були онкологічні захворювання в активній фазі. Перелік імунодефіцитних станів, що спостерігалися в учасників дослідження, представлено в таблиці 1.
Частота госпіталізації та смертність серед пацієнтів з ослабленим імунітетом станом на 29-й день у групі молнупіравіру (8,3%, 2/24) були нижчими, ніж у групі плацебо (22,6%, 7/31) (різниця -14,2%, ДІ 95% від -33,5 до 6,6).
Слід зазначити, що одним із госпіталізованих учасників групи молнупіравіру був 81-річний чоловік із дифузною великою В-клітинною лімфомою, який отримував циклофосфамід, доксорубіцин, вінкристин, преднізон та ритуксимаб за 10 днів до першої дози досліджуваного препарату; він був госпіталізований щодо непозалікарняної пневмонії на 7-й день дослідження і помер від поліорганної недостатності на 26-й день випробування. Другим госпіталізованим імуноскомпрометованим пацієнтом із групи молнупiравіру був 49-річний чоловік з активним перебігом неуточненого онкологічного захворювання та перенесеною геміколектомією, який був госпіталізований на 8-й день дослідження у зв’язку з періанальним абсцесом. За даними підтверджувального аналізу, серед госпіталізованих або померлих станом на 29-й день дослідження хворих, в 1 (4,2%, 1/24) учасника групи молнупіравіру та 5 (16,1%, 5/31) пацієнтів із групи плацебо госпіталізація чи смертність, на думку дослідників, були пов’язані з COVID-19.
У групі молнупіравіру частка пацієнтів, які були госпіталізовані або померли, була схожою в обох підгрупах незалежно від наявності імунодефіциту. В групі плацебо серед імуноскомпрометованих хворих частота госпіталізації та смертність були вищими порівняно з учасниками без імунодефіциту. Пропорційно смертність була вищою серед імуноскомпрометованих пацієнтів (5,5%, 3/55) порівняно з учасниками без ослабленого імунітету (0,5%, 7/1353).
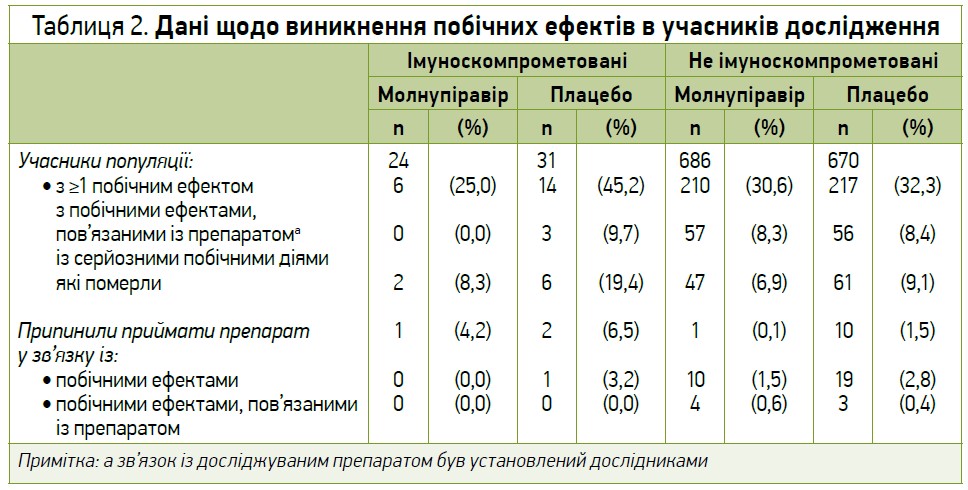
Молнупіравір загалом добре переносився учасниками з ослабленим імунітетом, а профіль його небажаних явищ був схожим у підгрупах пацієнтів незалежно від імунодефіцитного статусу. В учасників з ослабленим імунітетом спостерігалося менше побічних явищ та серйозних побічних явищ у групі молнупіравіру (25%, 6/24 та 8,3%, 2/24 відповідно) порівняно із групою плацебо (45,2%, 14/31 та 19,4%, 6/31 відповідно), тоді як у пацієнтів без імунодефіциту профіль небажаних явищ у групі молнупіравіру був схожим до такого в групі плацебо. Було зафіксовано 3 летальні випадки внаслідок небажаних явищ серед учасників з імуносупресією (1 – у групі молнупіравіру та 2 – в групі плацебо), жоден з яких, за оцінкою дослідників, не був пов’язаний з прийомом досліджуваного препарату. Дані щодо виникнення побічних ефектів в учасників дослідження наведено в таблиці 2.
Середній титр РНК SARS-CoV-2 (log10 копій/мл) станом на 1-й день дослідження був дещо вищим серед імуноскомпрометованих учасників (6,98, n=17 у групі молнупіравіру та 7,07, n=28 у групі плацебо) порівняно з учасниками без імунодефіциту (6,88, n=597 у групі молнупіравіру та 6,90, n=569 у групі плацебо).
Серед учасників без імунодефіциту середнє зниження титрів РНК SARS-CoV-2 стосовно вихідного рівня було значнішим у пацієнтів, які отримували молнупіравір (порівняно з підгрупою плацебо), в усіх часових точках, тоді як середні зміни титрів РНК у когорті учасників з ослабленим імунітетом виявилися схожими в підгрупах препарату та плацебо.
Серед пацієнтів групи молнупіравіру, в яких на початку дослідження виявили інфекційно спроможний вірус, у жодного учасника незалежно від їхнього імунного статусу інфекційний вірус не був виявлений у жодній часовій точці після початку лікування.
У групі плацебо 42,9% (3/7) учасників когорти з ослабленим імунітетом мали інфекційно спроможний вірус, виявлений на 3-й день дослідження, а в когорті пацієнтів без імуносупресії - 19,1% (17/89), 2,4% (2/82) учасників мали інфекційний вірус, виявлений на 3-й та 5-й день відповідно.
Висновки
Згідно з результатами ретроспективного аналізу даних, отриманих у подвійному сліпому рандомізованому плацебо-контрольованому дослідженні ІІІ фази MOVe-OUT, використання молнупіравіру в терапії негоспіталізованих імуноскомпрометованих дорослих пацієнтів із легким та середньотяжким перебігом COVID-19, які належали до групи підвищеного ризику щодо прогресування коронавірусної хвороби до тяжкого стану, є ефективним і безпечним. Молнупіравір демонстрував зіставні позитивні вірологічні ефекти в обох підгрупах пацієнтів незалежно від імунного статусу. За даними дослідження інфекційної спроможності вірусу SARS-CoV-2, а також генетичного аналізу збудника методом NGS до початку і після терапії дослідним препаратом, було визначено, що когорта імуноскомпрометованих учасників не демонструє підвищеної схильності до розвитку нових варіантів SARS-CoV-2 після лікування молнупіравіром.
Підготувала Ганна Гаврюшенко
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (537-538), 2023 р.
СТАТТІ ЗА ТЕМОЮ Інфекційні захворювання
Світ не бачив нового класу диво-ліків уже 40 років...
Рекомендації щодо антибіотиків першого і другого вибору для емпіричної терапії негоспітальної пневмонії, середнього отиту та загострення ХОЗЛ...
SARS-CoV‑2 виявився непересічним респіраторним вірусом і спричинив пандемію, яка тривала із 2019 по 2023 рік. Проте вплив цієї інфекції на імунну систему (ІС) людини не обмежується активацією фізіологічних механізмів противірусного захисту. Вірус здатний надмірно активувати ІС, зумовлюючи загрозливе ускладнення – т. зв. цитокіновий шторм, спричинити тяжку вірусну пневмонію, розвиток автоімунного синдрому, впливати на систему коагуляції тощо....
Риносинусит (РС) є одним із найчастіших захворювань у первинній медичній практиці. Трьома найбільш чутливими й специфічними симптомами гострого РС є виділення з носа, закладеність носа, лицевий і головний біль. Неконтрольований гострий біль значно погіршує якість життя пацієнтів із РС: спричиняє психоемоційні розлади, знижує працездатність і соціальну активність, сприяє хронізації больового синдрому і збільшує вартість лікування. Отже, полегшення болю при РС є найпершим завданням лікаря....