Подходы к антитромботической терапии у пациентов с острым коронарным синдромом без элевации сегмента ST: cлучай из практики
Острый коронарный синдром (ОКС) – это совокупность симптомов, которые позволяют заподозрить развитие острого инфаркта миокарда (ОИМ). Настоящая классификация ОКС основана на простом клиническом признаке (наличии элевации сегмента ST на электрокардиограмме – ЭКГ), однако позволяет разделить всех пациентов на две большие группы, характеризующиеся особенностями развития, клинического течения заболевания, кратковременного и длительного прогноза [14, 16, 24]. В основе ОКС с элевацией сегмента ST лежит полное закрытие коронарной артерии тромбом, которое, как правило, приводит к развитию ОИМ с зубцом Q.
Лечение этой категории пациентов в первую очередь состоит в скорейшей реваскуляризации миокарда (открытие инфаркт-обусловливающей коронарной артерии) механически (ангиопластика) или путем введения медикаментов (фибринолитическая терапия). Затем проводится профилактика и лечение осложнений ОИМ. Пациенты без стойкой элевации сегмента ST на ЭКГ представляют собой более разнородную категорию пациентов: от нестабильной стенокардии до ИМ с зубцом Q. В основе ОКС без элевации сегмента ST также зачастую лежит повреждение атеросклеротической бляшки с последующим тромбообразованием и частичным закрытием просвета коронарной артерии. В то же время чаще, чем у пациентов с элевацией ST, в патогенезе заболевания имеют значение спазм коронарных артерий, микроваскулярные нарушения коронарного кровотока, а также вторичное повреждение миокарда в результате несоответствия между потребностью миокарда в кислороде и возможностью его обеспечения (анемия, тахиаритмии, стрессовая ситуация на фоне значимого коронарного атеросклероза и т. п.).
Нередко с диагнозом ОКС без элевации сегмента ST госпитализируют пациентов с высоким функциональным классом (ФК) стабильной стенокардии, а также пациентов с болью в грудной клетке для проведения дифференциальной диагностики. Поэтому неудивительно, что согласно статистике пациенты без элевации сегмента ST составляют примерно две трети от общего количества пациентов, госпитализированных по поводу ОКС. Подходы к ведению этой категории пациентов основываются на определении степени риска развития осложнений. В настоящее время выделяют четыре категории риска: очень высокий, высокий, промежуточный и низкий [16, 24].
Категория риска определяет необходимость и сроки проведения ангиографии, а также подходы к антитромботической и антиангинальной терапии. Рассмотрим принципы ведения пациентов с ОКС без элевации ST на клиническом примере.
Пациент 74 лет, поступил из поликлиники с жалобами на боли за грудиной, умеренную одышку, слабость. При поступлении артериальное давление – 134/80 мм рт. ст.; частота сердечных сокращений (ЧСС) – 71 уд/мин; сатурация кислорода по данным пульсоксиметрии (без ингаляции кислорода) – 96%. Дополнительные тоны и шумы при аускультации сердца не выслушивались. В легких жесткое дыхание, влажные хрипы в нижних отделах, которые перемещаются при изменении положения тела (острая левожелудочковая недостаточность – ОЛЖН, Killip II). В анамнезе – хроническая ишемическая болезнь сердца (ИБС) с сопутствующей артериальной гипертонией. Десять лет назад пациент перенес острый с зубцом Q ИМ в области задней стенки левого желудочка (ЛЖ), в последнее время – стенокардия напряжения на уровне ІІ-ІІІ ФК. Два года назад перенес острое нарушение мозгового кровообращения по ишемическому типу (без клинически значимой остаточной неврологической симптоматики). Явное прогрессирование ангинозных болей отмечает в течение последних суток после интенсивной физической нагрузки. Боли носят волнообразный характер и появляются при минимальной нагрузке, два приступа боли в покое длительностью более 30-40 мин.
Приступ боли ангинозного характера развился во время транспортировки пациента из поликлиники. На ЭКГ при поступлении на фоне болевого синдрома (рис. 1) отмечается депрессия сегмента ST в отведениях I, II, aVL, V2-V6 c максимумом до 5-6 мм, минимальный подъем ST до 1 мм в aVR, признаки перенесенного ранее Q-ИМ в области задней стенки ЛЖ.
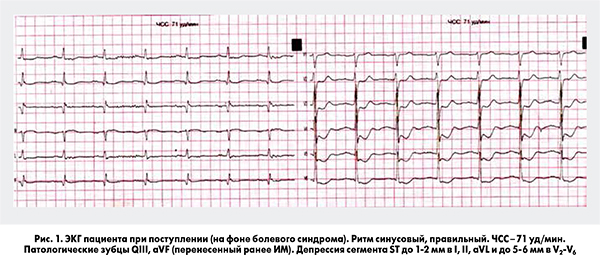
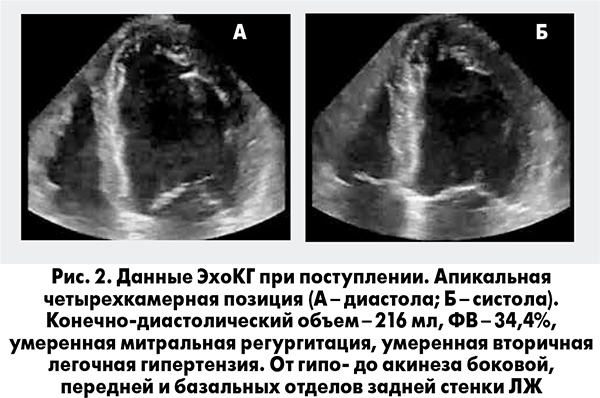
Пациент был госпитализирован с диагнозом ОКС без стойкой элевации сегмента ST. Болевой синдром был купирован после сублингвального приема нитроглицерина. Пациент помещен под мониторное наблюдение, после катетеризации периферической вены налажена внутривенная инфузия нитратов. Уже на догоспитальном этапе (поликлиника) пациент получил нагрузочную дозу клопидогреля 300 мг и ацетилсалициловой кислоты (АСК) 150 мг. Дополнительно при поступлении получил 80 мг аторвастатина, введены фондапаринукс 2,5 мг подкожно и 20 мг пантопразола с целью профилактики желудочно-кишечного кровотечения на фоне проводимой антитромботической терапии (АТТ). Для оценки выраженности нарушений сегментарной сократимости, систолической и диастолической функции ЛЖ, а также поиска возможных других причин развития ОЛЖН (Killip II) пациенту проведена трансторакальная эхокардиография (ЭхоКГ). По данным исследования выявлена дилатация полостей сердца, выраженные нарушения систолической функции ЛЖ (фракция выброса, ФВ – 34%) за счет нарушений сегментарной сократимости в области боковой, задней и апикальных отделов передней стенки ЛЖ. Диастолическая функция соответствовала рестриктивному типу нарушений, гемодинамически значимых клапанных проблем выявлено не было (рис. 2).
К этому времени были готовы результаты лабораторных анализов крови, взятых при поступлении. Выявлено повышение уровня кардиоспецифических ферментов (креатинфосфокиназы – КФК, МВ-фракции КФК, тропонина Т), повышение уровня глюкозы до 13,6 ммоль/л (ранее сахарный диабет (СД) не диагностировался), умеренный лейкоцитоз и снижение расчетной скорости клубочковой фильтрации до 45 мл/мин/1,73 м2 (табл.).
.jpg)
На основании клинической картины заболевания и данных проведенных исследований пациент был отнесен к категории высокого риска развития осложнений (повышение уровня тропонина, динамические изменения ЭКГ, 194 балла по шкале GRACE) [16, 24]. Стабильное состояние центральной гемодинамики, отсутствие жизнеопасных нарушений сердечного ритма, явной клинической симптоматики острой сердечной недостаточности (СН) и рецидивирования болей ангинозного характера на фоне проводимой терапии (признаки очень высокого риска) позволило запланировать проведение ангиографии на следующее утро (в пределах 24 ч) [16, 24]. В связи с этим был поставлен вопрос об оптимальном медикаментозном ведении такого пациента перед, во время и после проведения реваскуляризации.
В соответствии с рекомендациями Европейского общества кардиологов [16], Американской ассоциации сердца [14], а также на основании Унифицированного клинического протокола Министерства здравоохранения Украины [24] пациенты с ОКС без элевации сегмента ST из группы промежуточного и высокого риска должны получать двойную АТТ (ДАТТ), причем в дополнение к АСК предпочтительнее использовать тикагрелор. Клопидогрель рекомендовано назначать только в случае невозможности использования тикагрелора.
Тикагрелор* – это синтетический препарат, ставший родоначальником новой группы антитромбоцитарных препаратов триазолопиримидинов. Механизм действия препарата заключается в блокировании Р2Y12-рецепторов тромбоцитов [6, 22], что приводит к ингибированию воздействия на них аденозиндифосфата и снижает связывание фибриногена с гликопротеиновыми рецепторами IIb/IIIа, следствием чего является торможение I и II фаз агрегации тромбоцитов. В отличие от препаратов группы тиенопиридинов (клопидогреля, тиклопидина, прасугреля) тикагрелор является не пролекарством, а метаболически активным препаратом. Существенным также является тот факт, что блокада тромбоцитарных рецепторов на фоне применения тикагрелора имеет обратимый характер, что обусловливает постепенное и полное восстановление функции Р2Y12-рецепторов тромбоцитов после отмены препарата. Благодаря этим свойствам тикагрелор начинает действовать быстрее, чем клопидогрель, после приема нагрузочной дозы, а при отмене препарата наблюдается более быстрое восстановление функции тромбоцитов [6].
*Оригинальный тикагрелор зарегистрирован в Украине под торговым названием Брилинта. Регистрационное удостоверение № UA/12164/01/01 от 06.04.2017 № 373.
Клиническая эффективность препарата у пациентов с ОКС изучалась в исследовании PLATO, в которое было включено более 18,5 тыс. пациентов [22]. Применение тикагрелора (по сравнению с клопидогрелем) в комбинации с АСК в течение года после ОКС позволяло достоверно снизить вероятность развития комбинации смерть от сердечно-сосудистых причин / ИМ / инсульт (первичная конечная точка) на 16% (95% доверительный интервал, ДИ 0,77-0,92; p<0,001). Прием тикагрелора также приводил к существенному уменьшению вероятности развития нефатального ИМ (относительный риск, ОР 0,84; 95% ДИ 0,75-0,95; p=0,005), смерти от сердечно-сосудистых причин (ОР 0,79; 95% ДИ 0,69-0,91; p=0,001) и смерти от всех причин (ОР 0,78; 95% ДИ 0,69-0,89; p<0,001) без значимого увеличения общего количества больших кровотечений (ОР 1,04; 95% ДИ 0,95-1,13; p=0,43). В то же время в исследовании было показано, что прием тикагрелора как более сильного антитромбоцитарного препарата сопровождался увеличением количества кровотечений, не связанных с проведением аортокоронарного шунтирования (АКШ) [2].
После изменения клинических рекомендаций в ряде стран Европы тикагрелор занял лидирующие позиции в лечении пациентов с ОКС, и результаты исследования PLATO нашли подтверждение в реальной клинической практике. Преимущества тикагрелора в плане снижения сердечно-сосудистых осложнений у больных с ОКС были подтверждены в ряде одноцентровых, многоцентровых и национальных регистров на большом количестве пациентов (SWEDEHEART – 45 073 пациента [17], SHEFFIELDRWE – 10 793 пациента [5], Western Denmark Heart Registry – 2335 пациентов [4], ESTATE – 928 пациентов [3] и др.). Анализ имеющихся данных показал, что тикагрелор одинаково эффективен у пациентов как с элевацией, так и без элевации сегмента ST, причем в последней подгруппе препарат демонстрировал свою эффективность независимо от тактики ведения – инвазивной или консервативной [15].
Помимо тромботического риска перед назначением АТТ необходимо оценивать и возможные риски кровотечений. Оценку геморрагического риска у пациента с ОКС рекомендовано проводить по шкале CRUSADE [19]. Наш пациент по этой шкале набрал 51 балл (учитывался также СД, который был заподозрен анамнестически и по исходному уровню глюкозы, а в последующем подтвержден в ходе дальнейшей лабораторной диагностики), что соответствует категории очень высокого риска, а вероятность развития большого кровотечения составляет в среднем 12,8% в течение госпитального периода заболевания.
Следовательно, наш пациент имеет высокий тромботический и геморрагический риски, которые во многом обусловлены возрастом, наличием сопутствующей почечной дисфункции, СД и перенесенного острого нарушения мозгового кровообращения. Согласно данным исследования PLATO эффективность и безопасность тикагрелора не зависели от возраста пациентов и сохранялись у больных старших возрастных групп [9]. В одном из субанализов исследования также была подтверждена безопасность и эффективность приема тикагрелора у пациентов после перенесенного нарушения мозгового кровообращения [10]. Более того, у пациентов с острым инсультом в исследовании SOCRATES безопасность тикагрелора была сравнима с АСК [13]. Также тикагрелор эффективно предупреждал сердечно-сосудистые осложнения у пациентов с почечной дисфункцией [11] и СД [12] без существенного увеличения риска кровотечений, хотя данные относительно применения препарата при клиренсе креатинина <30 мл/мин ограничены.
Особенно эффективным был прием тикагрелора (по сравнению с клопидогрелем) в подгруппе пациентов с исходным уровнем гликированного гемоглобина >6%. Было показано, что гипергликемия повышает реактивность тромбоцитов за счет увеличения экспрессии P-селектина, изменения текучести клеточных мембран с повышением адгезии тромбоцитов и активации протеина C [1].
Помимо гипергликемии существенную роль в развитии протромбогенного состоянии на фоне СД играют также резистентность к инсулину, метаболические нарушения, эндотелиальная дисфункция и воспаление [1]. При этом антитромбоцитарный эффект клопидогреля у этой категории пациентов в среднем снижен. Среди возможных причин подобной тромборезистентности рассматривают снижение активности цитохрома Р450 в печени и, соответственно, более медленное образование активного метаболита клопидогреля. Определенное значение играют также повышение сигнальной активности P2Y12-рецепторов и ускорение образования новых тромбоцитов (рецепторы которых не блокированы клопидогрелем) [1].
Таким образом, несмотря на нагрузочную дозу клопидогреля 300 мг на догоспитальном этапе, было принято решение о переводе пациента на прием тикагрелора. Препарат назначен в нагрузочной дозе 180 мг с последующим приемом 90 мг каждые 12 ч. Тиеноперидины и тикагрелор имеют разные точки взаимодействия с P2Y12-рецепторами тромбоцитов, поэтому использование клопидогреля на постоянной основе или прием его нагрузочной дозы на предшествующих этапах оказания медицинской помощи не является противопоказанием для назначения тикагрелора. Клиническая безопасность применения препарата на фоне клопидогреля была подтверждена в исследовании PLATO, в котором около половины пациентов получили клопидогрель до рандомизации [22].
В качестве АТТ пациент также продолжал принимать АСК (при приеме тикагрелора важно, чтобы поддерживающая доза АСК не превышала 100 мг) и фондапаринукс. Согласно результатам исследования OASIS‑5 у пациентов с ОКС без элевации сегмента ST фондапаринукс имел преимущества перед эноксапарином в первую очередь за счет снижения количества кровотечений, что в дальнейшем реализовалось в улучшение выживания у этой категории пациентов [23]. Эти данные в последующем были подтверждены и в реальной клинической практике (анализ более 40 тыс. пациентов с ИМ без элевации сегмента ST) [20]. Причем первоначально отмеченное увеличение случаев тромбоза катетера при проведении интервенционных процедур на фоне антикоагулянтной терапии фондапаринуксом легко предупредить путем дополнительного введения нефракционированного гепарина во время процедуры [16].
Пациенту также продолжен прием розувастатина 40 мг (переведен в связи с высоким уровнем холестерина липопротеинов низкой плотности), пантопразола, назначены бета-блокатор, ингибитор ангиотензинпревращающего фермента (АПФ) и эплеренон (учитывая наличие ОЛЖН, систолическую дисфункцию ЛЖ, сопутствующий СД). Проводимая медикаментозная терапия позволила стабилизировать состояние пациента: боли ангинозного характера не рецидивировали, явления ОЛЖН нивелировались, что позволило отменить внутривенное введение нитратов. На следующий день в плановом порядке пациент был переведен для проведения коронаровентрикулографии в отдел интервенционной кардиологии.
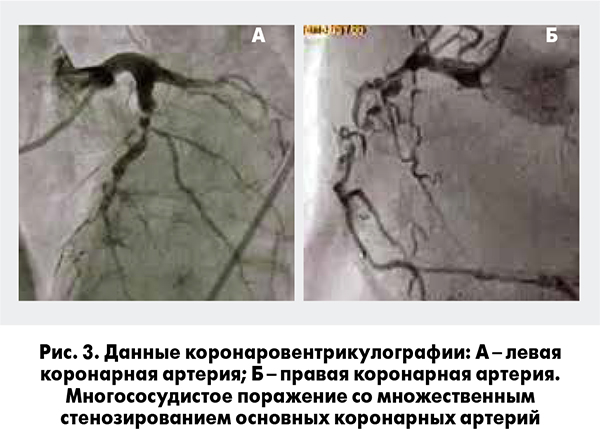
По данным коронаровентрикулографии (рис. 3) выявлено множественное поражение коронарных артерий с окклюзией передней межжелудочковой ветви в среднем сегменте. Пациенту рекомендовано проведение АКШ. Учитывая относительную стабилизацию состояния пациента (прекращение болей ангинозного характера, отсутствие признаков СН), высокий риск проведения вмешательства в ранние сроки ОИМ, а также развитие у пациента сопутствующей застойной пневмонии, совместно с кардиохирургами было принято решение о переносе сроков оперативного вмешательства на 3-4 нед. В связи с этим возник вопрос о назначении оптимальной терапии (в первую очередь АТТ), которая позволила бы безопасно довести пациента до оперативного вмешательства.
В исследовании PLATO операция АКШ после рандомизации была проведена у 1899 (около 10%) пациентов. В течение последних 7 дней до вмешательства хотя бы одну дозу исследуемого препарата (тикагрелора или клопидогреля) получил 1261 пациент, которые и были включены в последующий анализ [8]. Относительное снижение риска развития событий первичной конечной точки (сердечно-сосудистая смерть / ИМ / инсульт) на фоне приема тикагрелора в этой подгруппе пациентов было сравнимо с общей группой (ОР 0,84; 95% ДИ 0,60-1,16; p=0,29). Более того, прием тикагрелора сопровождался практически двукратным снижением риска общей (ОР 0,49; 95% ДИ 0,32-0,77; p<0,01), сердечно-сосудистой (ОР 0,52; 95% ДИ 0,32-0,85; p<0,01) и некардиоваскулярной (ОР 0,35; 95% ДИ 0,11-1,11; p=0,07) смерти у этой категории пациентов. При этом общее количество больших АКШ-обусловленных кровотечений в обеих группах не отличалось. Последующий анализ выявил, что, кроме снижения смерти от сердечно-сосудистых причин, успех терапии тикагрелором у этой категории пациентов был обусловлен уменьшением риска смерти от кровотечений и инфекционных осложнений [21].
Снижение риска фатальных кровотечений связывают с обратимым связыванием P2Y12-рецепторов тромбоцитов при приеме тикагрелора и, таким образом, более быстрым восстановлением функции тромбоцитов после отмены препарата перед операцией. Точная причина снижения количества смертей от инфекционных осложнений не известна. В качестве возможных механизмов рассматриваются модуляция участия тромбоцитов в формировании воспалительного ответа, а также наличие у тикагрелора дополнительных аденозиновых механизмов действия (повышение концентрации эндогенного аденозина за счет снижения его обратного захвата). Таким образом, описанные выше данные послужили основанием для продолжения ДАТТ тикагрелором и АСК у нашего пациента. АТТ фондапаринуксом была отменена на 7-е сутки после развития ОКС, когда пациент уже самостоятельно передвигался в пределах отделения и готовился к переводу в отделение реабилитации.
Очень важным является вопрос периоперационного назначения АТТ. В настоящее время рекомендовано у большинства пациентов, которым планируется проведение АКШ, терапию АСК продолжать до оперативного вмешательства (АСК отменяется за
3-5 дней только у пациентов с очень высоким риском кровотечений или у тех, кому по тем или иным причинам невозможно переливание крови) [16, 18]. Клопидогрель и тикагрелор рекомендовано отменить за 5 суток до вмешательства, прасугрель – за 7 суток [16, 18].
В инструкции к тикагрелору препарат рекомендовано отменять за 7 дней до предполагаемого АКШ (максимальный срок, который анализировался в PLATO). В то же время согласно результатам исследования PLATO было показано, что тикагрелор безопасно отменять за 72 ч перед операцией [8]. Эти данные в последующем были подтверждены и в шведском регистре ОКС [7]. Восстанавливать АТТ после проведения АКШ рекомендуют как можно раньше: АСК – в течение первых 24 ч (желательно 6 ч) после вмешательства, а блокаторы P2Y12-рецепторов – после контроля кровотечения (после прекращения геморрагического отделяемого по дренажам) [16, 18].
Длительность ДАТТ после ОКС не зависит от вида реваскуляризации и на сегодняшний день составляет минимум 12 мес [14, 16, 24]. Зачастую периоперационно таким пациентам назначают низкомолекулярные гепарины, хотя эффективность такого подхода для предупреждения артериальных тромбозов не доказана. В нашем случае пациенту был отменен тикагрелор за 5 суток до вмешательства. АСК в кардиохирургическом стационаре пациенту отменили за 3 суток до АКШ, а периоперационно были назначены профилактические дозы эноксапарина.
Для защиты миокарда в условиях острой ишемии и улучшения прогноза пациенту был также назначен триметазидин® MR*, что было обосновано его эффективностью при ИМ по данным корейского регистра KAMIR, в котором отмечалось уменьшение на 76% числа пациентов, достигавших комбинированной конечной точки (смерть от всех причин, нефатальный ИМ, необходимость повторной реваскуляризации) в течение первого года после ОИМ. В исследованиях El-Kady (2005), Di Napoli (2007), Fragasso (2011) показано улучшение сократительной функции миокарда ЛЖ при применении триметазидина MR при ишемической кардиопатии, а в метаанализе D. Gao (2014) – снижение общей смертности.
*Зарегистрированная в Украине форма оригинального триметазидина, который изучали в приведенных в обзоре исследованиях (Р. с. МЗ Украины № UA/3704/02_/01), – Предуктал® MR. Биоэквивалентность Предуктала и Предуктала MR доказана, представлена и подтверждена в процессе регистрации.
Полученные данные были подтверждены в многоцентровом исследовании, проведенном Fragasso (2013), где у 669 пациентов с хронической СН при назначении триметазидина отмечалось снижение частоты госпитализаций, снижение кардиоваскулярной и общей смертности.
Антиишемическое действие на уровне кардиомиоцитов, антиоксидантный и противовоспалительный эффекты, а также благоприятное влияние на эндотелиальную функцию имеют большое значение при проведении вмешательств на коронарных сосудах.
Применение триметазидина MR тем более показано перед проведением АКШ, так как препарат показал эффективность в профилактике реперфузионного повреждения при операциях АКШ. Имеются данные о кардиопротекторном эффекте триметазидина MR при данном вмешательстве – достоверном снижении вымывания КФК и тропонина Т (Iskesen, 2009; Martins, 2011). В метаанализе 6 рандомизированных контролируемых исследований Zhang и соавт. показали достоверное снижение послеоперационных концентраций креатинкиназы-МВ и тропонина у пациентов, получавших перед операцией триметазидин, по сравнению с контрольной группой (N. Zhang, J. Lei, Cardiology, 2015; 131: 86-96).
Таким образом, рациональное применение АТТ на разных этапах оказания помощи пациенту с ОКС без стойкой элевации сегмента ST с высоким ишемическим и геморрагическим риском (АСК, тикагрелор, фондапаринукс – острый период, стабилизация состояния пациента; АСК, тикагрелор – поддерживающая терапия до вмешательства; эноксапарин периоперационно) позволило стабилизировать состояние пациента, предупредить развитие сердечно-сосудистых осложнений до проведения оперативного вмешательства и безопасно провести реваскуляризацию миокарда. В дальнейшем пациенту было рекомендовано продолжение приема ДАТТ (АСК и тикагрелор), розувастатина, бета-блокатора, ингибитора АПФ и эплеренона.
Литература
1. Angiolillo D.J., Jakubowski J.A., Ferreiro J.L., et al. Impaired responsiveness to the platelet P2Y12 receptor antagonist clopidogrel in patients with type 2 diabetes and coronary artery disease. J Am Coll Cardiol. 2014; 64: 1005-1014.
2. Becker R.C., Bassand J.P., Budaj A., et al. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J. 2011; 32: 2933-44.
3. Chen I.C., Lee C.H., Fang C.C., et al. Efficacy and safety of ticagrelor versus clopidogrel in acute coronary syndrome in Taiwan: a multicenter retrospective pilot study. J Chin Med Assoc. 2016; 79: 521e30.
4. Fallesen C.O., Thayssen P., Pedersen K.E., et al. Stent Thrombosis With Ticagrelor Versus Clopidogrel After Percutaneous Coronary Intervention and Ticagrelor or Clopidogrel in Patients With Acute Coronary Syndromes in a Real World Setting. JACC. 2014; 64, Suppl. B: B145
5. Gosling R., Yazdani M., Parviz Y., et al. Comparison of P2Y12 inhibitors for mortality and stent thrombosis in patients with acute coronary sydromes: ingle center study of 10793 consecutive ‘real-world’patients. Platelets, 2017: 1-7.
6. Gurbel P.A., Bliden K.P., Butler K., et al.Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/OFFSET studyCirculation. 2009; 120: 2577-2585.
7. Hansson E.C., Jideus L., Aberg B., et al. Coronary artery bypass grafting-relatedbleeding complications in patients treated with ticagrelor or clopidogrel: a nationwide study. Eur. Heart J. 2016; 37: 189-197.
8. Held C., Asenblad N., Bassand J.P., et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes under going coronary artery bypass surgery: results from the PLATO (Platelet Inhibitionand Patient Outcomes) trial. J Am Coll Cardiol. 2011; 57 (6): 672-684.
9. Husted S., et al. Ticagrelor versus clopidogrel in elderly patients with acute coronary syndromes: a substudy from the prospective randomized Platelet Inhibition and Patient Outcomes (PLATO) trial. Circ. Cardiovasc. Qual. Outcomes 5, 680-688 (2012).
10. James S., et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes and a history of stroke or transient ischemic attack. Circulation 125, 2914-2921 (2012).
11. James S., et al. Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation 122, 1056-1067 (2010).
12. James S., et al. Ticagrelor vs. clopidogrel in patients with acute coronary syndromes and diabetes: a substudy from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Eur. Heart J. 31, 3006-3016 (2010).
13. Johnston S.C., Amarenco P., Albers G.W., et al.; SOCRATES Steering Committee and Investigators. Ticagrelor versus aspirin in acute stroke or transient ischemic attack. N Engl J Med. 2016; 375: 35-43.
14. Levine G.N., Bates E.R., Bittl J.A., et al. 2016 ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American college of Cardiology / American heart association task force on clinical practice guidelines. J Am Coll Cardiol 2016; 68: 1082-1115.
15. Lindholm D., Varenhorst C., Cannon C.P., et al.Ticagrelor vs. clopidogrel in patients with non-ST-elevation acute coronary syndrome with or without revascularization: results from the PLATO trial. Eur Heart J 2014; 35: 2083-2093.
16. Roffi M., Patrono C., Collet J.-P., et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016; 37 (3): 267-315.
17. Sahlen A., Varenhorst C., Lagerqvist B., et al.. Outcomes in patients treated with ticagrelor or clopidogrel after acute myocardial infarction: experiences from SWEDEHEART registry. Eur Heart J. 2016, 37 (44): 3335-3342.
18. Sousa-Uva M., Storey R., Huber K., et al. ESC Working Group on Cardiovascular Surgery and ESC Working Group on Thrombosis. Еxpert position paper on the management of antiplatelet therapy in patients under going coronary artery bypass graft surgery. Eur Heart J. 2014; 35 (23): 1510-1514.
19. Subherwal S., Bach R.G., Chen A.Y., et al. Baseline risk of major bleeding in non-ST-segment-elevation myocardial infarction: the CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines) bleeding score. Circulation, 2009; 119: 1873-1882.
20. Szummer K., Oldgren J., Lindhagen L., et al. Association between the use of fondaparinux vs low-molecular-weight heparin and clinical outcomes in patients with non-ST-segment elevation myocardial infarction. JAMA. 2015; 313: 707-16.
21. Varenhorst C., Alstrom U., Scirica B.M., et al. Factors contributing to the lower mortality with ticagrelor compared with clopidogrel in patients under going coronary artery bypass surgery. J Am Coll Cardiol. 2012; 60: 1623-1630.
22. Wallentin L., Becker R.C., Budaj A., et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045-57.
23. Yusuf S., Mehta S.R., Chrolavicius S., et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med 2006; 354: 1464-76.
24. Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації. Гострий коронарний синдром без елевації сегмента ST. Наказ Міністерства охорони здоров’я України № 164 від 03.03.2016.
Додаток № 1 до тематичного номеру газети «Здоров’я України» «Кардіологія. Ревматологія. Кардіохірургія» № 4 Вересень 2017
СТАТТІ ЗА ТЕМОЮ Кардіологія
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Інколи саме з цього перерізу вдається візуалізувати тромбоемболи в основних гілках легеневої артерії або вегетації на стулках легеневого клапана (що трапляється надзвичайно рідко). Нахиливши датчик до самої верхівки серця, можна отримати її переріз по короткій осі, на якому, знову ж таки, порожнина лівого шлуночка має круглясту форму, а правого шлуночка – близьку до трикутника із виразною трабекулярністю (рис. 22.9). Розглядаючи зображення, також звертають увагу на те, що в нормі всі сегменти ЛШ скорочуються синхронно, не випереджаючи інші і не відстаючи. ...
Застосування статинів середньої інтенсивності в комбінації з езетимібом порівняно зі статинами високої інтенсивності окремо може забезпечити більше зниження рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) у пацієнтів із нещодавнім ішемічним інсультом. Пропонуємо до вашої уваги огляд статті Keun-Sik Hong et al. «Moderate-Intensity Rosuvastatin Plus Ezetimibe Versus High-Intensity Rosuvastatin for Target Low-Density Lipoprotein Cholesterol Goal Achievement in Patients With Recent Ischemic Stroke: A Randomized Controlled Trial», опублікованої у виданні Journal of Stroke (2023; 25(2): 242‑250). ...
Артеріальна гіпертензія (АГ) сьогодні є одним із найпоширеніших серцево-судинних захворювань (ССЗ), що асоціюється з високим кардіоваскулярним ризиком, особливо в коморбідних пацієнтів. Навіть помірне підвищення артеріального тиску (АТ) пов’язане зі зменшенням очікуваної тривалості життя. До 40% хворих на АГ не підозрюють у себе недугу, бо це захворювання на початку може мати безсимптомний перебіг. Оптимальний контроль АТ є вагомим чинником профілактики фатальних серцево-судинних подій (ССП) для забезпечення якісного та повноцінного життя таких хворих. ...




