Звичне невиношування: що необхідно робити і чого робити не слід
Проблема збереження здоров’я нації в Україні сьогодні стоїть дуже гостро. В умовах соціально-економічної напруженості в нашій державі значно погіршуються медико-демографічні показники.
Серед чинників, що визначають здоров’я нації, найвпливовішими є невиношування й недоношування вагітності, адже саме новонароджені від передчасних пологів формують показники перинатальної захворюваності та смертності, інвалідності з дитинства.
Незважаючи на підвищення якості надання акушерської допомоги, частота невиношування вагітності, зокрема екстремально ранніх передчасних пологів, не має тенденції до зниження. Як свідчать літературні джерела, частота невиношування й недоношування вагітності залишається високою – на рівні 10-30%. Більше того, у загальній популяції породіль за останні роки значно зросла частота передчасних пологів, що, на думку багатьох дослідників, зобов’язує акцентувати увагу на питанні невиношування вагітності як на одному з найбільш значущих у сучасному акушерстві.
З огляду на значущість цієї проблеми особливої важливості набуває питання підготовки та ведення вагітності у жінок зі звичним невиношуванням.
Звичним невиношуванням (ЗН), за визначенням ВООЗ, є наявність в анамнезі жінки 3 та більше мимовільних абортів поспіль (за дефініцією American Society for Reproductive Medicine (2015) – 2) у термін до 22 тижнів вагітності.
Вітчизняний клінічний протокол з акушерської допомоги «Невиношування вагітності» (наказ МОЗ України № 624 від 03.11.2008 р.) також визначає ЗН як наявність в анамнезі жінки 2 та більше мимовільних абортів поспіль у термін до 22 тижнів вагітності, але додатково вводить такі поняття, як вторинний звичний викидень (якщо серії викиднів передувало нормальне успішне виношування вагітності) та первинний звичний викидень (якщо успішного виношування вагітності не було).
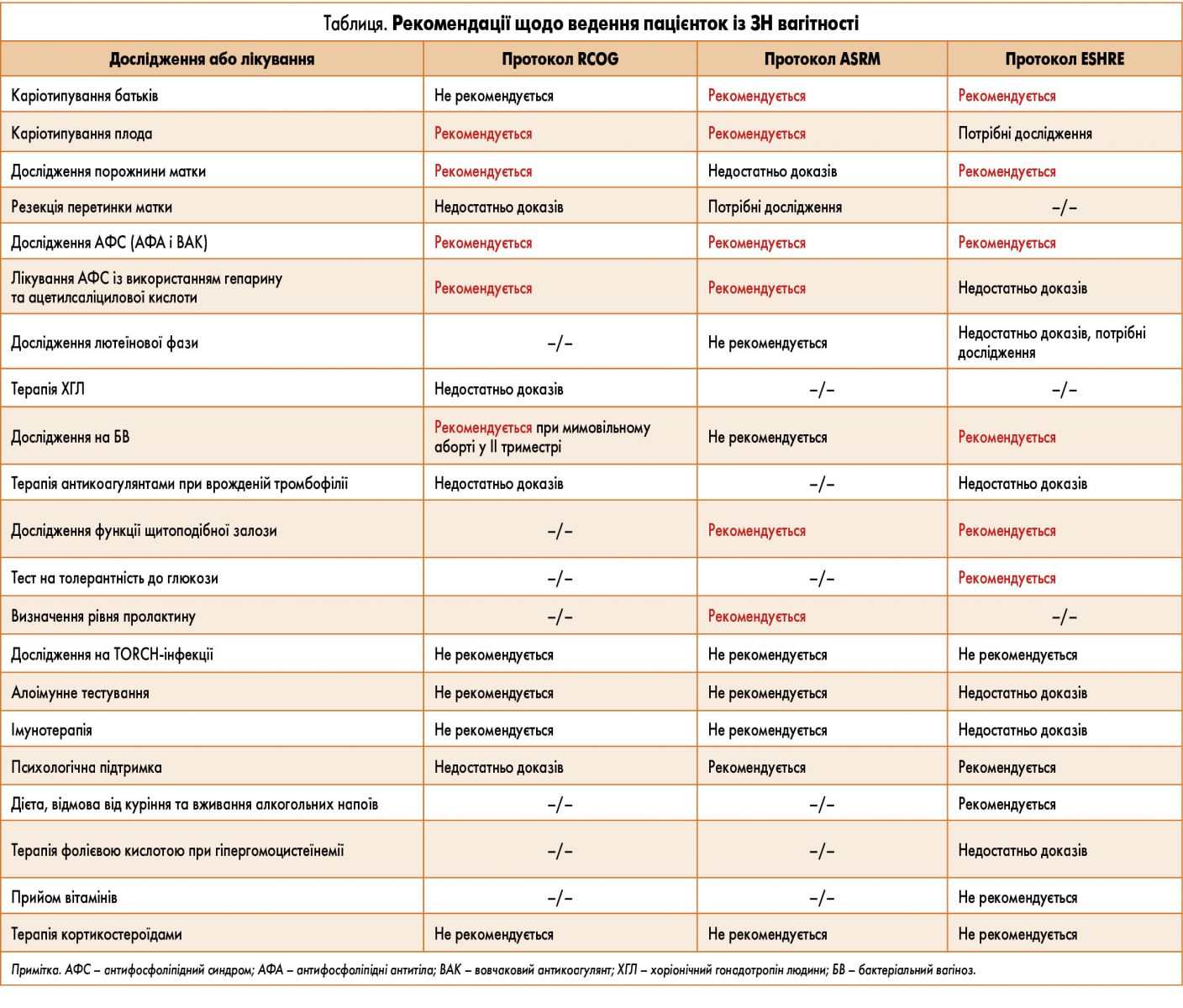
При зверненні до лікаря жінки, яка щойно втратила чергову вагітність, одразу виникає низка питань щодо подальшої тактики ведення такої пацієнтки. Такі проблеми впродовж десятиліть досліджують фахівці в різних країнах світу, але й досі немає єдиної думки щодо їх вирішення. У таблицi згруповано рекомендації спеціалістів провідних акушерсько-гінекологічних установ і спільнот світу з питань прегравідарної підготовки та ведення вагітності у жінок із ЗН, а саме: Королівського коледжу акушерства та гінекології (RCOG), Американського товариства репродуктивної медицини (ASRM) та Європейського товариства репродукції людини та ембріології (ESHRE).
Розбіжності думок щодо проблеми ЗН починаються вже з питання, через який час після викидня слід планувати наступну вагітність. Розповсюджена думка, що наступну вагітність жінкам слід планувати через 6-12 міс після викидня. Однак останнім часом з’явилися переконливі дані щодо скорочення цього терміну. Так, за даними E.R. Love та співавт. (2010), період «спокою» слід скоротити, а оптимальний час для настання нової вагітності – 3-6 міс після мимовільного аборту (МА). За даними авторів, у цей час істотно нижчою є частота виникнення повторного МА, ектопічної вагітності, передчасних пологів, гіпотрофії плода, кесаревого розтину й індукованих пологів.
L.F. Wong та співавт. (2015) взагалі вважають, що немає доведеного зв’язку несприятливих результатів вагітності як зі скороченням інтервалу між МА та новим зачаттям до 3 міс, так і з його подовженням до 6 міс.
Змінилися пріоритети й у розумінні етіології ЗН, хоча й досі приблизно у половині випадків остаточно визначити її не вдається. На сьогодні відомими причинами ЗН вважають генетичні (13%), анатомічні (10-15%), ендокринні, імунні, інфекційні чинники, «чоловічий фактор» тощо. За останні 10-15 років значно змінились погляди на антифосфоліпідний синдром як причину ЗН у 15% жінок зі ЗН. Вважається, що більшість спорадичних ранніх МА пов’язані з хромосомними аномаліями плода і не є ознаками проблем в організмі жінки. Водночас залишаються незмінними погляди на істотну роль у розвитку ЗН таких негативних чинників, як куріння, вживання алкогольних напоїв, наркоманія, низький соціально-економічний статус, дефіцит/надлишок маси тіла, стрес.
Привертають увагу дані щодо зв’язку між віком жінки та здатністю до народження живих дітей після МА. Так, після першого раннього МА 70-80% молодих здорових жінок мають сприятливий прогноз щодо наступної вагітності, а після 40 років сприятливий прогноз мають лише 30%. З кожним наступним МА прогноз погіршується на 5-10%. Вірогідність народження живої дитини у жінок із ЗН навіть після ретельного обстеження та прегравідарної підготовки становить не більше 60%!
І все ж основним для акушерів-гінекологів при веденні жінок із ЗН є сакраментальне питання: що робити?
Узагальнюючи дані й думки провідних фахівців світу з цього питання, можна сформулювати ключові рекомендації щодо ведення пацієнток із ЗН. До них слід включити прегравідарну підготовку жінок із ЗН в анамнезі, що має бути комплексною та передбачати:
- генетичне обстеження, починаючи з другого МА (каріотипування залишків плодового яйця та медико-генетичне консультування пари);
- рутинне призначення препаратів прогестерону у ІІ фазі кожного меструального циклу до зачаття та впродовж вагітності задля покращення репродуктивних результатів;
- корекцію «чоловічого фактора»: залучення до репродуктивної реабілітації подружжя уролога-андролога дозволяє знизити частоту ранніх МА у 3 рази, вроджених вад розвитку у плода – у 4 рази, перинатальну смертність – на 6%;
- корекцію психоемоційних порушень у подружньої пари із залученням психолога/психотерапевта;
- корекцію анатомічних дефектів жіночих репродуктивних органів, що на І етапі має включати діагностику поза вагітністю (ультразвукове дослідження, гістероскопія, гістеросальпінгографія) та на ІІ етапі за необхідності – хірургічне лікування, а саме: видалення внутрішньоматкових перетинок, синехій, поліпів, лейоматозних вузлів, які деформують порожнину матки, видалення гідросальпінксу та міжм’язової міоми понад 4 см в діаметрі, що значно покращує результат наступної вагітності (C.R. Jaslow, W.H. Kutten, 2013).
Окремим аспектом у проблемі ЗН вагітності стоїть визначення тактики при АФС у жінки. Не можна недооцінювати значення цієї патології в розвитку ЗН, але також неприпустимими є і гіпердіагностика АФС та призначення недоцільних дороговартісних досліджень і лікування. Однак саме лікування АФС, яке є добре розробленим та ефективним, може надати можливість жінкам з цією патологією виносити та народити здорових дітей. Тобто АФС є однією з найважливіших причин ЗН, що піддається корекції.
Отже, АФС – це поєднання несприятливого закінчення вагітності або тромбозу (венозного/артеріального) з підвищенням титру антифосфоліпідних антитіл: вовчакового антигену, антитіл (АТ) до кардіоліпіну та β2-глікопротеїну-1. Діагноз АФС можна встановити лише за наявності 1 клінічного та 1 лабораторного критеріїв (Австралійські критерії, 2006); наявність цього діагнозу є показанням до направлення на консультацію гематолога.
Клінічні критерії:
- судинний тромбоз в анамнезі;
- невиношування вагітності:
- 1 МА або більше у термін від 10 тижнів з підтвердженою нормальною морфологією плода, або
- 1 передчасні пологи чи більше у термін від 34 тижнів вагітності з нормальною морфологією новонародженого в результаті тяжкої прееклампсії, еклампсії, плацентарної недостатностi, або
- 3 МА або більше у термін до 10 тижнів вагітності за винятком анатомічних, гормональних і генетичних причин невиношування вагітності.
Лабораторні критерії:
- виявлення одного з маркерів (двічі з інтервалом не менш ніж 12 тижнів):
- наявність вовчакового антикоагулянту у плазмі крові, або
- помірний/високий титр антикардіоліпінових АТ (імуноглобулін (Ig) G/IgM) у сироватці/плазмі крові, або
- АТ до β2-глікопротеїну-1 (IgG/IgM) у сироватці/плазмі крові.
Рекомендації щодо медикаментозного лікування АФС сьогодні зводяться до призначення комбінації низькомолекулярного гепарину з ацетилсаліциловою кислотою у низьких дозах, що дозволяє знизити ризик виникнення МА на 54%. Водночас доведено, що монотерапія ацетилсаліциловою кислотою не є ефективною, а застосування преднізолону або інших кортикостероїдів жодною мірою не покращує результат вагітності, але при цьому підвищує ризик розвитку гестаційної артеріальної гіпертензії та гестаційного цукрового діабету.
Ще одим важливим аспектом є лікувальна тактика щодо спадкових тромбофілій (ТФ) та їх зв’язок із ЗН. Загальне «захоплення» цією проблемою призводить до гіпердіагностики та перенавантаження пацієнток непотрібними лабораторними дослідженнями та зайвим витрачанням чималих коштів. Сучасні дані переконливо доводять, що рутинний скринінг на наявність спадкових ТФ проводити недоцільно.
Обстеження слід призначити жінкам, у яких:
- родичі першої лінії мають високий ризик ТФ;
- в анамнезі є ідіопатичний артеріальний тромбоз у молодому віці, ідіопатична венозна тромбоемболія, епізоди венозної тромбоемболії після впливу помірних чинників ризику, понад 3 МА у термін до 10 тижнів, 1 чи більше – після 10 тижнів вагітності, прееклампсія, затримка внутрішньоутробного розвитку плода, передчасне відшарування нормально розташованої плаценти;
- наявний високий ризик ТФ: гомозиготні мутації генів G1691A (фактора V, лейденівська мутація) та G20210А (фактора ІІ, протромбіну) та їх поєднання;
- мутації в генах фолатного циклу МТНFR, MTR, MTRR, асоційовані з порушенням метаболізму фолатів і розвитком гiпергомоцистеїнемiї, що саме по собі може підвищувати ризик тромбозів та акушерських ускладнень; при їх виявленні показане застосування препаратів, які містять фолієву кислоту (ФК), вітаміни В6 та В12.
Вітаміни та мікроелементи жінкам із ЗН слід призначати ще на етапі прегравідарної підготовки. Найбільше доказів про необхідність такої «дотації» наведено щодо ФК. Застосування фолатів є обов’язковим впродовж 3 міс. преконцепційного періоду та І триместру вагітності для профілактики гіпергомоцистеїнемії й анемії у матері та вад розвитку нервової трубки у плода. Оптимальним є призначення фолатів у складі комплексів у дозі 400-800 мкг/добу. Водночас з обережністю слід призначати ФК у високих дозах (1000 мкг і більше) без наявності показань впродовж тривалого часу, оскільки це підвищує ризик розвитку злоякісних пухлин і неврологічних ускладнень.
Відомо, що споживання ФК щоденно у дозі 400 мкг знижує рівень гомоцистеїну на 20%. Водночас ФК є синергістом вітаміну В12. Реакції метилювання ДНК, що відбуваються за участю вітаміну В12, сприяють зниженню рівня гомоцистеїну ще додатково на 7%.
Доведено також позитивний вплив призначення ФК статевому партнеру: кожні 100 мкг ФК щоденно знижують частку аномальних сперматозоїдів на 3,6%.
Ще одним важливим для настання та виношування вагітності мікроелементом є йод. На етапі планування вагітності його надходження в організм жінки у складі мінерально-вітамінних комплексів має становити не менше ніж 150 мг/добу, а її партнера – 100 мкг/добу впродовж 3 міс. В ендемічних за йододефіцитом районах цю дозу підвищують до 300 мкг/добу.
Препарати заліза призначають на підставі оцінювання показників червоної крові та вмісту заліза в організмі. При прихованому/явному дефіциті заліза в преконцепційний період його призначають у дозі 60 мг/тиждень.
Цим вимогам повністю відповідає вітамінно-мінеральний комплекс Гесталідер, до складу якого входять ФК (400 мкг), вітамін В12 (2,5 мкг), залізо (21 мг) та йод (225 мкг).
Саме така доза ФК (400 мкг) у поєднанні з ціанокобаламіном (2,5 мкг) є дієвим профілактичним чинником щодо вроджених вад розвитку нервової трубки у плода та забезпечує нормальний рівень гомоцистеїну в організмі жінки. Таким чином, це дозволяє запобігти мікротромбозам судин матково-плодово-плацентарного басейну та репродуктивним втратам у жінок з ожирінням, у яких завжди підвищений ризик гіперкоагуляційних ускладнень.
Достатня доза заліза (21 мг) забезпечує надійну профілактику анемії у вагітних, а доза йоду (225 мкг) задовольняє добову потребу вагітної в цьому мікроелементі.
Вітамін D з метою профілактики його дефіциту в преконцепційний період застосовують у дозі 600-800 МО/добу, після настання вагітності – 800-1200 МО/добу (при концентрації в крові менше ніж 75 нмоль/л, або 30 нг/мл).
Принципове значення для настання успішної вагітності має корекція інфекційного чинника.
Діагностичні маніпуляції слід проводити в преконцепційний період, особливо це стосується таких важливих для встановлення діагнозу методів, як полімеразна ланцюгова реакція, бактеріологічні та бактеріоскопічні методи, пайпель-біопсія ендометрія.
Серед запальних захворювань статевих шляхів найбільш значущим для подальшого розвитку хронічного ендометриту (ХЕ) є цервіцит. Ця патологія у 27% випадків призводить до розвитку ендометриту, тому підлягає обов’язковій етіотропній терапії. Серед його збудників найчастіше виявляють Ureaplasma, Mycoplasma, Chlamydia, рідше – збудники токсоплазмозу, кору, краснухи, вірус простого герпесу, цитомегаловірус, віруси Коксакі та Listeria monocytogenes.
При виявленні ознак ХЕ проводять етіотропну терапію з елімінацією збудника, після чого відновлюють морфофункціональний потенціал ендометрія.
У разі підтвердження автоімунного характеру ХЕ основними завданнями лікування є: знизити активність запалення (за допомогою нестероїдних протизапальних засобів); відновити рецептивність та імунну відповідь ендометрія за рахунок нормалізації співвідношення естрогени/гестагени; покращити кровообіг в органах малого таза (за допомогою фізіо- та бальнеотерапії).
Після нормалізації функції ендометрія та створення умов для успішної імплантації у жінок із ЗН на прегравідарному етапі слід продовжити корекцію ендокринних порушень. Для цього рутинно призначають препарати прогестерону у ІІ фазі кожного менструального циклу до зачаття та впродовж усього термiну гестації для покращення результатів вагітності. Препаратом вибору є різні форми (сублінгвальна, інтравагінальна) мікронізованого прогестерону (Лютеіна, «Адамед», Польща). Він не пригнічує овуляцію та не перешкоджає настанню вагітності. Мікронізований прогестерон під час прегравідарної підготовки у жінок із ЗН призначають сублінгвально/інтравагінально по 200-300 мг/добу з 17 до 26-го дня менструального циклу. Після настання вагітності Лютеіну продовжують призначати інтравагінально в дозі 200-400 мг/добу до терміну 34 тижні (після 22 тижнів – при високому ризику передчасних пологів).
Важливими перевагами мікронізованого прогестерону, представленого у двох зазначених вище лікарських формах, є відсутність побічних реакцій з боку печінки, що зумовлює можливість його тривалого та безпечного застосування. Крім того, за своїми властивостями він максимально наближений до ендогенного прогестерону, що значно підвищує його біодоступність та терапевтичний ефект.
Ще однією перевагою вагінальної форми Лютеіни є те, що вона розроблена з урахуванням нормального рН піхви, а саме: містить підкислювальний компонент і підтримує рН у нормі для розвитку лактофлори. Це дуже важливо для якісного запліднення, оскільки саме кисле середовище піхви (pH 3,5-4,5) виконує роль «еволюційного фільтра»: подолати кислотний бар’єр може тільки найбільш рухливий і здоровий сперматозоїд. Якщо ж відбувається олужнення піхви, ця функція втрачається, і яйцеклітину може запліднити і неповноцінний сперматозоїд.
Для настання та подальшого нормального перебігу вагітності у жінок із ЗН не тільки необхідно знати, що потрібно таким пацієнткам, а й чого слід уникати при їх веденні.
Слід уникати необґрунтованих і невиправданих призначень: додаткових обстежень, лікарських препаратів тощо.
При збалансованому раціоні харчування необхідно уникати призначення харчових добавок та інших фортифікаторів аліментарного статусу.
Також слід уникати поліпрагмазії – одночасне введення 5 препаратів і більше вже потребує консультування клінічного фармаколога.
Не потрібно проводити і так звану профілактичну санацію піхви без лабораторного підтвердження вагініту/БВ, тому що це створює умови для активації умовно-патогенної флори. Оскільки лактобактерії піхви відновлюють свою популяцію дещо повільніше, ніж інша резидентна мікрофлора, це може стати передумовою розвитку БВ.
Таким чином, лише раціональний підхід до ведення пацієнток із ЗН на прегравідарному етапі та в період вагітності, що ґрунтується на достатній сучасній доказовій базі, може надати їм можливість народити здорових дітей. Безумовно, твердження у цій статті не є істиною в останній інстанції, але в ній представлено узагальнені дані, надані багатьма дослідниками з різних країн.
Список літератури знаходиться в редакції.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...
Хронічний тазовий біль (ХТБ) є поширеним патологічним станом, який відзначається у жінок будь-якого віку і супроводжується сексуальною дисфункцією, емоційною лабільністю, аномальними матковими кровотечами, порушенням сечовипускання, розладами з боку кишечника тощо. Пацієнтки, які страждають на ХТБ, часто скаржаться на симптоми тривоги та депресії, що негативно позначається на їхній повсякденній активності, включаючи зниження працездатності та погіршення якості життя [1]. Сьогодні проблема ХТБ є економічним тягарем, пов’язаним із прямими або непрямими медичними витратами, які в середньому в різних країнах світу оцінюються у 4,9 млрд доларів на рік [2]. Раціональна фармакотерапія,спрямована на полегшення та контроль симптомів болю, є ключовою стратегією боротьби із ХТБ...
Дефіцит заліза є найпоширенішим патологічним станом у світі та однією з п’яти основних причин інвалідності. У той час як низький показник феритину у сироватці крові є діагностичною ознакою залізодефіциту, підвищений його рівень визначається як гострофазовий маркер, що може реєструватися при запальних станах уже в І триместрі вагітності. Відповідно до сучасних настанов, проведення рутинного скринінгу на залізодефіцит у невагітних та вагітних жінок за відсутності ознак анемії не рекомендоване. З огляду на останні літературні дані ця рекомендація має бути переглянута...
Наказ Міністерства охорони здоров’я України від 25.08.2023 № 1533 ...