Четверте універсальне визначення інфаркту міокарда (ESC, 2018)
Минулого року опубліковано четверте універсальне визначення інфаркту міокарда (ІМ), основними концепціями якого є принципове розмежування понять «ушкодження міокарда» та «інфаркт міокарда», у тому числі при проведенні процедур реваскуляризації; формулювання критеріїв 5 типів ІМ; необхідність урахування процесів електричного ремоделювання при оцінці порушень реполяризації в пацієнтів із тахіаритміями, штучною стимуляцією та частотозалежними порушеннями провідності; доцільність використання візуалізаційних методів дослідження для діагностики та диференціювання причин ушкодження міокарда (Thygesen K. et al., 2018).
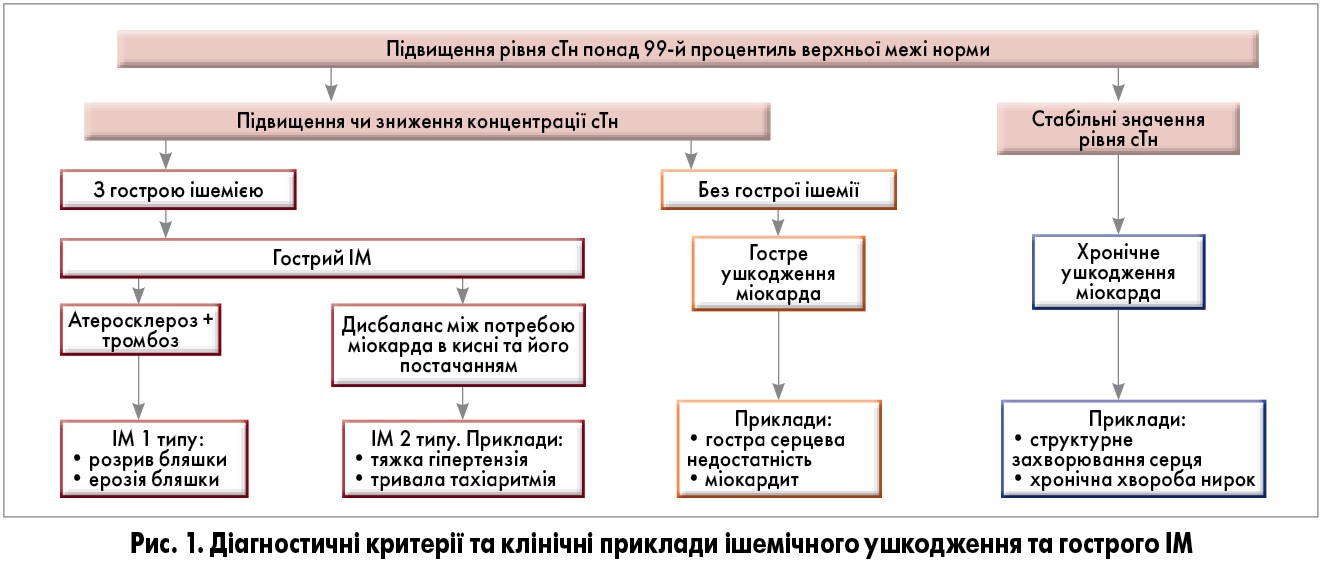
Термін «ушкодження міокарда» слід використовувати у випадку підвищення рівня серцевого тропоніну (сТн) щонайменше на одне значення понад 99-й процентиль верхньої межі норми. Ушкодження вважається гострим за наявності нещодавнього динамічного наростання та/або зниження концентрації cTн у крові, натомість його постійно підвищені рівні вказують на хронічне ушкодження. Термін «інфаркт міокарда» застосовують у разі виявлення ознак гострого ушкодження міокарда в поєднанні з клінічними проявами ішемії міокарда (табл. 1, рис. 1).
 Серцеві біомаркери (тропоніни I і T) – це компоненти скоротливого апарату клітин міокарда, які переважно експресуються в серці. Підвищення рівня тропоніну І зумовлене виключно ушкодженням кардіоміоцитів. У клінічній практиці рекомендують використовувати високочутливі (hs) cTн-тести. Інші біомаркери, як-от креатинкіназа (СК-MB), є менш чутливими та специфічними.
Серцеві біомаркери (тропоніни I і T) – це компоненти скоротливого апарату клітин міокарда, які переважно експресуються в серці. Підвищення рівня тропоніну І зумовлене виключно ушкодженням кардіоміоцитів. У клінічній практиці рекомендують використовувати високочутливі (hs) cTн-тести. Інші біомаркери, як-от креатинкіназа (СК-MB), є менш чутливими та специфічними.
Вивільнення структурних білків з клітин є наслідком не лише некрозу, а й нормального життєвого циклу клітин міокарда, виведення продуктів деградації cTн з клітин, підвищеної проникності клітинної стінки, апоптозу тощо. Підвищення концентрації сТн може спричинити не лише ішемія, а й механічний стрес, гіпертрофія лівого шлуночка (ГЛШ), хронічна ниркова недостатність тощо (табл. 2). Вивільнення сТн у циркулюючу кров залежить від кровотоку і часу отримання зразків крові після появи симптомів. Надто ранній забір крові може не показувати суттєвого підвищення сТн навіть при ІМ (рис. 2). Це підкреслює важливість динамічного визначення сТн з інтервалом 3-6 год, а при повторних епізодах ішемії чи в пацієнтів з високим ризиком рекомендують більш часті визначення впродовж 18 год. Якщо тест на cTн недоступний, можна використовувати кількісне визначення CK-MB.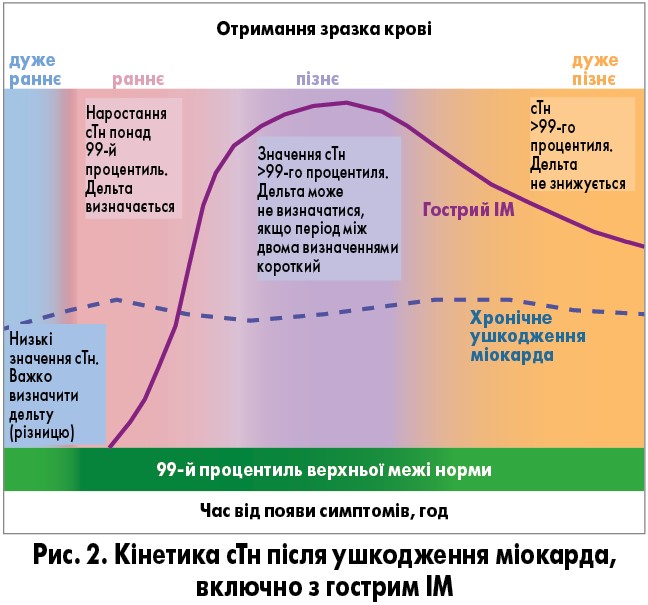
Клінічні прояви ІМ
Виникненню ІМ передує ішемія, яка є наслідком дисбалансу між потребою міокарда в кисні та його постачанням. Клінічно це визначається анамнезом та змінами на ЕКГ. Можливі симптоми ішемії/ІМ включають різні комбінації дискомфорту в грудях, верхніх кінцівках, нижній щелепі або епігастрії під час навантаження чи в спокої; дискомфорт, не пов’язаний з локальними рухами чи певним положенням. Ішемічними еквівалентами є задишка, слабкість, утома, які не мають іншого пояснення. Зазначені симптоми не є специфічними і можуть спостерігатися при інших патологічних станах – шлунково-кишкових, неврологічних, легеневих, опорно-рухових. Короткі епізоди ішемії, що не супроводжуються некрозом міокарда, також можуть відбуватися з підвищенням cTн. У пацієнтів з підозрою на гострий коронарний синдром (ГКС) з нормальними показниками сТн (≤99 процентиль) діагностують нестабільну стенокардію або встановлюють інший діагноз.
Електрокардіографічні ознаки ІМ
 При підозрі на ІМ слід записати ЕКГ упродовж 10 хв після першого медичного контакту, в ідеалі – до госпіталізації, що скорочує час до початку лікування і сприяє швидкому відбору пацієнтів з ІМ з елевацією сегмента ST (STEMI) для проведення реваскуляризації. У випадку тривалих чи повторних симптомів ішемії доцільно проводити повторний запис з інтервалом 15-30 хв протягом перших 2 год або використовувати безперервне ЕКГ‑моніторування. Серійні чи безперервні записи ЕКГ можуть бути корисними і для визначення статусу реперфузії або повторної оклюзії.
При підозрі на ІМ слід записати ЕКГ упродовж 10 хв після першого медичного контакту, в ідеалі – до госпіталізації, що скорочує час до початку лікування і сприяє швидкому відбору пацієнтів з ІМ з елевацією сегмента ST (STEMI) для проведення реваскуляризації. У випадку тривалих чи повторних симптомів ішемії доцільно проводити повторний запис з інтервалом 15-30 хв протягом перших 2 год або використовувати безперервне ЕКГ‑моніторування. Серійні чи безперервні записи ЕКГ можуть бути корисними і для визначення статусу реперфузії або повторної оклюзії.
Тільки ЕКГ недостатньо для діагностики гострої ішемії або ІМ, оскільки відхилення сегмента ST можливе й при інших станах, таких як гострий перикардит, ГЛШ, блокада лівої ніжки пучка Гіса (БЛНПГ), синдром Бругада, синдром ранньої реполяризації тощо. Порівняння з попередньою ЕКГ часто допомагає відрізнити нові зміни від хронічних. Зміни сегмента ST або інверсії зубців Т, що включають кілька анатомічно пов’язаних відведень, асоціюються з гіршим прогнозом. Наприклад, депресія сегмента ST ≥1 мм у 6 відведеннях, яка може супроводжуватися елевацією ST в aVR або V1, свідчить про багатосудинне ураження чи оклюзію основного стовбура лівої коронарної артерії.
Прогресуючий новий випуклий підйом ST, особливо з реципрокною депресією ST, зазвичай відображає гостру коронарну оклюзію, що призводить до ушкодження та некрозу міокарда. Реципрокність дозволяє диференціювати STEMI від перикардиту та ранньої реполяризації. Гіпергострі зубці Т (симетричні, високої амплітуди) принаймні у 2 суміжних відведеннях є ранньою ознакою елевації ST. На рисунку 3 показано приклад оцінки елевації ST, в таблиці 3 підсумовано критерії змін ST-T, що свідчать про гостру ішемію міокарда, яка може призвести до ІМ.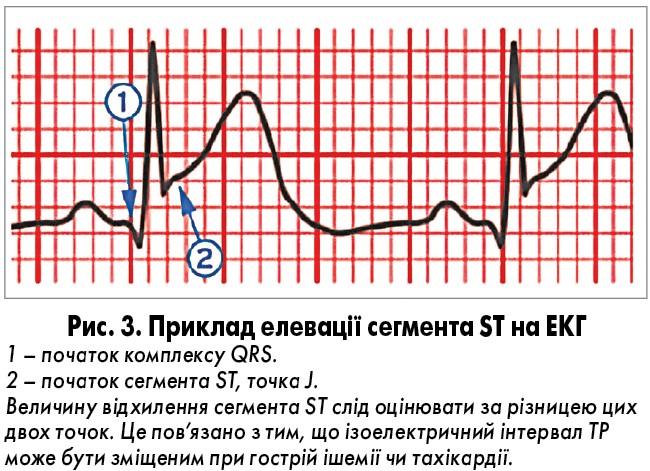
Відсутність елевації ST у грудних відведеннях у поєднанні з високими симетричними зубцями T, косовисхідна депресія сегмента ST >1 мм у точці J у цих відведеннях у поєднанні з елевацією ST (>1 мм) в aVR або симетричною глибокою (>2 мм) інверсією зубців Т у передніх грудних відведеннях свідчать про значну оклюзію лівої передньої низхідної артерії. Елевація ST в aVR >1 мм може супроводжувати передній чи нижній STEMI та асоціюється з високим ризиком 30-денної смертності у хворих на гострий ІМ.
Аномалії ST-T слід диференціювати з такими станами: тромбоемболія легеневої артерії (ТЕЛА), внутрішньочерепні процеси, електролітні розлади, гіпотермія або периміокардит.
 Виникнення нових патологічних зубців Q свідчить про некроз міокарда, який починається через хвилини/години після нападу і також асоціюється з гіршим прогнозом. Транзиторні зубці Q можуть виникати під час епізоду гострої ішемії або при гострому ІМ з успішною реперфузією. Передчасне збудження, кардіоміопатія, амілоїдоз серця, фіброз міокарда, БЛНПГ, блокада передньої гілки ЛНПГ, ГЛШ, гіпертрофія правого шлуночка, міокардит, гостре легеневе серце, гіперкаліємія можуть бути пов’язані із зубцями Q або комплексами QS за відсутності ІM. Комплекс QS у V1 є нормальним; зубець Q <0,03 с і <0,25 амплітуди зубця R у відведенні III є нормальним, якщо фронтальна вісь QRS перебуває в межах від -30° до 0°, а також в aVL, якщо фронтальна вісь QRS знаходиться між 60° і 90°. Септальні зубці Q – це малі непатологічні зубці Q <0,03 с і <0,25 амплітуди зубця R в I, aVL, aVF і V4-V6.
Виникнення нових патологічних зубців Q свідчить про некроз міокарда, який починається через хвилини/години після нападу і також асоціюється з гіршим прогнозом. Транзиторні зубці Q можуть виникати під час епізоду гострої ішемії або при гострому ІМ з успішною реперфузією. Передчасне збудження, кардіоміопатія, амілоїдоз серця, фіброз міокарда, БЛНПГ, блокада передньої гілки ЛНПГ, ГЛШ, гіпертрофія правого шлуночка, міокардит, гостре легеневе серце, гіперкаліємія можуть бути пов’язані із зубцями Q або комплексами QS за відсутності ІM. Комплекс QS у V1 є нормальним; зубець Q <0,03 с і <0,25 амплітуди зубця R у відведенні III є нормальним, якщо фронтальна вісь QRS перебуває в межах від -30° до 0°, а також в aVL, якщо фронтальна вісь QRS знаходиться між 60° і 90°. Септальні зубці Q – це малі непатологічні зубці Q <0,03 с і <0,25 амплітуди зубця R в I, aVL, aVF і V4-V6.
Менш специфічними ознаками гострої ішемії міокарда є аритмії, блокади ніжок пучка Гіса, порушення атріовентрикулярної провідності та втрата амплітуди зубців R у грудних відведеннях.
Запис додаткових відведень показаний пацієнтам з клінічними проявами ішемії, у яких стандартна ЕКГ не зафіксувала типових змін, особливо це стосується ураження лівої огинаючої артерії. При виявленні ізольованої депресії ST ≥0,5 мм у V1-V3, особливо в поєднанні з позитивним зубцем Т, слід записати задні відведення у V міжребер’ї зліва по передній аксилярній (V7), лопатковій (V8) та паравертебральній (V9) лініях. Діагностичною вважається елевація ST ≥0,5 мм, для чоловіків <40 років – ≥1 мм, що вказує на нижньобазальну ішемію (раніше позначалася терміном «задній ІМ»).
У пацієнтів з нижнім ІМ та підозрою на інфаркт правого шлуночка можна виявити елевацію сегмента ST ≥1 мм в aVR або V1. У таких випадках слід записати ЕКГ у правих грудних відведеннях V3R і V4R, де виявляють елевацію ST ≥0,5 мм (≥1 мм у чоловіків <30 років). Зміни в V3R і V4R можуть бути тимчасовими, тому їх відсутність не виключає ІМ. У подібних ситуаціях корисними є візуалізаційні методики.
Порушення провідності та кардіостимулятори
Діагностувати ІМ складніше за наявності порушення провідності, яке спричиняє зміни ST-T та може залежати від частоти серцевих скорочень. Порівняння з попередньою ЕКГ допомагає встановити давність (гостроту) змін (за умови, що це не затримує початок лікування).
Не пов’язані з частотою серцевих скорочень ішемічні симптоми в поєднанні з новою блокадою лівої чи правої ніжки пучка Гіса асоціюються з несприятливим прогнозом. Про гостру ішемію свідчать елевація ST ≥1 мм, конкордантна з QRS у будь-якому відведенні, в пацієнтів із БЛНПГ та новий підйом сегмента ST ≥1 мм або аномалії ST-T у будь-якому відведенні, за винятком V1-V4, у пацієнтів з блокадою правої ніжки пучка Гіса.
Тимчасове відключення кардіостимулятора не завжди допомагає діагностувати гостру ішемію, оскільки можливе тривале збереження змін, індукованих кардіостимуляцією (феномен електричної пам’яті).
Фібриляція передсердь
При тахісистолічній формі фібриляції передсердь (ФП) або пароксизмальній надшлуночковій тахікардії може спостерігатися депресія сегмента ST або інверсія зубця T навіть за відсутності ІХС. Причини цього до кінця не зрозумілі. Найімовірнішим поясненням є серцева пам’ять – феномен електричного ремоделювання, що характеризується вираженою дифузною інверсією зубців Т після періодів аномальної активації шлуночків, які також можуть бути зумовлені частотозалежними порушеннями провідності. Іноді тахікардія може призвести до недостатнього збільшення коронарного потоку, щоб задовольнити потребу міокарда в кисні, що індукує клітинну гіпоксію й аномальну реполяризацію. Тому при розвитку ФП та підвищенні початкового рівня cTн виникнення депресії сегмента ST не обов’язково означає ІМ 2 типу. У цьому випадку слід з’ясувати наявність типових ішемічних симптомів та їх появу відносно початку ФП, оцінити динамічні зміни cTн, висновки візуалізаційних методів та/або ангіографії.
Неінвазивні методи візуалізації
Регіонарна гіпоперфузія та ішемія зумовлюють дисфункцію міокарда, загибель клітин і фіброз. Важливими параметрами візуалізації є перфузія і товщина міокарда, потовщення і рухомість, життєздатність міоцитів і вплив їх некрозу на кінетику парамагнітних або радіоізотопних контрастних речовин, що вказують на фіброз чи рубець міокарда. Методами візуалізації, що найчастіше використовуються при гострому і перенесеному ІМ, є ехокардіографія (ЕхоКГ), магнітно-резонансна томографія серця (МРТ), перфузійна сцинтиграфія міокарда з однофотонною емісійною комп’ютерною томографією (SPECT) чи позитронною емісійною томографією (ПET). Їх діагностичні можливості значною мірою перекриваються, кожен з методів здатен більшою чи меншою мірою оцінити життєздатність міокарда, перфузію і функцію. Утім, лише радіонуклідні методики дають можливість безпосередньо оцінити життєздатність міоцитів. Натомість інші діагностичні методи оцінюють цей параметр за непрямими ознаками, такими як скорочувальна реакція на добутамін при ЕхоКГ або підвищення позаклітинного простору внаслідок втрати міоцитів у разі КТ чи МРТ.
Ехокардіографія
ЕхоКГ дозволяє оцінити структуру і функцію серця, зокрема товщину міокарда, потовщення/стоншення і рухомість. Індуковані ішемією порушення сегментарної скоротливості можна виявити на ЕхоКГ майже відразу за умови, що уражено ≥20% трансмуральної товщини міокарда. Якщо ці порушення нові, не пов’язані з іншими причинами та супроводжуються динамічними змінами рівнів сТн, діагностують ІМ. Цей метод дозволяє виявити некоронарогенні причини болю в грудях – гострий перикардит, стеноз аорти, гіпертрофічну кардіоміопатію, розшарування аорти, ТЕЛА. Введення внутрішньовенного контрасту поліпшує візуалізацію межі ендокарда і може використовуватися для оцінки перфузії міокарда та мікросудинної обструкції. Тканинна доплерографія дозволяє кількісно оцінювати загальну та сегментарну скоротливість.
Радіонуклідна візуалізація
Декілька радіонуклідних індикаторів дозволяють безпосередньо візуалізувати життєздатні міоцити, наприклад 201TI‑хлорид, 99mTc-сестамібі і 99mTc-тетрофосмін для SPECT та 18F‑фтордезоксиглюкоза і 82Rb для ПET. Ці методи здатні виявити втрату міоцитів, що становить 4% міокарда (5-10 г м’язової маси). Візуалізація під контролем ЕКГ забезпечує надійну оцінку рухомості, потовщення і загальної скоротливості міокарда. Розвиток радіонуклідних методів діагностики ІМ включає візуалізацію симпатичної іннервації з використанням 123I мета-йодобензилгуанідину, візуалізацію активації матриксної металопротеїнази при ремоделюванні шлуночків та оцінку метаболізму міокарда.
Магнітно-резонансна томографія серця
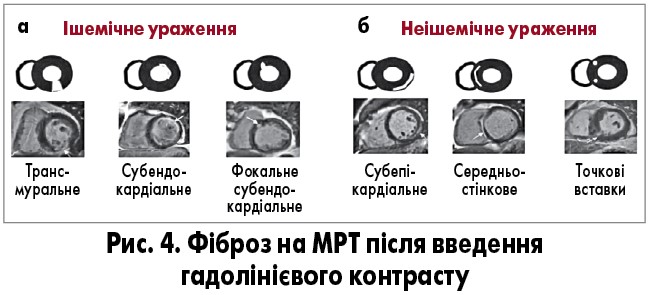 Висока контрастність тканин і розподільна здатність МРТ забезпечують точну оцінку структури і функції міокарда. Для оцінки перфузії міокарда і виявлення збільшення позаклітинного простору, пов’язаного з фіброзом унаслідок перенесеного ІМ, використовують парамагнітні контрасти. Ці методики застосовуються й для діагностики гострого ІМ. Локалізована затримка контрастного посилення може виявити навіть невеликі ділянки субендокардіального ІМ (приблизно 1 г). МРТ здатна ідентифікувати наявність та ступінь набряку/запалення, що дозволяє диференціювати гостре і хронічне ушкодження міокарда. Контрасти на основі гадолінію повільно вимиваються з міокарда з підвищеним позаклітинним простором (фіброз), вказуючи ділянки рубців (рис. 4). За структурою розрізняють ішемічні та неішемічні рубці. Ішемічний рубець поширюється від субендокарда до епікарда (рис. 4a), своєю чергою, неішемічний фіброз може бути в епікарді, всередині стінки або в точках вставки правого шлуночка (рис. 4б).
Висока контрастність тканин і розподільна здатність МРТ забезпечують точну оцінку структури і функції міокарда. Для оцінки перфузії міокарда і виявлення збільшення позаклітинного простору, пов’язаного з фіброзом унаслідок перенесеного ІМ, використовують парамагнітні контрасти. Ці методики застосовуються й для діагностики гострого ІМ. Локалізована затримка контрастного посилення може виявити навіть невеликі ділянки субендокардіального ІМ (приблизно 1 г). МРТ здатна ідентифікувати наявність та ступінь набряку/запалення, що дозволяє диференціювати гостре і хронічне ушкодження міокарда. Контрасти на основі гадолінію повільно вимиваються з міокарда з підвищеним позаклітинним простором (фіброз), вказуючи ділянки рубців (рис. 4). За структурою розрізняють ішемічні та неішемічні рубці. Ішемічний рубець поширюється від субендокарда до епікарда (рис. 4a), своєю чергою, неішемічний фіброз може бути в епікарді, всередині стінки або в точках вставки правого шлуночка (рис. 4б).
Комп’ютерна томографічна коронарна ангіографія
Цей метод може бути використаний у відділенні невідкладної допомоги для діагностики ІХС у пацієнтів із ГКС, насамперед у групах низького та середнього ризику з нормальними показниками сТн при госпіталізації.
Клінічна класифікація ІМ
Задля проведення реперфузійної терапії в клінічній практиці STEMI діагностують у пацієнтів із дискомфортом у грудях або іншими ішемічними симптомами і новою елевацією ST у 2 суміжних відведеннях або новою блокадою ніжок пучка Гіса з ішемічним типом порушень реполяризації. За відсутності елевації ST діагностують nSTEMI.
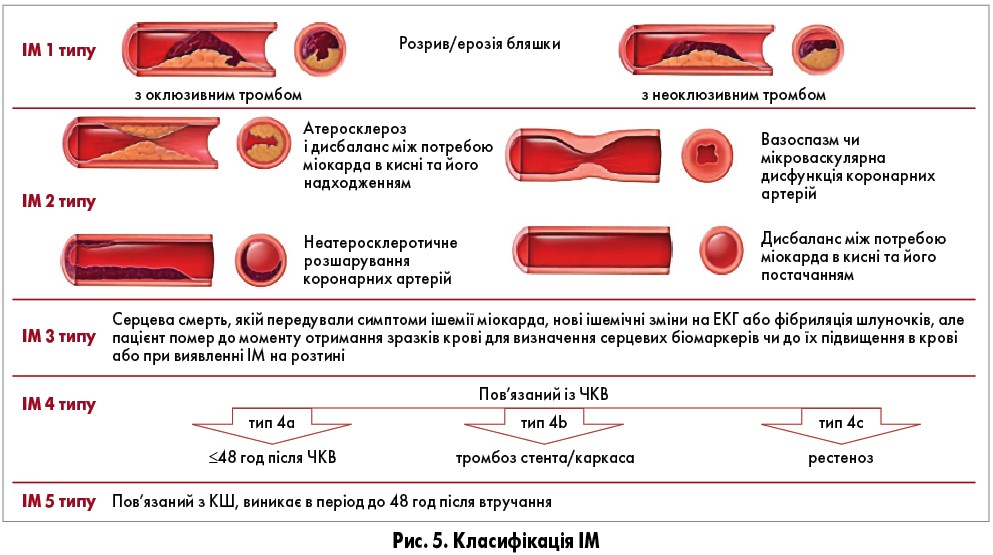
Окрім того, запропоновано класифікацію ІМ за 5 типами, які мають різні механізми, клінічні прояви, прогноз та стратегії лікування (рис. 5).
ІМ 1 типу зумовлений атеротромбозом коронарних артерій та руйнуванням (розривом чи ерозією) атеросклеротичної бляшки. Наслідком розриву бляшки може бути не лише інтралюмінальний тромбоз, а й крововилив усередині бляшки, що також супроводжується оклюзією просвіту судини. У випадку ІМ 1 типу обов’язково слід оцінити зміни на ЕКГ, щоб класифікувати цей тип як STEMI або nSTEMI для вибору стратегії лікування відповідно до сучасних рекомендацій.
ІМ 2 типу діагностують за наявності доказів невідповідності між потребою міокарда в кисні та його постачанням та за відсутності ознак гострого атеротромбозу (рис. 5). Можливими причинами є фіксований атеросклероз коронарних артерій (стабільна бляшка), що створює часткову оклюзію просвіту, яка за певних умов, наприклад при навантаженні, може стати гемодинамічно значущою або навіть критичною; коронарний спазм; коронарна мікроваскулярна дисфункція; емболія коронарних артерій; розшарування коронарних артерій з інтрамуральною гематомою чи без неї; тривала тахіаритмія; тяжка артеріальна гіпертензія, особливо при супутній ГЛШ; тяжка брадіаритмія; дихальна недостатність; тяжка анемія; гіпотензія, шок. У гострій фазі слід обов’язково впливати на основний механізм, що призводить до дисбалансу надходження/споживання кисню та спричиняє ішемію: корекція об’єму, введення препаратів крові, контроль артеріального тиску та/або частоти серцевих скорочень, респіраторна підтримка тощо. Залежно від клінічної ситуації для визначення ймовірності ІХС можна оцінити стан коронарних судин. За наявності ІХС, залежно від змін на ЕКГ, можна використовувати рекомендації щодо ведення STEMI або nSTEMI. За відсутності ІХС переваги цих стратегій щодо зменшення серцево-судинного ризику залишаються невизначеними. Доведено, що прогностично несприятливими є як ушкодження міокарда, так і ІМ 2 типу.
Виявлення серцевих біомаркерів в крові є основою діагностики ІМ, однак певна частка пацієнтів помирає ще до визначення цього параметра або до моменту підвищення серцевих біомаркерів у крові. Такі випадки класифікують як ІМ 3 типу, тобто висока імовірність гострої ішемічної події за відсутності серцевих біомаркерів. Частота цього типу ІМ становить 3-4% усіх випадків ІМ. Ця категорія дозволяє відмежувати фатальні ІМ від набагато більшої групи раптової смерті, яка включає неішемічні серцеві й несерцеві причини. Якщо подальша аутопсія виявляє ознаки нещодавнього ІМ зі свіжими чи недавніми тромбами в артерії, пов’язаними з інфарктом, встановлюється діагноз ІМ 1 типу.
Ушкодження та ІМ, пов’язані з коронарними втручаннями
Виникнення ІМ 4 та 5 типу пов’язують з виконанням процедур реваскуляризації – черезшкірного коронарного втручання (ЧКВ) та коронарного шунтування (КШ) відповідно. Ушкодження може бути тимчасовим і пов’язаним з процедурою або виникати пізніше внаслідок ускладнень, наприклад ранній чи пізній тромбоз стента, внутрішньостентовий рестеноз, оклюзія шунта чи стеноз унаслідок КШ. При проведенні МРТ з гадолінієвим контрастом ушкодження міокарда виявляють у 32% пацієнтів. Підвищені рівні сТн має значна кількість осіб після ЧКВ, 20-40% – при стабільній ІХС та 40-50% – у разі ІМ. Ушкодження можна виявити, якщо визначати рівень сТн до та через 3-6 год після процедури. Коли другий результат підвищений, слід проводити подальші аналізи, щоб виявити пікове значення cTн. Якщо рівні сТн підвищуються після процедури, а їх початкові значення були нормальними, це пов’язано з ушкодженням під час процедури.
Діагноз ІМ 4 типу встановлюють при 5-кратному підвищенні рівня сТн, 5 типу – при 10-кратному збільшенні сТн у порівнянні з показниками до процедури, що поєднується хоча б з одним із діагностичних критеріїв ІМ та виникає в термін ≤48 год після втручання.
Патологічний зубець Q може вважатися критерієм ІМ 4 або 5 типу, коли він виникає після процедури реваскуляризації та супроводжується підвищенням і подальшим наростанням концентрації сТн, навіть якщо вона не досягла порогу 5-кратного збільшення. Крім того, для постінтервенційних ІМ додається ще один діагностичний критерій: ангіографічні ознаки, що вказують на виникнення процедурних ускладнень порушення кровотоку (розшарування коронарної артерії, оклюзія великої епікардіальної артерії чи шунта, тромботична оклюзія бокової гілки, порушення колатерального кровотоку, дистальна емболізація), або наявність внутрішньокоронарного тромбу внаслідок процедури, або макроскопічно велика обмежена ділянка некрозу з внутрішньоміокардіальним крововиливом чи без нього за даними аутопсії.
ІМ 4 типу поділяється на три підтипи: тип 4а – ІМ, пов’язаний із ЧКВ, виникає в термін ≤48 год після процедури; тип 4b – ІМ, асоційований з тромбозом раніше встановленого стента, підтверджений ангіографією чи аутопсією з використанням відповідних критеріїв із зазначенням часових категорій: гострий – 0-24 год; підгострий – від 24 год до 30 днів; пізній – від 30 днів до 1 року; дуже пізній – >1 рік після ЧКВ; тип 4с – ІМ, асоційований з рестенозом унаслідок ЧКВ, – фокальний або дифузний рестеноз у стенті чи балоні чи комплекcне ураження з підвищенням та/або зниженням значень cTн за загальними критеріями.
Що стосується ІМ 5 типу, то серед факторів, які можуть зумовлювати ушкодження міокарда під час КШ, можна назвати як пряме травматичне ушкодження міокарда, так і будь-яке потенційне ішемічне ушкодження. Тому збільшення значень cTн слід очікувати після всіх процедур КШ, хоча малоінвазивні методики асоціюються з меншим ризиком ушкодження. Загалом частота ушкоджень після КШ за даними МРТ серця варіює від 32 до 44%. Зміни ST-Т часто виникають після КШ через епікардіальну травму і не є надійними показниками ішемії в цій ситуації. Більш надійним доказом ішемічної події є підйом ST з реципрокними змінами.
Рецидив ІМ
Коли ознаки ІМ проявляються в перші 28 днів після першої події, друга подія не вважається новим ІМ. Якщо прояви ІМ розвиваються через >28 днів після першого ІМ, то встановлюється діагноз рецидивуючого ІМ.
Повторний ІМ (реінфаркт)
Термін використовується для опису гострого ІМ, що виникає протягом >28 днів після першого ІМ або рецидиву. Про повторний ІМ свідчить поява на ЕКГ елевації ST ≥1 мм або нових зубців Q принаймні у 2 суміжних відведеннях, особливо при супутніх ішемічних симптомах. Разом із тим повторна елевація ST можлива і при перикардиті чи загрозі розриву міокарда. За підозри на реінфаркт рекомендується негайне вимірювання cTн та повторне через 3-6 год. Якщо початкова концентрація cTн підвищена, то для діагностики повторного ІМ необхідне збільшенні значення сТн >20% у другому зразку. Якщо початкова концентрація cTн у межах норми, застосовують діагностичні критерії, наведені в таблиці 1.
Стаття підготовлена за матеріалами: Thygesen K. et al. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018 Oct 30; 72 (18): 2231-2264.
Підготувала Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 7 (452), квітень 2019 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....