Лауреати Нобелівської премії з медицини та фізіології – 2019
 Цього року Нобелівську премію з медицини та фізіології було присуджено групі науковців за відкриття того, як живі клітини реагують на присутність кисню й адаптуються до його рівня. Це допоможе розробити нові способи боротьби з раком та іншими захворюваннями. Нагороду отримають американські вчені – 61-річний Вільям Келін-молодший і 63-річний Грег Семенза, а також їхній британський колега – 65-річний Пітер Реткліфф. Вільям Келін є професором Гарвардської медичної школи, сер Пітер Реткліфф – Оксфордського університету, а Грег Семенза – Університету Джонса Хопкінса.
Цього року Нобелівську премію з медицини та фізіології було присуджено групі науковців за відкриття того, як живі клітини реагують на присутність кисню й адаптуються до його рівня. Це допоможе розробити нові способи боротьби з раком та іншими захворюваннями. Нагороду отримають американські вчені – 61-річний Вільям Келін-молодший і 63-річний Грег Семенза, а також їхній британський колега – 65-річний Пітер Реткліфф. Вільям Келін є професором Гарвардської медичної школи, сер Пітер Реткліфф – Оксфордського університету, а Грег Семенза – Університету Джонса Хопкінса.
Історії успіху
 «Ця нагорода – трьом ученим, які винайшли молекулярний регулятор, що визначає, як наші клітини адаптуються, коли рівень кисню знижується», – сказав професор Рандал Джонсон, член Нобелівської асамблеї.
«Ця нагорода – трьом ученим, які винайшли молекулярний регулятор, що визначає, як наші клітини адаптуються, коли рівень кисню знижується», – сказав професор Рандал Джонсон, член Нобелівської асамблеї.
Як зазначають у комітеті, про фундаментальне значення кисню знали давно, але, як клітини адаптуються до змін його рівня, залишалося невідомим. І цьогоріч нарешті було пролито світло на це питання, адже робота розкриває молекулярні механізми, що лежать в основі того, як клітини адаптуються до змін у постачанні кисню. На думку шведських експертів, відкриття лауреатів допомагає зрозуміти процеси, які відбуваються при фізичному навантаженні, а також при недокрів’ї та інсульті, коли клітини відчувають нестачу кисню.
 Вільям Келін, американський учений-медик, онколог. Професор Dana-Farber Cancer Institute
Вільям Келін, американський учений-медик, онколог. Професор Dana-Farber Cancer Institute
Вільям Келін-молодший народився 1957 року в Нью-Йорку (США) в родині податкового адвоката. Отримав ступінь бакалавра з математики та хімії в Університеті Дьюка. У 1982 році став доктором медицини. Потім пройшов терапевтичну підготовку в госпіталі Університету Джона Хопкінса, а також стажування в Інституті раку «Дана-Фарбер», де Келін заснував власну лабораторію (1992) з досліджування спадкових форм раку. Із 1998 року є дослідником Медичного інституту Говарда Хьюза. У 2002 році став професором Гарвардської медичної школи.
Із 2008 року – заступник директора з фундаментальних наук в онкологічному центрі «Дана-Фарбер». Його роботи зосереджені на розумінні ролі мутацій у генах-супресорах пухлин у розвитку раку. Основна його робота присвячена ретинобластомі, генам-супресорам пухлини фон Гіппеля-Ліндау (VHL).
Келін був удостоєний престижної нагороди разом із британцем Пітером Реткліффом і американцем Грегом Семензою за відкриття механізму чутливості клітин до кисню та їх адаптації до його нестачі. При цьому зазначив, що в дослідженнях важливу роль відіграє випадок, а результати бувають несподіваними. «Я біолог, який вивчає рак, і лікар, проте перший метод лікування, що запропонувала моя лабораторія, був від анемії. Я завжди стверджую, що в науці буває саме так», – підкреслив учений. Він не виключає, що велике відкриття щодо раку може стати результатом наукових пошуків у суміжній сфері.
«Коли я був молодий, улюбленим дозвіллям мого батька було рибальство. Один із секретів полягає в тому, щоб знати, де риба, а в цьому велику роль відіграють гіпотези, – вважає Келін. – Думаю, одна річ, щодо якої я мав рацію, стало розуміння того, що хвороба Гіппеля-Ліндау є хорошим місцем для лову».
Як пояснили представники Гарвардського університету, дослідження Келіна спочатку стосувалися зазначеної хвороби.
 Грег Семенза, американський учений-медик, педіатр, генетик, першовідкривач білка HIF1A. Професор Університету Джонса Хопкінса
Грег Семенза, американський учений-медик, педіатр, генетик, першовідкривач білка HIF1A. Професор Університету Джонса Хопкінса
Грег Семенза народився 1956 року в Нью-Йорку. Захоплення наукою з’явилося в хлопчика завдяки шкільному вчителю біології, а народження у друга його сім’ї дитини із синдромом Дауна підштовхнуло до вивчення педіатричної генетики. У 1978 році він успішно закінчив Гарвардський університет.
У 1984 році Семенза отримав ступінь доктора медицини й доктора філософії в Пенсильванському університеті. Потім займався педіатрією і, зокрема, пройшов інтернатуру в медичному центрі Університету Дьюка. Із 1986 року був постдоком із медичної генетики в Університеті Дж. Хопкінса, а з 1990-го – перебуває в його штаті.
Грег Семенза обіймає низку професорських посад у школі медицини Університету Дж. Хопкінса. Він є директором-засновником програми із судинної біології Інституту клітинної інженерії цього ж університету, членом Інституту медичної генетики та Sidney Kimmel Comprehensive Cancer Center, а також афілійований в Інституті нанобіотехнологій.
 Пітер Реткліфф, британський учений-медик, молекулярний біолог. Директор Target Discovery Institute
Пітер Реткліфф, британський учений-медик, молекулярний біолог. Директор Target Discovery Institute
Пітер Реткліфф народився 1954 року в м. Моркам (Велика Британія). Навчався медицині в коледжі Гонвілл-енд-Кіз, де отримав ступінь бакалавра медицини (1978). Пройшов клінічну підготовку в найстарішій лікарні Лондона – госпіталі Святого Варфоломія. У 1987 році здобув ступінь доктора медицини в Кембриджському університеті.
Реткліфф працював у London postgraduate hospitals. Пізніше навчався нефрології в Оксфорді, а згодом – молекулярної біології. В Оксфорді заснував (1990) лабораторію біології гіпоксії, яку очолював понад двадцять років. У 1996 році отримав звання професора.
Із 2003 по 2016 рік Пітер Реткліфф був професором Оксфордського університету. Потім обійняв посаду директора Target Discovery Institute Оксфордського університету і там же став членом Інституту Людвига з дослідження раку. Також був призначений директором із клінічних досліджень Інституту Френсіса Крика.
Хід досліджень
Усім тваринам необхідний кисень, щоб на клітинному рівні перетворювати їжу на корисну енергію. Життєва важливість кисню була зрозумілою сторіччями, проте, як саме клітини пристосовуються до зміни його рівня, довго залишалося невідомим. Нинішні нобелівські лауреати відкрили, яким чином клітини можуть відчувати кисень й адаптуватися до зміни його доступності. Учені визначили молекулярні механізми, що регулюють активність генів у відповідь на коливання концентрації кисню. Їхні дослідження розкрили секрети одного з найважливіших адаптаційних життєвих процесів. Вони заклали основу для нашого розуміння того, як рівень кисню впливає на клітинний метаболізм та фізіологічні функції.
Так, ключовою фізіологічною відповіддю на брак кисню є підвищення рівня гормона еритропоетину, що призводить до підвищеного вироблення червоних кров’яних тілець, які переносять кисень (еритропоез). Про важливість гормонального контролю еритропоезу було відомо ще на початку ХХ сторіччя, але довгий час залишалося незрозумілим, як саме цей процес контролювався киснем.
Педіатр і генетик, професор Університету Джона Хопкінса Грег Семенза вивчав відповідальний за вироблення еритропоетину ген (EPO-ген) і те, як саме цей процес регулюється зміною рівня кисню. Використовуючи генетично модифікованих мишей, він виявив особливі сегменти ДНК, розташовані поруч з EPO-геном, які відповідають за реакцію організму на гіпоксію. Британський колега Семензи, сер Пітер Реткліфф, професор Оксфорду, також вивчав кисневозалежну регуляцію EPO-гена. Обидві їхні дослідницькі групи встановили, що механізм сприйняття кисню присутній практично в усіх тканинах, а не лише в клітинах нирок, де зазвичай безпосередньо виробляється еритропоетин. Це були важливі відкриття, які показують, що механізм був повсюдним і функціональним у багатьох різних типів клітин.
Семенза пішов далі – він хотів встановити клітинні компоненти, які беруть участь у цій відповіді. У культивованих клітинах печінки дослідник виявив білковий комплекс, який зв’язується з ідентифікованим сегментом ДНК кисневозалежним чином. Він назвав цей комплекс фактором, індукованим гіпоксією (HIF). У даному випадку під фактором розуміються особливі види білків, які контролюють перенесення генетичної інформації, а конкретно – фактори, робота яких безпосередньо залежить від рівня кисню. Розпочалася інтенсивна робота з виділення комплексу HIF, і 1995 року Семенза зміг опублікувати деякі свої ключові результати, наприклад щодо виявлення генів, що кодують HIF. Як виявилося, HIF складається з двох різних ДНК-зв’язуючих білків, так званих факторів транскрипції, які отримали назви HIF‑1α і ARNT. Тепер дослідники могли розв’язувати головоломку, яка б дала їм змогу зрозуміти, які додаткові компоненти залучені до процесу і як працює весь механізм.
Механізм, за допомогою якого клітини реагують на концентрацію кисню, відіграє певну роль у розвитку різних захворювань людини. Наприклад, пацієнти з нирковою недостатністю страждають від анемії, оскільки нирки не справляються з виробництвом еритропоетину. А багато пухлин, навпаки, виробляють надмірну кількість білків, пов’язаних із гіпоксією, а не стимулюють ріст судин. Детальне розуміння сигнального каскаду, який лежить в основі цих процесів, може допомогти в розробці лікарських засобів для посилення або пригнічення відповіді на гіпоксію в клітинах.
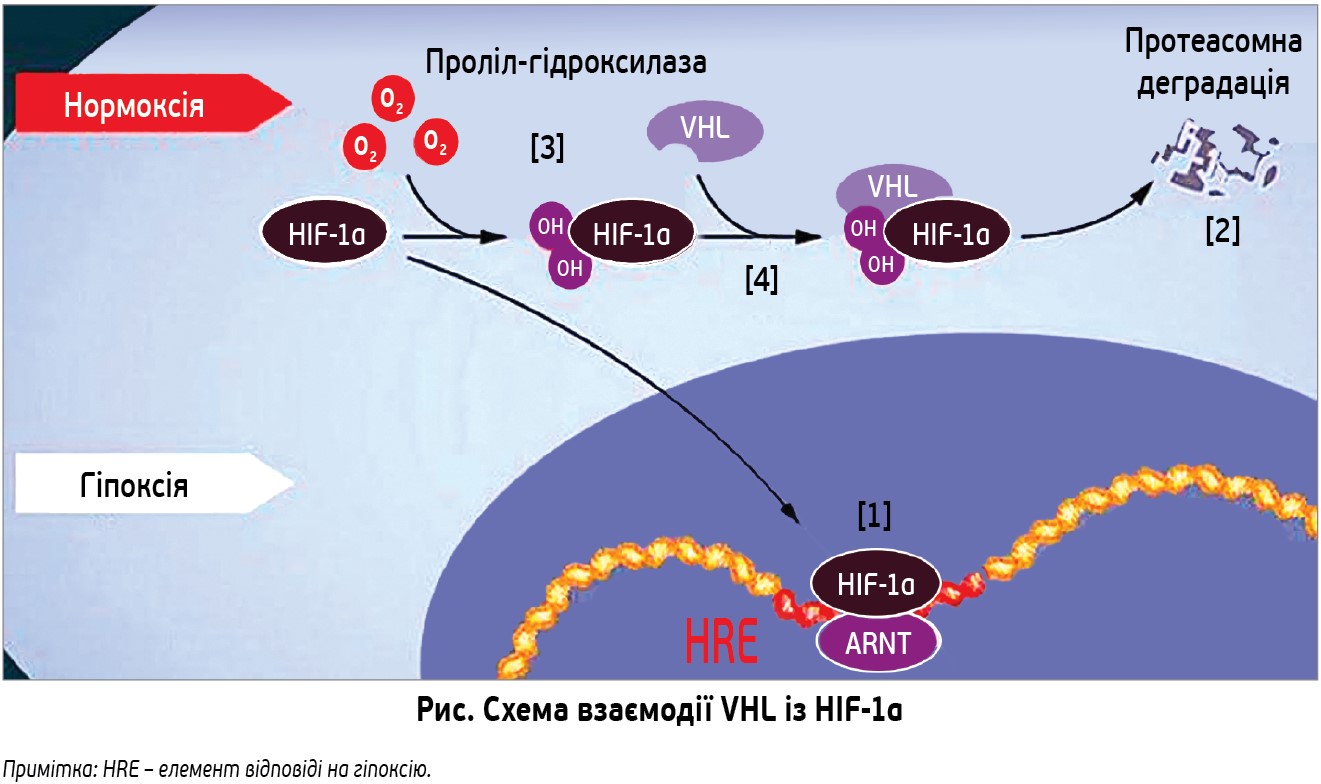
Як відбувається робота факторів, індукованих гіпоксією? Якщо рівень кисню високий, у клітинах міститься дуже невелика кількість HIF‑1α. Проте якщо він низький – вміст HIF‑1α починає підвищуватися так, що він може зв’язуватися і таким чином регулювати EPO-ген, а також інші гени з HIF-зв’язуючими сегментами ДНК. Дослідницькі групи показали, що HIF‑1α, який зазвичай розпадається швидко, в умовах гіпоксії захищений від розпаду. За нормального рівня кисню білковий комплекс (протеасома) руйнує HIF‑1α. За нормальних умов до білка HIF‑1α приєднується маленький пептид убіквітин, а він, своєю чергою, слугує мішенню для протеасоми, яка доводить процес розпаду до кінця. Однак, як саме убіквітин приєднується до HIF‑1α залежно від рівня кисню, залишалося для дослідників загадкою, яку вкрай важливо було розгадати.
Відповідь прийшла звідки й не чекали. У той самий час, коли Семенза і Реткліфф вивчали регуляцію EPO-гена, онколог Вільям Келін-молодший досліджував спадковий синдром – хворобу Гіппеля-Ліндау (VHL-хвороба). Цей синдром значно підвищує ризик деяких видів раку в сім’ях зі спадковими мутаціями VHL-гена. Келін встановив, що VHL-ген кодує білок, який запобігає виникненню раку. Учений також довів, що ракові клітини, які позбавлені функціонального VHL-гена, демонструють аномально високий рівень генів, регульованих гіпоксією. Утім, коли VHL-ген знову вводився в ракові клітини, цей рівень відновлювався до нормального. Це було важливою зачіпкою, яка показала, що VHL якимось чином бере участь у контролі реакції клітини на гіпоксію. Додаткові відомості принесли кілька дослідницьких груп, які виявили, що VHL є частиною того самого означеного комплексу, який маркує білки убіквітином. Іншими словами, «вказує» протеасомі, що саме їй необхідно зруйнувати. Реткліфф із колегами згодом дійшов важливого висновку: продемонстрував, що VHL може фізично взаємодіяти з HIF‑1α та є необхідним для руйнування цього фактора за нормальних рівнів кисню. Це остаточно довело зв’язок VHL із HIF‑1α (рис.).
У подальших дослідженнях учених було виявлено, що функція активації гена HIF‑1α регулюється кисневозалежним гідроксилюванням. Отже, нобелівські лауреати з’ясували механізм визначення рівня кисню і показали, як він працює. Завдяки їхнім новаторським дослідженням ми знаємо набагато більше про те, як зміна рівня кисню регулює фундаментальні фізіологічні процеси в організмі. Чутливість до кисню дає клітинам можливість адаптувати свій метаболізм і до зниження його рівня. Це відбувається постійно, наприклад у м’язах під час інтенсивних тренувань. Інші приклади адаптивних процесів, контрольованих чутливістю до кисню, включають утворення нових кровоносних судин і вироблення еритроцитів. Наша імунна система й чимало інших фізіологічних функцій також налаштовуються за допомогою механізмів чутливості до рівня кисню. Він, як виявилося, серйозно впливає і на внутрішньоутробний період – з його допомогою контролюється нормальне формування кровоносних судин плода і розвиток плаценти.
Ключ до регулювання клітинних процесів
Чутливість до рівня кисню є ключовим фактором безлічі захворювань. Так, пацієнти з хронічною нирковою недостатністю часто страждають на тяжку анемію через зниження вироблення еритропоетину. Цей гормон, як зазначено вище, виділяється клітинами нирок і необхідний для контролю утворення червоних кров’яних тілець – еритроцитів. Крім того, механізми, регульовані за допомогою кисню, відіграють важливу роль у розвитку ракових пухлин. Саме ці механізми дають злоякісним утворенням вирощувати необхідні їм кровоносні судини й змінювати метаболізм для значного розмноження ракових клітин. Отже, роботи нобелівських лауреатів 2019 розкрили секрет одного з найважливіших адаптаційних життєвих процесів. Дослідники заклали основу для нашого розуміння того, як рівень кисню впливає на клітинний метаболізм і фізіологічні функції. Їхні відкриття також проклали шлях до багатообіцяючих нових стратегій боротьби з анемією, раком і багатьма іншими захворюваннями.
Фармацевтичні компанії, спираючись на ці дані, спрямовуватимуть свої зусилля на виготовлення ліків, здатних впливати на різні хворобливі стани шляхом активації або блокування механізмів чутливості до кисню.
Минулого року Нобелівську премію з фізіології та медицини отримали вчені-імунологи Джеймс Еллісон (США) і Тасуку Хондзьо (Японія) за відкриття терапії раку шляхом активації імунної відповіді.
За матеріалами https://uk.wikipedia.org wiki
https://ruspekh.ru people item uilyamkelin-william-bill-george-kaelin-jr
https://bykvu.com
https://www.interfax.ru world
Підготувала Олександра Завидович
Медична газета «Здоров’я України 21 сторіччя» № 22 (467), листопад 2019 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...