Фармакогенетическое тестирование для персонализации дозирования варфарина
Мы раньше думали, что нашу судьбу определяют звезды.
Сейчас мы знаем, что во многом наша судьба – это наши гены.
Джеймс Уотсон, лауреат Нобелевской премии по физиологии и медицине
Антикоагулянтом непрямого действия, наиболее часто назначаемым сегодня пациентам, является варфарин. Его начали применять в медицинской практике еще с середины прошлого века у пациентов с анамнезом артериального и венозного тромбоза, фибрилляции предсердий, а также при тромбоэмболии, протезировании сердечных клапанов и др. С тех пор варфарин обрел у врачей во всем мире большую популярность, а в США он занимает 11-е место среди наиболее часто применяемых лекарственных средств (ЛС).
Подбор дозы варфарина осуществляется на основе значений такого показателя системы свертываемости крови, как международное нормализованное отношение (МНО). Несмотря на жесткость лабораторного контроля, наличие схем тщательного подбора дозы, основной опасностью при назначении варфарина по-прежнему остается риск развития кровотечений. Так, по данным крупных международных клинических исследований, кровотечения возникают с частотой до 26,5% (в т. ч. большие от 0,2 до 5,2% и фатальные от 0,07 до 0,7% [1]), а серьезные геморрагии – с частотой 0,34,2 случая на 100 пациентов ежегодно [2]. Имеются данные, что из 700 тыс. пациентов с фибрилляцией предсердий, получающих варфарин ежедневно, у 17 тыс. произошли кровотечения, из них у 4 тыс. – фатальные [3]. Примерно у 15% пациентов, принимающих варфарин, имеет место хотя бы один эпизод небольшого кровотечения в год. Исследование ЕSPIRIT показывает, что риск развития кровотечений напрямую зависит от уровня МНО и с каждым его повышением на 0,5 единицы возрастает в 1,37 раза.
Иногда, несмотря на повышение дозы препарата, желаемого эффекта достичь не удается. Более того, известны случаи отсроченных осложнений, которые возникают спустя несколько месяцев после терапии. При этом бессимптомное повышение МНО может произойти не только на этапе подбора дозы препарата, но и при длительном его применении [4]. Повышение значений МНО >3,0 не дает дополнительных преимуществ в эффективности профилактики, но увеличивает риск внутричерепного кровоизлияния почти в 2,5 раза, а при МНО от 4,0 до 6,0 этот риск возрастает в 16 раз. Однако не все кровотечения можно связать с повышением уровня МНО. Так, 30-40% кровотечений, в т. ч. больших, развиваются на фоне терапевтического диапазона МНО. Увеличению уровня МНО >4,0 на фоне применения варфарина способствуют различные факторы, учет которых может влиять на расчет риска кровотечений у конкретного больного [4].
Можно заключить, что даже при использовании в практике хорошо разработанных методов контроля безопасности применения варфарина риск развития кровотечений остается довольно высоким. Поэтому столь актуальным является изучение факторов, определяющих индивидуальную чувствительность к варфарину, на которую влияют клинические и генетические факторы (17-21 и 53-54% вариабельности дозы соответственно). К клиническим факторам, влияющим на выбор дозы варфарина, относят возраст, пол, вес, курение, почечную и печеночную недостаточность, употребление больших доз алкоголя, потерю крови при операции, потребление ряда пищевых продуктов, прием некоторых лекарственных препаратов [5], генетические особенности пациента [6]. Последние обусловлены полиморфизмами в генах CYP2C9, VKORC1. При своевременном выполнении фармакогенетического тестирования возможно выявить лиц, нуждающихся в индивидуальном подборе дозы варфарина, и, соответственно, снизить вероятность осложнений.
Все этапы фармакокинетики и фармакодинамики ЛС (всасывание, распределение, биотрансформация, выведение) находятся под контролем определенных генов. Доказано, что концентрация ЛС в организме зависит от активности ферментов метаболизма (метаболизаторов) и транспортеров. Генетически детерминированные межиндивидуальные различия по этому показателю позволяют выделить группы индивидов, дифференцированные по активности того или иного фермента биотрансформации, т. н. метаболизаторов:
- экстенсивные (активные) метаболизаторы (extensive metabolism, EM) имеют нормальный ген того или иного фермента метаболизма; к ним принадлежит большая часть популяции;
- медленные метаболизаторы (poor metabolism, PM) имеют мутации гена того или иного фермента метаболизма, которые приводят либо к синтезу дефектного фермента, либо к отсутствию синтеза фермента метаболизма, результатом чего является снижение ферментативной активности и даже ее отсутствие. У медленных метаболизаторов ЛС накапливается в организме в высоких концентрациях, что приводит к появлению выраженных побочных реакций. В связи с этим для медленных метаболизаторов должен быть осуществлен тщательный подбор дозы ЛС, т. е. доза должна быть меньше, чем для активных метаболизаторов;
- сверхактивные (быстрые) метаболизаторы (ultraextensive metabolism, UM) имеют мутации гена того или иного фермента метаболизма, которые приводят к синтезу фермента, обладающего высокой метаболизирующей активностью. Следствием этого является недостаточная для достижения терапевтического эффекта концентрация ЛС в крови. Сверхактивным метаболизаторам требуется более высокая доза ЛС, чем активным [7].
 В зависимости от скорости превращения варфарина метаболизаторы в популяции распределяются следующим образом (рис. 1).
В зависимости от скорости превращения варфарина метаболизаторы в популяции распределяются следующим образом (рис. 1).
Полиморфизм гена CYP2C9
Основным геном, который кодирует фермент, осуществляющий метаболизм варфарина в организме, является изофермент цитохрома Р450 – CYP2C9. Изменение его активности в значительной мере влияет на чувствительность пациента к терапии варфарином. Вариантные аллели гена изофермента CYP2C9*2 и CYP2C9*3 отличаются от нормального гена одной аминокислотой, замещенной в кодоне Arg144Cys и Ile359Leu (рис. 2). Носительство вариантных аллелей по метаболизирующему ферменту приводит к снижению скорости биотрансформации и выведения S-варфарина, что, в свою очередь, сопровождается повышенными плазменными концентрациями активного энантиомера варфарина и является фактором риска развития серьезных осложнений при фармакотерапии данным ЛС.
CYP2C9 имеет 6 вариантов однонуклеотидных замен (табл. 1).
Эти структурные полиморфизмы влияют на скорость метаболизма и, как следствие, на эффективность и безопасность приема варфарина. Если у носителей «дикого» типа – CYP2C9*1 – скорость метаболизма препарата является стандартной, то при наличии вариантов CYP2C9*2 и CYP2C9*3 активность фермента может быть снижена до 90%, что приводит к повышению концентрации варфарина в плазме. Таким образом, носители указанных аллелей являются медленными метаболизаторами, которым необходима более низкая по сравнению со стандартной доза варфарина (рис. 3).
VKORC1
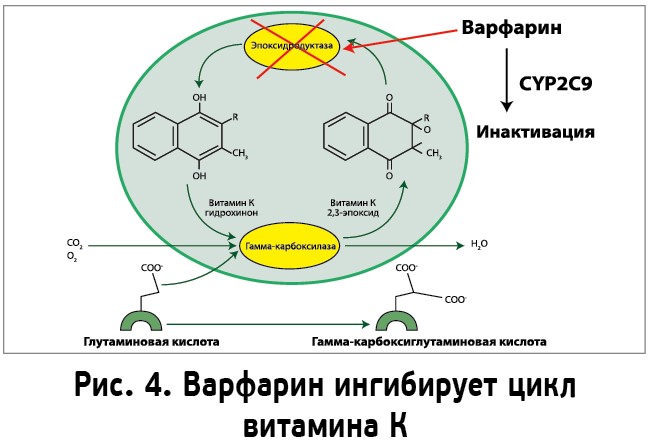
 Ген VKORC1, локализованный на хромосоме 16 в области p12q21, кодирует субъединицу 1 витамин К-эпоксидредуктазного комплекса (Vitamin К Epoxide Reductase Complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К. Эпоксидредуктаза витамина К – это фермент, переводящий витамин К из неактивной (2,3-эпоксид витамин К) в активную форму (витамин К-гидрохинон). Витамин K-гидрохинон является кофактором для фермента гамма-глутамилкарбоксилазы, которая катализирует реакцию посттрансляционного карбоксилирования остатков глутаминовой кислоты в витамин K-зависимых белках (факторы свертывающей и противосвертывающей систем крови), тем самым активируя их. Активная форма фермента влияет на выработку витамин К-зависимых факторов свертывания крови, регулируя процесс тромбообразования. Дефицит витамина К может приводить к опасным для жизни кровотечениям. При приеме варфарина происходит блокирование фермента эпоксидредуктазы витамина К. При этом варфарин связывается с субъединицей VKORC1, влияя на синтез факторов свертывания (рис. 4). Ингибирование VKORС1 приводит к образованию в печени и попаданию в кровь функционально неактивных витамин К-зависимых факторов свертывания (факторы II, VII, IX, X, регуляторные белки C и S), что проявляется антикоагулянтным действием препарата. В результате образуются неактивные витамин К-зависимые формы, которые носят название PIVKA (Proteins Induced in Vitamin K Absence), вследствие чего происходит снижение свертываемости крови. Мутации в гене VKORC1 ассоциируются с дефицитом фермента, что приводит к неадекватности терапии варфарином.
Ген VKORC1, локализованный на хромосоме 16 в области p12q21, кодирует субъединицу 1 витамин К-эпоксидредуктазного комплекса (Vitamin К Epoxide Reductase Complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К. Эпоксидредуктаза витамина К – это фермент, переводящий витамин К из неактивной (2,3-эпоксид витамин К) в активную форму (витамин К-гидрохинон). Витамин K-гидрохинон является кофактором для фермента гамма-глутамилкарбоксилазы, которая катализирует реакцию посттрансляционного карбоксилирования остатков глутаминовой кислоты в витамин K-зависимых белках (факторы свертывающей и противосвертывающей систем крови), тем самым активируя их. Активная форма фермента влияет на выработку витамин К-зависимых факторов свертывания крови, регулируя процесс тромбообразования. Дефицит витамина К может приводить к опасным для жизни кровотечениям. При приеме варфарина происходит блокирование фермента эпоксидредуктазы витамина К. При этом варфарин связывается с субъединицей VKORC1, влияя на синтез факторов свертывания (рис. 4). Ингибирование VKORС1 приводит к образованию в печени и попаданию в кровь функционально неактивных витамин К-зависимых факторов свертывания (факторы II, VII, IX, X, регуляторные белки C и S), что проявляется антикоагулянтным действием препарата. В результате образуются неактивные витамин К-зависимые формы, которые носят название PIVKA (Proteins Induced in Vitamin K Absence), вследствие чего происходит снижение свертываемости крови. Мутации в гене VKORC1 ассоциируются с дефицитом фермента, что приводит к неадекватности терапии варфарином.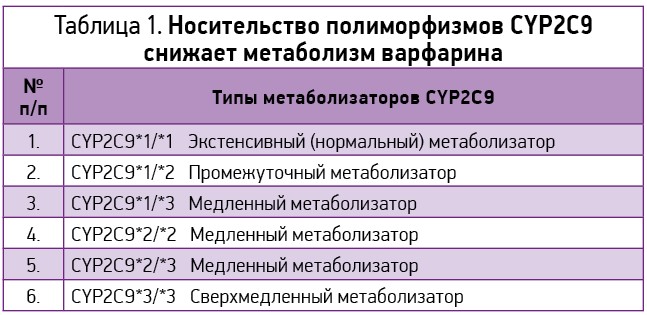
Полиморфизм VKORC1
Исследования в различных популяциях показали важность генетической изменчивости VKORC1. Были определены 3 наиболее распространенных и важных полиморфизма, к настоящему времени хорошо изученных [10-12]:
1639G>А (rs9923231)
1639G>А является полиморфизмом в промоторной области VKORC1, который считают причиной точечного нуклеотидного полиморфизма (SNP – Single Nucleotide Polymorphysm) для низкодозового фенотипа. Этот полиморфизм приводит к изменению VKORC1, что проявляется увеличением активности аллеля G на 44% по сравнению с активностью аллеля А [13]. Кроме того, анализ мРНК VKORC1, выделенной из образцов печени человека, показал, что у носителей аллеля А в положении 3673 уменьшалось количество мРНК VKORC1 [14]. Изменения в экспрессии генов приводят к снижению количества функциональных копий VKORC1 и уменьшают активность фермента в цикле витамина K.
В разных этнических группах этот полиморфизм имеет ярко выраженные различия по частоте встречаемости. Частота встречаемости аллеля А среди коренных жителей Азиатского региона составляет примерно 90%, это объясняет применение более низких доз варфарина у представителей этой популяции. Среди представителей европеоидной расы частота встречаемости аллеля А равняется приблизительно 40%. Носителям этого аллеля требуются более низкие начальные терапевтические дозы варфарина, чем носителям аллеля G (согласно недавним клиническим исследованиям, на 28% [15], табл. 2).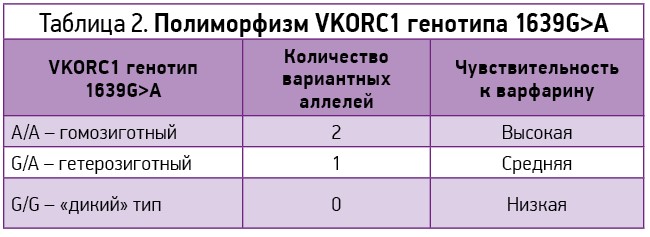
1173C>T (rs9934438)
Замена остатка цитозина на остаток тимина в позиции 1173 первого интрона гена (rs9934438) обусловливает полиморфизм VKORC1 C1173T в гене VKORC1. Этот полиморфный вариант, приводящий к снижению активности фермента, ассоциирован с повышенной чувствительностью пациентов к варфарину. Пациентам с мутантным аллелем VKORC1 1173T требуются более низкие дозы варфарина, чем носителям нормального аллеля VKORC1 1173С, причем средняя ежедневная доза варфарина должна быть снижена на 43% для гомозигот VKORC1 1173TT и на 22% для гетерозигот VKORC1 1173СТ.
Интерпретация результатов:
- Т/Т – пациентам с генотипом ТТ требуется меньшая доза препарата, чем лицам с генотипами ТС и СС;
- Т/С – пациентам с генотипом ТС требуется меньшая доза препарата, чем лицам с генотипом СС;
- С/С – пациентам с генотипом СС требуется большая доза препарата, чем лицам с генотипами ТС и ТТ.
Например, в одном из исследований было показано, что у пациентов с генотипом СС подобранная доза варфарина составляла 6,2 мг/сут, с генотипом СТ – 4,8 мг/сут, с генотипом ТТ – 3,5 мг/сут.
G9041A (rs7294)
G9041A, или 3730G>А, – точечный нуклеотидный полиморфизм, предусматривающий использование более высокой дозы варфарина [16, 17].
Таким образом, VKORC1 полиморфизмы могут существенно изменить фармакодинамику варфарина и требования к определению поддерживающей дозы. Пациенты с 1639A (rs992323) и 1173T (rs9934438) аллелем нуждаются в более низкой дозе варфарина (средняя доза 24-26 мг/нед vs 35 мг/нед для носителей «дикого» типа), в то время как пациентам с 9041A (rs7294) назначают более высокую дозу препарата (средняя доза – 40 мг/нед) [18].
Полиморфизмы CYP2C9 оказывают влияние примерно в 10-15% случаев, а полиморфизмы VKORC1 – в 25-30% случаев вариаций дозы варфарина (рис. 5).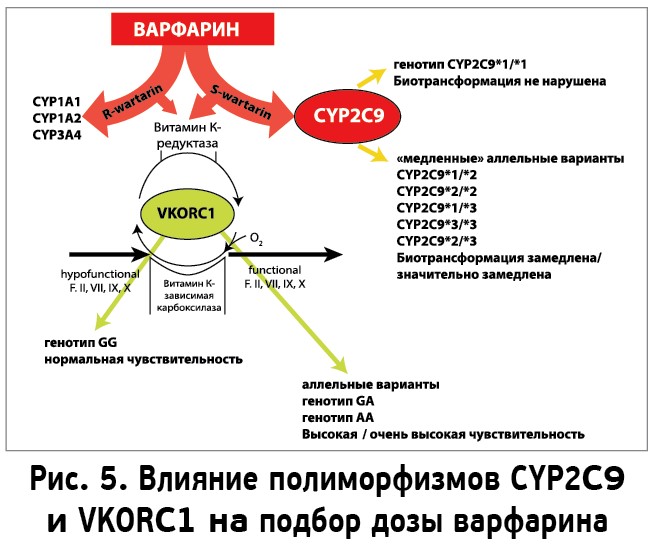
Одновременное определение генотипов цитохрома CYP2C9 и фермента VKORC1 позволит улучшить прогнозирование оптимальной дозы варфарина еще до его применения и повысить безопасность антикоагулянтной терапии. Управление по контролю качества продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) включило исследование полиморфизма CYP2C9 наряду с изучением полиморфизма VKORC1 в число рекомендуемых мероприятий перед назначением лечения варфарином. В феврале 2007 г. FDA одобрило внесение поправки в инструкцию по применению варфарина, информирующей, что при наличии у пациента *2 или *3 варианта гена CYP2C9 или аллеля A в позиции 1639 гена VKORC1 (генотипы G/A или А/А) стартовая доза варфарина должна быть уменьшена [19] (табл. 3).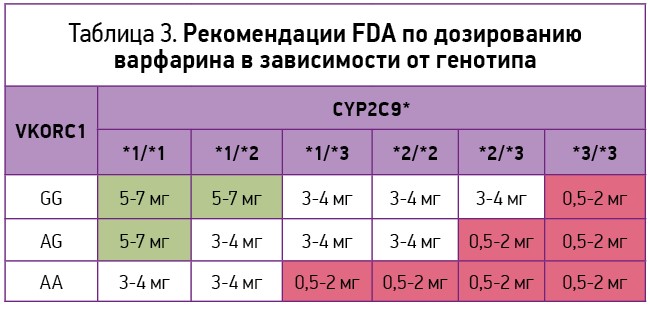
Некоторые авторы рекомендуют в ряде случаев на основе фармакогенетического тестирования по CYP2C9 и VKORC1 не регулировать дозу варфарина, а использовать в качестве антикоагулянтов новые ЛС (дабигатран, ривароксабан, апиксабан), поскольку существует мнение, что при выявлении носительства аллеля CYP2C9*3 (гетерозиготное или гомозиготное) при сочетании с аллелем А по полиморфному маркеру G‑1639A гена VKORC1 необходимо выбирать новые пероральные антикоагулянты [20].
Расчет индивидуальной дозы варфарина
В основе современного подхода к расчету индивидуальной дозы варфарина лежит алгоритм, предложенный Gage и соавт. [21, 22]; он позволяет учесть ряд соматических показателей, сопутствующую терапию и результаты генотипирования CYP2C9, VKORC1. Алгоритм не исключает необходимости титровать дозу варфарина под лабораторным контролем, но дает возможность уменьшить время, требуемое для подбора дозы, повысить уровень безопасности терапии и назначить адекватное лечение большему числу пациентов.
Выбор начальной дозы варфарина в соответствии с результатами фармакогенетического тестирования может быть рассчитан с помощью on-line-калькулятора (www.warfarindosing.org). Для этого необходимо внести следующие данные: возраст, пол, этническую и расовую принадлежность, вес, рост, статус курения, наличие/отсутствие заболеваний печени, показание к назначению варфарина, базовое значение МНО, целевое значение МНО, CYP2C9 генотип, VKORC1 1639/3673, прием амиодарона/кордарона, статинов.
Индивидуальная доза варфарина рассчитывается на основании введенных данных.
Преимущества использования алгоритма Gage и соавт.:
- сокращение сроков подбора индивидуальной дозы;
- снижение частоты эпизодов гипокоагуляции (МНО >3,0) в 3 раза;
- снижение частоты кровотечений в 4,5 раза;
- снижение частоты госпитализаций на 43%.
При подборе индивидуальной дозы варфарина важно учитывать следующие моменты.
- Генотипирование не исключает необходимости титрования дозы.
- Генотипирование не исключает значимости клинических факторов (прием амиодарона, наличие печеночной или почечной недостаточности и др.).
- Рассчитанная на основании генотипирования доза должна быть пересмотрена, если изменяются клинические факторы. Например, чаще всего у врача настороженность вызывает ситуация, когда доза в 7,5 мг не приводит к достижению целевых значений МНО. Причинами таких состояний могут быть низкий комплаенс, прием высоких доз витамина К или ЛС, являющихся индукторами изофермента CYP2C9. В подобных случаях требуется исключить возможные провоцирующие факторы.
- Проведение генотипирования чувствительности к варфарину для дальнейшего расчета его дозы может быть оправдано у больных, имеющих факторы риска кровотечения или геморрагические осложнения в анамнезе, а также у пожилых пациентов. Однако клинически предположить повышенную чувствительность к варфарину невозможно, т. к. существует риск, что и у пациента без отягощенного анамнеза на фоне стандартного насыщения может произойти передозировка, обусловленная генетическими нарушениями метаболизма препарата. Выявить пациентов с наследственными нарушениями чувствительности к варфарину можно только при проведении генетического анализа.
- У некоторых пациентов реальная доза существенно отличается от рассчитанной на основании генотипирования.
Фармакогенетическое тестирование дает возможность врачу выбрать тактику дозирования варфарина, поскольку позволяет выявить пациентов с различным типом метаболизма: медленных метаболизаторов, которым для эффективного действия препарата и достижения рекомендуемого показателя МНО требуется доза ниже средней, или, наоборот, быстрых метаболизаторов, которым нужно увеличить дозу варфарина. Такой подход в сочетании с регулярным определением величины МНО существенно ускоряет подбор адекватной дозы препарата и помогает избежать возможных нежелательных реакций.
К сожалению, в Украине по ряду причин анализ на генетическую чувствительность к варфарину в настоящее время является недоступной медицинской технологией, хотя в принципе провести это исследование можно в любых лабораториях, выполняющих тесты, основанные на ПЦР-диагностике. В то же время некоторые частные медицинские лаборатории предлагают услугу фармакогенотипирования с проведением исследования за рубежом.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 24 (469), грудень 2019 р.
СТАТТІ ЗА ТЕМОЮ Діагностика
Еритроцити, або червоні кров’яні тільця, є найпоширенішим компонентом клітин крові, які становлять 40-45% їхнього обсягу. Плазматична мембрана еритроцитів має унікальну будову, що надає їм біологічних і механічних властивостей, необхідних для виконання специфічних функцій. Основна функція еритроцитів в організмі – це транспорт кисню, опосередкований гемоглобіном. Вони активно беруть участь як в артеріальних, так і у венозних тромбозах [1]. Гемоглобін – висококонсервативний білок, який завдяки своїй здатності зворотно зв’язувати кисень бере участь у процесах, що лежать в основі аеробного життя на планеті Земля. Головна роль цього білка полягає у підтримці клітинного гомеостазу. Однак завдяки майже 200-річним дослідженням гемоглобіну тепер відомо, що цей білок також відіграє важливу роль в інших метаболічних процесах, як-от передача сигналів у клітинах, модуляція запальної реакції, за тромбозу при гемолізі еритроцитів тощо [2-4]....
У сучасному світі онкологічні захворювання становлять чи не найбільшу загрозу життю людини, поступаючись тільки серцево-судинній патології [1]. Більшість неінфекційних хвороб людини, зокрема й онкологічні захворювання, є багатофакторними, і їх розвиток пов’язаний у тому числі з генетичними чинниками. Це, з одного боку, підвищує з віком ризик виникнення хронічних захворювань, а з іншого – дає змогу разом з лікарем розробити заходи з їх профілактики, раннього виявлення й ефективного лікування [2]....
Власна патоморфологічна лабораторія – необхідність для всіх клінік ендоскопічного, хірургічного й онкологічного профілю. Одним із видів діяльності такої лабораторії є проведення інтраопераційних досліджень. Ці дослідження виконують для визначення тактики подальшого оперативного втручання під час операції. Тому створення лабораторії на колесах, що може надавати результати патоморфологічного дослідження в будь-якому місці та ще під час операційного втручання, стало логічним рішенням для Медичної лабораторії CSD LAB, найбільшої патоморфологічної лабораторії України та Східної Європи....
Нефракціоновані (НФГ) і низькомолекулярні гепарини (НМГ) є препаратами, що широко використовуються та запобігають артеріальним і венозним тромбозам. Однак їхнє застосування також пов’язано з парадоксальною реакцією, що зумовлює потенційно небезпечний для життя протромботичний стан, результатом чого є серйозні ускладнення (гангрена, ампутація кінцівок) або фатальні наслідки. Гепарин-індукована тромбоцитопенія (ГІТ) – це імуноопосередкована відповідь на введення гепарину, який спричиняє небезпечний для життя тромбоз і є клінічно значущим негеморагічним ускладненням. ГІТ вважається потенційно загрозливим для життя станом за терапії гепарином, що спричиняє утворення нових згустків крові, а не сприяє запобіганню утворення нових тромбів. Хоча при введенні гепарину імунна реакція зустрічається досить часто (від 8 до 50%), клінічні ускладнення у разі ГІТ виникають у ≈0,2-3% пацієнтів, які приймають гепарин протягом >4 дні; частіше спостерігаються в жінок [1-3]. У цьому стані тромбоцити різко знижуються до рівня ≥20×109/л. Смертність становить 10-20%....