Кишечно-мозговая ось, микрофлора кишечника и их связь с развитием ожирения
Ожирение – это глобальная эпидемия, представляющая значительную социоэкономическую проблему для систем здравоохранения. Она особенно актуальна в таких странах, как Австралия, США, Великобритания и Канада. Ожирение развивается вследствие нарушения баланса между потребляемой и расходуемой энергией, когда объем потребляемой энергии превышает объем расходуемой. Современные неинвазивные методы лечения в борьбе с ожирением малоэффективны, демонстрируя, что это более многогранное и комплексное состояние, чем считали раньше. Это привело к увеличению количества исследований энергетического гомеостаза и к открытию системы двунаправленной связи, известной как кишечно-мозговая ось.
Кишечно-мозговая ось включает в себя различные нейрогуморальные компоненты, которые позволяют кишечнику и мозгу поддерживать связь друг с другом. Эту связь обеспечивают локальные паракринные и/или эндокринные механизмы, включающие множество гастроинтестинальных пептидов, продуцируемых эндокринными клетками кишечника. Среди этих пептидов – глюкагоноподобный пептид‑1, холецистокинин, пептид YY, панкреатический полипептид и оксинтомодулин. Нервная система (в частности, энтеральная нервная система и блуждающий нерв) тоже участвует в передаче информации по кишечно-мозговой оси. Выявляют доказательства того, что кишечная микрофлора (комплексная экосистема, находящаяся в желудочно-кишечном тракте) может влиять на массу тела посредством взаимосвязанных механизмов (накопления энергии, передачи сигнала короткоцепочечными жирными кислотами, изменения поведения хозяина, контроля его насыщения и модулирования воспалительного ответа).
В этом обзоре рассмотрим кишечно-мозговую ось, микрофлору кишечника, связь между этими элементами и роль, которую каждый из них играет в активации и регулировании энергетического обмена и развитии ожирения.
Ожирение: растущая проблема
Ожирение – это одна из самых быстрораспространяющихся эпидемий, представляющих проблему для зарубежных систем здравоохранения, в особенности развитых стран – Австралии, США, Великобритании и Канады. В 1970-е годы избыточная масса тела и ожирение не были распространены, и менее 15% австралийцев входили в эти категории (Hayes et al., 2017). К 1995 году доля лиц с избыточной массой тела и ожирением увеличилась приблизительно до 20% (Tolhurst et al., 2016; Hayes et al., 2017). Сейчас Австралия находится на первом месте в мире по распространенности избыточной массы тела и ожирения: 63,4% взрослых и 29,5% детей и подростков до 17 лет имеют избыточную массу тела (Grima, Dixon, 2013; Tolhurst et al., 2016). 44,5% взрослых и 70,1-91,7% лиц до 17 лет не имеют необходимого минимума ежедневной физической активности и примерно 40% ежедневно употребляют фаст-фуд. Такая избыточно калорийная диета, богатая насыщенными жирами, трансжирами и простыми углеводами, получила название западной (Tolhurst еt al., 2016).
Причиной ожирения является отложение жиров из-за дисбаланса между потреблением пищи и расходом энергии, когда потребление пищи превышает энергозатраты. Исходя из этого упрощенного определения, ожирение – это следствие сложного комплекса генетических, диетических, социоэкономических, психологических и экологических факторов. Такое определение упрощает понимание ожирения и борьбу с ним как комплексным заболеванием (Moran, Shanahan, 2014; Bauer et al., 2016).
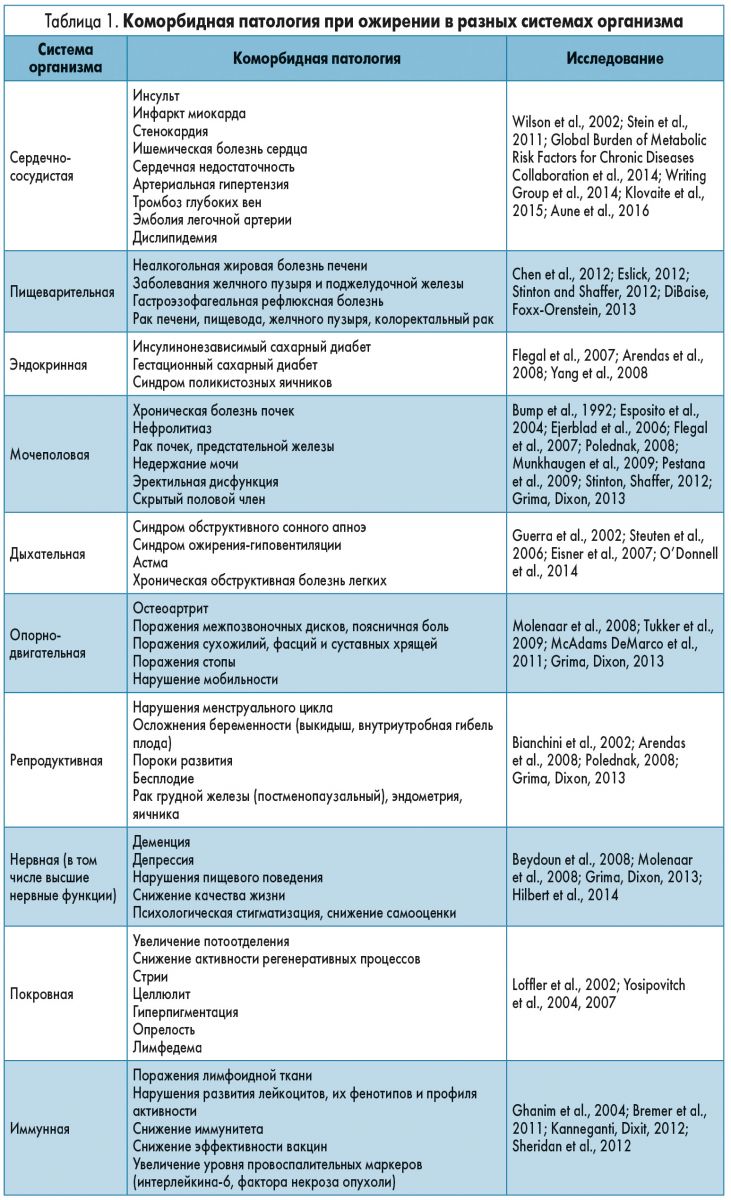
При ожирении наблюдается увеличение количества жировой ткани, развитие неспецифического воспаления, дисбактериоза и гормонального дисбаланса, повышение нейрогенного тонуса (Buhmann et al., 2014; Moran, Shanahan, 2014; Bauer et al., 2016). Эти факторы приводят к развитию коморбидной патологии (табл. 1), которая в свою очередь увеличивает частоту летальных исходов. Факторы, способствующие развитию ожирения, а также связанные с ними расходы (превышающие 8 млрд долларов США в год только в Австралии) и неэффективность неинвазивных методов лечения ожирения привели к увеличению числа исследований, направленных на улучшение подходов к снижению массы тела (Grima, Dixon, 2013; Buhmann et al., 2014). В настоящее время бариатрические операции, такие как желудочное шунтирование Roux-en-Y, лапароскопическая рукавная гастрэктомия и лапароскопическое бандажирование желудка, являются наиболее эффективными методами увеличения и поддержания потери массы тела в долгосрочной перспективе. Тем не менее причина успеха бариатрических операций пока не ясна. Предполагается, что ключом к пониманию этого явления могут стать изменения в системной и локальной концентрациях пептидов, продуцируемых кишечником, изменение ответа в местах их действия, а также изменения функционирования блуждающего нерва и, соответственно, в сигналах, поступающих в головной мозг (Santo et al., 2016; Yavuz et al., 2017). Эта идея легла в основу большого числа исследований о взаимодействии между центральной нервной системой (ЦНС), желудочно-кишечным трактом (ЖКТ; а с недавних пор и микрофлорой кишечника) и энергетическим гомеостазом. В этом обзоре внимание сосредоточено на исследовании связи между компонентами оси «кишечник – мозг – микрофлора», а также роли, которую каждое из звеньев оси играет и в активации, и в регуляции энергетического обмена, приводя к развитию ожирения.
ЦНС, в частности головной мозг, выполняет сложную функцию анализа непрерывного потока информации об энергетическом состоянии организма, которую поставляют нервы и химические вещества. Эта информация используется для запуска подходящей для поддержания гомеостаза реакции. Сигналы варьируют, и ответы на них изменяются в зависимости от типа потребляемой пищи. Хотя сначала пища попадает в полость рта, где вступает во взаимодействие с оральной микрофлорой, ЖКТ остается основным местом сбора и переваривания пищи. Поэтому кишечник является ответственным за генерацию большинства сигналов, идущих в ЦНС, о содержании и объеме поглощенной пищи. Таким образом формируется сложная система двунаправленной связи, которую называют кишечно-мозговой осью (Bauer et al., 2016; Gribble, Reimann, 2016).
Кишечно-мозговая ось: связь кишечника и мозга
Кишечно-мозговая ось – это комплексная нейрогуморальная связующая система, необходимая для поддержания метаболического гомеостаза. Ее элементами являются ЦНС, энтеральная нервная система (ЭНС), вегетативная нервная система (ВНС) и относящиеся к ней симпатические и парасимпатические ветви, нейроэндокринная и иммунная системы, а также кишечная микрофлора (Grenham et al., 2011). Связь между компонентами оси осуществляется посредством преобразования сенсорной информации в нейронные, гормональные и иммунные сигналы, передающиеся от ЦНС к кишечнику и обратно (Mayer et al., 2015). Хотя выявляют все больше доказательств того, что изменения иммунной системы в кишечнике влияют на энергетический гомеостаз, большинство признанных эффектов оси является следствием работы нейронных и гормональных сигналов в кишечнике, так как ЖКТ обладает более чем 500 млн нейронов и может продуцировать большое количество гормонов (Monje, 2017). Из-за высокой иннервации ЖКТ питательные вещества перед всасыванием могут способствовать отправке в ЦНС сигналов об их калорийности и содержании макронутриентов через специфические сенсорные механизмы, расположенные по всему ЖКТ (Hamr et al., 2015). Эти сигналы в дальнейшим передаются в разные области головного мозга, такие как ствол мозга и гипоталамус. Более высокая обработка сигналов в этих центрах позже инициирует ряд реакций, которые приводят как к острым, так и к хроническим изменениям в потреблении и расходе энергии. Это позволяет поддерживать метаболический гомеостаз до и после приема пищи (Buhmann et al., 2014).
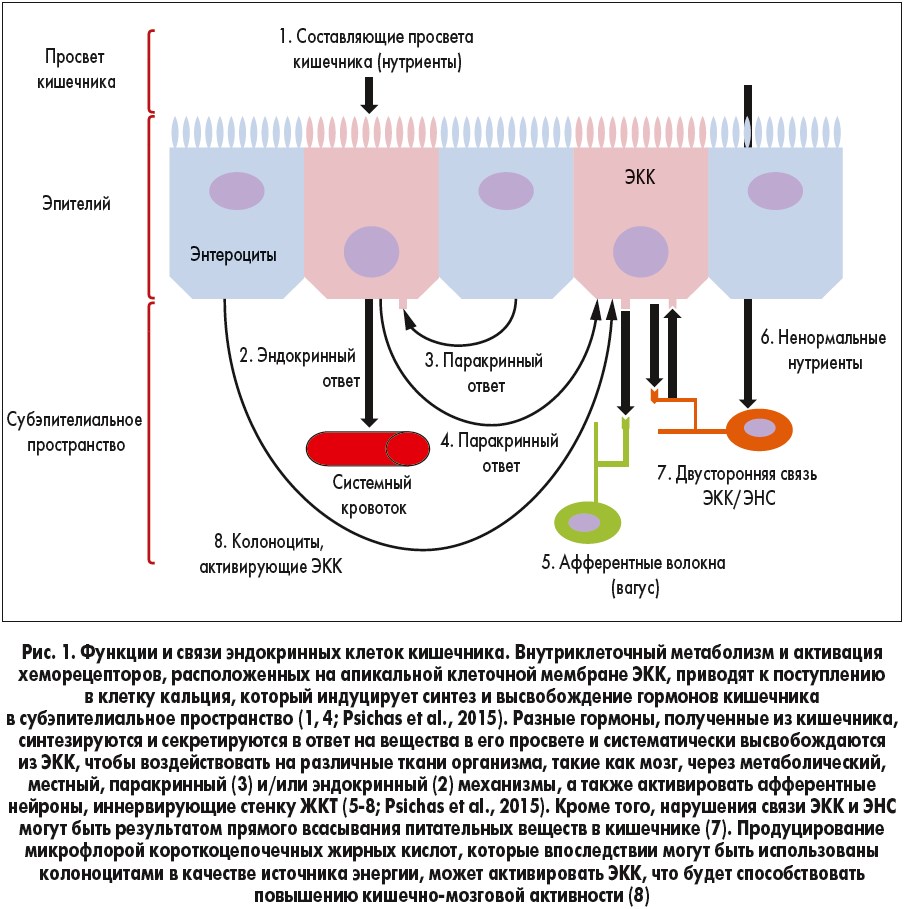
Гормоны кишечника высвобождаются из эндокринных клеток кишечника (ЭКК). Они инициируют большинство сигналов внутри кишечно-мозговой оси в ответ на воздействие питательных веществ перед их всасыванием. Эти клетки находятся в эпителии ЖКТ, и апикальные мембраны многих из них покрыты микроворсинками, непосредственно контактирующими с содержимым просвета ЖКТ (Gribble, Reimann, 2016). Схема работы ЭКК представлена на рисунке 1.
Переваривание и всасывание в основном происходят в желудке и тонком кишечнике, поэтому эти органы высокоиннервированы: они являются первичными участками, ответственными за определение содержания питательных веществ в поступающем пищевом комке. За иннервацию этих органов отвечают блуждающий и внутренностные нервы (Bauer et al., 2016). Здесь количество афферентных волокон превосходит количество эфферентных волокон, что указывает на фундаментальную роль нейронной передачи сигналов от кишечника в мозг (Prechtl, Powley, 1990; Berthoud et al., 1995). Волокна блуждающего нерва подходят к собственным пластинкам кишечных ворсинок, имеют окончания на базолатеральной мембране эндокринных клеток кишечника и экспрессируют рецепторы к гормонам кишечника, таким как грелин, лептин, холецистокинин, глюкагоноподобный пептид‑1 (GLP1) и пептид YY (PYY). Активация рецептора приводит к последующей нейронной активации (Dockray, 2013). Кроме того, нейроны ЭНС, обладающие рецепторами для разных гастроинтестинальных гормонов, могут косвенно активировать волокна блуждающего и внутренностных нервов (Almato et al., 2010; Richards et al., 2014). В то время как ЭНС контролирует кишечную функцию локально через рефлекторные действия, нельзя не отметить ее роль в передаче сигналов о питательных веществах афферентным волокнам блуждающего нерва, что способствует работе кишечно-мозговой оси (Costa et al., 2000; Sayegh et al., 2004). Нейроны ЭНС расположены проксимально как относительно ЭКК, так и относительно окончаний афферентных нервов; они стимулируются введением питательных веществ в кишечник и активируют афферентные волокна блуждающего нерва в кишечнике (Sayegh et al., 2004; Ritter, 2011). Хотя точный механизм работы ЭНС не выяснен, а мнение о том, что ЭНС работает независимо от ЦНС, все еще превалирует, согласно результатам этих исследований очевидно, что нейронный сигнал в кишечно-мозговой оси возникает из-за гормональной секреции кишечника, вызванной поступлением питательных веществ.
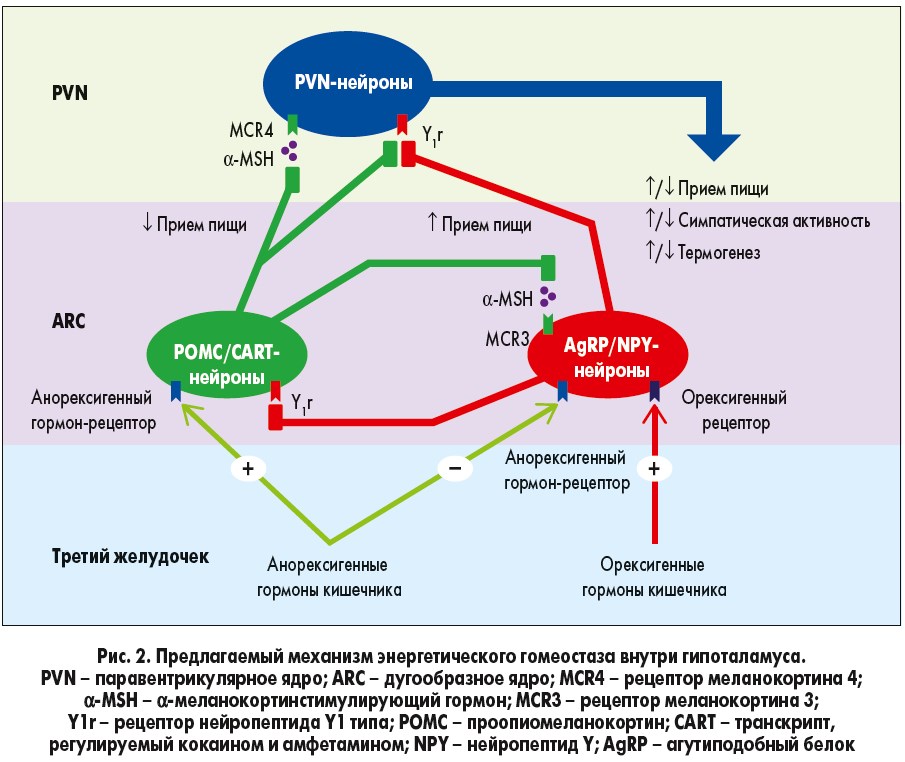
При приеме пищи сенсорная информация поступает по афферентным волокнам блуждающего нерва и/или соматосенсорной системе в ядро одиночного пути (nucleus tractus solitarii – NTS). Так, афферентные волокна блуждающего нерва сходятся в NTS дорсального вагального комплекса внутри ствола мозга, а соматосенсорные афферентные волокна образуют синапсы с нейронами пограничной зоны заднего рога спинного мозга, которые затем проецируются в NTS (Zittel et al., 1994; Schwartz et al., 2000). NTS, в свою очередь, собирает и доставляет сигналы из ЖКТ в гипоталамус (Craig, 1996; Schwartz et al., 2000). При использовании c-Fos-a-маркера, выявляющего повышенную активность нейронов (Zittel et al., 1994), был обнаружен рост его экспрессии в NTS во время всасывания пищи в ЖКТ. В то же время введение высокой дозы нейротоксина капсаицина уменьшало экспрессию c-Fos-a-маркера и блокировало связь кишечника с мозгом через блуждающий нерв (Moennikes et al., 1997). Кроме того, в исследовании Campos и соавт. (2013) утверждалось, что нейроны NТС стимулировались афферентными волокнами блуждающего нерва путем активации рецепторов N-метил-D-аспартата (NMDA-рецепторы) в афферентных окончаниях. Впоследствии это приводило к высвобождению нейромедиаторов путем фосфорилирования внеклеточных сигнальных киназ 1/2 и синапсина 1. Babic и соавт. (2009) установили, что другие нейроны NTC активируются через афферентные волокна блуждающего нерва, стимулирующие проопиомеланокортиновые (ПОМК) и катехоламинергические нейроны. Считалось, что эти нейроны NTC участвуют в сообщении о насыщении через сигнальные меланокортиновые рецепторы внутри гипоталамуса (рис. 2). Интересно, что недостаточность меланокортинового рецептора 4 типа способствует развитию ожирения (Farooqi et al., 2003). Более углубленные исследования механизмов взаимодействий различных рецепторов и нейронов могут привести к более точному пониманию того, как нейроны NTC способствуют энергетическому гомеостазу. Кроме того, выявление стимуляции ПОМК и катехоламинергических нейронов через волокна блуждающего нерва, а также наличия NMDA-рецепторов в NTS может помочь понять связь между потреблением пищи и модификациями поведения, учитывая то, что эти нейроны высвобождают нейромедиаторы, ассоциированные с возбуждением, мотивацией и эмоциями (например, дофамин).
Нейроны NTS заканчиваются в нескольких более высоких центрах головного мозга, включая систему меланокортина, в которую входит гипоталамус (Suzuki et al., 2012). Гипоталамус выполняет фундаментальную роль интеграции периферических гуморальных сигналов, которые передают информацию о потреблении питательных веществ и энергозатратах, а также информацию из NТS и других областей мозга (Bauer et al., 2016). Особую роль в пищевом поведении играют дугообразное, паравентрикулярное, вентромедиальное и дорсомедиальные ядра гипоталамуса, а также латеральный отдел гипоталамуса (Сone et al., 2001; Suzuki et al., 2012). Эти зоны объединены сетью, регулирующей энергетический гомеостаз. Большинство исследований было сосредоточено на изучении дугообразного ядра и его участия в поддержании энергетического гомеостаза (Suzuki et al., 2012; Buhmann et al., 2014). Следовательно, необходимо изучение роли остальных зон гипоталамуса в пищевом поведении и регулировании энергетического гомеостаза. Впрочем, ясно, что чувствительность к питательным веществам появляется в ЖКТ и вызывает множество нейронных и/или гуморальных ответов, которые вносят основной вклад в работу кишечно-мозговой оси, участвующей в регуляции энергетического баланса.
Дугообразное ядро отвечает на периферические и центральные сигналы об аппетите через тщательно регулируемое выделение нейромедиаторов из двух групп нейронов: ПОМК и нейронов, связанных с агутиподобным (AgRP) пептидом. AgRP-нейроны, расположенные в медиальной части дугообразного ядра, выбрасывают ингибирующие нейромедиаторы – AgRP и нейропептид Y (NPY; Сone et al., 2001; Suzuki et al., 2012). Эти нейромедиаторы стимулируют голод и аппетит, а также уменьшают расход энергии. Это увеличивает потребление пищи и способствует набору массы тела (Dryden et al., 1995; Ollmann et al., 1997; Enriori et al., 2007). ПОМК-нейроны в латеральной части дугообразного ядра выбрасывают проопиомеланокортин, который стимулирует выделение альфа-меланоцитстимулирующего гормона (α-MSH) и СART (cocaine-amphetamine-regulated transcript)-пептида (Suzuki et al., 2012). Эти нейромедиаторы являются антагонистами AgRP и NPY, уменьшают аппетит и ощущение голода, что снижает потребление пищи, а также стимулируют увеличение расхода энергии. Все эти факторы способствуют потере массы тела (Cowley et al., 2001; Nakhate et al., 2011). Энергетический гомеостаз зависит от сбалансированной работы этих двух групп нейронов.
Регуляторные механизмы гипоталамуса усложняются за счет того, что на дугообразное ядро напрямую влияют гастроинтестинальные гормоны, количество которых увеличивается после приема пищи (van der Kooy, 1984). Дугообразное ядро и NТS находятся в зоне мозга, где гематоэнцефалический барьер проницаем. Эта зона называется самым задним полем (area postrema – AP). Повреждение АP и ваготомия уменьшают действие гастроинтестинальных гормонов. Это свидетельствует о том, что высвобождение этих гормонов в системный кровоток напрямую влияет на указанную зону (van der Kooy, 1984; Date et al., 2002).
Гастроинтестинальные гормоны и роль кишечно-мозговой оси в энергетическом гомеостазе
Рассмотрев связи с ЦНС, проанализируем роль желудка в потреблении питательных веществ. Желудок – один из первых органов, откуда поступают сигналы в меланокортиновую систему. Когда пищевой комок попадает в ЖКТ, желудок растягивается, сигнализируя мозгу о необходимости прекращения приема пищи. Поступление пищи из желудка в двенадцатиперстную кишку происходит при расслаблении пилорического сфинктера. Как только питательные вещества попадают в двенадцатиперстную кишку, скорость опорожнения желудка уменьшается, что увеличивает его растяжение и ограничивает количество потребляемой пищи.
Скорость опорожнения желудка снижается при активации блуждающего нерва и высвобождении гормонов кишечника, таких как холецистокинин (CCK), PYY и GLP1 (Cooke, Clark, 1976; Talsania et al., 2005; Suzuki et al., 2012). Этот механизм обратной связи был продемонстрирован в исследовании Davis и Smith (1990), которые установили, что потребление пищи при повторном кормлении у крыс уменьшается в течение 6 мин после первого кормления, предотвращая переедание. Phillips и Powley (1996) продемонстрировали на крысах, использyя физиологический раствор вместо пищевых продуктов, что именно растяжение желудка, а не содержание питательных веществ в пищевом комке, вызывает сигнал обратной связи, прекращающий чрезмерное потребление, и что для его развития требуется менее чем 3 мин. Эти исследования показывают, что иннервирующие желудок нейроны экспрессируют механорецепторы, которые активируются растяжением желудка, способствуют передаче ограниченной информации в мозг и участвуют в регулировании питания и долгосрочного энергетического гомеостаза (Bauer et al., 2016). Поступают также новые данные о содержании в желудке вкусовых рецепторов. Они могут противоречить результатам предыдущих исследований о природе сенсорной информации, транслируемой в ЦНС, и о том, как ЦНС интегрирует эту информацию и передает ее остальной части кишечника (Young et al., 2009; Depoortere, 2014). Классические исследования, впрочем, демонстрируют, что ложный прием пищи (процесс, при котором пищевые продукты, поступающие в желудок, не попадают в тонкую кишку, а сразу в толстую кишку или удаляются непосредственно из желудка) замедляется с помощью инфузии кишечного питательного вещества. Тем самым доказывается, что питательные вещества в кишечнике могут подавлять потребление пищи независимо от опорожнения желудка и передачи информации на кишечно-мозговую ось с помощью нейрогуморальных механизмов (Gibbs et al., 1981; Reidelberger et al., 1983).
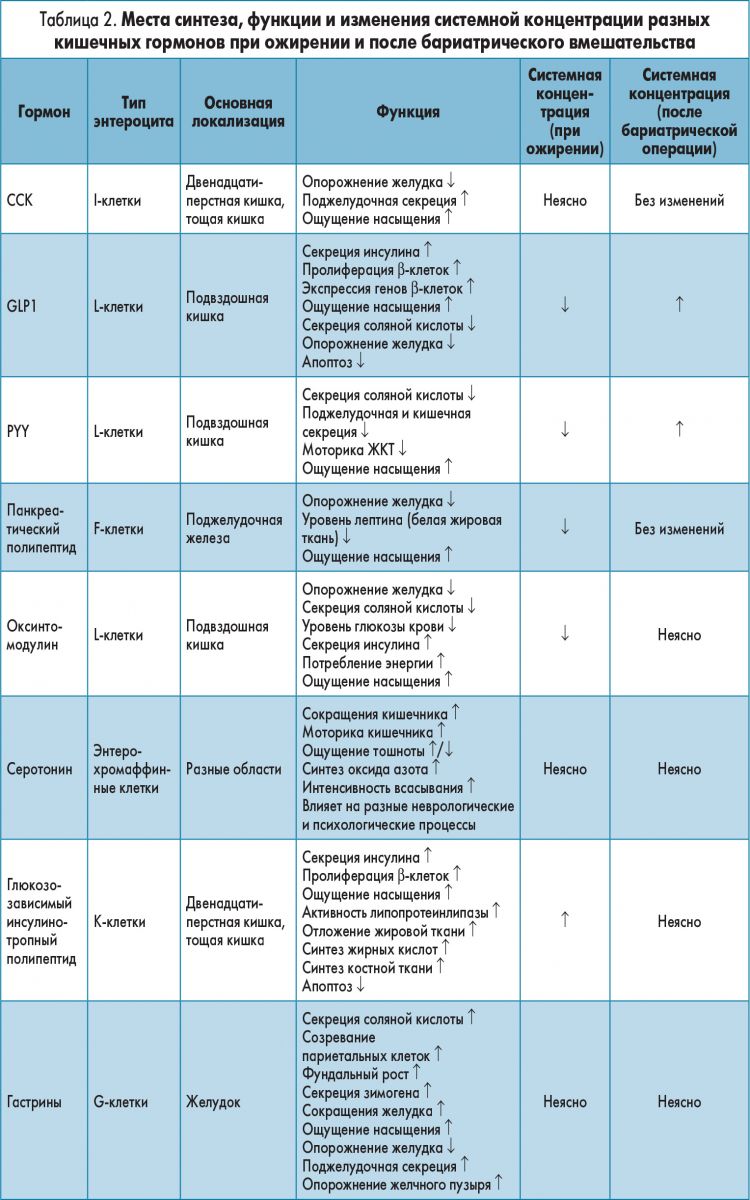
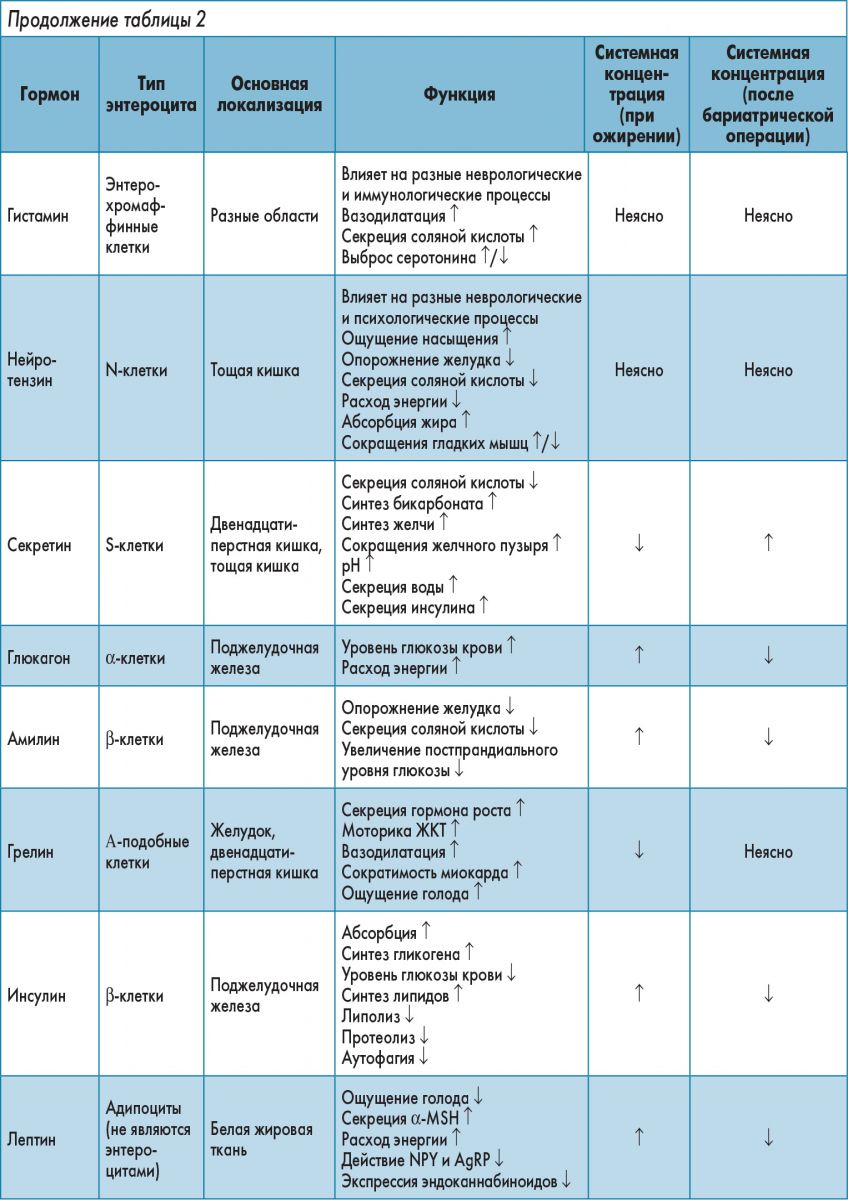
Далее рассмотрим роль гормонов кишечника в качестве контролеров приема пищи в отношении энергетического гомеостаза (табл. 2; Sakata, Sakai, 2010; Dimitriadis et al., 2011; Jones et al., 2012; Pan et al., 2014).
Холецистокинин
ССК – желудочно-кишечный гормон, связь которого с контролем аппетита установлена первой. Он секретируется эндокринными клетками в двенадцатиперстной и тощей кишке после приема пищи (Gibbs et al., 1973). Высвобождение CCK стимулируется потреблением жиров и белков, а его концентрация увеличивается в течение 15 мин после приема пищи (Lieverse et al., 1995; Buhmann et al., 2014). CCK имеет короткий период полураспада (в течение нескольких минут) и, следовательно, – ограниченное время воздействия на рецепторы CCK‑1 и CCK‑2, расположенные в тканях ЖКТ и ЦНС, например, в блуждающем нерве, NTS и гипоталамусе (Buhmann et al., 2014; Lo et al., 2014). CCK увеличивает моторику ЖКТ и желчного пузыря и их секрецию в дополнение к тому, что играет значительную роль в инициации контроля кишечно-мозговой осью потребления пищи, расхода энергии и использования глюкозы (Cheung et al., 2009; Suzuki et al., 2012). Периферическое введение CCK в ходе исследований на животных показывает его дозозависимый эффект относительно регуляции потребления пищи. Введение антагонистов рецепторов CCK‑1 в сочетании с потреблением жирных кислот и белков препятствует стимуляции афферентных волокон блуждающего нерва в тонкой кишке и регуляторному влиянию CCK на потребление пищи (Calingasan et al., 1992; Cox et al., 1996; Duca, Yue, 2014). Следовательно, CCK является специфическим медиатором насыщения жирами и белками. Дозы CCK, повторно попадающие в общий кровоток, и спонтанное всасывание CCK во время еды уменьшают количество потребляемой пищи. Впрочем, со временем толерантность организма к CCK повышается, а количество и частота приема пищи увеличиваются (Kopin et al., 1999; Buhmann et al., 2014). Этот десенсибилизирующий эффект может объяснить неудачные попытки использовать CCK-производные гормоны, такие как GI 181771X, для уменьшения массы тела (Castillo et al., 2004; Kim et al., 2011).
ССК оказывает влияние на обмен глюкозы – он увеличивает активацию блуждающего нерва, который, в свою очередь, индуцирует NDMA-нейроны NTS для проведения сигналов в печень для снижения глюконеогенеза (Rasmussen et al., 2012).
Глюкагоноподобный пептид‑1
GLP1 представляет собой нейропептид, продуцируемый преимущественно эндокринными клетками подвздошной и толстой кишки в ответ на потребление углеводов, липидов и/или белков (Elliott et al., 1993; Adam, Westerterp-Plantenga, 2005). Он синтезируется посредством посттрансляционного процессинга препроглюкагона в ЦНС и ЖКТ, а затем активирует рецепторы GLP1 (тип GPCR, экспрессируемый в ЦНС, ЖКТ и поджелудочной железе; Larsen et al., 1997; Yamato et al., 1997). Введение GLP1 стимулирует центры сытости в мозге, в частности дугообразные, паравентрикулярные ядра, NTS и AP, для уменьшения ощущения голода (Larsen et al., 1997; Abbott et al., 2005). Следовательно, GLP1 считается ключевым фактором, приводящим к насыщению. Он синтезируется и высвобождается в течение 15 мин после приема пищи. Это представляет особый интерес, если учитывать то, что кишечные L-клетки (эндокринные клетки, которые его выделяют) расположены дистально в подвздошной кишке (Elliott et al., 1993; Bauer et al., 2016).
GLP1 является мощным инкретином (гормоном, регулирующим уровень глюкозы в крови), который стимулирует рецептор GLP1 панкреатических β-клеток для высвобождения инсулина (Buhmann et al., 2014). Кроме того, повышенный уровень GLP1 увеличивает экспрессию гена фактора 1 промотора инсулина β-клеток поджелудочной железы, способствует их развитию и препятствует их апоптозу. В свою очередь, это активизирует процессы утилизации глюкозы в организме (Villanueva-Penacarrillo et al., 2001; Suzuki et al., 2012). Наконец, GLP1 уменьшает скорость опорожнения желудка в двенадцатиперстную кишку и препятствует секреции желудочного сока, что, в свою очередь, увеличивает желудочное растяжение, ограничивает чрезмерное потребление пищи, усиливает насыщение и оказывает положительное влияние на энергетический гомеостаз (Edwards et al., 1999).
Хотя GLP1 обеспечивает мощный эффект, его действие непродолжительно, поскольку GLP1 уязвим для быстрой деградации и инактивации посредством катализа дипептидилпептидазой IV (Deacon et al., 1995; Holst, 2007). Только 10% GLP1 из кишечника достигает системного кровообращения. Это указывает на то, что он передает свои эффекты паракринным образом (Vilsboll et al., 2003; Holst, 2007; Kuhre et al., 2015).
Пептид YY3-36
PYY – небольшой пептид, принадлежащий к семейству панкреатических пептидов, и, подобно GLP1, секретируемый кишечными L-клетками после приема пищи (Batterham et al., 2002, 2006). Он выделяется в ответ на выявление кишечником поступивших питательных веществ в объеме, соответствующем количеству потребляемой энергии (Oesch et al., 2006). PYY секретируется через 15 мин после приема пищи. По механизмам чувствительности к пище, находящейся в двенадцатиперстной кишке, регулирования активности блуждающего нерва и химических реакций он сходен с GLP1 (Fu-Cheng et al., 1997). В отличие от CCK и GLP1, концентрации которых быстро снижаются, уровень PYY остается повышенным в течение нескольких часов после еды (Batterham et al., 2003a). Следовательно, эффекты PYY могут быть пролонгированы и более выражены по сравнению с таковыми CCK и GLP1.
PYY присутствует на всем протяжении ЖКТ – от пищевода до прямой кишки (Adrian et al., 1985). PYY связывается с рецептором Y2 и уменьшает потребление пищи. Кроме того, PYY вызывает активацию нейронов NTS и ПOMК в дугообразном ядре и при периферическом, и при центральном введении, что указывает на наличие рецепторов Y2 в блуждающем нерве, NTS и дугообразном ядре (Batterham et al., 2002, 2006; Koda et al., 2005; le Roux et al., 2006). PYY оказывает свое действие, ингибируя нейроны NPY в дугообразном ядре. Поскольку эти нейроны в изобилии экспрессируют Y2-рецепторы, их активация препятствует действию повышающего аппетит NPY (Dryden et al., 1995; Broberger et al., 1997). Таким образом, PYY может играть ключевую роль в энергетическом гомеостазе, эндокринно регулируя потребление пищи и подавляя переедание посредством активации нейронов ПОМК и ингибирования NPY в меланокортиновой системе (Bauer et al., 2016). Кроме того, результаты некоторых исследований свидетельствуют, что пациенты с ожирением имеют более низкую концентрацию PYY после приема пищи. В других исследованиях было высказано предположение о большой разнице концентрации PYY натощак у лиц с нормальной массой тела и с ожирением (Batterham et al., 2003a; Korner et al., 2005; Stock et al., 2005). Увеличенные концентрации PYY, кроме длительной потери аппетита, связаны с желудочно-кишечными заболеваниями (воспалительные заболевания кишечника и хронический деструктивный панкреатит; (El-Salhy et al., 2013). Кроме того, устойчивые концентрации PYY и CCK у пожилых лиц сопровождаются задержкой опорожнения желудка и сниженной сократимостью желчного пузыря (Di Francesco et al., 2005; Buhmann et al., 2014). Механизм, лежащий в основе этого явления, остается неясным.
Панкреатический полипептид (РР) относится к семейству панкреатических пептидов и секретируется специализированными F-клетками в островках Лангерганса (Khandekar et al., 2015). Его выделение, как и PYY, пропорционально потреблению калорий – продукты с высоким содержанием жира стимулируют секрецию РР (Guyenet, Schwartz, 2012). Он выделяется системно до и во время приема пищи, механизм секреции сходен с таковыми GLP1 и PYY в связи с чувствительностью к пище в двенадцатиперстной кишке, химическим реакциям и активации волокон блуждающего нерва (Schwartz et al., 1978; Khandekar et al., 2015). Было продемонстрировано, что высокая концентрация РР поддерживается вплоть до 6 ч после приема пищи, что предполагает наличие эндокринного действия (Adrian et al., 1976). Кроме того, РР выделяется в толстой и прямой кишке быка, где он действует как гормон внешней секреции (Pyarokhil et al., 2012). Наличие этой функции у человека, впрочем, не было подтверждено.
PP действует на рецептор Y4 в AP, NTS и дугообразном ядре, одновременно индуцируя расслабление желчного пузыря и ингибируя секрецию поджелудочной железы. Поскольку он действует как антагонист CCK, его работа приводит к задержке опорожнения желудка, что приводит к быстрому насыщению и уменьшению потребления пищи (Parker, Herzog, 1999; Balasubramaniam et al., 2006; Lin et al., 2009). Роль PP в подавлении аппетита доказана результатами исследований, демонстрирующими различие концентраций РР у лиц в анорексическом состоянии и состоянии ожирения, когда концентрация увеличивается и уменьшается соответственно (Batterham et al., 2003b). Хотя РР является мощным ингибитором аппетита, в исследованиях, проведенных Clark и соавт. (1984), было показано, что центральное введение РР стимулировало аппетит и приводило к увеличению потребления пищи. Данные по этому вопросу противоречивы. Необходимы дальнейшие исследования, чтобы определить направления воздействия РР на аппетит. Более того, по данным исследований, у пациентов с синдромом Прадера – Вилли и ожирением уровень PP после приема пищи был снижен по сравнению с таковым у здоровых лиц контрольной группы. Внутривенное введение РР этим пациентам приводило к значительному снижению потребления пищи (Lassmann et al., 1980; Berntson et al., 1993). Кроме того, при использовании обинепитида (7TM Pharma) – мощного синтетического аналога PP и агониста рецептора Y4 – удалось достичь снижения как потребления пищи, так и массы тела (Davenport, Wright, 2014). Хотя использование обинепитида хорошо переносилось и побочные эффекты были минимальными, его испытания проводились только в течение 28 дней (Davenport, Wright, 2014). Следовательно, до того, как агонисты рецептора Y4 и препараты, полученные из РР, будут использованы для лечения пациентов с ожирением, необходимы дальнейшие исследования с целью уточнения их долгосрочных эффектов.
Оксинтомодулин
Оксинтомодулин – пептидный гормон, секретируемый в ответ на прием пищи. Как и GLP1, он синтезируется посредством посттрансляционной обработки препроглюкагонального пептида в эндокринных клетках кишечника и ЦНС (Cohen et al., 2003; Baggio et al., 2004; Habib et al., 2012). Его секреция происходит одновременно с GLP1 и PYY. Пик концентрации гормона достигается в течение 30 мин после приема пищи, после чего он быстро разрушается дипептидилпептидазой IV (Anini et al., 1999; Druce et al., 2009). Оксинтомодулин связывается с рецепторами GLP1 внутри ЖКТ, поджелудочной железы и дугообразного ядра, индуцируя снижение секреции соляной кислоты и потребления пищи (Baggio et al., 2004; Dakin et al., 2004; Pocai et al., 2009). Центральное и периферическое введение оксинтомодулина усиливает ощущение сытости. Гормон снижает потребление пищи, что видно на моделях грызунов и человека, а также увеличивает затраты энергии (Dakin et al., 2002, 2004; Cohen et al., 2003; Baggio et al., 2004; Wynne et al., 2005). Кроме того, оксинтомодулин связывается с рецепторами глюкагона в поджелудочной железе, снижает концентрацию глюкозы в крови и способствует утилизации глюкозы (Maida et al., 2008). Хотя известно, что оксинтомодулин связывается с рецептором GLP1 и высвобождается одновременно с GLP1, точный механизм инкретинового действия оксинтомодулина при его связывании с рецептором глюкагона неизвестен (Pocai et al., 2009; Pocai, 2014). Гормон может выступать антагонистом глюкагона и индуцировать инсулинотропный эффект через местный, паракринный эффект и/или может активировать высшие центры мозга через гипоталамус. Поскольку сообщалось, что оксинтомодулин увеличивает затраты энергии, он может также активировать катехоламинергические нейроны и/или нейроны ПОМК, а также повышать активность волокон блуждающего нерва, иннервирующих бурый жир, тем самым увеличивая термогенез (Dakin et al., 2002; Wynne et al., 2006; Pocai, 2014). Хотя эти гипотезы правдоподобны, необходимы дальнейшие исследования механизмов действия оксинтомодулина до того, как его аналоги можно будет использовать при лечении пациентов с ожирением.
Серотонин
Кишечный серотонин выделяется энтерохромаффинными клетками ЖКТ в ответ на прием пищи. Серотонин оказывает свой эффект, действуя локально и системно на разные рецепторы 5-НТ (семейство рецепторов 5-НТ 2 и рецептор 5-НТ 4, экспрессированные на афферентных волокнах блуждающего нерва и других нейронах внутри ЦНС, а также клетках ЖКТ, сердца и надпочечников; Halford, Harrold, 2012; Li et al., 2015; Stiedl et al., 2015). Аналоги серотонина, такие как лоркасерин, подавляют аппетит и уменьшают массу тела, а его антагонисты, напротив, увеличивают аппетит и массу тела (Halford et al., 1997; Savastano et al., 2007; Lam et al., 2008; Smith et al., 2010). Хотя серотонин уменьшает аппетит и способствует потере массы тела, действуя на ЦНС, обратные результаты были получены в эксперименте на животных: после перевода на западную диету у них развилось ожирение, концентрация серотонина при этом была повышенной (Crane et al., 2015). Кроме того, Crane и соавт. (2015) продемонстрировали, что ингибирование периферического синтеза серотонина препятствует развитию ожирения и метаболических нарушений. Это связано с тем, что серотонин ингибирует эффекты β-адренергических нейронов, иннервирующих бурую жировую ткань, и снижает термогенез. Аналоги серотонина были удалены с рынка из-за большого количества серьезных побочных эффектов, таких как психические расстройства, кардиотоксичность, наркомания и смерть (Onakpoya et al., 2016). Серотонин оказывает комплексное влияние на энергетический гомеостаз и пищевое поведение, оно требует более детального изучения и не будут рассмотрено в этой статье.
Эндоканнабиноидная система
Было показано, что биоактивные липиды эндоканнабиноидной системы, такие как анандамид, влияют на работу кишечно-мозговой оси. Эти молекулы синтезируются и секретируются в ЖКТ и действуют на эндоканнабиноидные рецепторы, в основном на каннабиноидные рецепторы 1 и 2 (CB1/CB2), которые являются GPCR-рецепторами в эндоканнабиноидной системе (Moran, Shanahan, 2014; Bauer et al., 2016). CB1 широко распространены в ЦНС и периферической нервной системе, имеются в печени, поджелудочной железе и жировой ткани, тогда как CB2 преимущественно экспрессируются иммунными клетками в мозге, поджелудочной железе и жировой ткани (Mackie, 2008). Эндоканнабиноидная система регулирует различные физиологические функции, такие как перистальтика кишечника и аппетит. Это представляет интерес, поскольку введение экзогенных каннабиноидов способствует развитию ожирения (Mackie, 2008; Moran, Shanahan, 2014). Изучение антагонистов CB1, таких как римонабант и тарабант, показало, что они индуцируют уменьшение массы тела у лиц с ожирением. Это подтверждает роль эндоканнабиоидной системы в регулировании аппетита (Christensen et al., 2007; Aronne et al., 2010; Cluny et al., 2011). Однако эти продукты были сняты с рынка, поскольку их применение приводило к тяжелым побочным эффектам, например, хронической депрессии (Aronne et al., 2010; Moran, Shanahan, 2014).
Расход энергии
Как было указано выше, ожирение развивается вследствие увеличения потребления пищи и снижения расхода энергии. Малоподвижный образ жизни и малые затраты энергии способствуют набору массы тела (Grima, Dixon, 2013). Расход энергии связан не только с физической активностью, но и с термогенезом и поддержанием базального уровня метаболизма, хотя физическая активность может влиять на оба эти параметра (Melanson, 2017). Данные различных исследований свидетельствуют о том, что уменьшение жировой массы может происходить и без увеличения физической активности. Это доказывает, что затраты энергии возможны без системных физических упражнений, путем конкретного вмешательства (Panchal et al., 2012, 2013; Owen Bryn et al., 2014). Эти исследования бросают вызов догме, согласно которой физическая ативность является золотым стандартом регулирования энергозатрат и, следовательно, потери жировой ткани (Melanson, 2017). Кроме того, увеличение популярности фитнес-центров во многих западноевропейских странах и типичная схема их посещения также указывают на то, что физическая активность приводит к увеличению потери жира только в сочетании с правильной диетой (Австралия, 2009). Следовательно, нейрогуморальные сигналы, полученные из кишечника через кишечно-мозговую ось, могут активировать энергорегулирующие центры мозга в ответ на потребление питательных веществ, модулируя расход энергии соответственно ее поступлению и тем самым способствуя благоприятному энергетическому балансу (Bauer et al., 2016).
Периферическое и центральное введение GLP1, оксинтомодулина и PYY приводит к увеличению затрат энергии за счет повышения термогенеза и скорости обмена веществ (Dakin et al., 2002; Blouet, Schwartz, 2012). Blouet и Schwartz (2012) показали, что присутствие липидов в кишечнике активирует афферентные волокна блуждающего нерва, усиливая термогенез в бурой жировой ткани через CCK-зависимый путь. Это может служить доказательством существования оси «кишечник – мозг – бурый жир». Увеличивается и количество исследований, в которых рассматривают вмешательство в работу этой оси для лечения ожирения (Blouet, Schwartz, 2012; Panchal et al., 2012, 2013; Brown et al., 2015). Например, поступление с пищей небольших доз капсаицина, который стимулирует активность кишечных афферентных волокон блуждающего нерва, увеличивает выработку кишечных гормонов и тонус симпатической нервной системы, а также активирует бурый жир, что повышает скорость обмена веществ и термогенез, в итоге приводя к снижению массы тела (Kawabata et al., 2009; Ludy et al., 2011; Ono et al., 2011; Abdel-Salam, 2014; Janssens et al., 2014). Исследование этой оси может помочь в лечении ожирения и связанных с ним сопутствующих заболеваний, открывая пути влияния на термогенез посредством терапии или диеты.
Кишечная микрофлора
Выявляют все больше доказательств того, что микрофлора кишечника может влиять на ожирение и увеличение массы тела через несколько взаимозависимых путей. К ним относятся получение энергии и последующее образование метаболитов (например, короткоцепочечных жирных кислот), модификация поведения хозяина и влияние на воспалительный ответ в его организме (Moran, Shanahan, 2014).
Организм человека населяют более 3,9×1013 бактерий, большинство из них находится внутри ЖКТ и составляет сложную экосистему, называемую микрофлорой кишечника (Sender et al., 2016a, b). Исторически соотношение числа микробных и человеческих клеток оценивалось как 10:1, хотя по данным последних исследований приводят соотношение 1,3:1 (Sender et al., 2016a, b). Эти микробы образуют сложную симбиотическую связь с организмом-хозяином, в которой последний обеспечивает питательную среду для микрофлоры, а микрофлора, в свою очередь, ответственна за метаболические, защитные и структурные функции, которые не кодируются геномом хозяина (Qin et al., 2010; Wang, Wang, 2016). Предполагается, что в микрофлору входит более 1000 видов бактерий, и их композиция изменяется на протяжении всей жизни. Это изменение зависит от широкого спектра факторов, например, диеты, использования антибиотиков, перенесенных болезней и даже механизма родов (Qin et al., 2010). Следовательно, состав микробиоты не статичен, а претерпевает динамические изменения.
De Filippo и соавт. (2010) сравнили и охарактеризовали различия между здоровыми детьми, придерживающимися западной и сельской диеты, и выявили четкую связь между составом микрофлоры и потребляемыми пищевыми продуктами. Хотя De Filippo и соавт. исследовали детей из Италии, исследование не предусматривало, что эти дети могли соблюдать средиземноморскую диету, которая считается золотым стандартом здорового питания (Sanchez-Villegas et al., 2016). Ясно то, что существуют различия между двумя культурами, потребляемой пищей и, следовательно, составом микрофлоры. Это исследование, как и другие, показало, что западная диета и развитие ожирения связаны с повышенным количеством бактерий типа Firmicutes по отношению к количеству бактерий типа Bacteroidetes. Это соотношение изменяется в противоположную сторону при хирургических и диетических вмешательствах (Ley et al., 2006; Turnbaugh et al., 2009; De Filippo et al., 2010; Furet et al., 2010). Возможность использования отношения Firmicute/Bacertoidetes для определения фенотипа ожирения активно обсуждается, поскольку в более поздних исследованиях эта гипотеза не подтверждена (Zhang et al., 2009; Schwiertz et al., 2010; Finucane et al., 2014). Различия на уровне рода и вида бактерий по сравнению с уровнем отдела могут быть связаны с изменениями в метаболизме (Bauer et al., 2016).
Короткоцепочечные жирные кислоты, захват энергии и улавливание нутриентов
Приблизительно 60 г углеводов, потребляемых ежедневно в составе типичной западной диеты, не перевариваются. Микрофлора кишечника имеет специфические гликозидгидролазы, что позволяет ей ферментировать и гидролизировать неусвояемые полисахариды и вырабатывать короткоцепочечные жирные кислоты (КЖК) в виде метаболита в дистальной ободочной кишке (Moran, Shanahan, 2014). Эта функция и последующая продукция КЖК обеспечивают приблизительно 10% ежедневной потребности хозяина в энергии (Schwiertz et al., 2010). Бутират, пропионат и ацетат составляют 95% биологически значимых КЖК (Bauer et al., 2016). Клетки кишечника используют в качестве первичного источника энергии бутират, печень – пропионат в глюконеогенезе после того, как он попал в портальную циркуляцию, а ацетат систематически циркулирует по разным периферическим тканям (Gao et al., 2009; Bauer et al., 2016). Продукция бутирата обычно приписывается Firmicutes, в то время как синтез пропионата обычно связан с Bacteroidetes (Moran, Shanahan, 2014). У людей с ожирением фекалии содержат повышенное количество КЖК, в частности пропионата (Schwiertz et al., 2010). Предполагается, что это связано с изменением состава микрофлоры, а не с различными типами диеты и/или всасыванием КЖК в толстой кишке (Schwiertz et al., 2010; Rahat-Rozenbloom et al., 2014). Rahat-Rozenbloom и соавт. (2014) сообщили о превосходстве представленности Firmicutes над Bacteroidetes в группе лиц с избыточной массой тела, что должно соответствовать увеличению продукции бутирата, а не пропионата. Это значит, что для определения различий между худыми людьми и людьми с ожирением, а также для установления причины увеличения содержания КЖК в кале требуются дополнительные исследования. С учетом того, что диета с высоким содержанием жиров и высоким содержанием углеводов является одним из предрасполагающих факторов развития колоректального рака, дополнительный интерес вызывает тот факт, что КЖК оказывают онкопротективный эффект (Bindels et al., 2012; Grima, Dixon, 2013; Irrazabal et al., 2014). Определение роли КЖК в развитии колоректального рака при ожирении может стать объектом дальнейших исследований.
КЖК также помогают регулировать массу тела, так как введение пребиотиков, неусвояемых полисахаридов и КЖК в кожу и кишечник способствует улучшению метаболического состояния, снижению потребления пищи и массы тела (Pan et al., 2009; Bomhof et al., 2014). Это происходит, поскольку пребиотики и добавки способствуют росту и активности полезных бактерий, в то время как введение КЖК активирует сигнальные пути, увеличивая синтез гастроинтестинальных гормонов (Pan et al., 2009; Lin et al., 2012; Bomhof et al., 2014). Следовательно, КЖК можно рассматривать как ключевые эндогенные сигнальные молекулы. КЖК связывают и активируют свободные рецепторы жирных кислот 2 и 3 (FFAR2/FFAR3), которые являются GPCR-рецепторами, расположенными по всему ЖКТ, в клетках иммунной системы, печени и жировой ткани (Kasubuchi et al., 2015). Эти рецепторы экспрессируются в эндокринных клетках кишечника, в частности L-клетках (Kasubuchi et al., 2015). После связывания с данными рецепторами в L-клетки поступает сигнал о синтезе и высвобождении гормонов кишечника, таких как GLP1 и PYY (табл. 2). Эти результаты подтверждаются исследованиями in vivo и in vitro: в культурах клеток и у мышей, лишенных FFAR2 и FFAR3, нарушается высвобождение GLP1 и PYY даже при инфузии КЖК (Tolhurst et al., 2012). Кроме того, FFAR3 преимущественно экспрессируются в периферической нервной системе, в частности, ЭНС и ВНС (Nohr et al., 2015). Активация этих рецепторов в симпатической ветви ВНС регулирует механизмы запасания жировой ткани и влияет на расходование энергии, воздействуя на потребление глюкозы тканями мышц и печени (Moran, Shanahan, 2014; Nohr et al., 2015). Хотя точный механизм этого явления еще предстоит выяснить, имеющиеся данные указывают на то, что синтез КЖК микрофлорой оказывает сигнальное и стимулирующее влияние на кишечно-мозговую ось.
Пребиотики (например, олигофруктоза) увеличивают чувствительность кишечника к поступлению питательных веществ, что приводит к улучшению барьерной функции, потере массы тела и уменьшению потребления пищи (Bauer et al., 2016). Было высказано предположение, что эти эффекты обусловлены изменениями микрофлоры кишечника. Исследования показали, что у лиц с ожирением уменьшено количество отдельных типов бактерий и пептидов. Это было использовано в попытке восстановить число этих бактерий и увеличить уровень циркулирующих гастроинтестинальных гормонов (Bauer et al., 2016). Назначение пребиотиков способствует увеличению количества Akkermansia muciniphilia, Faecalibacterium prausnitzii, Bifidobacterium и Lactobacilli, что, в свою очередь, ассоциировано с улучшением барьерной функции кишечника путем воздействия на опосредованный глюкозой пептид 2 (GLP2) и стимуляции эндоканнабиноидной сигнальной системы (Cani et al., 2009; Dewulf et al., 2012). GLP2 секретируется совместно с GLP1, и его высвобождение положительно связано с ростом и функционированием кишечной ткани (увеличение высоты ворсинок, глубины крипт и скорости пролиферации их клеток, а также уменьшение смерти энтероцитов; Rowland et al., 2011). Кроме того, применение пребиотиков было связано с улучшенной дифференциацией эндокринных клеток кишечника и увеличением концентраций GLP1, GIP и PYY, которые усиливают ощущение насыщения, уменьшают потребление пищи и содержание жира (Cani et al., 2005; Neyrinck et al., 2012). Несмотря на то что необходимы дополнительные исследования для подтверждения связи между изменением состава микрофлоры кишечника и образованием гастроинтестинальных гормонов, имеются данные о том, что микрофлора может влиять на чувствительность к поступлению питательных веществ в ЖКТ, продуцирование гормонов кишечника и стимуляцию кишечно-мозговой оси.
Микрофлора кишечника также может быть связана с жировой тканью через эндоканнабиноидную систему. На различных моделях у мышей было продемонстрировано, что периферическая эндоканнабиноидная система в кишечных и жировых тканях, принимающая участие в регуляции барьерной функции кишечника и адипогенеза, регулируется кишечной микрофлорой (Muccioli et al., 2010). Введение пребиотиков для увеличения количества Bifidobacterium у мышей с ожирением вызывает снижение экспрессии CB1 толстой кишки и концентрации анандамида дополнительно к экспрессии жирно-кислотной амидной гидролазы (FAAH; Muccioli et al., 2010; Moran, Shanahan, 2014). FAAH является основным ферментом, ответственным за распад анандамида. Уменьшение содержания этих факторов в толстой кишке, а также увеличение экспрессии FAAH предполагает, что микрофлора кишечника может избирательно модулировать рецепторы CB1 толстой кишки, которые впоследствии регулируют активность эндоканнабиноидов (Muccioli et al., 2010). Необходимы дополнительные исследования для подтверждения этих данных и уточнения того, как микрофлора может влиять на эндоканнабиноидную систему и ее активность, связанную с ожирением. Усиление влияния этих факторов в толстой кишке может быть обусловлено увеличением концентрации гастроинтестинальных гормонов, а не составом микрофлоры напрямую. Возможно также, что микрофлора стимулирует сигнализацию посредством гормонов кишечника, чтобы повлиять на эндоканнабиноидную систему путем стимуляции афферентных рецепторов блуждающего нерва. Выявление задействованного механизма может предоставить дополнительную информацию о том, как кишечно-мозговая ось и микрофлора связаны с регулированием энергии.
Липополисахарид, воспаление и интеграция микрофлоры в работу кишечно-мозговой оси
Ожирение считается воспалительным состоянием, поскольку оно характеризуется наличием хронического неспецифического воспаления. Недавно было обнаружено, что высококалорийная западная диета, приводящая к ожирению и другим связанным с ним заболеваниям (табл. 1), способствует повышению системных концентраций липополисахарида (ЛПС; Cani et al., 2007; de La Serre et al., 2010). ЛПС является провоспалительным компонентом в клеточной стенке грамотрицательных бактерий. Считается, что ЛПС проникает в системный кровоток через эпителий кишечника, скомпрометированный ожирением и диетой, богатой жирами. Предполагается, что этот процесс, названный метаболической эндотоксемией, происходит из-за неблагоприятного изменения состава микрофлоры кишечника. Из-за этого просвет в плотных контактах, образованных кишечным эпителием, увеличивается, а значит, увеличивается и проницаемость кишечной стенки (рис. 3; Cani et al., 2007; de La Serre et al., 2010). Попадание ЛПС в кровоток инициирует каскад провоспалительных событий во всем организме-хозяине, особенно в белой жировой ткани.
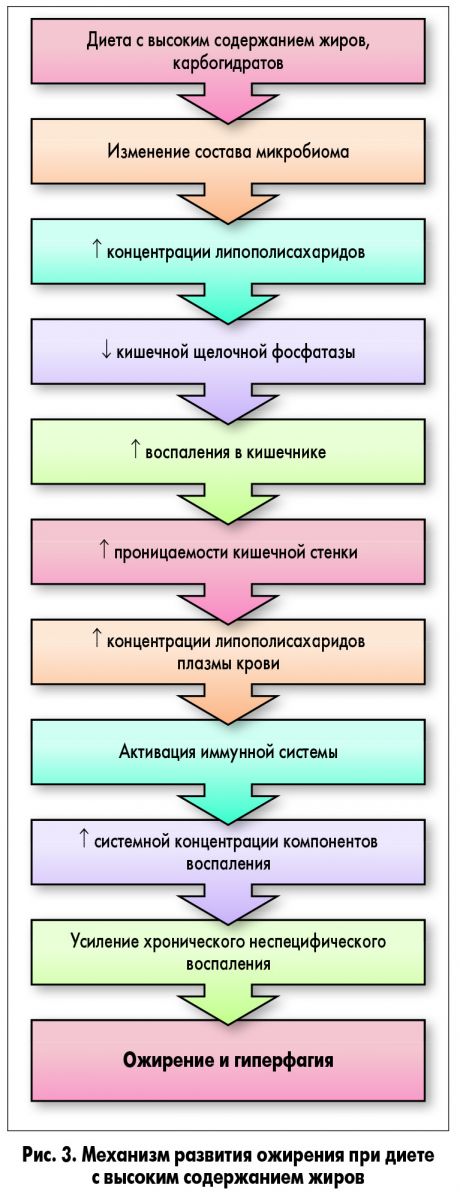 ЛПС оказывает мощное стимулирующее воздействие на толл-подобные рецепторы 4 (TLR4), активация которых приводит к синтезу воспалительных цитокинов и последующей активации врожденного иммунитета (Vaure, Liu, 2014). Caesar и соавт. (2015) сообщали об увеличении системной концентрации ЛПС, активации TLR4 и воспалении белой жировой ткани, а также снижении чувствительности к инсулину и изменениях состава микрофлоры кишечника у мышей, рацион которых соответствовал западной диете.
ЛПС оказывает мощное стимулирующее воздействие на толл-подобные рецепторы 4 (TLR4), активация которых приводит к синтезу воспалительных цитокинов и последующей активации врожденного иммунитета (Vaure, Liu, 2014). Caesar и соавт. (2015) сообщали об увеличении системной концентрации ЛПС, активации TLR4 и воспалении белой жировой ткани, а также снижении чувствительности к инсулину и изменениях состава микрофлоры кишечника у мышей, рацион которых соответствовал западной диете.
ЛПС подавляет активность интерстициальных клеток Кахаля, которые выступают в роли пейсмейкеров, регулирующих перистальтику кишечника и работу ЭНС (Zuo et al., 2013; Bauer et al., 2016). Ингибирование этих клеток приводит к нарушению моторики ЖКТ, изменяя частоту высвобождения нейромедиаторов внутри ЭНС, что может влиять на секрецию гастроинтестинальных гормонов и, следовательно, ослаблять связь микрофлоры кишечника с сигнальными механизмами кишечно-мозговой оси (Zuo et al., 2013). Для подтверждения этой гипотезы необходимы дальнейшие исследования, поскольку механизмы, связывающие этот участок периферической нервной системы с ЦНС и кишечно-мозговой осью, неизвестны. Возможность восстановления функции интерстициальных клеток Кахаля путем увеличения концентрации щелочной фосфатазы для снижения образования ЛПС могла бы способствовать уменьшению частоты развития воспалительных заболеваний кишечника, связанных с ожирением.
Микрофлора кишечника может напрямую влиять на сигнальные механизмы в ЦНС. Хотя механизм влияния на регуляцию энергетического гомеостаза в ЦНС неясен, очевидно что микрофлора может воздействовать на развитие стресса и тревожности (Bauer et al., 2016).Можно предположить, что патогенные бактерии, количество которых увеличивается при стрессе и питании с высоким содержанием жиров, высвобождают ЛПС, активирующий TLR4 в афферентных волокнах блуждающего нерва. Тем самым в гипоталамус и другие центры головного мозга посылается сигнал, активирующий соответствующее поведение. Впрочем, для подтверждения этой гипотезы необходимы дальнейшие исследования.
Использование добавки Lactobacillus rhamnosus CGMCC1.3724 способствовало уменьшению количества жира у женщин с ожирением, а также снижению концентрации лептина и относительной численности Lachnospiraceae, семейства Firmicutes (Sanchez et al., 2014). Эти результаты были воспроизведены в более позднем исследовании с использованием того же пробиотика (способствовало усилению ощущения сытости, повышению самооценки пациентов, снижению тяги к пище и уменьшению выраженности депрессии; Sanchez et al., 2017). Кроме того, непатогенные бактерии, такие как Lactobacillus lactis, также могут стимулировать блуждающий нерв, и эта стимуляция усиливает активность симпатической нервной системы. Субдиафрагмальная ваготомия в присутствии Lactobacillus lactis ослабляет этот эффект (Tanida et al., 2005; Forsythe, Kunze, 2013). Механизмы активации блуждающего нерва непатогенной флорой представляют собой дополнительный уровень взаимодействия микрофлоры и кишечно-мозговой оси и требуют уточнения.
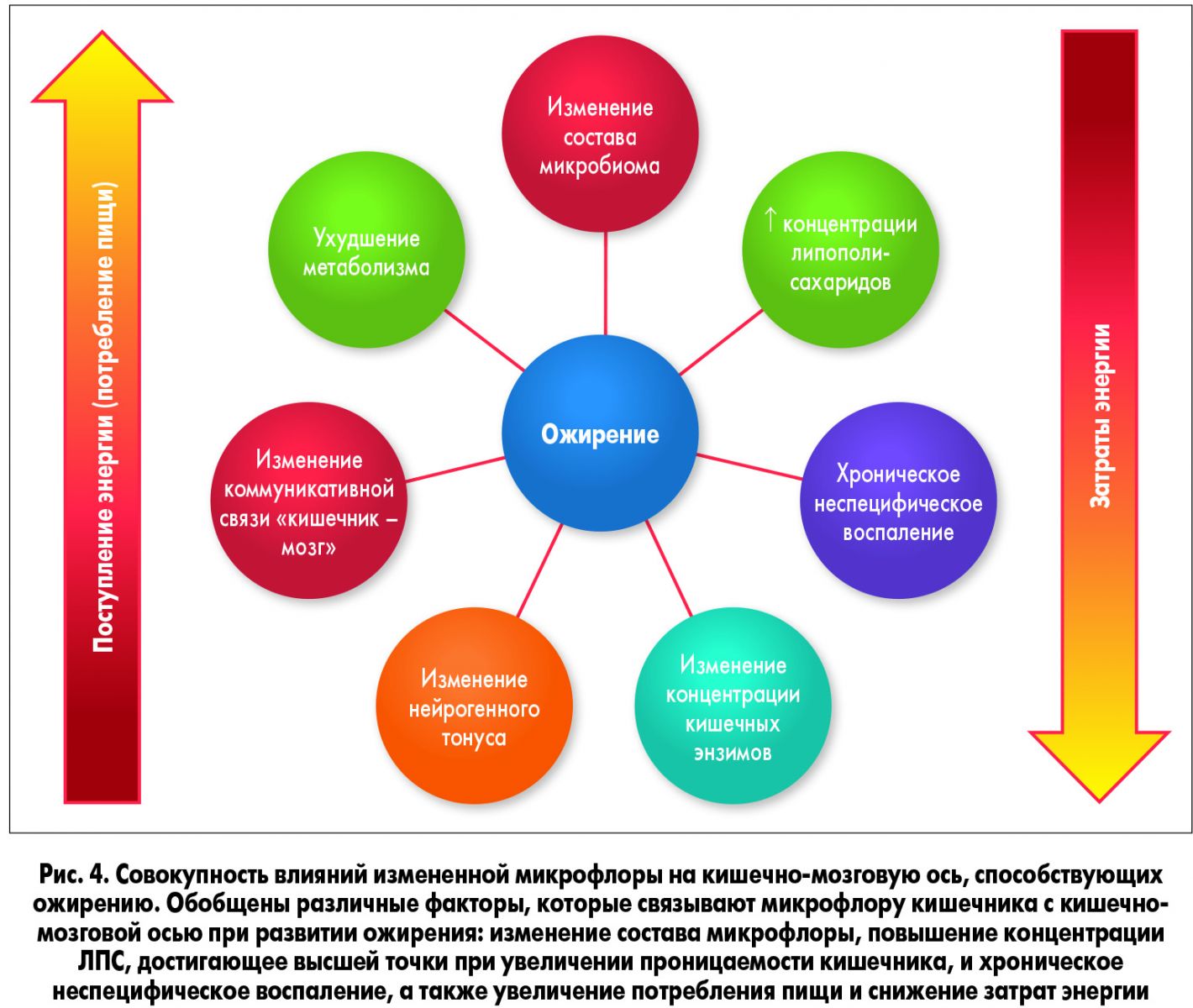
Становится все более очевидным, что микрофлора кишечника влияет на функции ЦНС, связанные с регуляцией энергетического гомеостаза. Backhed и соавт. (2004) продемонстрировали, что мыши, лишенные микробиоты, устойчивы к ожирению, несмотря на увеличение количества потребляемой пищи. Это свидетельствует о том, что микрофлора прямо или косвенно влияет на ЦНС. В будущем следует изучить вопрос о том, какие именно манипуляции над микрофлорой кишечника могут влиять на ЦНС и ее роль в регулировании энергетического гомеостаза и развитии ожирения. Кроме того, поскольку изменение концентрации гастроинтестинальных гормонов связано с изменениями высших нервных проявлений, дальнейшие исследования могут быть посвящены влиянию микрофлоры на местные и центральные сигнальные механизмы и его связи с регулированием энергетического обмена через кишечно-мозговую ось (рис. 4; Forsythe, Kunze, 2013).
Заключение
Ожирение – это глобальная эпидемия, представляющая социально-экономическую проблему для систем здравоохранения разных государств. Имеющиеся данные свидетельствуют о том, что ожидаемая продолжительность жизни будет снижаться по мере того, как уровень ожирения будет расти и станет неконтролируемым (Olshansky et al., 2005; Grima, Dixon, 2013). Сейчас количество эффективных методов лечения ожирения ограничено изменениями образа жизни и диеты, а также хирургическими и фармакологическими методами, которые приводят к нежелательным побочным эффектам из-за недостаточного понимания механизмов, лежащих в основе этой патологии (Bauer et al., 2016). Сейчас наиболее действенным вариантом лечения является хирургическое вмешательство (например, шунтирование желудка), но механизмы, обусловливающие успех таких операций, недостаточно изучены (Grima, Dixon, 2013). Тем не менее анализ изменений концентрации гастроинтестинальных гормонов, иннервации и состава микрофлоры кишечника (т.е. компонентов оси «кишечник – мозг – микрофлора») после операции, а также анализ причин этих изменений может помочь в разработке новых стратегий лечения. Учитывая, что хирургическое вмешательство может увеличить популяцию эндокринных клеток кишечника, способствуя тем самым увеличению продукции пептидов и улучшению нейрональной коммуникации, а также повышению секреции гормонов после приема пищи, необходимо максимально подробно изучить все аспекты кишечно-мозговой оси (Mumphrey et al., 2013; Bauer et al., 2016). Увеличение энергозатрат за счет активации симпатических ветвей ВНС и оси «кишечник – мозг – бурая жировая ткань» в дополнение к работе нейрогуморальной системы может быть эффективным методом регулирования энергетического баланса. Необходимы и исследования роли внутренностного нерва и других соматосенсорных путей, которые дадут возможность понять роль этих волокон в пределах кишечно-мозговой оси, особенно учитывая их присутствие на всем протяжении ЖКТ. Изучение механизмов, связанных с этой осью и вспомогательными нейронными путями, а также интеграция полученной информации в уже имеющуюся систему знаний представляет сложную задачу, но может лечь в основу новых стратегий борьбы с ожирением.
Воздействие на микробиом кишечника может стать новой терапевтической стратегией в борьбе с ожирением и сопутствующими заболеваниями (Bauer et al., 2016). Быстрые и стойкие изменения в микрофлоре кишечника сопровождаются улучшением метаболических параметров после операции (Liou et al., 2013; Osto et al., 2013). Кроме того, исследования, в которых стерильным мышам произвели трансплантацию микрофлоры кишечника мышей после операции, продемонстрировали, что у первых уменьшилась степень ожирения и увеличился расход энергии, что было связано с изменением продукции КЖК и/или уменьшением концентрации ЛПС (Liou et al., 2013; Casselbrant et al., 2015). Хотя влияние на состав микробиоты может стать новым направлением в лечении ожирения, для изучения идеального состава микрофлоры у здорового индивида требуются дополнительные исследования. Использование пребиотиков и пробиотиков предоставило возможность более детально изучить роль микробиоты в функционировании кишечно-мозговой оси и развитии ожирения. Впрочем, время, необходимое для развития благоприятных изменений, все еще не установлено. Учитывая, что современный образ жизни делает акцент на удобство и динамичность, данный тип лечения может оказаться непопулярным, если он не приведет к быстрому результату. Многообещающие результаты также были получены при применении капсул, содержащих идеальную композицию микробиоты, а также при трансплантации фекальной микробиоты как у крыс, так и у добровольцев. Но эффективность этого варианта лечения может быть ограничена из-за психологических факторов. Для повышения комплаентности и, следовательно, эффективности лечения необходимо проведение программ, направленных на просвещение и укрепление здоровья населения. Эти программы могут также способствовать «закреплению» здорового образа жизни и вследствие этого – формированию здоровой микробиоты.
Хотя пока что имеется лишь зачаточное понимание сложных взаимодействий оси «кишечник – мозг – микрофлора» и ожирения, исследований в этой сфере появляется все больше, и она предоставляет перспективное поле для разработки методов лечения. Появляющиеся факты должны дополнять, а не заменять исследования относительно образа жизни и психологических факторов, связанных с ожирением. В совокупности они способствуют увеличению приверженности пациентов к лечению и улучшению исхода борьбы с эпидемией ожирения.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6052131/ Front Physiol. 2018; 9: 900; doi: HYPERLINK “https://dx.doi.org/10.3389%2Ffphys.2018.00900” \
t “pmc_ext” 10.3389/fphys.2018.00900.
Лечащий врач, 2018 г.; https://www.lvrach.ru/2046/foreign_articles/15437162.
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (48) грудень 2019 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
За визначенням Всесвітньої організації охорони здоров’я, цукровий діабет (ЦД) – це група метаболічних розладів, що характеризуються гіперглікемією, яка є наслідком дефектів секреції інсуліну, дії інсуліну або обох цих чинників. За останні 15 років поширеність діабету зросла в усьому світі (Guariguata et al., 2014). Згідно з даними Diabetes Atlas (IDF), глобальна поширеність діабету серед осіб віком 20-79 років становила 10,5% (536,6 млн у 2021 році; очікується, що вона зросте до 12,2% (783,2 млн у 2045 році (Sun et al., 2022). Наразі триває Програма профілактики діабету (ППД), метою якої є визначити, які підходи до зниження інсулінорезистентності (ІР) можуть допомогти в створенні профілактичних заходів ЦД 2 типу (The Diabetes Prevention Program (DPP), 2002). У цьому світлі визначення впливу вітаміну D на розвиток ЦД є актуальним питанням....
Внутрішній біологічний годинник людини тісно та двоспрямовано пов’язаний зі стресовою системою. Критична втрата гармонійного часового порядку на різних рівнях організації може вплинути на фундаментальні властивості нейроендокринної, імунної та вегетативної систем, що спричиняє порушення біоповедінкових адаптаційних механізмів із підвищеною чутливістю до стресу й уразливості. Поєднання декількох хвороб зумовлює двоспрямованість патофізіологічних змін....
Метформін – протидіабетичний препарат першої лінії, який пригнічує глюконеогенез у печінці і в такий спосіб знижує рівні глюкози в крові. Крім того, він знижує ризик кардіоваскулярних подій, чинить нефропротекторний ефект і здатен подовжувати тривалість життя. Завдяки цим властивостям метформін нині розглядають як мультифункціональний препарат і дедалі частіше застосовують для лікування та профілактики різноманітних захворювань....
Сучасне лікування хворих на цукровий діабет (ЦД) 2 типу включає зміну способу життя і медикаментозну терапію для контролю глікемії та профілактики ускладнень. Проте дослідження показують, що на практиці небагато хворих досягають контролю захворювання (частково через погану прихильність до лікування). Частка пацієнтів, які дотримуються протидіабетичної терапії, коливається від 33 до 93% (упродовж 6-24 міс) [1, 2]....