Гранулематоз с полиангиитом (гранулематоз Вегенера): клинические наблюдения
 В.К. Гаврисюк, д.м.н., профессор, А.В. Литвиненко, к.м.н., ГУ «Национальный институт фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины», г. Киев
В.К. Гаврисюк, д.м.н., профессор, А.В. Литвиненко, к.м.н., ГУ «Национальный институт фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины», г. Киев
Вопросы лечения больных гранулематозом с полиангиитом (ГПА) относятся к сфере компетенции ревматологов. Вместе с тем клиническая семиотика ГПА обусловлена поражением верхних дыхательных путей, трахеи, бронхов и паренхимы легких, в связи с чем больные обычно направляются для обследования к отоларингологам и пульмонологам. Таким образом, проблема своевременной диагностики ГПА имеет мультидисциплинарный характер.
В последние годы отмечается рост заболеваемости системными патологиями соединительной ткани, в том числе системными васкулитами. На долю первичных системных некротизирующих васкулитов приходится от 0,4 до 14 и более случаев на 100 тыс. населения в год. Патологические изменения в легких описаны при любом типе васкулита, однако в ряде случаев они доминируют в клинической картине, являясь одним из диагностических критериев. Примером такого системного васкулита с облигатным вовлечением в патологический процесс органов дыхательной системы является гранулематоз Вегенера.
Гранулематоз Вегенера – системный васкулит, для которого характерным является гранулематозное воспаление респираторного тракта и некротизирующий васкулит, поражающий мелкие и средние сосуды (артерии, артериолы, капилляры, венулы) и, как правило, сочетающийся с некротизирующим гломерулонефритом. В дальнейшем в патологический процесс могут вовлекаться другие органы и системы: органы зрения, центральная нервная система, желудочно-кишечный тракт и т.д.
Первое наблюдение заболевания относится к 1897 г. и принадлежит шотландскому отоларингологу P. McBride, опубликовавшему свои наблюдения в статье Photographs of a case of rapid destruction of the nose and face. В дальнейшем случай гранулематоза Вегенера описал H. Klinger в 1931 г., который наблюдал 70-летнего врача с нефритом, артритом и длительным анамнезом хронического риносинусита. При аутопсии были выявлены инвазия некротизирующего очага в основании черепа около глаз, а также изъязвление трахеи, разрушение носовой перегородки. Гистологически определялся васкулит с формированием гранулем. Описанный случай был расценен H. Klinger как форма узелкового полиартериита.
F. Wegener, работавший патологом в г. Бреслау (Германия), был первым, кто расценил заболевание, впоследствии названное его именем, как самостоятельную нозологическую форму. Всего F. Wegener описал семь случаев васкулита мелких сосудов с гранулематозным воспалением. Первые наблюдения опубликованы в 1936 г. В том же году на заседании Немецкого общества патологов был сделан доклад On generalised septic vessel disease. В 1954 г. американские врачи G.C. Godman и J. Churg выделили триаду патологических признаков, включающих системный некротизирующий васкулит, некротизирующее гранулематозное воспаление дыхательных путей и некротизирующий гломерулонефрит. Ими было описано 22 случая данного заболевания и предложено назвать его гранулематозом Вегенера в честь первого автора, выделившего эту патологию в отдельную нозологическую единицу. В последние годы Американская коллегия ревматологов, Европейская антиревматическая лига, а также Американское общество нефрологов рекомендуют вместо эпонимического названия использовать термин «гранулематоз с полиангиитом», который в настоящее время все чаще встречается в медицинской литературе.
Традиционно ГПА считается редким заболеванием, распространенность которого в США составляет 25-60 случаев, а заболеваемость – 3-12 случаев на 1 млн населения. Однако за последние 30 лет отмечено увеличение заболеваемости в 4 раза. Сравнительно недавно проведенные эпидемиологические исследования показали диспропорции в распространенности и частоте новых случаев ГПА в зависимости от географической широты. Так, данные, полученные в европейских странах, показывают меньшую частоту ежегодной регистрации новых случаев на юге Европы, в Испании (4,9 случая на 1 млн населения в год) по сравнению с аналогичными показателями в северных странах – Великобритании (10,6 случая на 1 млн населения в год) и Норвегии (10,5 случая на 1 млн населения). Дебют заболевания возможен в любом возрасте, но чаще – в 40-65 лет, крайне редко данная патология встречается в детском возрасте. В европейской популяции заболевание встречается в 1,5 раза чаще у мужчин.
Несмотря на многолетнее изучение этого заболевания, этиология ГПА остается неизвестной. В таких ситуациях в медицине, как правило, принято говорить о вероятной мультифакторной природе болезни, подразумевая, что заболевание развивается в результате критического сочетанного воздействия нескольких факторов: воздействия антигена(-ов) одного или нескольких микроорганизмов или иммуногенных химических субстанций в условиях неблагоприятного гормонального фона и возможной генетической предрасположенности. Типичное начало болезни с поражения верхних дыхательных путей, придаточных пазух носа, среднего уха, гортани и легких подтверждают гипотезу об этиологической роли респираторных патогенов, что побуждает исследователей к поиску конкретного инфекционного агента. На этом фоне привлекают внимание сообщения голландских авторов о возможном значении инфицированности слизистой оболочки полости носа золотистым стафилококком (Staphylococcus aureus) в качестве фактора риска рецидивирующего течения ГПА. Однако признать этот микроорганизм этиологическим фактором болезни сложно, учитывая постоянное его присутствие в так называемом микробном пейзаже здоровой кожи человека и, напротив, непостоянное выявление в полости носа у больных.
ГПА относится к некротизирующим васкулитам с поражением сосудов малого и среднего калибра и образованием гранулем с большим количеством гигантских многоядерных клеток как в стенке сосуда, так и в окружающих тканях. B патогенезе ведущее место отводится образованию антинейтрофильных цитоплазматических антител (АНЦА) с последующим развитием опосредованного нейтрофилами повреждения эндотелиальных клеток. Термином «АНЦА» обозначают аутоантитела, специфичные по отношению к протеинам, находящимся внутри цитоплазматических гранул нейтрофилов и лизосом моноцитов. Методом непрямой иммунофлюоресценции при исследовании фиксированных спиртом человеческих нейтрофилов были выявлены три типа свечения: цитоплазматический (цАНЦА), перинуклеарный (пАНЦА) и гомогенный (аАНЦА). Первый тип антител оказался специфичным в отношении протеиназы-3 (ПР3), второй тип – миелопероксидазы (МПО). Гомогенный тип свечения характеризует так называемые атипичные АНЦА, значение которых остается неясным до настоящего времени. В ходе взаимодействия АНЦА с цитоплазматическими антигенами ПР3 и МПО нейтрофилов индуцируется адгезия последних к стенке сосудов, а также их дегрануляция с образованием свободных кислородных радикалов, токсических гранулярных продуктов и активацией каскадных воспалительных систем. При гранулематозе с полиангиитом в качестве антигенов для АНЦА выступает сериновая ПР3 (ПР3-цАНЦА). Также в группу АНЦА-васкулитов входят микроскопический полиангиит и эозинофильный гранулематоз с полиангиитом (Чердж-Стросса), при которых преимущественно определяются антитела к МПО (МПО-АНЦА). У пациентов с ГПА в активной фазе ПР3-цАНЦА выявляется в 80-90% случаев. Согласно материалам международного соглашения по определению и оценке результатов тестирования АНЦА при определении АНЦА у всех пациентов следует применять метод иммунофлюоресценции (ИФ). АНЦА-положительные сыворотки необходимо повторно тестировать методом ELISA на предмет ПР3 или МПО-АНЦА. Метод ELISA следует применять во всех случаях, так как приблизительно 5% АНЦА-положительных сывороток являются положительными только при использовании этого метода, а не метода ИФ. Специфичность АНЦА для ГПА колеблется от 88 до 100%, а чувствительность зависит от активности, распространенности патологического процесса, формы заболевания и варьирует от 28-50% в начальной фазе болезни до 92% у пациентов с генерализованным васкулитом. Повышение титра АНЦА у больных в стадии ремиссии – фактор риска обострения, а динамика их титра на фоне цитотоксической терапии позволяет дифференцировать обострение самого заболевания от интеркуррентной инфекции. Определение АНЦА в качестве скринингового теста позволяет увеличить выявляемость гранулематоза Вегенера, особенно в ранней стадии болезни, у больных с лимитированной и атипичной формами заболевания или перекрестными ангиитными синдромами.
Диагноз ГПА (гранулематоза Вегенера) устанавливают с использованием классификационных критериев Американской коллегии ревматологов (1990):
• воспаление носа и полости рта: язвы в полости рта, гнойные и/или кровянистые выделения из носа;
• изменения в легких при рентгенологическом исследовании: узелки, инфильтраты или полости в легких;
• изменения мочи: микрогематурия (>5 эритроцитов в поле зрения) или скопления эритроцитов в осадке мочи;
• биопсия: гранулематозное воспаление в стенке артерии или в периваскулярном и экстравазальном пространстве.
Наличие у больного двух и более критериев позволяет поставить диагноз с чувствительностью 88% и специфичностью 92%.
Для классической картины ГПА характерна триада признаков: поражение верхних дыхательных путей, легких и почек. Однако первые проявления заболевания разнообразны. Как правило, диагноз устанавливается достаточно поздно, что объясняется отсутствием специфических признаков на начальных этапах болезни. Чаще заболевание начинается постепенно, у 90% больных в дебюте наблюдается поражение верхних дыхательных путей в виде хронического риносинусита в сочетании с неспецифическими симптомами, такими как субфебрилитет, снижение массы тела, слабость, утомляемость, миалгии и артралгии. На начальной стадии заболевания больные жалуются на заложенность носа, сухость и скудные слизистые выделения, которые в скором времени становятся гнойными, а затем появляется примесь крови. У некоторых пациентов с грануляциями в носовой полости и разрушением носовой перегородки наблюдаются носовые кровотечения. Одним из характерных симптомов ГПА является образование гнойно-кровянистых корок буро-коричневой окраски. Удаляются они в виде слепков, при этом слизистая истончается и приобретает синюшно-красный цвет, а местами наблюдается некротизация тканей. С развитием воспалительного процесса количество корок увеличивается, и они приобретают неприятный, гнилостный запах. В некоторых случаях в носовых ходах наблюдается образование грануляционной ткани, которая имеет ярко-красный цвет, контактно кровоточит. Чаще всего она располагается на раковинах, а также в верхних хрящевых отделах носовой перегородки, несколько реже местом ее локализации становится задний отдел носовой перегородки. Характерным является изъязвление слизистой оболочки в передних отделах носовой перегородки. В начале заболевания язва находится на поверхности, но постепенно углубляется и доходит до хряща. При дальнейшем прогрессировании образуется перфорация носовой перегородки, на краях которой располагается грануляционная ткань, формируется «седловидная» деформация носа. У трети пациентов наблюдаются поражения уха, но средний отит только в редких случаях является первым признаком заболевания. Гораздо реже встречаются язвенно-некротические изменения в гортани, глотке и трахее. При этом слизистая оболочка гиперемирована, а на небных дужках, миндалинах, мягком небе и задней стенке глотки появляются бугорки, которые быстро изъязвляются. Эрозированную поверхность покрывает налет, который имеет серо-желтый цвет и трудно снимается, а поверхность под ним кровоточит. Пациенты жалуются на охриплость, боли в горле, отмечается стридорозное дыхание.
Системное поражение при ГПА достаточно часто проявляется как сочетание ринологических и офтальмологических симптомов. Вовлечение органа зрения, по данным разных авторов, наблюдается в 28-52% случаев и проявляется как конъюнктивит, кератит, дакриоцистит, увеит, склерит. Болезнь часто распространяется на орбиту, вызывая картину орбитального новообразования с экзофтальмом, хемозом, ограничением подвижности глаза, понижением зрения вплоть до слепоты, порой разрушением глазного яблока.
Поражение легких при ГПА наблюдается у 80-90% пациентов и иногда может быть первым проявлением болезни. К клиническим особенностям поражения легких при ГПА можно отнести, как правило, скудную аускультативную симптоматику и нередко отсутствие кашля, одышки даже при наличии выраженных рентгенологических изменений. По данным некоторых авторов, в 34% случаев поражение легких является асимптомным. Предпочтительным рентгенологическим методом исследования легких у больных ГПА является многосрезовая компьютерная томография (МСКТ) органов грудной полости (ОГП), позволяющая визуализировать минимальные проявления поражения паренхимы легких. Обзорная рентгенография грудной клетки обладает значительно меньшей информативностью. При ГПА наблюдаются следующие радиологические симптомы:
• альвеолярные геморрагии (плотности по типу «матового стекла»);
• узелки и узлы различных размеров (от мелких до довольно крупных, в среднем 2-4 см в диаметре), расположенных преимущественно по ходу бронховаскулярных пучков. Приблизительно в 50% случаев в узлах определяется образование полостей (кавитация);
• периферические субплевральные консолидации преимущественно базально, часто в виде пирамидок основанием к плевре;
• ретикулонодулярный паттерн (линейные плотности с маленькими узелками);
• плевральный выпот наблюдается в 10-25% случаев, может быть одно- или двусторонним.
Увеличение лимфатических узлов средостения может наблюдаться приблизительно в 15% случаев и всегда сочетается с поражением паренхимы легких. В редких случаях могут наблюдаться участки интерстициального фиброза, «сотового» легкого, располагающиеся базально. В зависимости от стадии заболевания (первичная манифестация, обострение или ремиссия) может наблюдаться различная комбинация упомянутых признаков. У половины больных рентгенологические изменения в легких долгое время остаются скудными и часто проявляются вместе с поражением почек. По данным некоторых авторов, изменения паренхимы легких могут присутствовать в 45% случаев дебюта ГПА и клинически проявляться малопродуктивным кашлем, кровохарканьем, болью в грудной клетке.
Поражение почек является важным диагностическим маркером ГПА. На момент установления диагноза поражение почек отмечается у 20-80% пациентов, а при дальнейшем наблюдении – у 94%. Клинически наблюдается нефротический, мочевой синдром с гематурией, протеинурией и цилиндрурией с последующим развитием ХПН. Морфологически поражение почек при ГПА соответствует диффузному некротизирующему гломерулонефриту. Типичным для поражения почек при ГПА является редкость артериальной гипертензии, эта особенность может быть полезной для дифференциальной диагностики с другими некротизирующими васкулитами.
При ГПА могут наблюдаться поражения различных органов и систем. В ранней стадии болезни часто наблюдаются неспецифические артралгии, артриты крупных и мелких суставов без выраженной деформации. Кожные проявления при ГПА встречаются нечасто и представлены пальпируемой пурпурой, изъязвлениями, папулами. Поражение периферической нервной системы представлено периферическими мононевритами, имеющими смешанный (сенсорный и моторный) характер. Центральная нервная система поражается редко.
В течении ГПА принято выделять следующие стадии:
І – риногенный гранулематоз (гнойно-некротичный, язвенно-некротичный риносинусит, назофарингит, ларингит, деструкция костной и хрящевой перегородки носа);
II – легочная стадия (распространение процесса на легочную ткань);
III – генерализованное поражение (поражение дыхательных путей, легких, почек, сердечно-сосудистой системы, желудочно-кишечного тракта);
IV – терминальная стадия (почечная и легочно-сердечная недостаточность, приводящая к летальному исходу).
Прогноз при ГПА зависит от своевременно установленного диагноза и раннего начала терапии. Как правило, без лечения генерализованные формы заболевания приводят к смерти 90% больных в течение 2 лет. Адекватная иммуносупрессивная терапия ведет к значительному увеличению продолжительности жизни пациентов. По данным некоторых авторов, на современном этапе 10-летняя выживаемость составляет 75-88%.
Учитывая системный характер заболевания, сложность диагностики на ранних этапах, высокую летальность в отсутствие адекватной и своевременно начатой терапии, каждый клинический случай этой болезни заслуживает особого внимания.
Ниже представлено описание двух клинических наблюдений. Больные с верифицированным диагнозом ГПА были направлены из клиники профессора О.Б. Яременко в Национальный институт фтизиатрии и пульмонологии (НИФП) им. Ф.Г. Яновского НАМН Украины для более детального обследования бронхолегочной системы в рамках выполнения научного проекта.
Клинический случай 1
Пациент С., 1967 года рождения, считает себя больным с августа 2010 года, когда появились гнойные выделения из носа, периодически повышалась температура до 38,0-39,5°С, беспокоила слабость, снижение массы тела (похудел за 3 мес на 8 кг). С октября 2010 г. наблюдался у отоларинголога по месту жительства по поводу двухстороннего гайморита. Проводилась антибактериальная терапия, неоднократные пункции гайморовых пазух. Несмотря на лечение, состояние пациента ухудшалось – продолжались гнойные выделения из носа с неприятным запахом, появилась боль и припухлость в области коленных суставов, боли в икроножных мышцах, сохранялся субфебрилитет.
08.04.2011 г. по экстренным показаниям был госпитализирован в Центр интенсивной терапии сепсиса с диагнозом двухсторонней септической пневмонии. КТ ОГП от 08.04.2011 г.: признаки диссеминированного процесса в легких, необходимо дифференцировать с неопластическим процессом, туберкулезом легких. В клиническом анализе крови – увеличение СОЭ до 62 мм/ч. В общем анализе мочи единичные эритроциты в поле зрения, белок – 0,033 г/л. При осмотре больного обнаружен увеличенный лимфоузел в надключичной области слева, на коже голеней – геморрагии с изъязвлением. Пациент получил массивную антибактериальную терапию (имипенем, ванкомицин, офлоксацин, нетилмицин, клиндамицин, амикацин). 20.04.2011 г. состояние больного резко ухудшилось – появились интенсивные боли в животе, рвота. В экстренном порядке выполнено оперативное вмешательство – срединная лапаратомия по поводу перфорации стенки подвздошной кишки с образованием межпетельного абсцесса.
На контрольной КТ ОГП от 04.05.2011 г. – без существенной динамики, КТ-картина изменений в легких может соответствовать периферическому образованию верхней доли левого легкого, очаговому поражению обоих легких – определяются множественные округлые, расположенные в толще легкого и субплеврально, тени размерами 0,5-0,7 см в диаметре, с относительно четкими контурами без признаков деструкции. Выполнена трансторакальная биопсия легкого 04.05.2011 г. Согласно патогистологическому заключению – некротическая ткань; необходимо дифференцировать с опухолью легкого и туберкуломой.
Пациент выписан в стабильном состоянии с рекомендацией обратиться в онкоцентр. После выписки из септического центра до марта 2012 г. в специализированные медицинские учреждения не обращался. Сохранялись гнойные выделения из носа, субфебрилитет, несколько раз были эпизоды носового кровотечения. 28.03.2012 г. был госпитализирован в ревматологическое отделение КГКБ № 3 с жалобами на одышку при умеренной физической нагрузке, гнойные выделения из носовых ходов, субфебрилитет, онемение 3 и 4 пальцев левой кисти, боли в голеностопных и коленных суставах, мышцах.
При обследовании обнаружено увеличение уровня специфических антител цАНЦА (ПР3) – 9,57 U/ml при норме <2,0.
Клинический и биохимический анализ крови без особенностей, в общем анализе мочи – протеинурия (0,033 г/л), эритроцитурия (8-15 эр. в п/з).
КТ придаточных пазух носа: признаки двухстороннего хронического гаймороэтмоидита, инородного тела правой верхнечелюстной пазухи, искривления перегородки носа. Concha bullosa средней носовой раковины справа. Изменения могут соответствовать гранулематозу Вегенера.
Посев из носа на флору и чувствительность к антибиотикам – массивный рост Staphylococcus aureus.
На основании данных обследования установлен клинический диагноз: гранулематоз с полиангиитом (гранулематоз Вегенера), генерализованная стадия, активность 3 ст. с поражением верхних дыхательных путей (хронический двусторонний гаймороэтмоидит, деструкция медиальной стенки левой гайморовой пазухи), глаз (рецидивирующий краевой кератит), легких (инфильтративное поражение, ДН І), кожи (геморрагически-некротические изменения в анамнезе, очаговая гиперпигментация), суставов (полиартрит в анамнезе, полиартралгии, ФНС І), мышц (миозит в анамнезе), почек (с мочевым синдромом, ХПН 0), РЭС (лимфаденопатия), периферической нервной системы (тригеминит, сенсорная нейропатия левой кисти – 3 и 4 пальцев), ЖКТ (абдоминальный синдром с перфорацией подвздошной кишки – апрель 2011 г.), цАНЦА (+).
Пациенту назначен преднизолон 70 мг/сут в сочетании с циклофосфаном. На фоне проводимой терапии состояние больного улучшилось – нормализовалась температура тела, улучшился аппетит, уменьшилась слабость и одышка. Повторная госпитализация в ревматологическое отделение КГКБ № 3 – 10.09.2013 г. По результатам КТ ОГП выявлена негативная динамика – появление новых инфильтратов с элементами деструкции. Пациент в условиях стационара получил пульс-терапию метилпреднизолоном. Амбулаторно рекомендовано продолжать прием преднизолона в дозе 40 мг в сутки по схеме на протяжении 2 мес, азатиоприн 100 мг в сутки.
11.12.2013 г. пациент обследован в НИФП.
На рисунке 1 представлены идентичные аксиальные срезы КТ ОГП: слева – до проведения пульс-терапии метилпреднизолоном (18.09.2013 г.), справа – после пульс-терапии (18.12.2013 г.). Отмечена положительная динамика в виде рубцевания инфильтрата с полостью деструкции в верхней доле левого легкого, уменьшения в размерах полости деструкции другого инфильтрата.
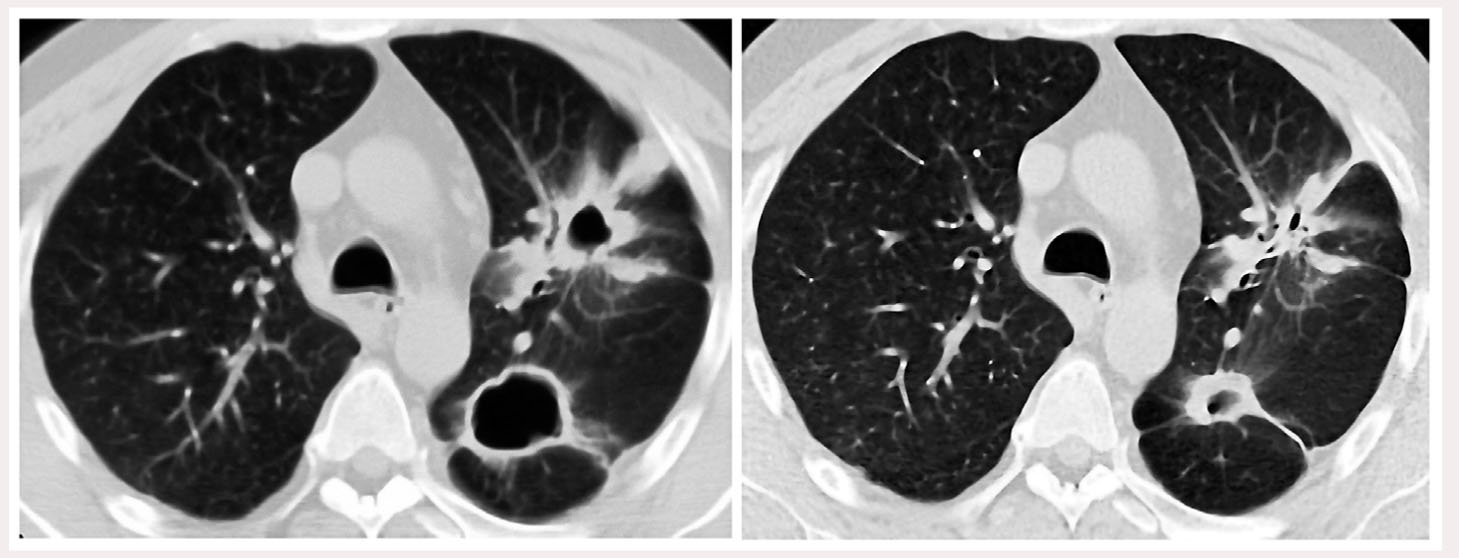 Рис. 1. КТ ОГП больного С. до (слева) и через 3 мес после (справа) проведения пульс-терапии метилпреднизолоном: отчетливая положительная динамика – рубцевание инфильтрата с полостью деструкции в верхней доле левого легкого, уменьшение в размерах полости деструкции другого инфильтрата
Рис. 1. КТ ОГП больного С. до (слева) и через 3 мес после (справа) проведения пульс-терапии метилпреднизолоном: отчетливая положительная динамика – рубцевание инфильтрата с полостью деструкции в верхней доле левого легкого, уменьшение в размерах полости деструкции другого инфильтрата18.12.2013 г. Бодиплетизмография и спирометрия: общая емкость легких (TLC) – 116,9%, жизненная емкость легких (VC) – 109,9%; остаточный объем (RV) – 141,6%; функциональная остаточная емкость легких (ITGV) – 114,8%; объем форсированного выдоха за первую секунду (FEV1) – 90,4%; форсированная VC (FVC) – 110,7%; индекс Генслера (FEV1/ FVC, %) – 65,8%. Несмотря на высокие значения FEV1 и FVC, у больного имеются нарушения бронхиальной проходимости (FEV1/FVC <70%; увеличение RV).
18.12.2013 г. Диффузионная способность легких (DLCO – 104,1%) не нарушена.
18.12.2013 г. Газовый состав крови без изменений: РаО2 – 88 мм рт. ст., РаСО2 – 36 мм рт. ст.
Клинический случай 2
Пациент Б., 1966 года рождения, болеет 2,5 года. Заболевание началось с интенсивных головных болей, снижения массы тела, беспокоили полиартралгии (колени, стопы, кисти) с длительной утренней скованностью. В конце февраля 2013 г. появилась эритематозная сыпь, сопровождавшаяся повышением температуры. За медицинской помощью обратился в марте 2013 г. При обследовании обнаружены множественные очаговые изменения в легких. По данным МРТ головного мозга – объемное образование гипофиза (вероятно макроаденома), признаки пансинусита. Клинически – проявления несахарного диабета. Прооперирован 28.04.2013 г. по поводу аденомы гипофиза с временным улучшением (определенный период после операции получал дексаметазон), затем симптомы возобновились. Беспокоили миалгии, утренняя скованность, слабость, в общем анализе крови – увеличение СОЭ до 43 мм/ч (ранее – норма). 24.07.2013 г. осмотрен профессором О.Б. Яременко, предположительный диагноз – ГПА (гранулематоз Вегенера), рекомендовано дообследование: pANCA, cANCA, ANA. Назначена пробная терапия метилпреднизолоном в дозе 32 мг/сут, на фоне которой пациент почувствовал значительное облегчение.
При обследовании обнаружено увеличение уровня специфических антител цАНЦА (ПР3) – 18,0 U/ml при норме <2,0.
Таким образом, учитывая спектр клинических проявлений, в том числе отсутствие стойкого эффекта от оперативного лечения «аденомы» гипофиза, данные МРТ головного мозга от 24.03.2013 г. (утолщение слизистых, пристеночные округлые образования в придаточных пазухах носа), увеличение СОЭ, повышение цАНЦА, положительную реакцию на пробную терапию глюкокортикоидами, установлен клинический диагноз: Системный васкулит: ГПА (гранулематоз Вегенера), хроническое течение, 3 ст. активности, с поражением головного мозга (гранулема гипофиза с симптоматикой несахарного диабета, оперирован 04.2013 г.), легких (очагово-инфильтративный пульмонит, ДН 0), суставов (полиартрит, ФНС ІІ), кожи (эритематозный дерматит – 02.2013 г.), периферических сосудов (сетчатое ливедо), мышц (миалгии), придаточных пазух носа (очагово-инфильтративный пансинусит), цАНЦА(+). Рекомендовано продолжить прием метилпреднизолона в дозе 32 мг/сут в сочетании с инъекциями циклофосфана 200 мг 2 раза в неделю.
27.01.2014 г. обследован в НИФП.
По данным МСКТ ОГП, отмечается положительная динамика процесса: справа в S3, S6, билатерально в S5 – рассасывание фокусов инфильтрации, расположенных субплеврально.
На рисунке 2 представлены идентичные аксиальные срезы КТ ОГП, на которых визуализируется один из пяти субплевральных инфильтратов: слева – до проведения терапии метилпреднизолоном (18.07.2013 г.), справа – после лечения (27.01.2014 г.).
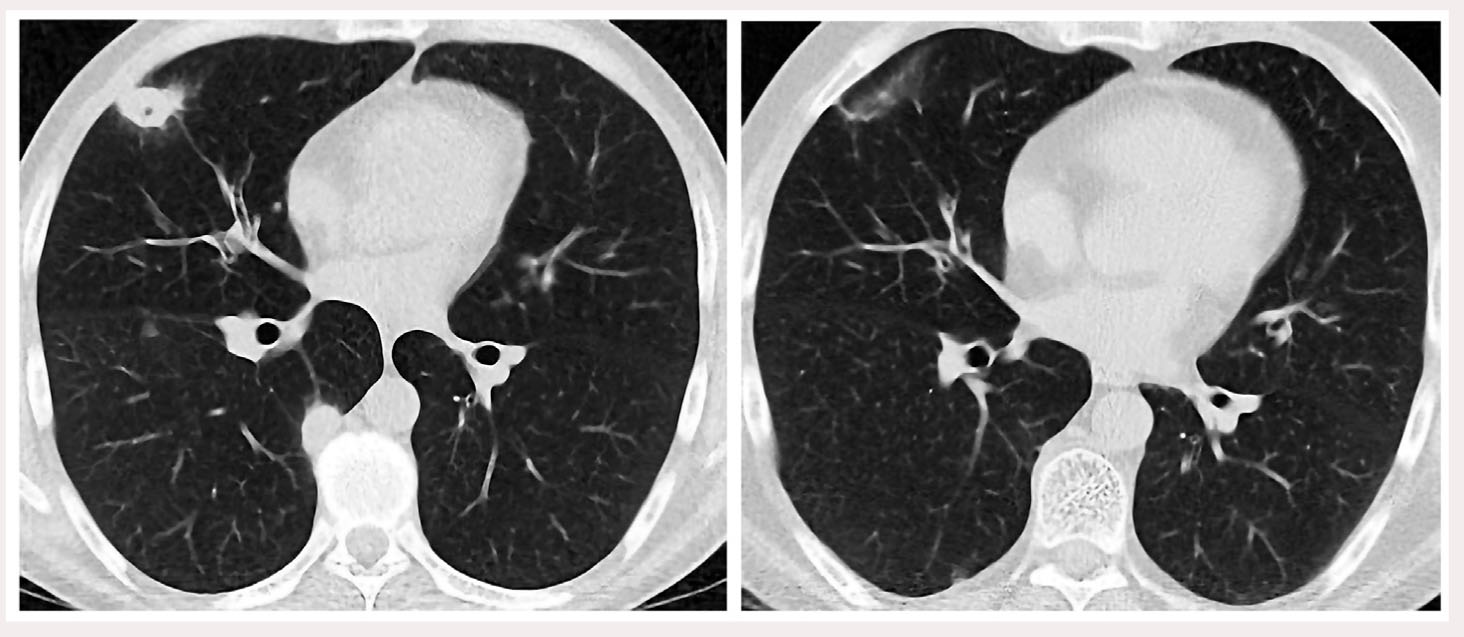 Рис. 2. КТ ОГП больного Б. до (слева) и через 6 мес после (справа) терапии метилпреднизолоном: отчетливая положительная динамика – рассасывание инфильтрата с небольшой полостью деструкции в верхней доле правого легкого
Рис. 2. КТ ОГП больного Б. до (слева) и через 6 мес после (справа) терапии метилпреднизолоном: отчетливая положительная динамика – рассасывание инфильтрата с небольшой полостью деструкции в верхней доле правого легкого27.01.2014 г. Бодиплетизмография и спирометрия: TLC – 113,2%, VC – 116,4%; RV – 111,4%; ITGV – 83,8%; FEV1 – 103,4%; FVC – 109,8%; FEV1/ FVC – 76,6%. Структура общей емкости легких и показатели бронхиальной проходимости в норме.
27.01.2014 г. Газовый состав крови – незначительно выраженная гипоксемия: РаО2 – 67 мм рт. ст., РаСО2 – 42 мм рт. ст.
Таким образом, диагноз ГПА в первом случае был установлен через 1,5 года после появления первых симптомов заболевания, во втором случае – через 2,5 года. Если у второго пациента позднее выявление болезни и позднее начало специфической терапии могли быть обусловлены атипичным дебютом заболевания, то у первого больного клиническая и рентгенологическая семиотика была достаточно типичной. Это позволяет считать главной причиной поздней диагностики ГПА в данном случае недостаточную информированность врачей об этом редком заболевании и одновременно подчеркивает необходимость данной публикации.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ Пульмонологія та оториноларингологія
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Хронічна кропив’янка (ХК) – це патологія, яка характеризується рецидивними нестійкими висипаннями з/без ангіоневротичного набряку, які виникають мало не щодня впродовж більш як 6 тиж [1]. Розрізняють два варіанти ХК – хронічна індукована кропив’янка (ХІК), або фізична кропив’янка, зумовлена певними фізичними подразниками, такими як тиск, тепло або холод, і більш поширена хронічна спонтанна кропив’янка (ХСК), яка розвивається у 80-90% випадків і характеризується відсутністю відомих екзогенних чинників і причин [2]. На це захворювання страждає від 0,5 до 1% населення світу, переважно особи жіночої статі [3]. Повторні симптоми часто призводять до порушень сну та чинять виражений негативний вплив на якість життя (QoL) [4]. ...
Сечова кислота (СК) – кінцевий продукт метаболізму пуринів, який здебільшого синтезується в печінці та виводиться нирками і кишечником [1, 2]. Гіперурикемія – підвищений рівень СК у сироватці крові – є метаболічною основою подагри, одного з найпоширеніших запальних артритів. У середні віки подагра вважалася хворобою надмірності аристократії, нині її поширеність зростає у всьому світі через зміни в харчуванні, переважання в дієті оброблених продуктів, фруктози та збільшення поширеності ожиріння [3]....
Глюкокортикоїди (ГК), які використовуються з початку 1950-х рр., стали невід’ємною частиною лікування ревматоїдного артриту (РА) [1]. Ключовою перевагою ГК є швидке настання ефекту, особливо порівняно з класичними синтетичними хворобомодифікувальними антиревматичними препаратами (ХМАРП) на кшталт метотрексату. Відповідно, ГК мають привабливий профіль для лікування спалахів хвороби або для застосування в ролі засобів для бридж-терапії на ранніх стадіях РА в очікуванні ефекту класичних синтетичних ХМАРП. Ця стратегія широко використовується після публікації результатів дослідження COBRA в 1997 р. [2]. ...




