Відновлення хрящової тканини: нова парадигма консервативного лікування остеоартриту
Приблизно в кожного десятого мешканця планети віком ≥60 років спостерігаються серйозні клінічні проблеми, що є наслідком остеоартриту (ОА) (Cooper C. et al., 2013). Зумовлене ОА навантаження на систему охорони здоров’я є надзвичайно великим, оскільки це захворювання прогресивно вражає населення похилого та старечого віку, частка котрого в глобальній популяції неухильно зростає (Tiku M.L., Sabaawy H.E., 2015). Кількість осіб з ОА колінного суглоба збільшується не лише внаслідок старіння населення, а й у зв’язку з ожирінням (Vina E.R., Kwoh C.K., 2018).
Остеоартрит: епідеміологія, етіологія, діагностика
Основними етіологічними чинниками ОА є травми, дегенеративні захворювання суглобів, метаболічні фактори (передусім надлишкова маса тіла), а також механічні (нестабільність суглобів) (Felson D., 2009).
Діагностику ОА проводять після звернення пацієнта зі скаргами на біль і неможливість виконувати рутинні фізичні навантаження. Насамперед за діагностичним алгоритмом при ОА здійснюють виключення ревматоїдного, псоріатичного та септичного артритів, травматичного пошкодження суглоба. Тяжкість ОА визначається за допомогою спеціалізованих опитувальників, наприклад індексу WOMAC (Western Ontario McMaster Index), візуальної аналогової шкали, індексу Лекена; встановлення інтенсивності болю за візуальною аналоговою шкалою; візуалізаційних обстежень (рентгенографії). Під час фізикального обстеження слід визначити обсяг активних і пасивних рухів, м’язову силу, стабільність зв’язок, наявність набряку чи крепітації, болючість уражених суглобів. Мета рентгенографії – з’ясувати ширину суглобової щілини та її асиметрію, а також виявити остеофіти. Крім рентгенографії, для візуалізації змін у суглобі можуть використовуватися магнітно-резонансна томографія, ультразвукове дослідження, оптична когерентна томографія (Grover A.K., Samson S.E., 2016).
Будова та функції суглобового хряща
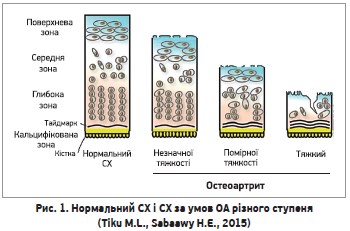
Суглобовий хрящ (СХ) є унікальною тканиною. СХ утворює прошарок між кістками, допомагаючи зменшити навантаження на кістку та забезпечити змащування суглоба; водночас він має достатньо позаклітинного матриксу, в якому безладно розкидані хондроцити (Poole A., 2005). Хрящ дорослої людини має зоновану структуру, складається з поверхневої, середньої та глибокої зон, які відрізняються за біохімічним складом матриксу, щільністю розташування клітин та їхньою морфологією, а також метаболізмом (Grogan S. et al., 2013; Wilusz R. et al., 2014). На поверхневу зону припадає 10-20% товщини СХ; хондроцити цієї зони видовжені, сплощені, розташовані паралельно поверхні хряща й оточені щільно розміщеними колагеновими фібрилами. Середня (проміжна) зона становить 40-60% товщини хряща; в цій зоні хондроцити оточені хаотично розміщеними фібрилами колагену ІІ типу з великим умістом агреканів, гіалуронової кислоти та дерматансульфату. Хондроцити глибокої зони є еліпсоїдними, вони формують своєрідні колонки, пронизані радіально орієнтованим колагеновим матриксом. Між глибокою зоною хряща та кальцифікованим хрящем розташований прошарок аморфного матеріалу на кшталт мембрани (Poole A. et al., 1996; Poole A., 2005; Wilusz R. et al., 2014).
Патогенез ОА та механізми регенерації хрящової тканини
СХ, субхондральна пластинка, трабекулярна кістка – біологічно та функціонально неподільна остеохондральна одиниця, що розподіляє навантаження в суглобі та є місцем обміну нутрієнтами й газами між кісткою та хрящем (Grover A.K., Samson S.E., 2016). Патофізіологічними ознаками ОА є втрата й кальцифікація хряща, потовщення субхондральної кістки з одночасним зменшенням маси трабекулярної кісткової тканини, утворення остеофітів (Grover A.K., Samson S.E., 2016). Ступені тяжкості ОА супроводжуються різним рівнем ураження СХ (рис. 1).
Причинами ерозивних змін СХ і синовіального запалення (основних морфологічних змін за OA) є складні патобіохімічні каскади, в т. ч. реакції за участю протеолітичних ферментів (Troeberg L., Nagase H., 2012). Активовані синовіоцити, хондроцити та мононуклеари виробляють прозапальні цитокіни, зокрема інтерлейкін‑1 і фактор некрозу пухлини α. Ці цитокіни підвищують експресію матриксних металопротеїназ (ММП) (Mobasheri A. et al., 2017). Родина ММП – це група цинкозалежних протеолітичних ферментів, які регулюють ремоделювання тканин і деградацію позаклітинного матриксу. Такі ферменти здатні руйнувати практично всі компоненти СХ, у т. ч. різні типи колагену, фібронектини, ламініни, еластини тощо (Verma R.P., Hansch C., 2007). ММП також стимулюють функціонування остеокластів і сприяють залученню до вогнища ураження запальних клітин (Li Z.G. et al., 2009).
Гомеостаз СХ підтримується за рахунок балансу між умістом агреканів і колагену, що забезпечує одночасно міцність й еластичність хряща (Poole A., 2005). Втрату агреканів хондроцити відновлюють швидко, тоді як колаген II типу є білком-«довгожителем», період напіврозпаду котрого становить приблизно 117 років. Унаслідок цього синтез і дозрівання колагену є складним і тривалим процесом, що обмежує регенерацію хряща (Verzijl N. et al., 2000).
Першим етапом відновлення хряща є активація хондроцитів та їх вивільнення з матриксу. Після руйнування ушкоджених тканин хондроцити-попередники мігрують до ураженої ділянки та розпочинають регенерацію (Morales T., 2007). У моделі in vitro було показано, що хондроцити поверхневої зони хряща швидко проліферують, мігрують і розповсюджуються ушкодженою поверхнею хряща; такий процес нагадує реепітелізацію ран (Seol D. et al., 2012). Регенерація середньої та глибокої зон СХ є набагато повільнішою. Донедавна вважалося, що регенерація хряща в ссавців практично неможлива, проте на сьогодні встановлено, що СХ властивий певний потенціал регенерації (Huey D. et al., 2012).
Лікування ОА
Існує широкий спектр як фармакологічних, так і нефармакологічних методів лікування ОА. До нефармакологічних методів належать навчання пацієнтів, фізичні навантаження (водні види спорту, йога, тай-чи), фізіотерапія, зменшення маси тіла, хірургічні втручання (Grover A.K., Samson S.E., 2016). Основними фармакологічними методами лікування є аналгетики та нестероїдні протизапальні препарати (НПЗП), однак застосування останніх значно обмежене через їхній негативний вплив на травну систему та метаболізм хряща (Ofman J.J. et al., 2002; Huskisson E.C. et al., 1995).
Для підтримання здоров’я суглобів можуть застосовуватися такі харчові добавки, як глюкозамін, N-ацетилглюкозамін (НАГ), хондроїтин, колаген тощо (Schwenk T.L., Costley C.D., 2002; Gorsline R.T., Kaeding C.C., 2005; Ostojic S.M. et al., 2007).
Глюкозамін
Глюкозамін гальмує деградацію та стимулює синтез глікозамінових полісахаридних ланцюгів протеогліканів (Fenton J.I. et al., 2000; Gouze J.N. et al., 2001), а також пригнічує експресію ферментів, які руйнують колаген, зокрема ММП, одночасно підвищуючи експресію колагену ІІ типу в хондроцитах (Nakamura H. et al., 2004; Derfoul A. et al., 2007). На основі цих ефектів було зроблено висновок про хондропротекторну дію глюкозаміну та його можливе застосування в лікуванні ОА (McAlindon T.E. et al., 2000; Reginster J.Y. et al., 2001; Pavelká K. et al., 2002). J. Kongtharvonskul і співавт. (2015) показали, що НПЗП і глюкозамін є однаково ефективними в усуненні симптомів при ОА колінного суглоба, проте НПЗП мають більше побічних ефектів. Уживання глюкозаміну протягом 2,5 років запобігало звуженню суглобової щілини відповідно до даних рентгенографії (Runhaar J. et al., 2016).
H.M. El-Saadi та співавт. (2019) у масштабному тематичному огляді вказують, що важливими учасниками патогенезу ОА є реактивні форми кисню, здатні спричиняти ушкодження СХ, деградацію колагену та гальмування синтезу протеогліканів (рис. 2). Глюкозамін зменшує оксидативний стрес у хондроцитах й активує ферменти антиоксидантного захисту (супероксиддисмутазу, каталазу та глутатіонпероксидазу) (Terencio M.C. et al., 2016; Mendis E. et al., 2008; Fang C. et al., 2007; Calamia V. et al., 2010).
Ще одним із репаративних механізмів хрящової тканини є автофагія, котра дає змогу хондроцитам усунути пошкоджені чи дисфункціональні органели без порушення клітинності СХ (Chin K.Y., Pang K.L., 2017; Aigner T. et al., 2001). У багатьох експериментальних дослідженнях показано, що глюкозамін сприяє автофагії в різних клітинних лініях, у т. ч. первинних хондроцитах людського хряща (Kang Y.H. et al., 2015; Carames B. et al., 2013).
N-ацетилглюкозамін
НАГ є похідним глюкозаміну, що стимулює синтез гіалуронану (Shikhman A.R. et al., 2009) і чинить протизапальний ефект, гальмуючи експресію індуцибельної NO-синтази, циклооксигенази‑2 й інтерлейкіну‑6 у хондроцитах (Shikhman A.R. et al., 2001). Синтезований під дією НАГ гіалуронан гальмує експресію ММП‑3 та -13, протидіючи руйнуванню хряща (Julovi S.M. et al., 2011), і запобігає деградації агреканів у хондроцитах (Yatabe T. et al., 2009). Оскільки з віком в організмі зменшується вироблення глікозаміногліканів із глюкози (Shuster S. et al., 1975), пероральний прийом НАГ підвищує синтез компонентів хряща та сприяє усуненню симптомів із боку колінного суглоба (Altman R.D. et al., 2015; Tsuji T. et al., 2016).
Продемонстровано, що призначення НАГ посилює синтез колагену II типу та зменшує вираженість симптомів у пацієнтів з ОА колінного суглоба (Katsuno S. et al., 2010). Показано, що НАГ здатний зменшувати деградацію та збільшувати синтез колагену ІІ типу навіть у здорових осіб без симптомів захворювань суглобів; він виявився високобезпечним засобом, адже частота несприятливих побічних ефектів у групах лікування та плацебо не відрізнялася (Tomonaga A. et al., 2016).
Кверцетин
Кверцетин (3, 3’, 4’, 5, 7-пентагідроксифлавон) є природним флавоноїдом із низкою біологічних впливів; він безпечний для людини, оскільки навіть одноразовий прийом 4 г цієї речовини чи 500 мг 2 р/добу протягом 1 міс не зумовлював жодних побічних ефектів (Lamson D.W., Brignall M.S., 2000). Показано, що цьому флавоноїду властива протизапальна дія в умовах експериментального артриту (Guardia T. et al., 2001; Mamani-Matsuda M. et al., 2006). Кверцетин (як і НАГ) пригнічує активність однієї з ММП, а саме ММП‑2 (Tan W. et al., 2003), таким чином протидіючи руйнуванню базальної мембрани й ушкодженню СХ. Окрім того, кверцетин здатний регулювати активацію ядерного фактора κB і гальмувати транскрипцію запальних факторів синовіальної оболонки суглоба (Ji J.-J. et al., 2013).
Глюквамін
Дієтична добавка Глюквамін (ПАТ НВЦ «Борщагівський ХФЗ», Україна) містить D-глюкозаміну гідрохлорид (0,125 г), НАГ (0,125 г) і кверцетин (0,08 г). Глюквамін може застосовуватися для збільшення надходження вищезазначених агентів до організму за умови хронічних процесів, які спричиняють деструктивні зміни СХ; обмеженої рухливості суглобів; підвищеного навантаження на суглоби внаслідок надлишкової маси тіла чи інтенсивної фізичної активності; при травмах суглобів або сухожиль.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 7 (476), квітень 2020 р.
СТАТТІ ЗА ТЕМОЮ Ревматологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Зв’язок між рівнем сироваткової сечової кислоти (ССК) і ризиком серцево-судинних захворювань (ССЗ) упродовж багатьох років є предметом вивчення дослідників. Установлено, що рівень ССК – незалежний предиктор смерті від усіх причин і серцево-судинної смерті, зокрема від гострого коронарного синдрому, інсульту та серцевої недостатності (СН). Також опубліковано багато робіт про зв’язок між ССК і функцією нирок. Попри значну кількість публікацій, деякі моменти, а саме: яким є оптимальний поріг ССК для визначення ризику ССЗ, чи необхідна корекція значень ССК для функції нирок, чи є ССК ключовим патологічним елементом метаболічної дисрегуляції, потребують прояснення....





.jpg)