Середньо- та довгострокові результати ендоскопічної резекції при раку стравоходу типу pT1b-SM1 та pT1b-SM2
Рак стравоходу (РС) – одне з 10 найпоширеніших онкологічних захворювань у світі та шоста за частотою причина смерті від раку [1]. Ендоскопічна резекція слизової оболонки (ЕМR) та ендоскопічна підслизова дисекція (ESD) є ендоскопічними техніками лікування РС, що демонструють хороші результати [3]. Останні дані літератури показують, що ESD є ефективнішою при ранньому РС, ніж ЕМR, з огляду на резекцію en bloc та меншу кількість рецидивів [4]. Однак не слід недооцінювати потенціал ЕМR у лікуванні невеликих та поверхневих пухлин [5]. Ендоскопічна резекція є відповідним методом лікування поверхневого РС, а вибір техніки має базуватися на розмірі та товщині пухлини.
Сьогодні пухлини видаляють методом ЕМR за допомогою петлі та/або ковпачка і лише тоді, коли пухлини невеликі (<2 см) та поверхневі, локалізовані у слизовій оболонці. За допомогою ESD, що включає видалення підслизової оболонки спеціалізованим ендоскопічним ножем, можна лікувати більші та, імовірно, глибші ураження. Глибина інвазії пухлини при ендоскопічному лікуванні за Японською класифікацією раку стравоходу (11-те видання) описується як гістологічно найглибша точка прямої інвазії первинної пухлини. При субслизовому ураженні ця точка – це відстань від м’язової пластинки слизової оболонки (lamina muscularis mucosae) до найглибшої точки інвазії. Отже, підслизовий рак можна розділити на pT1b-SM1 (SM1; в межах 200 мкм) та pT1b-SM2 (SM2; >200 мкм) [7].
І EMR, і ESD – це неінвазивні та порівняно не дорогі методи лікування РС, що розташований у слизовій оболонці, за відсутності метастазів у лімфатичних вузлах [8]. Однак у пацієнтів із субслизовими пухлинами показання до такого лікування остаточно не визначені. Японські настанови щодо діагностики та лікування РС передбачають такі показання до ендоскопічної резекції: відносні показання для ММ або SM1 ураження, відсутність клінічних проявів або метастазів у лімфатичних вузлах та дослідницькі показання для SM2 або глибших уражень, що націлені на місцевий контроль, 50% яких пов’язані з метастазуванням [8]. Для обох типів (SM1 та SM2) подальше тривале спостереження є обов’язковим, і може знадобитися додаткове лікування (радикальна хірургія або ад’ювантна терапія), залежно від гістопатологічних даних стану країв резекції [9].
Пацієнти та методи
Проведено ретроспективне дослідження даних пацієнтів з РС, у яких ендоскопічну резекцію проводили з червня 1995 по червень 2015 р., з гістопатологічним діагнозом T1b‑SM1 і T1b-SM2 згідно з настановами щодо діагностики та лікування карциноми стравоходу Японського стравохідного товариства. Клініко-патологічні характеристики були зібрані згідно з Японською класифікацією раку стравоходу (11-те видання) [7, 10]. Виключили пацієнтів, які раніше отримували променеву або хіміотерапію, та пацієнтів, які мали пухлини гастроезофагеального з’єднання або перенесений синхронний рак інших органів. Усі включені в дослідження пацієнти спостерігалися як мінімум 2 роки (лікування у 2015 р.) та максимум 20 років (лікування в 1995‑му). Ендоскопічна резекція була першою лінією лікування пухлин T1 і SM1, у випадку SM2-пухлин резекція проводилася лише у цьому дослідженні (рис.).
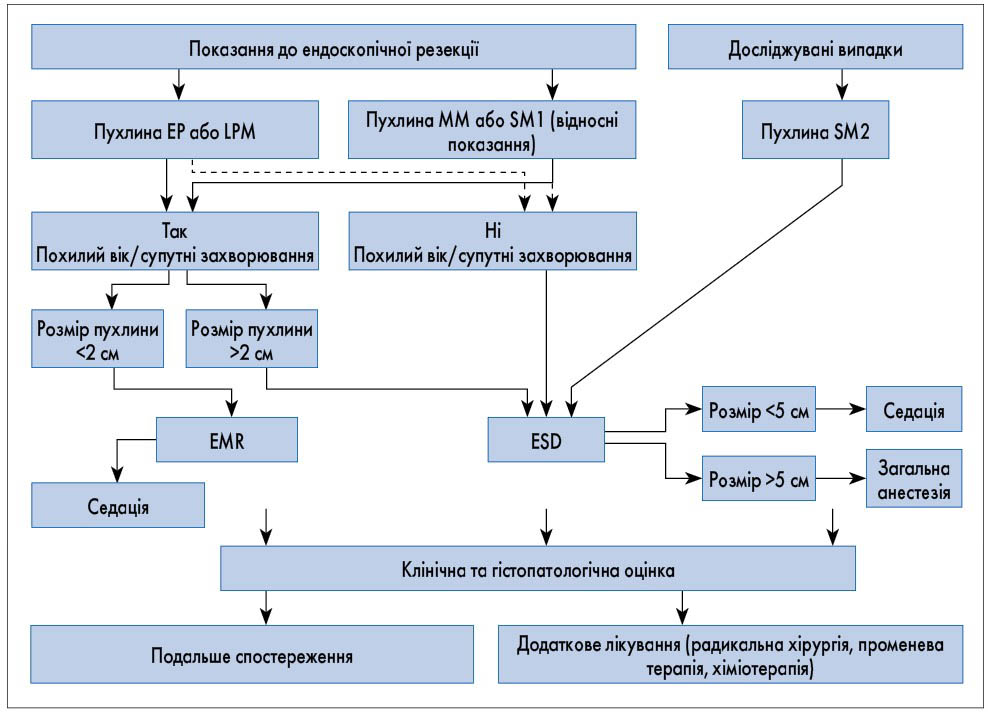 Рис. Алгоритм ведення хворих із поверхневими пухлинами стравоходу
Рис. Алгоритм ведення хворих із поверхневими пухлинами стравоходу
Результати
Характеристика пацієнтів. Загалом було 119 випадків із 137 пухлинними вогнищами. Середній вік ± стандартне відхилення склали 67,22±9,49 року; 87,4% пацієнтів були чоловіки. Ускладнення (включаючи кровотечу, стеноз, набряк або підшкірну емфізему) не виявлено в жодному з випадків. В анамнезі перенесений рак був у 21 (17,6%) випадку, зокрема рак ротоглотки (n=4; 3,4%), шлунка (n=4; 3,4%), гіпофарингеальний рак (n=2; 1,7%), рак легені (n=2; 1,7%) та товстої кишки (n=2; 1,7%). Первинно-множинні пухлини стравоходу (метахронні) виявлено у 17 випадках. Первинно-множинні пухлини кількох органів (синхронні) зафіксовано у 18 (15,1%) випадках. Найпоширенішими видами були гіпофарингеальний рак (n=6; 5%), рак шлунка (n=6; 5%) та ротоглотки (n=3; 2,5%)
Макроскопічні та гістологічні знахідки. ЕМR та ESD були виконані у 99 (72,3%) та 38 (27,7%) випадків відповідно. Найчастіше пухлина локалізувалась у грудному відділі стравоходу (86,8%), зокрема середньогрудному відділі (51,1%). Макроскопічний тип пухлини здебільшого становив 0-IIc (63,5%), а також 0-I (10,2%). Глибина ураження стінки органа пухлиною відповідала cT1a в 61 (44,5%) випадку, cSM1 – в 67 (48,9%) та cSM2 – у 9 (6,6%) випадках.
Згідно з поділом за розміром пухлини ураження <2 см виявлено у 84 (61,3%) випадках, а >2 см – у 53 (38,7%); загальний середній розмір становив 2,24±1,29 см. Позитивний вертикальний край резекції був у 13 (9,5%) випадках. Резекцію en bloc та резекцію частинами виконували у 44,5 та 55,5% усіх випадків відповідно. Плоскоклітинний рак був основним гістологічним типом пухлин (n=134; 97,8%).
За даними патоморфологічного дослідження глибина інвазії пухлини T1b-SM1 зафіксована у 34,3% випадків, а T1b-SM2 – у 54,7%. Лімфатична та венозна інвазія пухлини були відповідно у 37,2 та 43,1% випадків.
Результати під час періоду спостереження. Загальне спостереження становило 73,4±51,36 місяця, а максимальний період виживання – 20,3 року. Спостереження через 2 роки після процедури було досягнуто в 100% випадків, а через 5 років – у 68%.
Додаткове лікування, відповідно до рекомендацій, пропонувалося залежно від результатів клінічної та гістопатологічної оцінки всім пацієнтам, які мали лімфатичну та/або венозну інвазію та/або позитивні краї резекції [9]. Загалом 34 (29%) пацієнти отримали додаткове лікування: радикальну езофагектомію (n=23; 19%) та ад’ювантну терапію (CT-CRT; n=11; 9%). Загалом протягом періоду спостереження померло 30 (25%) пацієнтів. Причини смерті включали прогресування РС (n=13; 11%), інші види прогресуючого раку (n=7; 6%) та інші прогресуючі розлади (n=10; 8%).
Рецидиви. Рецидив хвороби діагностовано у 23 (19%) пацієнтів, середній вільний від пухлини період після процедури становив 34,8±36,25 місяця, а виживаність після констатації рецидиву – у середньому 29,4±30,7 місяця. Загалом у 23 пацієнтів, у яких розвинулися рецидиви, у 16 (70%) проводили ЕМR, а у 7 (30%) – ESD. Місцеві рецидиви та віддалені метастази мали місце у 15 (65%) та 8 (33%) випадках відповідно.
Згідно з аналізом чинниками ризику розвитку рецидиву, які впливають на тривалу виживаність за 5-річний період, що піднялися до статистичної значущості, були вік старше 65 років (р=0,0282), чоловіча стать (р=0,00152) та позитивний вертикальний край резекції у гістопатологічному матеріалі (р=0,0311)
Виживаність та фактори, що впливають на виживаність. Протягом дослідження 2- та 5-річна виживаність (за Капланом – Маєром) становила 90 та 79% відповідно. Виявлено статистично значно нижчий рівень виживаності (р=0,0112) пацієнтів, у яких був рецидив та позитивний вертикальний край резекції (табл.).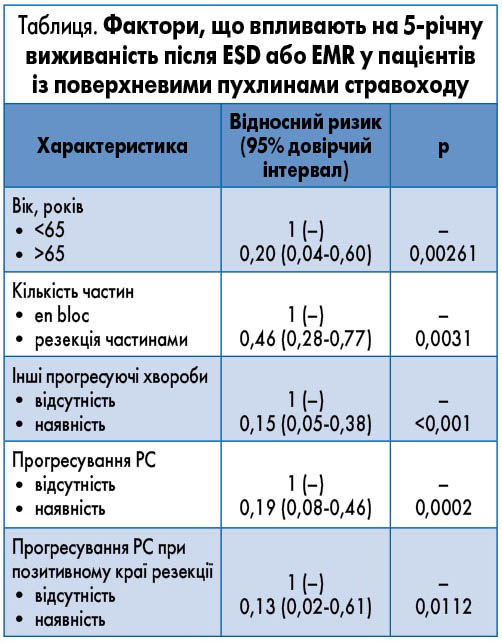
Обговорення
Виявлено зв’язок між похилим віком і смертністю пацієнтів після ендоскопічної резекції. Навіть після радикального лікування пацієнти старше 65 років мають вищий ризик розвитку будь-якого виду ускладнень [14]. У літніх пацієнтів зі значними супутніми захворюваннями, високим ризиком загальної анестезії, з поверхневою пухлиною та малим її розміром (<2 см) краще проводити ЕМR, головним чином через можливість виконання процедури під седацією. У всіх інших випадках саме ESD є кращою методикою для видалення поверхневих пухлин стравоходу.
Кілька звітів засвідчили, що ESD є більш ефективною при РС, з вищою частотою резекції en bloc та нижчою частотою локальних рецидивів порівняно з ЕМR [4, 5]. Ефективність резекції за допомогою ESD та видалення en bloc підтверджено у багатьох публікаціях, тоді як шляхом ЕМR можна видалити пухлину більш ніж однією частиною залежно від її розміру та товщини. Ми підтвердили, що резекція en bloc має істотний зв’язок з довготривалою виживаністю порівняно з резекцією частинами. Крім того, ми дійшли висновку, що ESD є кращою методикою за кількістю зразків для en bloc резекції. ЕМR можна використовувати лише при невеликих і поверхневих пухлинах (<2 см) у пацієнтів літнього віку зі значними супутніми захворюваннями, для яких загальний наркоз пов’язаний з дуже високим ризиком смерті.
Рецидив – ще один фактор, що впливає на виживання. У 19% пацієнтів у період спостереження виникли рецидиви. Значно більша частота рецидивів після ЕМR була зумовлена вищим рівнем резекції частинами. Однак ми вважаємо, що в цих випадках смертність знижується при локальному контролі рецидивів і призначенні додаткового лікування. Співвідношення між позитивним вертикальним краєм резекції та рецидивом було суттєвим у 2- та 5-річному спостереженні. Ми дійшли висновку, що пухлину слід видаляти en bloc, щоб уникнути позитивного вертикального краю резекції та розвитку рецидиву. Ми показали, що випадки з позитивним вертикальним краєм резекції тісно пов’язані з випадками рецидиву, і їх взаємозв’язок статистично впливає на тривалість виживання. З цієї причини необхідно призначати додаткове лікування у разі ураження лімфатичних судин та/або наявності позитивного краю в гістопрепараті, щоб знизити ризик розвитку рецидиву та покращити виживаність. У наших пацієнтів з вільним краєм резекції ми практикуємо спостереження протягом принаймні 5 років для забезпечення раннього контролю рецидивів. У разі розвитку будь-якого локального рецидиву або дистального метастазу ми віддаємо перевагу операції (з лімфаденектомією трьох зон) як першій лінії лікування, оскільки вона забезпечує хороші результати, а хіміотерапію призначаємо пацієнтам, які не можуть отримати хірургічне лікування або мають віддалені метастази [6, 14].
Позитивний вертикальний край резекції є найбільш критичним фактором розвитку рецидиву і впливає на виживаність у довгостроковій перспективі. Клінічне значення позитивного вертикального краю резекції також було визначено в інших дослідженнях нашого відділу [16, 17].
Висновки
На підставі результатів дослідження лікування РС (SM1 та SM2) можна дійти висновку, що ендоскопічна резекція є адекватним варіантом для субмукозних пухлин із хорошими виживаністю та віддаленими результатами. У разі пухлин SM1 ендоскопічна резекція є стандартним лікуванням. При пухлинах SM2 лікування суперечливе. У нашому дослідженні ми показали хороші результати довготривалої виживаності у разі пухлини SM2 без ураження лімфатичної системи або судин, вільного вертикального краю резекції та резекції en bloc. Додаткове лікування необхідно для всіх пухлин SМ з ураженням лімфатичної системи та судин або позитивним вертикальним краєм резекції, щоб уникнути розвитку рецидивів. Довготривале спостереження має важливе значення для виявлення рецидивів (19% у нашій когорті), оскільки це пов’язано з високим рівнем смертності (65%). При виборі методики ендоскопічної резекції слід враховувати досвід ендоскопіста, при цьому EDS є кращим вибором, а EMR – варіантом вибору для пацієнтів літнього віку зі значними супутніми захворюваннями, пухлинами <2 см та для яких загальний наркоз становить високий ризик.
Mora А., Kawada K., Nakajima Y., Okada T., Tokairin Y., Kawano T. Mid- and long-term outcomes of endoscopic resection for submucosal esophageal cancer types pT1b-SM1 and pT1b-SM2. Endoscopy International Open. 2019; 07: E733-E742. DOI https://doi.org/10.1055/a‑0838-5180.
Переклав з англ. Назар Лукавецький
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 2 (63) 2020 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...




