Антикоагулянтна терапія після первинного ЧКВ у пацієнтів із гострим інфарктом міокарда та дисфункцією лівого шлуночка
У пацієнтів із гострим інфарктом міокарда (ГІМ) передньої стінки лівого шлуночка (ЛШ) та його дисфункцією спостерігається підвищений ризик тромбозу ЛШ (ТЛШ), що може призвести до розвитку системної емболії та навіть смерті. Раніше тромболітична терапія передбачала проведення короткочасної антикоагуляції з використанням низькомолекулярного гепарину під час госпіталізації, що суттєво знижувало ризик ТЛШ, але на сьогодні ефект цього профілактичного підходу лишається до кінця не ясним. P. Chen et al. провели дослідження з метою оцінки впливу постпроцедурної антикоагулянтної терапії (ППАТ) із застосуванням еноксапарину на додаток до подвійної антитромбоцитарної терапії (ПАТT) після первинного черезшкірного коронарного втручання (ЧКВ) у таких пацієнтів. Отримані результати опубліковані у виданні Circulation Journal (2020; 84: 1728‑1733).
Частота розвитку ТЛШ зменшилася із появою первинного ЧКВ та рутинного використання ПАТТ. Однак, за даними метааналізу, в 9,1% хворих на ГІМ передньої стінки ЛШ виникав ТЛШ (Robinson et al., 2016). У попередніх рекомендаціях варфарин вказувався як терапевтичний варіант для осіб із підвищеним ризиком формування ТЛШ, сьогодні його призначають у межах профілактики на додаток до ПАТТ після первинного ЧКВ (O’Gara et al., 2013; Steg et al., 2012). Однак результати нещодавніх досліджень та метааналізу не підтверджують переваг додаткового використання варфарину в таких пацієнтів, оскільки при його застосуванні смертність не знижується, а частота великих кровотеч зростає (Le May et al., 2015; Shavadia et al., 2017; Moulson et al., 2017).
Лікування низькомолекулярним гепарином асоційоване з нижчим ризиком геморагій, ніж при застосуванні варфарину, тож він являє собою кращий інструмент для профілактики розвитку ТЛШ. Однак не ясно, чи зберігається ця профілактична користь після проведення первинної ЧКВ відповідно до сучасної клінічної практики (Kontny et al., 1997). Згідно з останніми рекомендаціями щодо терапії хворих на ІМ із підйомом сегмента ST, рутинне введення низькомолекулярного гепарину після первинного ЧКВ використовувати недоцільно (Ibanez et al., 2018).
Окрім того, роль ППАТ як профілактики розвитку ТЛШ у пацієнтів із високим ризиком на сьогодні не було чітко встановлено. Тож P. Chen et al. (2020) виконали дослідження, метою якого було оцінити ефект внутрішньолікарняної ППАТ із застосуванням еноксапарину після первинного ЧКВ щодо зниження частоти ТЛШ в осіб із переднім ГІМ та дисфункцією ЛШ, а також зв’язок лікування із 30-денними клінічними наслідками.
Матеріали й методи дослідження
Популяція пацієнтів
У ретроспективне дослідження було включено 426 пацієнтів, що на момент госпіталізації мали передній ГІМ, фракцію викиду (ФВ) ЛШ ≤40% та проходили первинне ЧКВ у період з січня 2011 по грудень 2016 рр. Діагноз ГІМ передньої стінки ЛШ базувався на таких ознаках, як біль за грудиною тривалістю >30 хв, стійке підвищення сегмента ST (≥0,2 мВ) або наявність зубців Q у прекардіальних відведеннях (V1-V6) на електрокардіограмі у 12 відведеннях, а згодом був підтверджений збільшенням серцевих маркерів. Наявність ТЛШ оцінювали за допомогою трансторакальної ехокардіографії, яку проводили протягом 48 год після госпіталізації (вихідні дані) та повторювали через 30 днів спостереження.
Пацієнтів розподілили на дві групи: ті, хто отримував (39,4%) чи не отримував ППАТ (60,6%). Рутинна ППАТ, рішення щодо проведення якої приймав лікар, передбачала використання еноксапарину (1 мг/кг, максимальна доза – 100 мг, підшкірно кожні 12 год) після первинного ЧКВ упродовж семи днів. Істотної різниці між групами щодо базових характеристик, лабораторних показників та клінічної оцінки не спостерігалося.
З аналізу були виключені: пацієнти із ТЛШ або іншими показаннями до антикоагуляції, включно з фібриляцією передсердь, механічними клапанами, тромбозом глибоких вен тощо; особи із протипоказаннями до антикоагулянтної терапії; хворі, яким провели екстрене чи планове ЧКВ відразу після тромболізису; пацієнти, медичні записи яких були неповними або ж дані відсутні.
Стандартна терапія
Усі пацієнти отримували 300 мг ацетилсаліцилової кислоти (АСК) та навантажувальну дозу інгібітора рецепторів P2Y12 (300 мг клопідогрелю або 180 мг тікагрелору) перед первинним ЧКВ. Також хворим вводили нефракціонований гепарин внутрішньовенно болюсно з урахуванням ваги для досягнення активованого часу згортання крові 200‑250 с під час процедури. Додатковий гепарин використовували у дозі залежно від активованого часу згортання.
Застосування інгібітора глікопротеїну IIb/IIIa (тирофібану) було залишене на розсуд лікаря. За можливості проводили пряме стентування. Лікування після ЧКВ передбачало ПАТТ із пожиттєвим прийманням 100 мг/добу АСК та 75 мг/добу клопідогрелю протягом щонайменше 12 місяців. Бета-блокатори, інгібітори ангіотензинперетворювального ферменту (іАПФ) та статини призначали згідно з чинними рекомендаціями.
Кінцеві точки
Первинну кінцеву точку становив ТЛШ, діагностований через 30 днів за допомогою ехокардіографії. Вторинними кінцевими точками були 30-денна смертність, емболічні події та великі кровотечі. Емболічні ускладнення визначали як ішемічний інсульт відповідно до оцінки за шкалою тяжкості інсульту Національних інститутів охорони здоров’я США (NIHSS) і даних магнітно-резонансної томографії та периферичну емболію, підтверджену ангіографією. Велику кровотечу визначали як внутрішньочерепний крововилив, зниження концентрації гемоглобіну ≥5 г/дл або абсолютне зниження гематокриту ≥15% згідно з критеріями тромболізу при ІМ (Chesebro et al., 1987).
Статистичний аналіз
Безперервні змінні перевіряли на предмет нормального розподілу за допомогою критерію узгодженості Колмогорова – Смірнова. Безперервні дані були представлені як середнє значення ± стандартне відхилення або міжквартильний діапазон у разі ненормального розподілу та зіставлені шляхом використання t-критерію Ст’юдента. Категорійні дані порівнювали за допомогою критерію хі-квадрат або точного тесту Фішера. Багатовимірний логістичний регресійний аналіз слугував для врахування різниці у базових характеристиках. Всі статистичні тести виконували із застосуванням програмного забезпечення SPSS (версія 17.0). Значення р<0,05 вважали статистично значущим.
Результати дослідження
Учасники групи ППАТ частіше отримували статини та іАПФ / блокатори рецепторів ангіотензину (БРА). Пароксизмальна фібриляція передсердь спостерігалася у 19 пацієнтів: 4,2% у групі ППАТ та 4,6% у хворих, що не отримували дане лікування.
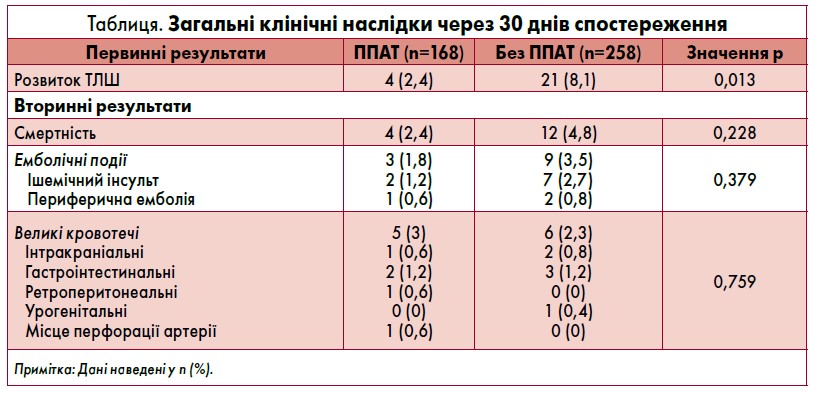
На момент госпіталізації та через 30 днів після виписки пацієнти, які отримували ППАТ із застосуванням еноксапарину, мали значно нижчу частоту ТЛШ (2,4 vs 8,1%). У хворих на ППАТ порівняно із тими, хто її не отримував, спостерігалася тенденція до зменшення загальної смертності (2,4 vs 4,8%) та емболічних подій (1,8 vs 3,5%), але вона була статистично незначущою. Зокрема, у 3 із 168 пацієнтів групи ППАТ та 9 із 258 осіб, яким її не призначали, зафіксовано 2 і 7 ішемічних інсультів, 1 та 2 периферичні емболії відповідно. Частота великих кровотеч була зіставною між групами. Детальні результати загальних 30-денних клінічних наслідків наведені в таблиці.
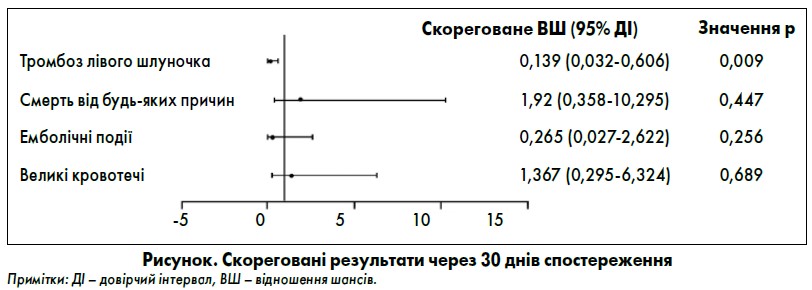
Як показано на рисунку, суттєве зниження частоти ТЛШ при проведенні ППАТ із використанням еноксапарину відзначалося навіть після коригування результатів з урахуванням різниці у вихідних характеристиках пацієнтів, які включали цукровий діабет, гіперліпідемію або інсульт в анамнезі, гостру серцеву недостатність за Кілліпом, використання інгібітора рецепторів P2Y12, статинів чи іАПФ/БРА, багатосудинне ураження та ангіопластику променевої артерії. Незалежна кореляція між ППАТ і смертністю, емболічними подіями та основними кровотечами була відсутня.
Висновки
Пошук безпечних та ефективних стратегій для профілактики ТЛШ у пацієнтів із високим ризиком є вкрай важливим. У дослідженні P. Chen et al. (2020) ППАТ із використанням еноксапарину після первинного ЧКВ була незалежним чином пов’язана зі зниженням частоти ТЛШ у пацієнтів із переднім ГІМ та дисфункцією ЛШ. Також варто зауважити, що частота великих кровотеч у групі ППАТ не зростала. Усі включені хворі отримували ППАТ щонайменше один місяць, і більшості з них (98%) було рекомендовано продовжувати терапію протягом 12 місяців.
Отже, короткочасна ППАТ із застосуванням еноксапарину може бути ефективною та безпечною стратегією для запобігання розвитку ТЛШ без підвищення ризику кровотечі. Однак необхідне проведення масштабних проспективних рандомізованих досліджень із тривалішим періодом спостереження для додаткового вивчення ефекту ППАТ.
Підготувала Олена Коробка
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (72) 2020 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....