Комплексний регіонарний больовий синдром І типу: питання ґенезу, діагностики та лікування

Епідеміологія
Згідно з визначенням Міжнародної асоціації з вивчення болю (IASP), КРБС І – це розмаїття посттравматичних больових станів, що виникають регіонарно з домінуванням патологічних змін у дистальних відділах та перевищенням їхньої нормальної тривалості й інтенсивності для даного травмувального чинника. Ці патологічні зміни часто призводять до значних порушень рухової функції та варіабельно прогресують із часом (Merskey, Bogduk, 1994).
На КРБС І страждає 6‑16% населення. На сьогодні зареєстровано понад 6 млн осіб із КРБС І (1:100 000). У 40% випадків ця патологія розвивається після переломів. КРБС І частіше виникає у жінок (2,3‑3:1) та пацієнтів віком 35‑55 років (Catelijne van Bussel et al., 2014).
Етіологія
Етіологія КРБС І є різноманітною та включає периферичні, центральні, змішані й інші чинники. До периферичних етіологічних факторів відносять травму кінцівки, хірургічні втручання, удар електрострумом, іммобілізацію. Серед центральних етіологічних факторів виділяють інсульт, розсіяний склероз, ураження спинного мозку, травми та пухлини мозку. Так званими змішаними причинами є оперізувальний герпес, травми плечового сплетіння тощо.
КРБС І може бути спровокований серцево-легеневими захворюваннями (стан після інфаркту міокарда, операції на серці, захворювання легень) або медикаментозно (фенобарбітал, ізоніазид, фентоламін тощо). КРБС І при онкопатологіях імовірніше розвивається як варіант паранеопластичного синдрому або їхній безпосередній наслідок, зокрема, при пухлині Панкоста. Своєю чергою ідіопатична форма може спостерігатися в дітей (частіше як ураження нижніх кінцівок), а транзиторні – під час вагітності.
Факторами ризику КРБС І є ревматичні захворювання, мігрень, остеомаляція, порушення менструального циклу, невропатія в анамнезі, бронхіальна астма.
Таким чином, ревматологічні, онкологічні та паранеопластичні захворювання створюють фон для формування комплексу змін, що призводить до хронізації процесу.
Патогенез
Механізми розвитку КРБС І остаточно не вивчені, але відомо, що провідним є периферична сенситизація тканин. Також певна роль належить центральній сенситизації, порушенню функції симпатичної нервової системи та перебудові сенсорних і рухових зон кори головного мозку.
Щодо патогенетичних складових розвитку КРБС І, формування структурних порушень розпочинається у дистальних відділах, що зумовлено альтерацією (пошкодження, травма), яка супроводжується запаленням із наступною активацією супраспінальних структур на рівні гіпоталамічних утворень, кори мозку. Дані зміни проходять на рівні регуляторних механізмів пре-/посткапілярних сфінктерів. Як наслідок – виникають периферичні вазомоторні зміни й порушення, активація біологічно активних речовин, калікреїн-кінінової системи та α-адренорецепторів. Таким чином, формується хибне коло структурних порушень, що зумовлює клінічні ознаки КРБС І – насамперед біль.
Біль з’являється в результаті невідповідності між наміром виконати рух кінцівкою (рухова імпульсація) та відсутністю адекватної сенсорної відповіді (Ramachandran, 1996).
Клінічні симптоми та ознаки
Перша ознака КРБС І – ниючий, пекучий, пульсуючий або стріляючий біль. Також характерними є гіпералгезія, алодинія та гіперпатія. Це супроводжується вегетативними порушеннями, зокрема, у хворих спостерігаються ненормальне потовиділення або ангідроз, почервоніння чи синюшність кінцівки тощо. Трофічні зміни виникають через 10 днів після початку захворювання у 30% уражених кінцівок. При цьому мають місце ригідність і набряк, атрофія волосся, нігтів та/або шкіри.
Стадійність процесу є умовною, але еволюція змін у переважної більшості пацієнтів формується таким чином:
- Реактивне запалення (2‑3 місяці після травми). Кінцівка набрякла, гаряча, відмічаються гіперемія і сухість шкіри. Біль пекучий, ниючий, глибокий, пульсуючий.
- Розпал, або стадія дистрофії (3‑6 місяців). Кінцівка набрякла, холодна, бліда, синюшна, суха; шкіра атрофічна, порушується рухомість суглобів. На рентгенографії – плямистий остеопороз Зудека.
- Пізня, або стадія атрофії (від 6 місяців до кількох років). Біль має стійкий, інтенсивний характер. Вазомоторні розлади постійні та спричиняють знерухомлення кінцівки. Можливі розлади психіки, мнестичні й особистісні зміни.
Діагностика
Діагностика КРБС І переважно ґрунтується на клінічній картині. Сьогодні загальноприйнятими є так звані будапештські критерії (Harden et al., 2013):
1. Тривалий біль, диспропорційний ініціювальному чиннику.
2. Скарги чи дані анамнезу щонайменше за одним із симптомів у 3 з 4 наступних категорій:
- сенсорні: гіперестезія та/або алодинія;
- судинні: температурна асиметрія та/або зміни та/або асиметрія кольору шкіри;
- судинорухові/набряк: набряк та/або порушення потовиділення та/або асиметрія потовиділення;
- моторні/трофічні: зниження амплітуди рухів та/або рухова дисфункція та/або трофічні зміни.
3. Об’єктивні ознаки під часу огляду хоча б за одним симптомом принаймні у двох із наступних категорій:
- сенсорні: гіперестезія (на укол) та/або алодинія (на легке торкання та/або зміну температури та/або глибоке стискання та/або рух у суглобі);
- судинні: температурна асиметрія (>1 °C) та/або зміни та/або асиметрія кольору шкіри;
- судиномоторні/набряк: набряк та/або порушення потовиділення та/або асиметрія потовиділення;
- рухові/трофічні: зниження амплітуди рухів та/або рухова дисфункція та/або трофічні зміни.
4. Відсутній інший діагноз, що може краще пояснити наявні симптоми, ніж КРБС І.
Інший комплекс критеріїв пов’язаний з ім’ям голландського вченого П. Велдмана (Veldman et al., 1993). Діагноз КРБС І встановлюється на підставі 4 із 5 симптомів захворювання, як-то дифузний біль під час рухів або навантаження, градієнт температури, різниця в кольорі чи об’ємі між хворою та контрлатеральною кінцівками, обмеження амплітуди активних рухів хворої кінцівки.
В ортопедичній практиці також використовують так звані критерії Аткінса, що визначають невропатичний біль, судинорухові порушення, порушення потовиділення, набряк, тугорухомість та контрактуру в суглобі. Симптоми повинні підкріплюватися рентгенологічними ознаками остеопорозу через три місяці або підвищеним накопиченням радіофармпрепарату при остеосцинтіграфії на ранній стадії захворювання (Atkins, 2003).
Також використовують опитувальні тести, як-от візуально-аналогова шкала (ВАШ), опитувальники болю МакГілла, опитувальник DN‑4 для визначення невропатичного характеру болю тощо. Додаткові методи обстеження: термографія, тест симпатичної відповіді шкіри, кількісний судиномоторний тест, магнітно-резонансна томографія, радіоізотопне сканування та ін.
Лікування
Основною метою терапії є зменшення набряку, покращення рухомості суглобів, усунення больового синдрому та його причин, м’язової контрактури, покращення якості життя пацієнта і функціональної працездатності кінцівки. Основний принцип лікування полягає в застосуванні комплексного підходу, що впливає на центральний та периферичний компоненти патогенезу та враховує стадію захворювання.
Використовують як медикаментозні, так і не медикаментозні (фізіо-, психо-, кріотерапія, інфільтраційна терапія, руховий режим) методи, а також оперативне лікування. Фармакотерапія включає місцеві антестетики, опіати, антиконвульсанти, антидепресанти, нестероїдні протизапальні препарати (НПЗП), міорелаксанти центральної дії тощо (Danilov, 2003).
Варто зауважити, що застосування НПЗП сьогодні є одним із базових методів лікування. Зокрема, висока ефективність, швидкість дії та профіль безпеки помірно селективного інгібітора ЦОГ‑2 етодолаку дозволяють широко використовувати його при КРБС І.
Відповідно до рекомендацій Міжнародного товариства з вивчення спондилоартритів (ASAS), ефективність етодолаку в дозі 600 мг є зіставною з диклофенаком (150 мг), ацеклофенаком (200 мг), еторикоксибом (90 мг), мелоксикамом (15 мг) (Grisanti et al., 1992; Zochling et al., 2006).
Препарат Етол Форт компанії Nobel (1 таблетка містить 400 мг етодолаку) забезпечує потужне знеболення та характеризується сприятливим профілем безпеки. Зокрема, етодолак (400 мг/добу) безпечніший за диклофенак (100 мг/добу) щодо небажаних явищ із боку шлунково-кишкового тракту – у 9 разів рідша частота виникнення диспепсії, у 7 разів – абдомінального болю (Taipei Medical University Hospital, 2003). Порівняно з коксибами етодолак має вищий профіль безпеки відносно серцево-судинної системи (Motsko et al., 2006). Максимальна добова доза етодолаку становить 1000 мг/добу.
Також слід відмітити, що додавання до стандартних доз НПЗП міорелаксанту центральної дії зі знеболювальним ефектом тіоколхікозиду (препарат Тійозид® компанії Nobel) при симптоматичному лікуванні болю дає кращі результати, дозволяючи синергічно зменшити больовий синдром та м’язове напруження. Тійозид® здатний розривати патологічне коло «біль – м’язовий спазм – ішемія – прозапальні цитокіни – подразнення больових рецепторів». Він проявляє селективну афінність до рецепторів ГАМК і гліцину, міорелаксуючий ефект проявляється переважно на супраспінальному рівні.
Поєднання препарату Етол Форт (етодолаку) по 1 таблетці 400 мг двічі на добу з Тійозидом® (тіоколхікозидом) по 1 таблетці 8 мг/добу добре переноситься та не викликає підвищення частоти побічних ефектів (Aksoy et al., 2002). Наприклад, у дослідженні за участю пацієнтів із гострим болем у попереку було засвідчено безпеку й ефективність комбінації 8 мг/добу тіоколхікозиду + 800 мг/добу етодолаку порівняно з 300 мг/добу толперизону + 800 мг/добу етодолаку, зокрема, втричі нижчу частоту виникнення сонливості та значно більшу ефективність у знятті болю та спазму. Як наслідок, було рекомендовано саме комбінацію тіоколхікозиду з етодолаком (Gorg et al., 2003).
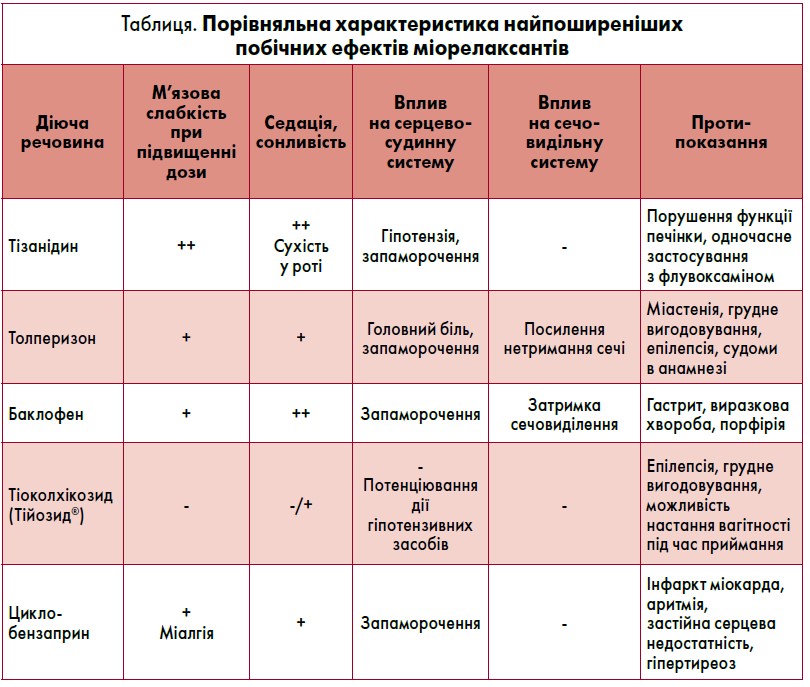
Порівняльну характеристику найчастіших побічних ефектів міорелаксантів наведено у таблиці.
Відтак, застосування патогенетично обґрунтованої комбінації фармакотерапевтичних засобів у комплексному лікуванні осіб із КРБС І на тлі переломів дистального кінця променевої кістки дозволяє ефективно зменшити інтенсивність больового синдрому, усунути ознаки невропатичного болю та значно покращити функціональну здатність ураженої кінцівки.
Підготувала Олександра Демецька
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (72) 2020 р.
СТАТТІ ЗА ТЕМОЮ Ревматологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Зв’язок між рівнем сироваткової сечової кислоти (ССК) і ризиком серцево-судинних захворювань (ССЗ) упродовж багатьох років є предметом вивчення дослідників. Установлено, що рівень ССК – незалежний предиктор смерті від усіх причин і серцево-судинної смерті, зокрема від гострого коронарного синдрому, інсульту та серцевої недостатності (СН). Також опубліковано багато робіт про зв’язок між ССК і функцією нирок. Попри значну кількість публікацій, деякі моменти, а саме: яким є оптимальний поріг ССК для визначення ризику ССЗ, чи необхідна корекція значень ССК для функції нирок, чи є ССК ключовим патологічним елементом метаболічної дисрегуляції, потребують прояснення....