Значення ультрасонографії у діагностиці гемофілічних артропатій
 Гемофілія – це спадкове порушення процесу згортання крові, яке характеризується зниженням або порушенням синтезу факторів згортання крові VIII (гемофілія А) чи IX (гемофілія В, або хвороба Крістмаса). Гемофілії притаманна спонтанна кровотеча, яка виникає головним чином у синовіальних суглобах. При тяжкій формі гемофілії (рівень фактора згортання VIII/IX <1%) множинні повторні кровотечі викликають каскад запальних і дегенеративних процесів, які ушкоджують та змінюють синовіальну оболонку, що супроводжується руйнуванням хряща та кісткової тканини. Патологічні та фізіологічні процеси, які проходять у синовіальному суглобі внаслідок крововиливу, впливають один на одного, можуть відбуватися паралельно або послідовно і призводять до виникнення специфічного ураження суглобів – гемофілічної артропатії (ГА). ГА є основною причиною інвалідизації та втрати працездатності осіб з гемофілією. Це не тільки перешкода для повноцінного життя та професійного розвитку окремої особи, а й економічне навантаження на системи охорони здоров’я та соціального захисту держави. Як пацієнти, так і держава зацікавлені в уникненні розвитку цього ускладнення та максимальному зменшенні його проявів.
Гемофілія – це спадкове порушення процесу згортання крові, яке характеризується зниженням або порушенням синтезу факторів згортання крові VIII (гемофілія А) чи IX (гемофілія В, або хвороба Крістмаса). Гемофілії притаманна спонтанна кровотеча, яка виникає головним чином у синовіальних суглобах. При тяжкій формі гемофілії (рівень фактора згортання VIII/IX <1%) множинні повторні кровотечі викликають каскад запальних і дегенеративних процесів, які ушкоджують та змінюють синовіальну оболонку, що супроводжується руйнуванням хряща та кісткової тканини. Патологічні та фізіологічні процеси, які проходять у синовіальному суглобі внаслідок крововиливу, впливають один на одного, можуть відбуватися паралельно або послідовно і призводять до виникнення специфічного ураження суглобів – гемофілічної артропатії (ГА). ГА є основною причиною інвалідизації та втрати працездатності осіб з гемофілією. Це не тільки перешкода для повноцінного життя та професійного розвитку окремої особи, а й економічне навантаження на системи охорони здоров’я та соціального захисту держави. Як пацієнти, так і держава зацікавлені в уникненні розвитку цього ускладнення та максимальному зменшенні його проявів.
Автори вважають, що для досягнення цієї мети потрібна прецизійна та своєчасна діагностика стану суглоба. Традиційно з цією метою використовували рентгенографію, а в останні роки – магнітно-резонансну томографію (МРТ), проте зазначені методи мають низку негативних моментів, які обмежують їх застосування як рутинних у пацієнтів з ГА. Зокрема, рентгенографія не дає змоги оцінити стан хряща та синовіальної оболонки, а МРТ має високу вартість. Крім цього, дослідження суглобів необхідно проводити регулярно залежно від клінічного перебігу хвороби, але не рідше одного разу на рік. На думку авторів, ультразвукове дослідження (УЗД) за співвідношенням доступності/діагностичної цінності є оптимальним для виконання цього завдання. Наведемо теоретичне підґрунтя та методику застосування УЗД у діагностиці ГА й оцінці стану суглобів у пацієнтів із гемофілією.
Огляд літератури
Зміни, які виникають у синовіальному суглобі, можна описати як спричинене кров’ю захворювання суглоба (Blood induced joint disease – BIJD) [1].
При виникненні першого (перших) крововиливу у порожнину суглоба під впливом іонів заліза гемоглобіну утворюються вільні кисневі радикали, які викликають апоптоз хондроцитів [2]. Аналіз двох біомаркерів – олігометричного протеїну хрящового матриксу та телопептидів колагену 2 типу – показує, що суглобовий хрящ є першою мішенню в розвитку BIJD [3-5]. Наступним в патогенезі є те, що змінена під впливом гемосидерину синовіальна оболонка починає продукувати прозапальні цитокіни, спричиняючи внутрішньосуглобову «цитокінову бурю», яка далі ушкоджує хрящ, а згодом і кістку. У хрящовому матриксі починаються дегенеративні зміни, зумовлені протеїназами сполучної тканини, які утворюються в гіпертрофованій синовії, хондроцитах та у так званій тканині пануса [6-8].
Суглобовий хрящ окрім клітинних елементів складається переважно з води, електролітів і хрящового матриксу – поєднання волокон колагену та протеогліканів (глікозаміногліканів) [9]. Наявність крові в порожнині суглоба веде до зменшення кількості протеогліканів, що послаблює матрикс [10]. Інтерлейкін (IL)-1 в поєднанні з продуктами гемолізу інгібує синтез простагландинів, що безпосередньо спричиняє деструкцію матриксу [11].
Накопичення заліза в порожнині суглоба підвищує синтез ДНК синовіальними фібробластами, а також стимулює проліферацію синовіальних клітин, що призводить до гіпертрофії синовії та її хронічного запалення. Серед клітин синовіальної оболонки особливу роль відіграють гемофілічні фібробластоподібні синовіоцити (НА-FLS клітини). Ці клітини мають вирішальне значення у патогенезі хронічних запальних захворювань суглобів, таких як ревматоїдний артрит і гемофілічна артропатія. Гемофілічні НА-FLS клітини внаслідок безпосереднього контакту з кров’ю можуть стимулювати експресію викиду запальних цитокінів [12]: фактора некрозу пухлини, інтерферону-γ, IL‑1, IL‑6 [13].
При вивченні ультраструктури синовіальної оболонки у пацієнтів з гемофілією були виявлені щільні залізовмісні гранули (сидеросоми), змішані сидеросоми та електронощільні частинки в цитоплазмі синовіальних клітин, субсиновіальних макрофагів і фібробластів [14].
Розвиток судин та ангіогенез є наслідком як фізіологічних, так і патологічних процесів. Подібно до росту пухлин, неоангіогенез при ГА дає змогу синовії збільшуватись за межі товщини в декілька міліметрів [15]. Нові капіляри формуються з ендотеліальних клітин і перицитів, утворених із різних інтимних/субінтимних гладеньком’язових клітин [16]. Перицити є ензимоактивними клітинами, які забезпечують цілість і безперервний ріст судин шляхом фібринолізу та протеолітичної деградації позаклітинного матриксу [17].
З подальшим розвитком BIJD починається ремоделювання кісткової тканини за рахунок підвищення активності остеокластів (але не остеобластів). Це зрозуміло з підвищення рівнів біомаркерів цього процесу, виявленого в дослідженнях [18-20]. Унаслідок цього щільність мінералізації кістки знижується, що призводить до виникнення остеопорозу, який пов’язують із розвитком ГА вже протягом більше п’яти десятиліть [21, 22]. Вираженість остеопорозу часто використовують для класифікації тяжкості ГА.
Протягом останніх десятиліть профілактичне лікування при гемофілії вважають оптимальним для запобігання кровотечам і збереження функції суглобів та відповідно – підвищення якості життя. Профілактика поділяється на первинну, вторинну та третинну залежно від наявності уражених суглобів, від результатів клінічного та додаткового (УЗД або МРТ) обстежень, а також від віку пацієнта. Метою профілактичного лікування є переведення тяжкої форми гемофілії у легшу з постійним підтриманням рівня дефіцитного фактора >1%. Профілактика може бути додатково персоналізована для поліпшення результатів та економічної ефективності лікування. Персоналізована профілактика найкраще здійснюється з урахуванням фенотипу кровоточивості, стану суглобів і даних фармакокінетичних обстежень, фізичної активності та способу життя. Однак якщо безперервне профілактичне лікування є неможливим, наприклад через відсутність фінансування та достатньої кількості антигемофільних препаратів, чи має місце утруднений венозний доступ, необхідне агресивне лікування власне гемартрозів (включаючи артроцентез), щоб запобігти розвитку хронічного синовіїту та надалі – ГА.
За неефективності первинної та вторинної профілактики й лікування консервативними методами (введення факторів згортання крові, протизапальна терапія, фізіотерапія) [23] обирають синовектомію – специфічний метод лікування гемофілічних артропатій, який полягає у видаленні (хімічному, радіоізотопному чи хірургічному) патологічно зміненої синовіальної оболонки [24]. Цей метод перебуває на межі профілактики та лікування і дозволяє розірвати порочне коло запально-патологічних змін синовіальної оболонки – патологічної васкуляризації синовії – гемартрозу.
Для хімічної синовектомії протягом останніх 50 років широко використовували осмієву кислоту, D-пеніциламін, рифампіцин [25] та окситетрациклін [26]. Найширшого застосування набув рифампіцин, ефективність якого доведена у дослідженнях [27], особливо у дітей молодшого віку, і при введенні у малі суглоби. Проте при застосуванні у дорослих і у великі суглоби ефективність рифампіцину значно поступається такій радіоізотопних препаратів [28].
Радіоізотопна синовектомія полягає у внутрішньосуглобовому введенні радіофармакологічних препаратів. Найчастіше використовують цитрат чи силікат ітрію (90Y), сульфід ренію (186Re), хромований фосфор (32Р) [29]. Застосування радіоізотопних препаратів має низку переваг перед хімічною синовектомією, оскільки ефект від їх уведення більш виражений і тривалий, відповідно потрібна значно менша кількість препарату та на порядок менша кількість ін’єкцій.
У разі неефективності хімічної та радіоізотопної синовектомії застосовують хірургічну тактику, яка поділяється на два основні види: відкрита й артроскопічна синовектомія. Хірургічна синовектомія показана пацієнтам з активним гемартрозом, розірваною кістою Бейкера, розривами ротаторної манжети плеча чи іншими травматичними ушкодженнями суглобів, які призводять до їх нестабільності. Тяжкі стадії гемофілічної артропатії з вираженим звуженням суглобової порожнини, вираженою контрактурою суглоба є протипоказанням до операції [30].
Відкрита синовектомія попри свою ефективність у запобіганні повторним крововиливам має і недоліки: інвазивність (широкий доступ), використання великої кількості фактора у замісній терапії, тривале перебування в лікувальному закладі, вища частота післяопераційних ускладнень (інфекція, контрактури, післяопераційний гемартроз) обмежують застосування цього методу [31].
Артроскопічна синовектомія після першого застосування в 1970 р. зарекомендувала себе як ефективний і безпечний метод лікування порівняно з відкритою операцією. Швидке одужання та відновлення після операції, мала частота післяопераційних кровотеч, коротке перебування на стаціонарному лікуванні, збільшення об’єму рухів – ось перелік факторів, які зробили артроскопічну операцію методом вибору у лікуванні колінних, надп’ятково-гомілкових і ліктьових суглобів у хворих на гемофілію [32]. Дослідження [33, 34] показали виражене зменшення на 84% кількості епізодів повторних гемартрозів у післяопераційний період.
Пацієнти з ураженням одного суглоба, який відомий як суглоб-мішень, з підгострим чи хронічним синовіїтом, що не піддається консервативному лікуванню протягом 3-6 місяців та супроводжується частими гемартрозами, є кандидатами для артроскопічної синовектомії. Всім пацієнтам перед операцією слід проводити дослідження на інгібітори факторів згортання крові та рентгенографію суглоба, оскільки високий рівень інгібіторів та пізні стадії гемофілічної артропатії можуть бути відносним протипоказанням для проведення хірургічного втручання.
На сьогодні не існує універсальних показників для оцінки результатів ефективності консервативного лікування чи показань для хірургічного лікування ГА, тому взаємодія між гематологами, лікарями променевої діагностики та хірургами-ортопедами є вирішальною. Розроблені клінічні класифікації, МРТ- та рентгенологічні класифікації стадій гемофілічної артропатії, проте жодна з них не дає однозначної відповіді, чи синовіальна оболонка є патологічно змінена, чи консервативне лікування (в тому числі хімічна та радіоізотопна синовектомія) є ефективним.
УЗД в останні роки набуває все більшої значущості в оцінці стану суглобів, у тому числі у пацієнтів з ГА, за рахунок постійного покращення діагностичної техніки, появи високочастотних трансдюсерів (датчиків), розроблення нових режимів сканування, засобів підсилення сигналу та алгоритмів покращення зображення. УЗД має низку важливих переваг, які виводять його на чільне місце додаткових методів дослідження. Які ж з цих переваг особливо важливі при обстеженні пацієнтів з ГА? Насамперед це висока діагностична цінність, яка тільки незначно поступається такій МРТ, проте, на відміну від МРТ, обстеження проводиться в режимі реального часу, що дозволяє виконувати його одночасно з функціональними пробами, а лікар має можливість взаємодіяти з пацієнтом. У результаті отримують, так би мовити, клініко-ультрасонографічну картину стану суглоба, що є поєднанням як інструментального, так і клінічного обстеження.
Доступність методу полягає в тому, що обстеження проводиться на діагностичних системах середнього й експертного класів, які наявні в більшості лікувальних закладів України. Єдиною вимогою для діагностичної системи є наявність доплерівського картування, що становить базову опцію для абсолютно всіх сучасних систем.
Обстеження проводиться протягом 10‑15 хв (для одного суглоба) у зручному для пацієнта положенні тіла. Вартість обстеження на порядок нижча від аналогічної МРТ, воно є безпечним, оскільки не пов’язане з іонізуючим випромінюванням, як рентгенографія. Вищевказані обставини дозволяють виконувати обстеження відносно часто, при клінічній потребі або для скринінгу стану суглоба.
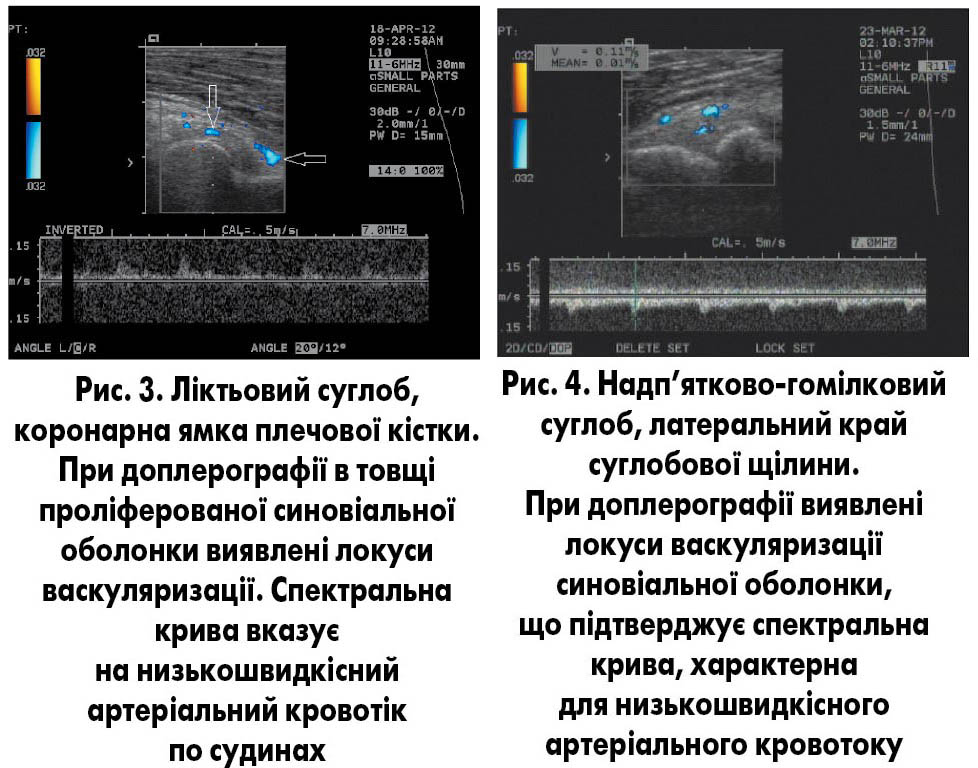
Проте найбільшою перевагою УЗД є можливість докладної візуалізації й оцінювання синовіальної оболонки суглоба. Як було зазначено вище, остання під дією заліза крові патологічно змінюється і стає джерелом прозапальних цитокінів, а також джерелом повторних гемартрозів. Основними ознаками цієї патологічної зміни є проліферація, гіпертрофія та неоваскуляризація ворсинок синовії. Автори переконані, що функція доплерографії, яка використовується в апаратах УЗД, дозволить реєструвати цей низькошвидкісний потік крові по судинах синовії і тим самим ідентифікувати у ній патологічні зміни. Ці дані можна використати як ознаку ефективності лікування та профілактики, а також як показання для хірургічного лікування (синовектомії). Слід наголосити, що жоден інший метод діагностики (крім, звичайно, гістологічного дослідження видаленої синовіальної оболонки при хірургічній синовектомії) не дозволяє реєструвати низькошвидкісний кровотік по судинах синовії.
Метою нашої роботи є визначення можливостей УЗД для оцінювання властивостей синовіальної оболонки (товщини, характеру проліферації, васкуляризації), що дозволить ідентифікувати її патологічну зміну (гемосидерозний синовіїт). Для досягнення цієї мети поставлені такі завдання:
- Визначити оптимальні показники УЗД-апарата й трансдюсера для найбільш інформативної візуалізації синовіальної оболонки.
- Визначити оптимальні доступи для найкращої візуалізації синовії в колінному, ліктьовому та надп’ятково-гомілковому суглобах (суглоби, які найчастіше уражаються при ГА).
- Дослідити основні види проліферації синовії.
- Визначити оптимальні режими доплерівського сканування синовії для вивчення її васкуляризації.
- Застосувати отримані результати для дослідження й опису стану синовіальної оболонки в пацієнтів.
Матеріали та методи
Для обстеження пацієнтів з ГА застосовували діагностичну систему Acuson Sequoia 512 з лінійним трансдюсером зі змінними частотами від 7,5 до 12 МГц, функцією доплерографії (енергетичної та швидкісної). Були оглянуті 65 пацієнтів з клінічними та рентгенологічними ознаками ГА віком від 8 до 36 років, у яких було обстежено 105 уражених суглобів (50 колінних, 31 надп’ятково-гомілковий, 24 ліктьових).
Обстеження колінного суглоба. Для обстеження основних заворотів капсули суглоба використовували такі стандартні доступи:
- поздовжній аксіальний над основою наколінка – для візуалізації наднаколінкового завороту;
- поздовжній передньо-медіальний по медіальному краю наколінка – для візуалізації медіального крилоподібного завороту;
- поздовжній передньо-латеральний по латеральному краю наколінка – для візуалізації латерального крилоподібного завороту;
- поздовжній медіальний на рівні суглобової щілини – для візуалізації медіального надменіскового та медіального підменіскового заворотів;
- поздовжній латеральний на рівні суглобової щілини – для візуалізації латерального надменіскового та латерального підменіскового заворотів;
- задній сагітальний – для візуалізації заворотів задньої фіброзої капсули та кісти Бейкера;
- поздовжній задньо-латеральний на рівні суглобової щілини – для візуалізації заднього верхнього та нижнього латеральних заворотів;
- поздовжній задньо-медіальний на рівні суглобової щілини – для візуалізації заднього верхнього та нижнього медіального заворотів.
Обстеження ліктьового суглоба:
- передній сагітальний доступ на рівні коронарної ямки плечової кістки;
- передній горизонтальний на рівні коронарної ямки плечової кістки;
- поздовжній медіальний (ліктьовий) на рівні суглобової щілини;
- поздовжній латеральний (променевий) на рівні суглобової щілини;
- задній сагітальний доступ на рівні ліктьової ямки плечової кістки в положенні зігнутого до 90° суглоба.
Обстеження надп’ятково-гомілкового суглоба:
- передній сагітальний доступ на рівні блоку надп’яткової кістки;
- поздовжній медіальний по передньому краю медіальної кісточки;
- поздовжній латеральний по передньому краю латеральної кісточки;
- задній сагітальний доступ на рівні блоку надп’яткової кістки.
З вищеназваних доступів можна візуалізувати основні великі завороти суглобів, у яких можна чітко дифереціювати синовіальну оболонку, провести її вимірювання та доплерографічне дослідження.
Вимірювання синовіальної оболонки проводили засобами діагностичної системи з точністю до 0,1 мм. Доплерографію виконували у 2 основних режимах: енергетичному та швидкісного картування. При цьому визначали наявність доплерівського сигналу в товщі синовії, що свідчило про рух крові по судинах синовії. Для диференціювання цього сигналу від можливих артефактів та невимушеного руху самого трансдюсера проводили реєстрацію сигналу у вигляді кривої (дуплексне обстеження). Отримана крива чітко вказувала на пульсову хвилю та була свідченням, що отриманий сигнал не є артефактом.
Результати
При обстеженні суглобів отримані такі результати (рис. 1-4).
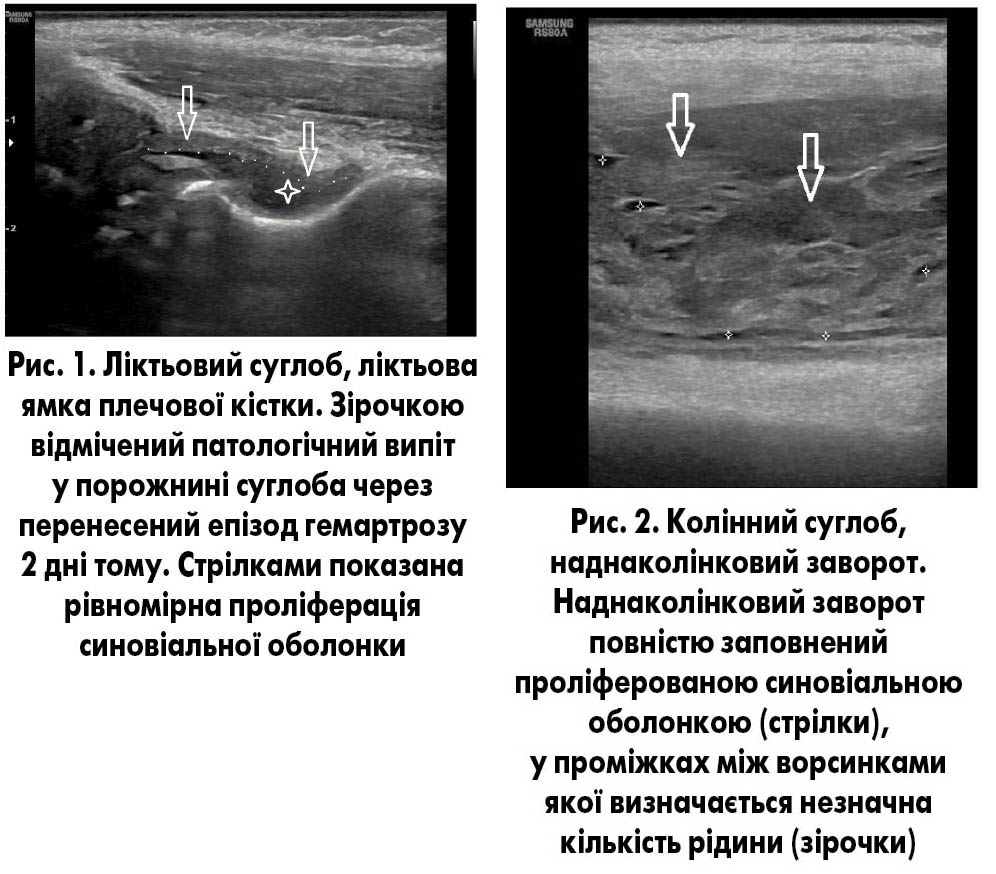
Колінні суглоби (всього обстежено 50). У 42 суглобах у порожнині заворотів визначався патологічний випіт, у 35 з них на фоні випоту мала місце проліферація синовіальної оболонки. Товщина синовії сягала від 3 до 7 мм. Проліферація в більшості випадків була нерівномірна, найбільше проявлялась у наднаколінковому та латеральних заворотах суглобів. Типи проліферації – дифузне потовщення (12), формування гіпермобільних гіпертрофованих ворсинок (15), а також змішаний тип проліферації (8). При доплерографії васкуляризація синовії була виявлена у 28 випадках. Васкуляризація найчастіше визначалась у ділянках прикріплення капсули до кістки, переважно в дистальних відділах крилоподібних заворотів, а також у над- та рідше підменіскових заворотах. Більш чутливим для визначення васкуляризації синовії є енергетичне доплерівське сканування.
Ліктьові суглоби (всього обстежено 24). У 20 у порожнині заворотів визначався патологічний випіт, у 15 з них на фоні випоту мала місце проліферація синовіальної оболонки. Товщина синовії в цих випадках сягала від 2 до 5 мм. Проліферація в більшості випадків була нерівномірна, найбільше проявлялась у ділянці ліктьової та коронарної ямок плечової кістки. Типи проліферації – дифузне потовщення (9), формування гіпермобільних гіпертрофованих ворсинок (2), а також змішаний тип проліферації (4). При доплерографії васкуляризація синовії була виявлена у 15 випадках. Васкуляризація найчастіше визначалась у ділянках прикріплення капсули до кістки, переважно в бічних заворотах і в ділянці коронарної ямки. Більш чутливим для визначення васкуляризації синовії є енергетичне доплерівське сканування.
Надп’ятково-гомілкові суглоби (всього обстежено 31). У 22 у порожнині заворотів визначався патологічний випіт, у 12 з них на фоні випоту мала місце проліферація синовіальної оболонки. Товщина синовії в цих випадках сягала від 2 до 4 мм. Проліферація в більшості випадків була нерівномірна, найбільше проявлялась у ділянці переднього завороту суглоба. Типи проліферації – дифузне потовщення (10), формування гіпермобільних гіпертрофованих ворсинок (3), а також змішаний тип проліферації (5). При доплерографії васкуляризація синовії була виявлена у 8 випадках. Васкуляризація найчастіше визначалась у ділянках прикріплення капсули до кістки, переважно в бічних заворотах і ділянці переднього завороту. Більш чутливим для визначення васкуляризації синовії є енергетичне доплерівське сканування.
Висновки
Золотим стандартом запобігання розвитку ГА є індивідуалізована профілактика факторами згортання крові на основі показників фармакокінетики. Отримані дані дозволяють планувати адекватну персоналізовану профілактику й обирати подальшу тактику лікування пацієнта.
Хворі на гемофілію з атиповим клінічним перебігом та прогресуючою артропатією потребують своєчасного хірургічного втручання – артроскопічної синовектомії.
УЗД суглобів у пацієнтів з ГА зарекомендувало себе як доступний високоінформативний метод діагностики патологічних змін синовіальної оболонки, які об’єднані терміном «гемосидерозний синовіїт». За допомогою доплерографії УЗД дозволяє виявити основну ознаку патологічної зміни синовіальної оболонки – її патологічну васкуляризацію.
Література
- Wessel L.M., Scholz S., Rusch M. Characteristic pattern and management of intra-articular knee lesions in different pediatric age groups. J Pediatr Orthop. 2001; 21: 14-9.
- Roosendaal G., Lafeber F.P. Pathogenesis of haemophilic arthropathy. Haemophilia. 2006; 12(suppl. 3): 117-21.
- Jansen N.W., Roosendaal G., Wenting M.J., Bijlsma J.W., Theobald M., Hazewinkel H.A., Lafeber F.P. Very rapid clearance after a joint bleed in the canine knee cannot prevent adverse effects on cartilage and synovial tissue. Osteoarthritis Cartilage. 2009; 17: 433-40.
- Saxne T., Heinegard D. Cartilage oligomeric matrix protein: a novel marker of cartilage turnover detectable in synovial fluid and blood. Br J Rheumatol. 1992; 31: 583‑91.
…
34. Journeycake J.M., Miller K.L., Anderson A.M., Buchanan G.R., Finnegan M. Arthroscopic synovectomy in children and adolescents with hemophilia. J Pediatr Hematol Oncol. 2003; 25: 726‑31.
Повний список літератури знаходиться в редакції.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...