Нейропротекторний потенціал холіну альфосцерату: залучення нейротрофічних сигнальних шляхів
Хвороба Альцгеймера (ХА) – найпоширеніше нейродегенеративне захворювання у світі, що характеризується порушеннями когнітивних функцій та пам’яті. Пошук нових терапевтичних підходів надзвичайно важливий для протидії цьому розладу. Пропонуємо до вашої уваги огляд статті M. Catanesi et al., у якій викладено результати дослідження ефективності холіну альфосцерату для запобігання загибелі нейронів у моделях ХА in vitro, що представляють ранню стадію хвороби. За отриманими даними, холіну альфосцерат активує нейротрофіновий шлях виживання та протидіє згубному ефекту β-амілоїду (Аβ), сприяючи зменшенню апоптотичної загибелі клітин і збереженню морфології нейронів. Матеріал опубліковано у виданні Cell Biology International (2020; 44 (8): 1734‑1744).
Холіну альфосцерат (L-α-гліцерилфосфорилхолін [α-ГФХ]), похідне фосфатидилхоліну, може посилювати холінергічну передачу шляхом активації ацетилхоліну в гіпокампі. Холін є важливим нутрієнтом, що відіграє потужну роль у різних шляхах розвитку ХА, як-то холінергічна дисфункція, порушення функції та формування синаптичної мембрани, а також метаболізм фосфоліпідів і метильних груп. При ХА потреба в холіні підвищена, адже його високий рівень у мозку необхідний для виправлення дефектів синапсів (Tayebati, Amenta, 2013).
Захисні ефекти α-ГФХ продемонстровано як на експериментальних моделях, так і в дослідженнях за участю пацієнтів з інсультом (De Jesus Moreno Moreno, 2003). Крім того, α-ГФХ чинив сприятливий вплив при ХА та деменції в подвійних сліпих рандомізованих плацебо-контрольованих клінічних дослідженнях (Gavrilova et al., 2018; Tayebati et al., 2009). Також на моделі in vivo було описано потенційну терапевтичну дію α-ГФХ за когнітивних порушень, спричинених індукованими пілокарпіном судомами (Lee et al., 2017, 2018).
Нещодавно А. Cuello et al. (2019) запропонували гіпотезу щодо ролі кортикальної холінергічної системи в патогенезі ХА. Вони повідомили про послаблення трофічної підтримки фактором росту нервів (ФРН), що призводить до втрати холінергічних нейронів базального переднього мозку. В межах іншого дослідження спостерігався позитивний ефект добавок холіну в дорослому віці. Зокрема, у мишей із ХА було показане уповільнене прогресування патології та поліпшення результатів поведінкових тестів. На додаток, вживання добавок холіну сприяло зменшенню мікрогліозу та відкладенню Аβ (Wang et al., 2019).
Холінергічні нейрони базального переднього мозку залежать від ФРН, потрібного для підтримки холінергічного фенотипу у дорослому віці та виживання нейронів під час розвитку. M. Catanesi et al. (2020) висунули гіпотезу про зміну шляху, який контролює дозрівання попередника ФРН (про-ФРН) до ФРН, у разі виникнення ХА. Порушення шляху дозрівання ФРН було продемонстроване при ХА та амілоїдних патологіях. Ця гіпотеза базується на прогнозованому зниженні когнітивних функцій, що має місце у пацієнтів із синдромом Дауна, в яких розвивається ХА. Останні повідомлення свідчать, що холінергічна система, а отже і ФРН можуть відігравати ключову роль у патогенезі ХА. Тому холінергічна терапія є корисною для збереження нейронів базального переднього мозку, що матиме важливе значення при лікуванні осіб із ХА.
За наявними даними, біосинтез та сигнальний шлях мозкового нейротрофічного фактора (МНТФ) залучені в патогенезі ХА (Budni et al., 2015). Дослідження S. Peng et al. (2005) показало, що рівень зрілого МНТФ в тім’яній корі знижується при розвитку ХА. Це дозволяє припустити, що порушення гомеостазу МНТФ є ранньою подією в патогенезі ХА (Zhang et al., 2012).
Останніми роками брак ефективної терапії нейродегенеративних захворювань зумовив значний інтерес до використання холіну альфосцерату. Було продемонстровано його потужний нейропротекторний потенціал щодо поліпшення когнітивних функцій та відстрочення початку деменції (Castelli et al., 2020). α-ГФХ сприяв купіруванню зниження когнітивних функцій та проявів деменції (De Jesus Moreno Moreno, 2003; Lee et al., 2017). Однак механізми, що лежать в основі стимулювальної дії α-ГФХ і приводять до когнітивного поліпшення, натепер переважно невідомі.
У дослідженні M. Catanesi et al. (2020) для розкриття молекулярних механізмів потенційних нейропротективних ефектів α-ГФХ було використано модель ХА in vitro, що представляє ранню стадію захворювання. Зокрема, автори вивчали вплив α-ГФХ до та після індукції ушкодження мозку внаслідок відкладення Аβ.
Матеріали та методи дослідження
У дослідженні використовували:
- лінію клітин людської нейробластоми SH-SY5Y, що застосовується для моделювання ХА in vitro, модифіковане середовище DMEM та бичачу ембріональну сироватку;
- первинні антитіла: кролячі поліклональні антитіла до людських нейрофіламенту 200 (анти-NF200), фосфорильованої протеїнкінази В (анти-p-Akt), фосфорильованого тропоміозинового рецептора кінази B (анти-p-TrkB), про-ФРН (анти-про-ФРН); кролячі моноклональні антитіла до людських МНТФ (анти-МНТФ) та фосфорильованої кінази, регульованої позаклітинними сигналами (анти-p-ERK5); мишачі поліклональні антитіла до людської Jun-N-термінальної кінази (анти-JNK); мишачі моноклональні антитіла до актину, кон’юговані з пероксидазою хрону, та людської каспази 9 (антикаспаза 9);
- вторинні антитіла: козячі до кролячого імуноглобуліну G (IgG), кон’юговані з барвником Alexa Fluor 488; козячі, кон’юговані з пероксидазою, до мишачого та кролячого Ig G.
Культура клітин та експериментальні методи
Клітинну лінію SH-SY5Y висівали на DMEM. Щоб викликати диференціацію, через 24 год після висіву клітини обробляли розчином політрансретиноєвої кислоти й інкубували протягом 72 год, а потім у свіжому середовищі розчинами α-ГФХ із різними концентраціями та/або розчином олігомерного Aβ (1‑42), який використовували для моделювання ранньої стадії патогенезу ХА (Brouillette, 2014). Обробку α-ГФХ проводили до та після індукції Аβ-ушкодження.
У першій моделі in vitro клітини інкубували з олігомерним Aβ (1‑42) протягом 1 год, а потім додавали різні концентрації α-ГФХ. Процедури тривали 24 год. Ця модель імітувала ранню фазу ХА та дозволяла вивчати вплив α-ГФХ на прогресування захворювання. У другій моделі in vitro клітини інкубували з різними концентраціями α-ГФХ упродовж 24 год, а потім додавали Аβ (1‑42) і підтримували культуру додаткові 24 год. Ця модель імітувала можливі профілактичні ефекти α-ГФХ проти нейродегенерації.
Тест на життєздатність клітин
Культури клітин (контрольні та оброблені), висіяні на 96 багатолункових планшетах, інкубували протягом 2 год, після чого оцінювали показник життєздатності колориметричним методом, основаним на кількості утвореного формазану. Життєздатність оцінювали при довжині хвилі 490 нм за допомогою апарату для зчитування, застосовуваного для твердофазного імуноферментного аналізу (ELISA).
Аналіз білкового спектра та вестерн-блотинг
Для екстракції білка та проведення вестерн-блотингу клітини висівали на чашки Петрі, промивали натрій-фосфатним буфером і зчищали у крижаний буфер для радіоімунопреципітаційного аналізу (Catanesi et al., 2018). Лізат піддавали центрифугуванню, супернатант використовували для електрофорезу в поліакриламідному гелі з додаванням додецилсульфату натрію. Білки з гелю переносили на полівінілідендифторидні мембрани та блокували у знежиреному молоці 1 год.
Мембрани інкубували з первинними антитілами, як-то анти-p-Akt (1:1000), анти-МНТФ (1:500), анти-p-TrkB (1:500), анти-p-ERK5 (1:500), анти-про-ФРН (1:500), анти-JNK (1:500) та антикаспаза 9 (1:1000) протягом ночі при 4 °C. Після промивання мембрани інкубували із вторинними мишачими або кролячими антитілами, кон’югованими з пероксидазою хрону (1:30000). Імунореактивні смуги візуалізували за допомогою хемілюмінесценції.
Імунофлюоресценція
Клітини висівали на мікроскопні скельця (Benedetti et al., 2017). Після обробок препарати клітин тричі промивали натрій-фосфатним буфером, фіксували 3,7% розчином формальдегіду, блокували 4% розчином бичачого сироваткового альбуміну та інкубували з первинними антитілами (кролячі анти-NF200, 1:200) протягом ночі при 4 °C.
Після промивання клітини інкубували з барвником Alexa Fluor 488, повторно промивали й обробляли середовищем Vectashield, що містить барвник 4’,6-діамідин‑2-феніліндол (DAPI). Спостереження проводили за допомогою приладу AxioPhot Zeiss, зображення зі збільшенням ×20 отримували за допомогою програмного забезпечення LCS Leica.
Аналіз довжини невритів та виявлення анексину V
Для кількісної оцінки довжини невритів використовували по три імунофлуоресцентних зображення імунолокалізації нейрофіламенту 200 для всіх умов. Вимірювання за допомогою програмного забезпечення ImageJ та інструменту Simple Neurite Tracer були усереднені та статистично проаналізовані. Для виявлення анексину V, маркера апоптозу, клітини висівали на 96-лункові планшети, обробляли, а потім інкубували з барвником Alexa Fluor 488. Планшети сканували за допомогою системи аналізу живих клітин та обробляли із використанням програмного забезпечення IncuCyte.
Статистичний аналіз
Експерименти проводили у трьох повторах. Дані виражали як середнє значення ± стандартна похибка, а значимість розраховували шляхом одностороннього дисперсійного аналізу за допомогою ретроспективного аналізу із критерієм Т’юкі. Значення р<0,05 вважали статистично значущими.
Результати дослідження
На рисунку 1 (А) відображено результати МТТ-тесту – аналізу проліферації клітин із додаванням 3-[4,5-диметилтіазол‑2-їл]-5-[3-карбоксиметоксифеніл]-2-[4-сульфофенил]-2Н-тетразолію. Показано діаграму залежності доза/ефект для впливу α-ГФХ у першій моделі, а також протидії α-ГФХ загибелі клітин, індукованій Aβ. На рисунку 1 (Б) відображено ефект α-ГФХ як профілактичного лікування (друга модель). В обох умовах α-ГФХ протидіяв згубному впливу, індукованому Aβ. Автори вказують на те, що ефект не залежав від дозування α-ГФХ в обох моделях, але був значущим вже при меншій дозі. Це означає, що в умовах in vitro такої оптимальної концентрації достатньо для активації шляху виживання.
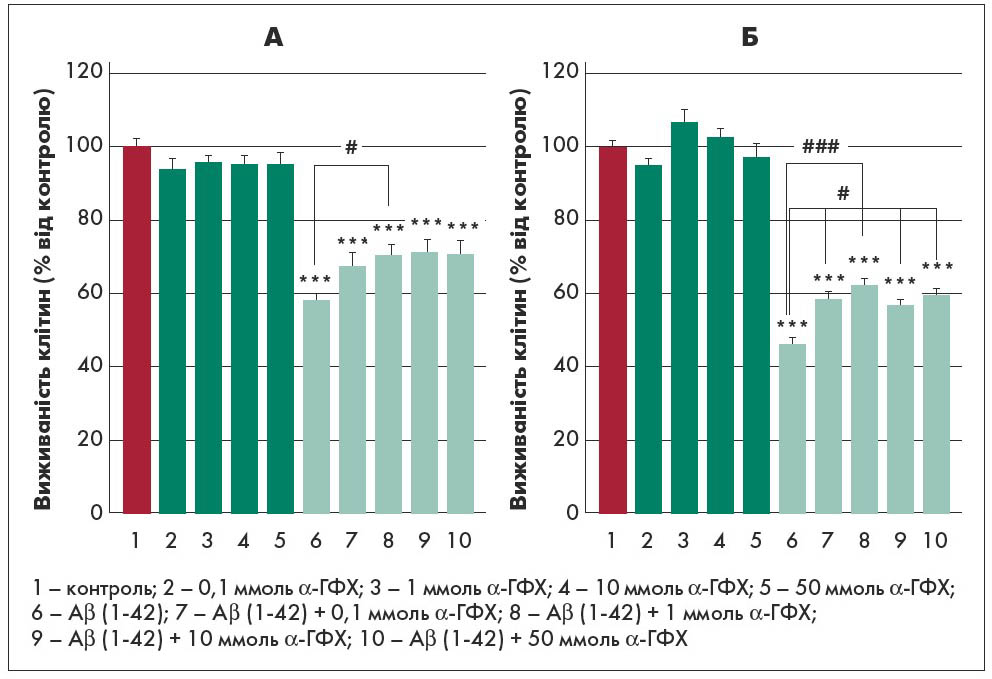 Рис. 1. Результати МТТ-тесту на виживаність диференційованих клітин лінії SH-SY5Y, інкубованих із α-ГФХ після (А) або до (Б) введення у середовище Aβ (1‑42)
Рис. 1. Результати МТТ-тесту на виживаність диференційованих клітин лінії SH-SY5Y, інкубованих із α-ГФХ після (А) або до (Б) введення у середовище Aβ (1‑42)
Примітки: Дані у вигляді середнє значення ± стандартна похибка для трьох різних експериментів; контроль проти додавання α-ГФХ: ** p<0,001, *** p<0,0001; Аβ (1‑42) проти Аβ (1‑42) + α-ГФХ, # p<0,05.
Адаптовано за M. Catanesi et al., 2020
Із цими даними узгоджуються результати, показані на рисунку 2. Апоптотична загибель клітин, оцінена за допомогою вестерн-блотингу з антитілами до каспази 9, була спричинена обробкою Aβ, а додавання α-ГФХ сприяло протидії апоптозу в обох моделях (рис. 2). Відповідно, аналіз методом вестерн-блотингу з антитілами до JNK показав, що рівень активності цього ферменту підвищувався при обробці Aβ і відновлювався до майже контрольних значень при додаванні α-ГФХ.
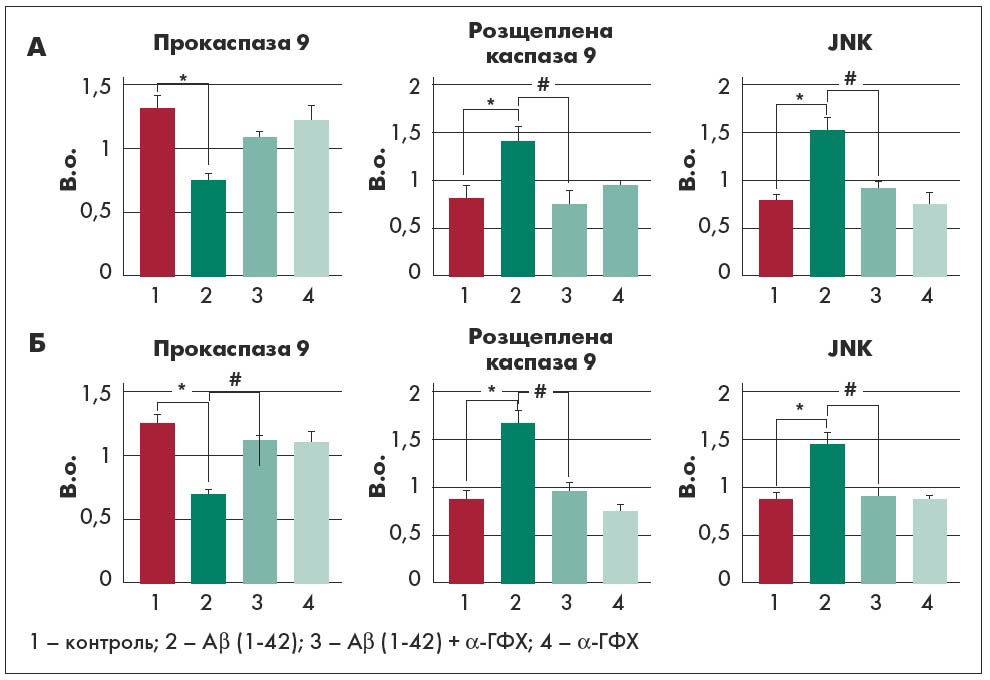 Рис. 2. Апоптотична загибель диференційованих клітин (контроль та інкубація з додаванням α-ГФХ) за методом вестерн-блотингу після (А) та до (Б) обробки Aβ
Рис. 2. Апоптотична загибель диференційованих клітин (контроль та інкубація з додаванням α-ГФХ) за методом вестерн-блотингу після (А) та до (Б) обробки Aβ
Примітки: В.о. – відносні одиниці. Дані надані у вигляді середнє значення ± стандартна похибка для трьох різних експериментів; контроль проти додавання α-ГФХ: ** p<0,05; Аβ (1‑42) проти Аβ (1‑42) + α-ГФХ, # p<0,05; JNK – Jun-N-термінальна кіназа.
Адаптовано за M. Catanesi et al., 2020
Ці результати були додатково підтверджені аналізом довжини нейритів, проведеним за допомогою імунолокалізації нейрофіламентів. Обробка Aβ призводила до зменшення кількості клітин, оцінюваної за методом забарвлювання DAPI, і одночасно – до значної атрофії довжини нейритів, тоді як додавання α-ГФХ сприяло відновленню даного параметра.
Окрім того, методом вестерн-блотингу оцінювали інтенсивність реакцій із залученням шляху, в якому задіяні p-Akt / p-TrkB / зрілий МНТФ / ERK5, що сприяє виживанню нейронів. Вона була значно зниженою під впливом Aβ, тоді як обробка α-ГФХ зумовлювала відновлення цього шляху, а отже й виживання нейронів. Уміст про-ФРН, що спричиняє Aβ-індуковану нейрональну смерть, значуще збільшувався при обробці Aβ, а при додаванні α-ГФХ зменшувався до контрольних значень в обох моделях (рис. 3). Це дозволяє припустити наявність нейропротекторних властивостей у α-ГФХ.
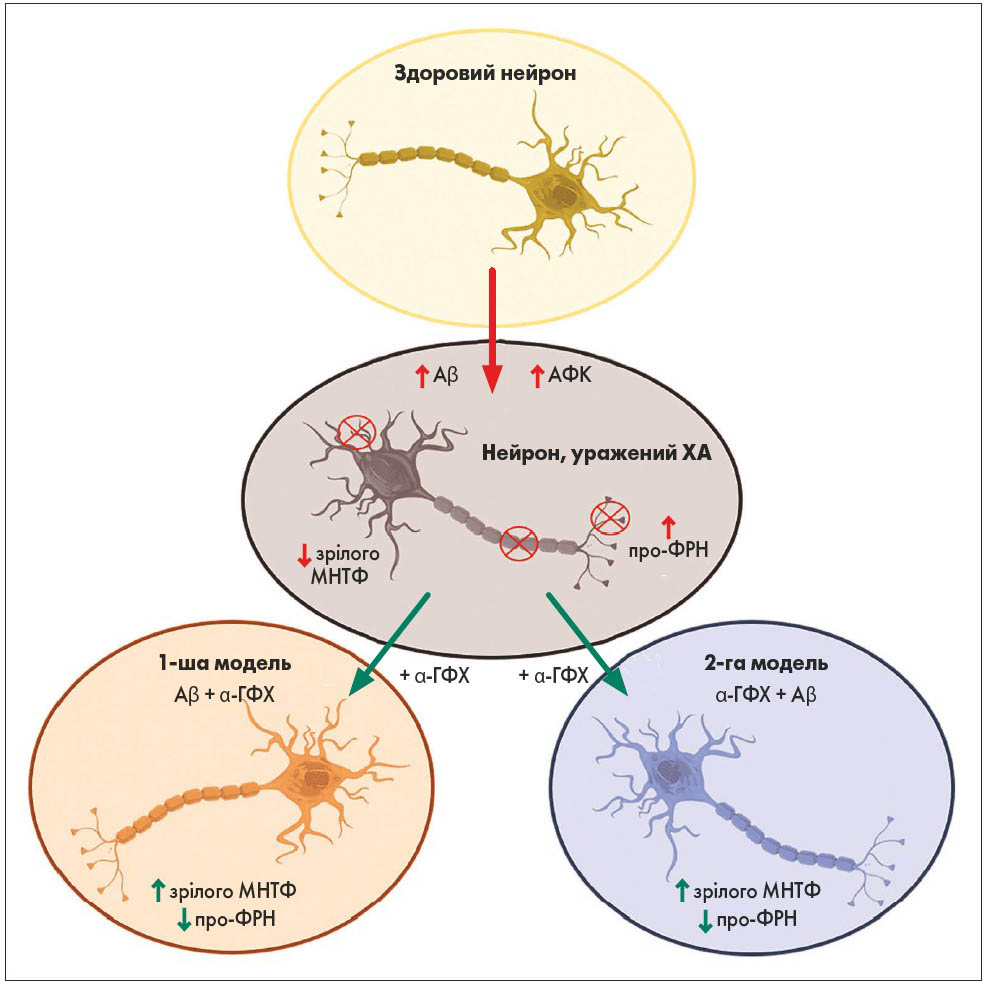 Рис. 3. Вплив α-ГФХ на перебіг ХА в моделях in vitro
Рис. 3. Вплив α-ГФХ на перебіг ХА в моделях in vitro
Примітка: АФК – активні форми кисню.
Адаптовано за M. Catanesi et al., 2020
Обговорення
Сучасна терапія ХА є лише симптоматичною й не здатна стримувати прогресування хвороби або сприяти її регресу. Отже, потреба в нових підходах до терапії ХА є нагальною. Симптоми проявляються вже на пізніх стадіях ХА, коли наявні пошкодження нейронів, атрофія нейритів та амілоїдні відкладення. Холіну альфосцерат (α-ГФХ) є попередником ацетилхоліну в нейронах, ефективність якого при ХА та деменції продемонстровано в дослідженнях (Lee et al., 2017). Терапія α-ГФХ може сприяти поліпшенню пам’яті та когнітивних показників у пацієнтів із ХА та інсультами, а також при епілепсії.
У роботі M. Catanesi et al. (2020) було використано дві експериментальні моделі, що дозволяють оцінити виразність захворювання при застосуванні α-ГФХ та з’ясувати ефекти препарату. Показано, що α-ГФХ захищає нейрони від пошкодження Аβ, протидіючи загибелі клітин та індукуючи шляхи виживання. Зазвичай вважається, що патогенез ХА супроводжується зменшенням вмісту зрілого МНТФ та факторів його сигнального шляху і одночасним підвищенням рівня про-МНТФ через дефектне розщеплення нейротрофіну (Cuello et al., 2019). Цікавим є те, що в обох моделях α-ГФХ зміг індукувати синтез зрілої форми МНТФ та його специфічного рецептора p-TrkB. Це супроводжувалося зростанням рівнів p-Akt і p-Erk5, задіяних у шляху, що сприяє виживанню нейронів, а отже, свідчило про захисний ефект α-ГФХ.
Вплив базальних холінергічних нейронів переднього мозку на процеси старіння та патогенез ХА є суттєвим (Fahnestock, Shekari, 2019). Їхня дегенерація пов’язана з розвитком ХА (Bierer et al., 1995; Whitehouse, 1998). Виживання та функціонування базальних холінергічних нейронів переднього мозку залежать від ФРН. У кількох публікаціях описане зниження рівня МНТФ у пацієнтів із ХА (Fahnestock, 2002, 2011; Peng et al., 2009). Було також продемонстроване збільшення вмісту про-ФРН при розвитку ХА (Fahnestock et al., 2012; Belrose et al., 2014).
M. Catanesi et al. (2020) виявили, що про-ФРН накопичується після обробки Аβ в обох моделях – це підтверджує припущення про порушення його розщеплення при ХА. Даному ефекту протидіяв α-ГФХ, який сприяв зниженню рівня про-ФРН у двох моделях. Отже, α-ГФХ, діючи через активацію нейротрофінового шляху виживання, може запобігати накопиченню Aβ до появи симптомів ХА та на ранній стадії захворювання. Результатом цього є зменшення апоптотичної загибелі клітин та збереження морфології нейронів.
Висновки
З огляду на отримані результати автори дійшли висновків, що холіну альфосцерат (α-ГФХ), активуючи шляхи виживання нейротрофінів, здатний протидіяти згубному ефекту β-амілоїду в обох моделях in vitro, зменшуючи апоптотичну загибель клітин і зберігаючи морфологію нейронів. Таким чином, холіну альфосцерат можна застосовувати для лікування пацієнтів із ХА, що сприятиме гальмуванню прогресування недуги.
Підготувала Наталія Купко
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 2 (57) 2021 р.
СТАТТІ ЗА ТЕМОЮ Неврологія
Проблема когнітивних розладів є однією з найважливіших у сучасній клінічній медицині. Це зумовлено не тільки збільшенням частки людей старшого віку серед населення, а й посиленням ролі стресу та інших патогенетичних чинників. У березні відбувся семінар «Академія сімейного лікаря. Біль в грудній клітині. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста», у якому прийняли участь провідні вітчизняні науковці і фахівці різних галузей. У рамках заходу професор кафедри військової терапії Української військово-медичної академії Міністерства оборони України, кандидат медичних наук Мар’яна Миколаївна Селюк представила доповідь «Війна та когнітивні порушення. Причина чи наслідок? Як вирішити проблему?». Подаємо огляд цієї доповіді у форматі «запитання – відповідь»....
Хоча нестероїдні протизапальні препарати (НПЗП) мають численні серйозні побічні ефекти, вони належать до найчастіше застосовуваних препаратів у всьому світі (McGettigan P., Henry D., 2013). Через часте застосування побічні дії НПЗП становлять значну загрозу для громадського здоров’я. Так, уже декілька декад тому було описано підвищення артеріального тиску та ризик загострень серцевої недостатності на тлі прийому цих препаратів (Staessen J. et al., 1983; Cannon P.J., 1986)....
У лютому відбувся медичний форум Ukraine Neuro Global 2024, організований ГО «Українська асоціація медичної освіти» (м. Київ). Під час заходу обговорювалися найактуальніші проблеми сучасної неврології. У рамках форуму відбувся сателітний симпозіум «Актуальні питання фармакотерапії в неврології». Слово мала в.о. завідувача кафедри неврології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Марина Анатоліївна Тріщинська з доповіддю «Краніоцервікалгії: особливості діагностики та лікування»....
Запаморочення є поширеним та іноді стійким симптомом після струсу мозку чи легкої черепно-мозкової травми (лЧМТ). Терміном «запаморочення» часто описують декілька симптомів, як-от головокружіння (вертиго; ілюзія руху), порушення рівноваги (нестійкість, нестабільність) і, власне, запаморочення (пресинкопальний стан). Запаморочення після струсу мозку є клінічним викликом, оскільки існує багато причин цього розладу, а його ведення залежить від етіології [1-3]. Однією з таких причин є пошкодження периферичної вестибулярної системи (внутрішнього вуха). У разі травм, отриманих під час війни, лЧМТ часто пов’язана з вибуховою дією, яка може пошкоджувати внутрішнє вухо. Лікарям важливо розуміти вестибулярні наслідки вибухової лЧМТ, оскільки ЧМТ є дуже характерною для сучасних війн [4]....




