Сучасні підходи до діагностики та терапії імунної тромбоцитопенії у дорослих і дітей
29-30 квітня у режимі онлайн пройшла XI науково-практична конференція з міжнародною участю «Перспективи діагностики та лікування гематологічних захворювань». У секції неонкологічної гематології особливу увагу приділили актуальним питанням імунної тромбоцитопенії з позиції міжнародних стандартів і доказової медицини.
 Доповідь завідувача гематологічного відділення КПН «Запорізька обласна клінічна лікарня» ЗОР, професора кафедри внутрішніх хвороб Запорізького державного медичного університету, доктора медичних наук Бориса Борисовича Самури була присвячена сучасним підходам до діагностики та терапії імунної тромбоцитопенії у дорослих.
Доповідь завідувача гематологічного відділення КПН «Запорізька обласна клінічна лікарня» ЗОР, професора кафедри внутрішніх хвороб Запорізького державного медичного університету, доктора медичних наук Бориса Борисовича Самури була присвячена сучасним підходам до діагностики та терапії імунної тромбоцитопенії у дорослих.
– Імунна тромбоцитопенія (ІТП; раніше застосовували термін «імунна, або ідіопатична тромбоцитопенічна пурпура») є імунно-опосередкованим набутим захворюванням дорослих і дітей, що характеризується тимчасовим або постійним зниженням кількості тромбоцитів і, залежно від ступеня тромбоцитопенії, підвищеним ризиком кровотечі. У 2009 р. Міжнародна робоча група з вивчення імунної тромбоцитопенії провела стандартизацію термінології, визначення та критеріїв оцінки ступеня тяжкості ІТП. Комісія вирішила уникати терміна «ідіопатичний», віддаючи перевагу «імунний», щоб підкреслити імуномедіаторний механізм захворювання. Термін «пурпура» було визнано недоречним, оскільки у значній частині випадків симптоми кровотечі відсутні або мінімальні, проте акронім ІТП зберігся через його широке використання в медичній літературі.
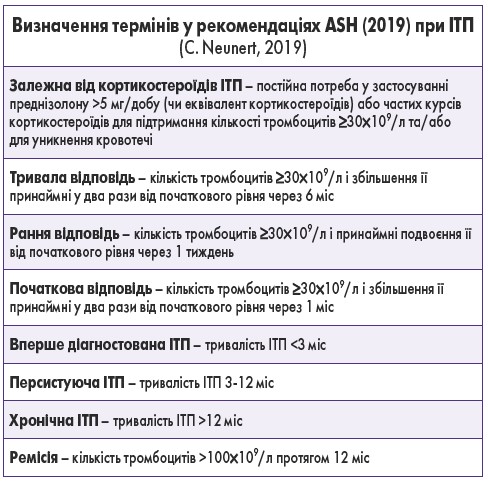 Відповідно до рекомендацій Міжнародної робочої групи з вивчення імунної тромбоцитопенії (2009), розрізняють первинну та вторинну ІТП. Первинна ІТП – це аутоімунний розлад, який характеризується ізольованою тромбоцитопенією (<100×109/л тромбоцитів) у периферичній крові за відсутності будь-якої очевидної ініціювальної та/або основної причини тромбоцитопенії. Первинна ІТП залишається діагнозом виключення; на сьогодні відсутні надійні клінічні або лабораторні параметри для точного встановлення діагнозу. До вторинної ІТП належать усі форми імунно-опосередкованої тромбоцитопенії, крім первинної. Вторинна ІТП є гетерогенним розладом, що виникає на тлі додаткової аутоімунної цитопенії або імунодефіцитних станів, асоціюється з інфекцією (віруси імунодефіциту людини, гепатиту С, вітряної віспи, Helicobacter pylori, цитомегаловірус), системними захворюваннями (системний червоний вовчак), хворобами печінки, застосуванням лікарських засобів, наркотичних речовин, хворобами кісткового мозку, нещодавніми переливаннями крові та щепленнями проти кору, паротиту та краснухи, спадковою тромбоцитопенією. Диференціювання первинної та вторинної ІТП є клінічно значущим через їх різну етіологічну природу та різні методи лікування. При вторинній тромбоцитопенії лікування часто спрямоване на основну патологію. У 2019 р. вийшли оновлені керівні принципи Американського товариства гематологів (ASH) щодо ведення пацієнтів з ІТП. Ці рекомендації присвячені лікуванню дорослих і дітей з ІТП та кровотечами, що не загрожують життю. У цьому документі була переглянута термінологія ІТП щодо визначення залежності від кортикостероїдів, відповіді на лікування та дефініції фаз захворювання.
Відповідно до рекомендацій Міжнародної робочої групи з вивчення імунної тромбоцитопенії (2009), розрізняють первинну та вторинну ІТП. Первинна ІТП – це аутоімунний розлад, який характеризується ізольованою тромбоцитопенією (<100×109/л тромбоцитів) у периферичній крові за відсутності будь-якої очевидної ініціювальної та/або основної причини тромбоцитопенії. Первинна ІТП залишається діагнозом виключення; на сьогодні відсутні надійні клінічні або лабораторні параметри для точного встановлення діагнозу. До вторинної ІТП належать усі форми імунно-опосередкованої тромбоцитопенії, крім первинної. Вторинна ІТП є гетерогенним розладом, що виникає на тлі додаткової аутоімунної цитопенії або імунодефіцитних станів, асоціюється з інфекцією (віруси імунодефіциту людини, гепатиту С, вітряної віспи, Helicobacter pylori, цитомегаловірус), системними захворюваннями (системний червоний вовчак), хворобами печінки, застосуванням лікарських засобів, наркотичних речовин, хворобами кісткового мозку, нещодавніми переливаннями крові та щепленнями проти кору, паротиту та краснухи, спадковою тромбоцитопенією. Диференціювання первинної та вторинної ІТП є клінічно значущим через їх різну етіологічну природу та різні методи лікування. При вторинній тромбоцитопенії лікування часто спрямоване на основну патологію. У 2019 р. вийшли оновлені керівні принципи Американського товариства гематологів (ASH) щодо ведення пацієнтів з ІТП. Ці рекомендації присвячені лікуванню дорослих і дітей з ІТП та кровотечами, що не загрожують життю. У цьому документі була переглянута термінологія ІТП щодо визначення залежності від кортикостероїдів, відповіді на лікування та дефініції фаз захворювання.
Основною клінічною проблемою первинної ІТП є підвищений ризик кровотечі, хоча симптоми кровотечі не завжди можуть бути наявні. У більшості пацієнтів симптомів немає, незважаючи на низький рівень тромбоцитів. Проте у когортному дослідженні за участю 152 дорослих пацієнтів із тяжкою формою тромбоцитопенії та стійким рівнем тромбоцитів <30×109/л спостерігалось 4-разове підвищення смертності порівняно із загальною популяцією та 4-разове підвищення захворюваності порівняно з іншими пацієнтами. Кровотечі та інфекції однаково часто були причинами смерті пацієнтів, які отримували численні схеми імуносупресивної терапії (J.E.A. Portielje et al., 2001).
Рішення щодо лікування ІТП залежить від багатьох факторів. Дорослим з уперше діагностованою ІТП і кількістю тромбоцитів <30×109/л, які не мають симптомів або мають незначні кровотечі зі слизових оболонок і шкіри, за оновленими рекомендаціями ASH слід призначати кортикостероїди (КС) та не використовувати тактику спостереження (умовна рекомендація). Однак для деяких пацієнтів тактика спостереження може бути виправданою. При цьому слід враховувати тяжкість тромбоцитопенії, додаткові супутні захворювання, використання антикоагулянтів або антитромбоцитарних препаратів, потребу у процедурах в майбутньому і вік пацієнта. Дорослим із вперше діагностованою ІТП та кількістю тромбоцитів ≥30×109/л, які не мають симптомів або мають мінімальні кровотечі зі слизових оболонок і шкіри, експерти ASH рекомендують активне спостереження без лікування КС (сильна рекомендація). У пацієнтів з кількістю тромбоцитів на нижньому рівні цього порогу або з додатковими супутніми захворюваннями, які приймають антикоагулянти чи антиагреганти, у майбутньому планують хірургічні втручання, а також у хворих літнього віку (понад 60 років) лікування КС може бути доцільним. У дорослих із вперше діагностованою ІТП та кількістю тромбоцитів <20×109/л, які не мають симптомів або мають незначні кровотечі зі слизових оболонок і шкіри, передбачається госпіталізація, а не амбулаторне лікування (умовна рекомендація). У дорослих із кількістю тромбоцитів ≥20×109/л, які не мають симптомів або мають незначні кровотечі зі слизових оболонок і шкіри, фахівці ASH пропонують амбулаторне лікування, а не госпіталізацію (умовна рекомендація). Госпіталізація може бути корисною для пацієнтів із резистентністю до лікування, при наявності соціальних факторів, невпевненості щодо правильності діагнозу, наявності тяжкої супутньої патології, яка супроводжується високим ризиком розвитку кровотечі, вираженими кровотечами зі слизових оболонок. Пацієнтів, яких не госпіталізують, має спостерігати гематолог протягом 24-72 год з моменту встановлення діагнозу або рецидиву захворювання. У дорослих із вперше діагностованою ІТП експерти ASH рекомендують не застосовувати тривалий курс (>6 тижнів, включаючи лікування та зменшення кількості) преднізолону, а також віддавати перевагу короткому курсу (≤6 тижнів; сильна рекомендація). Дорослим із вперше діагностованою ІТП слід вводити преднізолон (0,5-2,0 мг/кг маси тіла на день) або дексаметазон (40 мг на день протягом 4 днів) як тип КС для початкової терапії (умовна рекомендація). У дорослих із вперше діагностованою ІТП ASH рекомендує застосовувати для початкової терапії лише КС, а не ритуксимаб і КС (умовна рекомендація). Пацієнтам, у яких не досягнута відповідь на лікування КС, як друга лінія терапії пропонується спленектомія, введення агоністів рецепторів тромбопоетину (TPO-RA) та ритуксимабу.
На підставі даних порівняльного дослідження ефективності різних методів лікування колегія ASH розробила такі доказові настанови. У дорослих із персистуючою понад ≥3 міс ІТП, що залежить від КС, або пацієнтів, у яких не досягнута відповідь на КС і заплановане лікування TPO-RA, ASH рекомендує застосовувати ельтромбопаг або роміплостим (умовна рекомендація). У дорослих з ІТП, яка залежить від КС, тривалістю ≥3 міс або без відповіді на лікування КС ASH пропонує проведення спленектомії або призначення TPO-RA (умовна рекомендація). За можливості спленектомію слід відкласти щонайменше на 1 рік після встановлення діагнозу через можливість спонтанної ремісії протягом 1 року. У дорослих з ІТП, яка залежить від КС, тривалістю ≥3 міс або без відповіді на застосування КС експертна група пропонує ритуксимаб, а не спленектомію (умовна рекомендація), TPO-RA, а не ритуксимаб (умовна рекомендація).
Кожен з методів лікування другої лінії може бути ефективним, тому підбір препаратів має бути індивідуальним з урахуванням тривалості ІТП, частоти епізодів кровотеч, що вимагають госпіталізації, супутніх захворювань, віку, дотримання прийому ліків, медичної та соціальної підтримки, цінностей та уподобань пацієнта, вартості та доступності лікування (C. Neunert et al., 2019).
Оскільки патологія є рідкісною, основною проблемою всіх рекомендацій щодо ІТП є недостатня кількість інформації про хворобу, невелика кількість порівняльних досліджень щодо різних методів лікування та оновлених даних про старі методи, а через відсутність патофізіологічних відмінностей між стадіями хвороби до кінця не зрозуміло, коли треба розпочинати терапію. Майже всі світові рекомендації засновані на думці експертів (рівень доказовості С), в настановах ASH тільки 2 сильні рекомендації.
Безумовно, КС є стандартною початковою першою лінією терапії для пацієнтів із вперше діагностованою ІТП. Хоча лікування є ефективним в більшості пацієнтів, наявний ризик розвитку ускладнень, зумовлених застосуванням гормональних препаратів, які залежать від дози та тривалості їх прийому. Пульс-терапія дексаметазоном може «працювати» швидше за преднізолон, проте частіше викликає побічні ефекти з боку центральної нервової системи. У невеликої кількості пацієнтів може бути доцільним тривале введення преднізолону в дозі ≤5 мг/добу, у більшості пацієнтів ≤10 мг/добу при рівні тромбоцитів >30×109/ л. Тривалість лікування КС – до 6 тижнів. Немає переваг раннього призначення ритуксимабу. Внутрішньовенне введення імуноглобуліну (в/в Ig) або анти-D імуноглобуліну може розглядатися як перша лінія терапії при тяжких кровотечах.
Необхідно забезпечити належний моніторинг стану пацієнтів, які отримують КС, через можливі побічні ефекти: артеріальну гіпертензію, гіперглікемію, розлади сну та настрою, розлади з боку шлунка, глаукому, міопатію та остеопороз. Побічна дія у різних КС має деякі особливості: дексаметазон частіше спричиняє розлади центральної нервової системи, метилпреднізолон – порушення вуглеводного обміну й артеріальну гіпертензію, преднізолон – шлунково-кишкову кровотечу (C.N. Tarantino, 2009).
КС і в/в Ig забезпечують відповідь з боку рівня тромбоцитів у більшості пацієнтів протягом декількох днів, хоча різні критерії частоти відповіді в дослідженнях ускладнюють проведення прямого порівняння між різними видами терапії. Незважаючи на хорошу початкову відповідь, частота стійкої відповіді на використання КС залишається недостатньою. При призначенні повторних циклів терапії КС у спробі досягти або підтримати відповідь з боку рівня тромбоцитів шкода від побічних реакцій може переважити користь від лікування. При неефективності КС у дорослих залучається друга лінія лікування, що включає спленектомію, введення азатіоприну, циклоспорину А, циклофосфаміду, даназолу, дапсону, мікофенолату мофетилу, ритуксимабу та TPO‑RA.
На 2011 р. було зареєстровано щонайменше 17 досліджень лікування ритуксимабом у дітей і дорослих з ІТП. У дослідженні V.L. Patel (2012) у 26% дітей та 21% дорослих із хронічною ІТП, які отримували монотерапію ритуксимабом у стандартних дозах, підтримувалася відповідь без лікування протягом щонайменше 5 років без значної токсичності. Статистичний аналіз тривалості відповіді з боку рівня тромбоцитів на комбіновану терапію ритуксимабом у дозі 375 мг/м2 площі поверхні тіла по 4 інфузії щотижня одночасно з трьома 4-денними циклами дексаметазону по 28 мг/м2 через кожні 14 днів з максимальною добовою дозою 40 мг (R + 3Dex) показав, що 44% пацієнтів, які отримували таке лікування, мали довготривалу відповідь понад 5 років після лікування. Жінки мали краще прогнозований довгостроковий результат, ніж чоловіки. Ритуксимаб та три цикли дексаметазону забезпечували відповідь, подібну до такої після спленектомії, у жінок та осіб із тривалістю ІТП менш ніж два роки (J.B. Bussel et al., 2014).
До TPO-RA, схвалених для лікування ІТП, належать роміплостим та ельтромбопаг. В Україні з групи TPO-RA доступний тільки ельтромбопаг. Ельтромбопаг – непептидний TPO-міметик із невеликою молекулярною масою 442,5 d, який зв’язується з трансмембранним доменом рецепторів ТРО людини та індукує фосфорилювання рецепторів TPO з подальшою активацією шляхів JAK2, STAT5, PI‑3-кінази та MAP-кінази, але з меншою інтенсивністю, ніж TPO. Його призначають щодня перорально у формі таблеток (D.J. Kuter, 2010).
У відкритому дослідженні EXTEND оцінювали безпеку та ефективність тривалого лікування ельтромбопагом хронічної/стійкої ІТП у дорослих. Для 302 включених пацієнтів середня тривалість лікування препаратом становила 2,37 року. Введення ельтромбопагу сприяло підвищенню середнього рівня тромбоцитів до 50×109/л або більше протягом 2 тижнів. Загалом 85,8% пацієнтів досягли відповіді (кількість тромбоцитів ≥50×109/л принаймні 1 раз за відсутності терапії порятунку), а 52,0% хворих – тривалої відповіді 25 тижнів або довше. Частота симптомів кровотечі зменшилася з 57% на початку лікування до 16% через 1 рік терапії. 14% пацієнтів вийшли з дослідження через несприятливі явища (гепатобіліарна дисфункція, катаракта, тромбоз глибоких вен, інсульт, головний біль, мієлофіброз). У хворих із кількістю тромбоцитів <15×109/л, більшою кількістю застосованих попередньо методів лікування, включаючи спленектомію, ефект від лікування ельтромбопагом був дещо нижчим (R.S.M. Wong, 2017).
Мікофенолату мофетил (MFM) є антипроліферативним імунодепресантом. Це препарат того самого класу, що й азатіоприн, хоча справляє більш вибіркову дію і часто використовується як стероїдозберігаючий засіб, особливо при аутоімунних захворюваннях, включаючи ІТП, і в трансплантології. Протягом багатьох років MFM був варіантом другої лінії лікування при хронічній ІТП. У британському ретроспективному дослідженні за участю 46 хворих із первинною та вторинною ІТП, третина з яких мала вірусасоційоване захворювання, 52% респондентів досягли відповіді, а 33% – повної відповіді на стандартну дозу MFM 1 г/добу. Загалом препарат добре переноситься. Серед небажаних явищ – рідкісні випадки фатальних інфекцій, прогресивної мультифокальної лейкоенцефалопатії. MFM не використовують у період вагітності, він може бути менш ефективним при вірусасоційованій ІТП (A. Taylor еt al., 2015).
До хірургічних методів лікування при хронічній ІТП належить спленектомія. Її основними перевагами є висока ймовірність досягнення тривалої ремісії у пацієнтів, невисока вартість порівняно з лікуванням сучасними препаратами, імовірність відновлення відповіді на лікування лікарськими засобами, лише у 10% хворих відмічається рефрактерність. Попри потенційну ефективність цей метод все рідше використовується у дорослих пацієнтів у США та Європі у зв’язку з наявністю альтернативних варіантів терапії та можливим розвитком несприятливих явищ. Найвідомішим віддаленим ускладненням спленектомії є так званий OPSI-синдром (overwhelming post splenectomy infection), що характеризується тяжкими інфекціями з масивною бактеріємією. Останнім часом визнано, що потенційними небажаними наслідками після зазначеного втручання є тромбози та злоякісні новоутворення. Підвищений ризик розвитку судинних ускладнень стосується як венозної, так і артеріальної системи кровообігу (атеротромбоз, венозний тромбоз, легенева гіпертензія, кардіоваскулярні події). Через ці віддалені ризики показання та терміни спленектомії обговорюються в медичній спільноті (S. Crary, G. Buchanan, 2009; S.Y. Kristinsson, 2014). За можливості спленектомію відкладають на 12-24 міс; перед операцією необхідна аспірація/біопсія кісткового мозку, рекомендується належна імунізація хворих, обов’язкове інформування пацієнтів про побічні ефекти лікування; перевага надається лапароскопічному методу втручання.
При неефективності другої лінії терапії ІТП перед призначенням альтернативних стратегій третьої лінії необхідно оцінити показання до лікування, переглянути діагноз (можлива аспірація і/або біопсія кісткового мозку), оцінити переваги для пацієнта, доцільність спленектомії, розглянути участь хворих у клінічних дослідженнях, врахувати, що синергізм дії препаратів може сприяти зниженню дози КС. Оскільки послідовність ліній терапії не вивчалася у великих дослідженнях, спроби змінити цю послідовність та методи лікування можуть бути ефективними. При виборі варіанта терапії необхідно враховувати уподобання пацієнтів: їх страх і занепокоєння при зниженні рівня тромбоцитів та сприйняття цього факту, толерантність до незначних кровотеч, рівень активності, ставлення до тривалого лікування, бажання уникнути введення КС або спленектомії. Думка пацієнта має бути пріоритетною у прийнятті клінічних рішень.
 Про сучасні підходи до ведення ІТП у дітей розповіла завідувачка кафедри педіатрії № 2 Харківського національного медичного університету, доктор медичних наук, професор Наталія Іванівна Макєєва.
Про сучасні підходи до ведення ІТП у дітей розповіла завідувачка кафедри педіатрії № 2 Харківського національного медичного університету, доктор медичних наук, професор Наталія Іванівна Макєєва.
– Якщо проаналізувати еволюцію підходів щодо діагностики ІТП, то виявиться, що вони не зазнали істотних змін протягом останнього століття. У 1939 р. Egerton Elliot написав, що цей «діагноз може бути встановлено лише шляхом виключення інших чинників, які викликають пурпуру». ASH у настановах 2011 р. також задекларувало, що діагноз ІТП встановлюється шляхом виключення інших причин тромбоцитопенії (C. Neunert et al., 2011). У 2019 р. вийшли оновлені керівні принципи ASH щодо підходів до ведення ІТП у дорослих і дітей, які включали тактику спостереження, застосування КС, в/в Ig, анти-D імуноглобуліну, ритуксимабу, спленектомії та TPO-RA.
У дітей із вперше діагностованою ІТП за відсутності кровотеч або з мінімальними кровотечами експерти ASH рекомендують використовувати тактику спостереження, а не КС (умовна рекомендація). Дітям з уперше діагностованою ІТП, у яких відсутні кровотечі або наявні незначні кровотечі, показана тактика спостереження проти в/в Ig або анти-D імуноглобулін (сильна рекомендація). У разі вперше діагностованої ІТП та незагрозливих для життя кровотеч зі слизових оболонок та/або погіршення якості життя ASH пропонує преднізолон у дозі 2-4 мг/кг щодня, максимум 120 мг на день, протягом 5-7 днів проти дексаметазону 0,6 мг/кг на день, максимум 40 мг на день, протягом 4 днів (умовна рекомендація). У дітей із вперше діагностованою ІТП із незагрозливими для життя кровотечами зі слизових оболонок та/або погіршенням якості життя рекомендовано курс КС 7 днів або менше. При вперше діагностованій ІТП із незагрозливими для життя кровотечами зі слизових оболонок та/або погіршенням якості життя більш доцільним є застосування КС, а не в/в Ig чи анти-D імуноглобуліну. У дітей з ІТП, у яких не досягнута відповідь на першу лінію терапії, наявні незагрозливі для життя кровотечі зі слизових оболонок та/або погіршення якості життя, ASH пропонує використовувати TPO-RA замість ритуксимабу (умовна рекомендація). У разі ІТП без загрозливих для життя кровотеч зі слизових оболонок та/або погіршення якості життя та відповіді на першу лінію терапії ASH рекомендує TPO‑RA проти спленектомії (умовна рекомендація). У дітей з ІТП без загрозливих для життя кровотеч зі слизових оболонок та/або погіршення якості життя і відповіді на першу лінію лікування ASH пропонує замість спленектомії використовувати ритуксимаб (умовна рекомендація; C. Neunert et al., 2019). Отже, для ведення дітей, у яких не отримана відповідь на першу лінію лікування, пріоритет слід надавати TPO-RA.
Безпеку й ефективність застосування ельтромбопагу у дітей із хронічною ІТП вивчали у рандомізованих багатоцентрових плацебо-контрольованих дослідженнях PETIT та PETIT2. Учасниками стали пацієнти віком 1-17 років із кількістю тромбоцитів <30×109/л, підтвердженою хронічною ІТП протягом принаймні 1 року, у яких не досягнута відповідь щонайменше на один попередній курс терапії ІТП або стався рецидив під час такої терапії та які раніше не отримували TPO-RA. Діти були розподілені на 3 групи за віком (12-17 років, 6-11 років, 1-5 років) перед рандомізованим розподілом у співвідношенні 2:1 для прийому ельтромбопагу або плацебо впродовж 13-тижневого подвійного сліпого періоду. Пацієнтів, які закінчили подвійний сліпий період, включили у 24-тижневий відкритий період лікування, коли всі вони отримували ельтромбопаг. Первинною кінцевою точкою дослідження PETIT2 була стійка відповідь, визначена як частка осіб, які отримували ельтромбопаг і досягли кількості тромбоцитів ≥50×109/л протягом щонайменше 6 з 8 тижнів з 5-го по 12-й тижні під час подвійної сліпої рандомізованої фази при відсутності резервної терапії. За даними дослідження, під час застосування ельтромбопагу 40% пацієнтів досягли первинної кінцевої точки. Препарат сприяв підвищенню рівня тромбоцитів у крові в усі періоди спостереження, зниженню частоти виникнення кровотеч з 71% на початковому етапі до 13% під час відкритого періоду, зниження потреби у резервній терапії з 19% спочатку до 13% під час відкритого періоду, зменшення дози базових препаратів для лікування ІТП у 52% дітей на початковому рівні. Загалом ельтромбопаг характеризувався хорошою переносимістю та безпекою. Побічні ефекти, які частіше виникали у разі прийому ельтромбопагу, ніж плацебо, включали назофарингіт (17%), риніт (16%), інфекції верхніх дихальних шляхів (11%) та кашель (11%). Серйозні побічні явища мали місце у 8% пацієнтів, які отримували ельтромбопаг, та 14% дітей, які приймали плацебо. Підвищення рівня аспартатамінотрансферази/аланінамінотрансферази було найпоширенішим небажаним явищем, що призводило до припинення застосування досліджуваного препарату. Про випадки тромбоемболічних подій або злоякісних захворювань системи крові не повідомлялося (J.D. Grainger, 2015).
Фармакотерапія при ІТП у дорослих і дітей має переваги порівняно з хірургічним лікуванням протягом 12-24 міс. Застосування TPO-RA має переваги над ритуксимабом. Недоцільно чекати хронічної фази ІТП для застосування TPO-RA, ритуксимабу. При обмеженні ресурсів допускається використання старих методів лікування (MFM, азатіоприн). Необхідно переглядати діагноз та оцінювати показання до призначення препаратів перед кожною лінією лікування з врахуванням уподобань пацієнтів.
Підготувала Вікторія Бандалетова
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (70) 2021 р




