Міома матки у жінок із репродуктивними планами: досягнення максимальної ефективності терапії
За матеріалами конференції
 У рамках національної конференції з міжнародною участю «Ендометріоз, генітальний пролапс, гінекологічний рак», що проходила 18‑19 червня в м. Одесі, із доповіддю «Агоністи ГнРГ у веденні хворих із проблемними міомами матки» виступив завідувач кафедри акушерства і гінекології Дніпровського державного медичного університету, доктор медичних наук, професор Валентин Олександрович Потапов. Свою увагу він головним чином акцентував на консервативному веденні пацієнтів із проблемними міомами, навів дані власного спостереження щодо ефективності терапії й запропонував нові підходи до тактики лікування у парадигмі даної проблеми.
У рамках національної конференції з міжнародною участю «Ендометріоз, генітальний пролапс, гінекологічний рак», що проходила 18‑19 червня в м. Одесі, із доповіддю «Агоністи ГнРГ у веденні хворих із проблемними міомами матки» виступив завідувач кафедри акушерства і гінекології Дніпровського державного медичного університету, доктор медичних наук, професор Валентин Олександрович Потапов. Свою увагу він головним чином акцентував на консервативному веденні пацієнтів із проблемними міомами, навів дані власного спостереження щодо ефективності терапії й запропонував нові підходи до тактики лікування у парадигмі даної проблеми.
Ключові слова: міома, міомектомія, естрогенові рецептори, гозерелін, Ki‑67, Золадекс.
Міома матки є поширеною проблемою, що значно впливає на якість життя жінки. Після 50 років вона діагностується у 70‑80% пацієнток, а у 30% випадків зустрічається у жінок репродуктивного віку. Утім симптомні прояви цієї нозології можуть відзначатися у 20‑50% випадків.
Характерними симптомами міоми матки є:
- аномальна маткова кровотеча (АМК);
- анемія;
- больовий синдром;
- здавлення суміжних органів малого таза;
- диспареунія.
Вплив на репродуктивне здоров’я часто супроводжується безпліддям, невиношуванням вагітності, плацентарною дисфункцією (дистрес і затримка росту плода, втрата вагітності), високою ймовірністю оперативного розродження з видаленням матки (Потапов В. О., 2017).
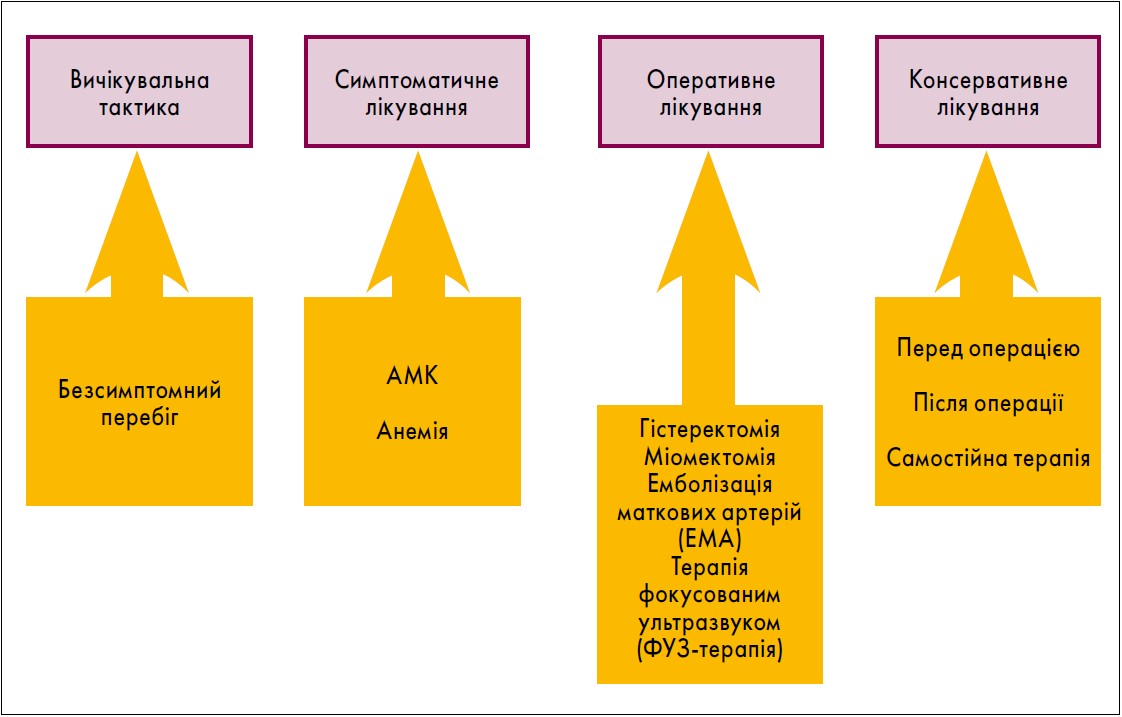
Згідно з рекомендаціями авторитетних міжнародних видань (SOGC Clinical Practice Guideline, 2015; Donnez J., 2016), сучасний менеджмент міоми матки передбачає як консервативне, так й оперативне лікування (рис. 1).
Рис. 1. Сучасний менеджмент міоми матки
Слід зауважити, що тактику лікування потрібно підбирати індивідуально на підставі таких факторів:
- наявність і тяжкість симптомів;
- бажання пацієнта отримати радикальне лікування;
- бажання зберегти дітородну функцію;
- важливість збереження матки;
- безпліддя, пов’язане з деформацією порожнини матки;
- ускладнення під час попередньої вагітності, пов’язані з лейоміомою.
У своїй доповіді професор В. О. Потапов зосередився саме на консервативному лікуванні, головною метою якого є гальмування процесу проліферації пухлини. Ефективні методи даної терапії міоми матки включають агоністи гонадотропін-рилізинг-гормона (ГнРГ) і селективні модулятори рецепторів прогестерону.
Як відомо, передумовою розвитку гіперпроліферативних процесів репродуктивної системи виступає абсолютна або відносна гіперестрогенія на фоні зниження/відсутності вироблення прогестерону. Проте виникнення й ріст міоми матки може відбуватись і за відсутності дисгормонемії. У цьому випадку прогресування пухлини пов’язане з мутацією кодуючих генів, що відповідають за синтез рецепторів до статевих гормонів і, як наслідок, за їх надлишкову експресію, утворення більшої кількості активованих ядерних комплексів «гормон – рецептор», здатних ініціювати процес мітозу (Потапов В. О., 2017; Fleischer R., 2008).
Доповідач представив увазі слухачів дані власного дослідження (Потапов В. О., Донська Ю. В., 2014) із вивчення експресії естрогенових рецепторів (ER) у тканинах лейоміоми, що відображало відсоток клітин із позитивною імуногістохімічною реакцією. Якщо в інтактному міометрії спостерігалась низька експресія ER (12,9±1,6), то у випадку лейоміоми матки вона підвищувалась у 3,1 раза (39,4±4,3). Те саме стосувалося й експресії прогестеронових рецепторів (PgR): імуногістохімічна оцінка стану міоматозної тканини продемонструвала її збільшення у 2,6 раза (21,1±1,7) на відміну від зразків інтактного міометрія (8,2±1,4). Це дозволило розглядати міому матки як пухлину, проліферативний потенціал якої в однаковій мірі зумовлений як естрогенами, так і прогестероном.
На сьогодні відомі ключові точки фармакологічної супресії проліферації клітин міоми, що полягають у блокуванні передачі гормонального мітогенного сигналу з поверхні клітини до її ядра. Гальмуючи цей процес, ми досягаємо неможливості передачі сигналу до поділу клітини.
Саме таким терапевтичним ефектом володіють агоністи ГнРГ: вони зменшують у крові концентрації промоторів проліферації – естрогенів і прогестерону, зумовлюючи редукцію комплексів «гормон – рецептор» та відсутність мітогенного сигналу (Потапов В. О., 2017).
Піонером аналогів ГнРГ є гозерелін, який був синтезований у 1976 році і схвалений для медичного використання у 1987 році. На сучасному фармацевтичному ринку цей лікарський засіб представлений препаратом Золадекс, що містить гозерелін у двох дозуваннях – 3,6 та 10,8 мг. Прямим показанням до його застосування є міома матки: гозерелін 10,8 мг (вводиться раз на 3 міс) – при терапії фіброїдів, включаючи зменшення ушкоджень, покращення гематологічного стану та полегшення таких симптомів, як біль; як допоміжний засіб при хірургічному втручанні з метою полегшення операційної техніки та зменшення крововтрати; гозерелін 3,6 мг (вводиться кожні 28 діб) у поєднанні з терапією препаратами заліза – для поліпшення гематологічного статусу хворих на анемію із фібромами перед хірургічним втручанням.
Механізм дії гозереліну (Золадекс) насамперед полягає у виснаженні рецепторного апарату гіпофіза, що призводить до зменшення викиду фолікулостимулюючого гормона (ФСГ) і лютеїнізуючого гормона (ЛГ). У відповідь на це яєчники перестають синтезувати естроген та прогестерон, і, як наслідок, формується блок передачі гормонального мітогенного сигналу з поверхні клітини до геному (Furr B. J.A., 1989).
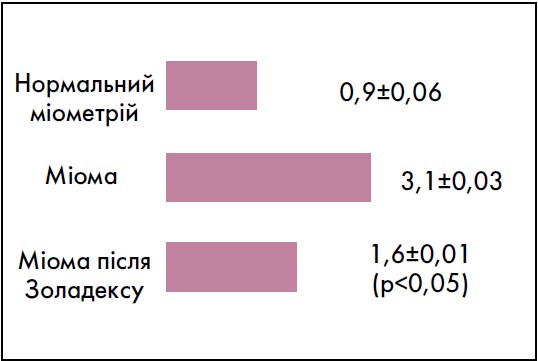
На сьогодні існує маркер, який дозволяє оцінити проліферативну активність клітин, а також антипроліферативний потенціал засобів для лікування міоми матки – антиген Кі‑67, що досліджується імуногістохімічним методом. Важливим є те, що цей білок відображає активність у фазі поділу клітинного циклу – стадії S, що характеризується реплікацією ДНК і підготовкою до процесу мітозу (Serenat Eris Yalcin, 2017; Потапов В. О., 2017). Таким чином, антиген Кі‑67 є своєрідним фактором прогнозу, маркером, що формує індекс проліферації й дозволяє оцінити об’єктивний результат лікування та досягти оптимальної ефективності лікарського засобу.
У контексті даної проблеми доповідач запропонував спиратись на визначення рівня маркера Кі‑67, щоб оцінити супресивний ефект агоністів ГнРГ. На матеріалах власного дослідження автором було показано збільшення експресії маркера або антигена Кі‑67 в біоптаті міоматозної тканини у 3,4 раза порівняно з нормальним міометрієм. Це вказує на інтенсифікацію процесів проліферації. А вже після 3-місячного застосування Золадексу у пацієнток експресія антигена зменшилась на 52% (рис. 2), що свідчить про ефективність препарату у зменшенні темпів росту клітин пухлини (Потапов В. О., Донська Ю. В., 2014).
Рис. 2. Експресія Кі-67 у тканинах міоми
Професор В. О. Потапов також розглянув питання проблемних міом із прогнозованим ризиком у жінок, що мають репродуктивні плани. Варто враховувати, що ефективне видалення міоми трансцервікально можливе при її розмірах до 4 см. Тому щодо цієї категорії пацієнтів часто виникає питання: чи є альтернатива міомектомії при більших розмірах вузлів, які деформують порожнину матки?
Доповідач запропонував у таких жінок, які ще не народжували і мають дану локалізацію міоми, застосовувати агоністи ГнРГ. За висновками міжнародного дослідження (Audebert A. J.N., 1994), застосування Золадексу протягом 3‑6 міс зменшує розмір міоми на 40% і сприяє успішній вагітності без проведення міомектомії. У цьому випадку показаннями були інтрамурально-субмукозні вузли 2-го типу розміром до 6 см.
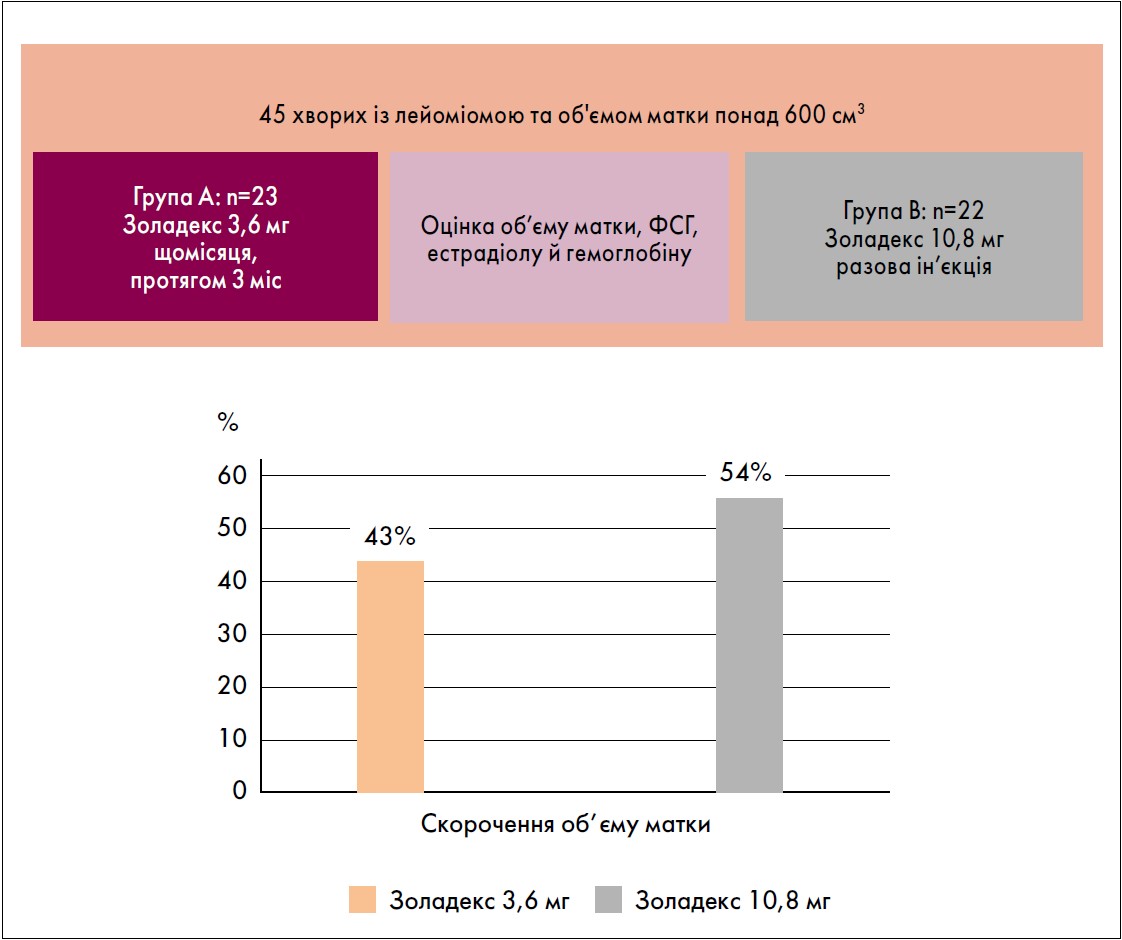
Важливим є те, що Золадекс 10,8 мг (разова ін’єкція) забезпечив рівнозначне зменшення об’єму матки порівняно із Золадексом 3,6 мг (триразове введення впродовж 3 міс) у пацієнток із лейоміомою (Bazzini N., 2004) (рис. 3).
Рис. 3. Середнє зменшення об’єму матки
Іншою проблемою у жінок із репродуктивними планами є міоми матки великих розмірів із множинними вузлами. Передопераційна медикаментозна підготовка Золадексом протягом 3 міс перед міомектомією може забезпечити значно вищу успішність оперативного втручання порівняно з відсутністю терапії (Потапов В.О., 2017). Передопераційний режим використання агоністів ГнРГ передбачений рядом міжнародних протоколів лікування.
Мета застосування агоністів ГнРГ перед операцією:
- зменшення розмірів вузлів;
- зменшення крововтрати під час операції;
- поліпшення техніки операції.
Дія препарату вводить організм жінки у фазу тимчасової медикаментозної кастрації, що проявляється зниженням рівня естрадіолу до <50 пг/мл, аменореєю, відсутністю овуляції (Потапов В.О., 2017).
.
Кокранівська база систематичних оглядів містить чимало даних щодо передопераційної медикаментозної підготовки із приводу міоми матки порівняно з відсутністю лікування або плацебо (Lethaby A. et al., 2017):
- лікування агоністами лютеїнізуючого гормона рилізинг-гормона (ЛГРГ) було пов’язане зі зменшенням як об’єму матки в середньому на 175 мл (95% довірчий інтервал [ДІ] 219,0‑131; 13 досліджень, n=858), так і об’єму міоми (гетерогенні дослідження, MD [середня різниця між групами лікування] від 5,7 до 155,4 мл) і підвищенням рівня гемоглобіну до операції (0,88 г/ дл, 95% ДІ 0,7‑1,1; 10 досліджень, 834 учасники); водночас була більша ймовірність побічних реакцій, особливо припливів (відношення шансів [ВШ] 7,68, 95% ДІ 4,6‑13,0; 6 досліджень, 877 учасників);
- тривалість гістеректомії була коротшою серед жінок, які отримували лікування агоністами ЛГРГ (9,59 хв, 95% ДІ 15,9‑3,28; 6 досліджень, 617 учасників), із меншою крововтратою (гетерогенні дослідження, MD – від 25 до 148 мл), із меншою кількістю переливань крові (ВШ 0,54, 95% ДІ 0,3‑1,0; 6 досліджень, 601 учасник) і меншою кількістю післяопераційних ускладнень (ВШ 0,54, 95% ДІ 0,3‑0,9; 7 досліджень, 772 учасники).
Проте результати після міомектомії не у всіх випадках є задовільними: у 37% випадків протягом 3‑24 міс відзначався рецидив міоми (Потапов В. О., Польщиков П. І., 2012). Цей фактор, безумовно, стає причиною неефективної репродукції, збільшення ймовірності викидня та зменшення числа вагітностей, що закінчуються пологами.
Першою причиною виникнення рецидивів є технічні проблеми під час операції, коли видаляються не всі вузли (часто при лапароскопічній операції не візуалізуються інтрамуральні вузли розміром до 2 см). Саме тому при множинній міомі матки (>3 вузлів) з інтрамуральною локалізацією перевагу слід віддавати лапаротомічній міомектомії (Потапов В.О., 2017). Іншою причиною, яка обґрунтовує доцільність призначення агоністів ГнРГ у післяопераційному періоді, є операційна травма. Вона викликає активацію експресії клітинних ростових регуляторних білків, які потенціюють клітинний розподіл не тільки нормальних клітин у зоні рани, а й «мовчазних» клітин міоми (Потапов В. О., Мутана Е., 2013).
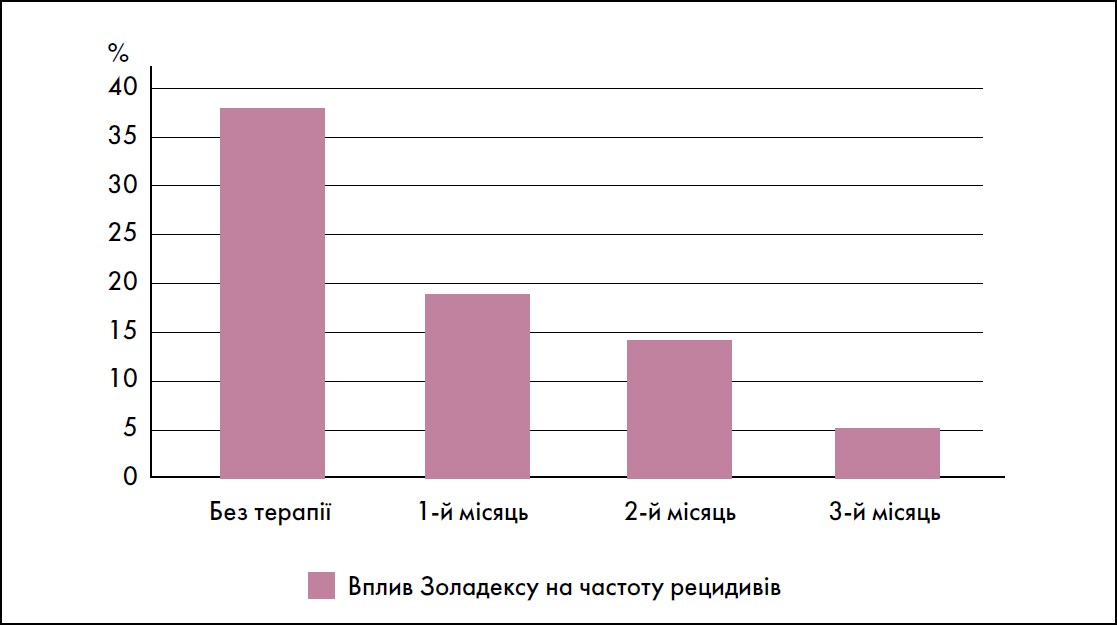
Була запропонована інша технологія застосування Золадексу в якості профілактики рецидивів після міомектомії: прийом препарату гозереліну в наступні 3 міс після оперативного втручання сприяє гальмуванню активного росту дрібних вузлів, що залишилися. Вплив Золадексу на частоту рецидивів міоми матки залежно від експозиції після операції продемонстрував їх зниження з 37,5 до 5,4% (Потапов В. О., 2017) (рис. 4).
Рис. 4. Частота рецидивів міоми матки протягом 24 міс
Запропонована технологія застосування агоністів ГнРГ після міомектомії продемонструвала позитивні наслідки в контексті успішної вагітності: показник нормального закінчення вагітності збільшився з 12,7 до 67% (Потапов В. О., 2017). Це стосувалося пацієнток саме з великими міомами, котрі сприяли невиношуванню вагітності або безпліддю, і тому такий підхід до лікування мав надзвичайно оптимістичні результати.
Окрему увагу слід приділити жінкам із проблемними міомами та відсутністю репродуктивних планів. Головним бажанням таких пацієнток є збереження матки задля психологічного комфорту та гармонічних партнерських стосунків, а також задля профілактики тазового пролапсу. Застосування Золадексу протягом 3‑6 міс дозволяє у ряді випадків уникнути оперативного втручання (в основному у жінок більш старшого віку). У подібних ситуаціях організм може перейти в період менопаузи, коли вже не відбувається стимулюючого впливу естрогенів на пухлинний ріст (Потапов В.О., 2017).
Міжнародні керівництва (Anne Lethaby, 2017; SOGC Clinical Practice Guideline, 2015) розглядають терапію агоністами ГнРГ як:
- варіант лікування міоми матки;
- ефективну у зниженні крововтрати і больового синдрому;
- ефективну у зменшенні об’єму міоми матки і здавлюючих симптомів.
Варто пам’ятати й про існуючі застереження:
- прийом препарату обмежений 6 міс через вплив на метаболізм кісткової тканини (розвиток остеопорозу);
- асоціюється з менопаузальними симптомами.
На сьогодні існує вихід у підвищенні ефективності консервативного лікування міоми матки із застосуванням агоністів ГнРГ. Терапія прикриття при застосуванні даного лікарського засобу – так звана add-back-терапія – передбачає його поєднання разом з іншими гормональними засобами з метою:
- продовження періоду застосування агоністів ГнРГ (до 12 міс);
- мінімізації побічних ефектів гіпоестрогенії при збереженні терапевтичної ефективності.
- Варто підкреслити необхідність одночасного старту терапії прикриття з лікуванням агоністами ГнРГ.
Препаратами для add-back-терапії можуть бути:
- низькодозовані комбіновані оральні контрацептиви з активними прогестагенами: левоноргестрелом, дезогестрелом, гестоденом (безперервний режим);
- комбіновані гормональні препарати для замісної гормональної терапії;
- трансдермальні форми естрогенів (17β-естрадіол 0,05 мг; 0,025 мг);
- селективні модулятори естрогенових рецепторів (Laufer M.R., 2008).
Враховуючи вищезазначене, можна стверджувати, що препарат Золадекс для консервативного лікування міоми матки у жінок, зокрема із репродуктивними планами, може бути клінічно ефективним, раціональним і патогенетично обґрунтованим препаратом вибору.
Підготувала Наталія Довбенко
Тематичний номер «Акушерство, Гінекологія, Репродуктологія» № 3 (44) 2021 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Чи варто змінювати свої харчові звички під час вагітності? Довкола цієї теми є багато суперечностей і рекомендацій, у яких легко заплутатися. Команда платформи доказової інформації про здоров’я «Бережи себе» спільно з лікарем-дієтологом Тетяною Лакустою з’ясували, чим раціон жінки в цей період особливий та на що слід звернути увагу. ...
Хронічний тазовий біль (ХТБ) є поширеним патологічним станом, який відзначається у жінок будь-якого віку і супроводжується сексуальною дисфункцією, емоційною лабільністю, аномальними матковими кровотечами, порушенням сечовипускання, розладами з боку кишечника тощо. Пацієнтки, які страждають на ХТБ, часто скаржаться на симптоми тривоги та депресії, що негативно позначається на їхній повсякденній активності, включаючи зниження працездатності та погіршення якості життя [1]. Сьогодні проблема ХТБ є економічним тягарем, пов’язаним із прямими або непрямими медичними витратами, які в середньому в різних країнах світу оцінюються у 4,9 млрд доларів на рік [2]. Раціональна фармакотерапія,спрямована на полегшення та контроль симптомів болю, є ключовою стратегією боротьби із ХТБ...
Дефіцит заліза є найпоширенішим патологічним станом у світі та однією з п’яти основних причин інвалідності. У той час як низький показник феритину у сироватці крові є діагностичною ознакою залізодефіциту, підвищений його рівень визначається як гострофазовий маркер, що може реєструватися при запальних станах уже в І триместрі вагітності. Відповідно до сучасних настанов, проведення рутинного скринінгу на залізодефіцит у невагітних та вагітних жінок за відсутності ознак анемії не рекомендоване. З огляду на останні літературні дані ця рекомендація має бути переглянута...
Наказ Міністерства охорони здоров’я України від 25.08.2023 № 1533 ...