Колхіцин: нові показання для старого знайомого
 На сьогодні широко відомо, що колхіцин застосовується в ревматології – лікуванні гострих нападів подагри [1], сімейної середземноморської лихоманки [2], хвороби Бехчета [3], а також він схвалений Європейським товариством кардіологів (European Society of Cardiology, ESC) для лікування пацієнтів з перикардитами [4]. Однак паралельно з цим проводяться дослідження щодо застосування колхіцину в лікуванні хворих з різноманітною серцево-судинною патологією, а в умовах пандемії – його ефективності у веденні пацієнтів з коронавірусною хворобою COVID‑19 [5].
На сьогодні широко відомо, що колхіцин застосовується в ревматології – лікуванні гострих нападів подагри [1], сімейної середземноморської лихоманки [2], хвороби Бехчета [3], а також він схвалений Європейським товариством кардіологів (European Society of Cardiology, ESC) для лікування пацієнтів з перикардитами [4]. Однак паралельно з цим проводяться дослідження щодо застосування колхіцину в лікуванні хворих з різноманітною серцево-судинною патологією, а в умовах пандемії – його ефективності у веденні пацієнтів з коронавірусною хворобою COVID‑19 [5].
Основні напрями досліджень щодо використання колхіцину в кардіології зосереджені на пацієнтах з гострим (ГКС) і хронічним коронарним синдромом, фібриляцією передсердь (ФП), гострим та рецидивуючим перикардитом, серцевою недостатністю [6].
Механізми дії
В папірусах, датованих 1500 роком до нашої ери, описано використання вихідної рослини колхіцину – Colchicum autumnale – для усунення болю та запалення, що робить колхіцин одним із найстаріших протизапальних засобів у світі [7].
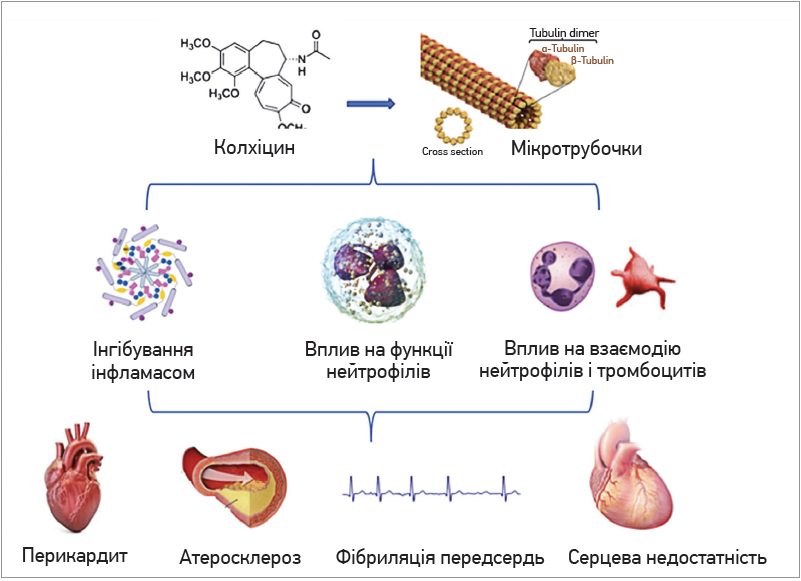
Основні механізми дії колхіцину, що можуть мати позитивний вплив у пацієнтів серцево-судинного профілю, представлені на рисунку [6].
Рис. Основні механізми дії колхіцину [6]
Найвивченіший механізм дії колхіцину – це його здатність зв’язуватися з тубулінами, блокуючи в такий спосіб утворення і полімеризацію мікротрубочок. Мікротрубочки, ключові компоненти цитоскелета, складаються з α- і β-тубулінових гетеродимерів. Мікротрубочки беруть участь у різних клітинних процесах, включаючи підтримку форми клітин, внутрішньоклітинний обмін, секрецію цитокінів та хемокінів, міграцію клітин, регуляцію іонних каналів і поділ клітин. Колхіцин – класичний антимітотичний препарат, який блокує мітотичні клітини в метафазі; він зв’язується з розчинним тубуліном, утворюючи тубулін-колхіцинові комплекси, котрі згодом приєднуються до кінців мікротрубочок; це спричиняє порушення функціонування клітини і формування полюсів притягування ядерного матеріалу у метафазі, що робить поділ клітини неможливим [8]. Окрім того, колхіцин зумовлює інгібування процесів хемотаксису, адгезію і мобілізацію нейтрофілів, а також продукцію ними супероксиданіону [9]. Також він блокує кріопіринову (NALP3) інфламасому, тим самим інгібуючи активацію каспази 1 з подальшим процесингом і вивільненням IL‑1 та IL‑18 [10]. Колхіцин зменшує виділення макрофагами NO, TNF-α і вільних радикалів кисню [11], у відносно невеликих концентраціях сприяє промоції дендритних клітин і презентації антигенів CD4+ лімфоцитам [12]. З огляду на застосування препарату в хворих з коронарними синдромами корисними є його антифібротичні ефекти й інгібування гіперплазії інтими та експресії VEGF [13]. У дослідженнях [14, 15] було продемонстровано, що застосування колхіцину зумовлює інгібування активації та агрегації тромбоцитів, а також взаємодію між лейкоцитами і тромбоцитами, що досягалося завдяки блокуванню перебудов мікротрубочок, які відбуваються в активованих тромбоцитах і спричиняють зміну форми тромбоцитів, секрецію вмісту гранул, вивільнення прокоагулянтних позаклітинних везикул. Також виявилося, що колхіцин може сприяти стабілізації, зменшенню запалення атеросклеротичних бляшок, стимулюючи експресію IL‑10 та TGF-β макрофагами М2, а також обмежуючи проліферацію і активність гладком’язових клітин, фібробластів, остеобластоподібних клітин [16].
Гострі та хронічні коронарні синдроми
У дослідженні Deftereos та співавт. [17] оцінювали вплив колхіцину на розмір інфаркту в 151 пацієнта з інфарктом міокарда (ІМ) з елевацією ST (STEMI), котрі були залучені до випробування протягом перших 12 год від початку больового нападу та яким проводилося черезшкірне коронарне втручання (ЧКВ). У 66 пацієнтів проводили оцінку ступеня некрозу міокарда за допомогою біологічних маркерів (креатинкінази-MB (CK-MB), високочутливого тропоніну Т) та прямого розрахунку об’єму інфаркту методом магнітно-резонансної томографії (МРТ). Усі залучені пацієнти були рандомізовані або в групу колхіцину, або в групу плацебо (на додаток до оптимального рекомендованого лікування STEMI).
Колхіцин вводили протягом 5 днів, починаючи з навантажувальної дози 2 мг: 1,5 мг, потім 0,5 мг через 1 год; продовжували в дозі 0,5 мг 2 р/день (0,5 мг 1 р/день, коли маса тіла становила <60 кг). І площа під кривою концентрації CK-MB, і середнє максимальне значення високочутливого тропоніну Т були значно нижчими у групі колхіцину. Прийом колхіцину також був пов’язаний з меншим абсолютним обсягом інфаркту.
Крім того, маркери запалення, представлені максимальною кількістю нейтрофілів та максимальним рівнем С‑реактивного протеїну (СРП), були нижчими у групі колхіцину; їхні значення були значною мірою пов’язані з показниками біомаркерів та об’ємом інфаркту за даними МРТ.
Протизапальна дія колхіцину за гострого ІМ (ГІМ) також оцінювалася в невеликому дослідженні, до якого залучили 21 пацієнта із ГКС [18]. Хворі були рандомізовані або до групи введення 1,5 мг колхіцину (1 мг, потім 0,5 мг через 1 год), або до групи плацебо; через 24 год після введення колхіцину рівень секретованого та внутрішньоклітинного IL‑1β був значно нижчим порівняно з вихідними значеннями.
Як відомо, за наявності нестабільних атеросклеротичних бляшок підвищується кількість прозапальних клітин і цитокінів. У дослідженні G. Martinez і співавт. [19], до якого залучили 83 пацієнтів (40 осіб із ГКС, 33 хворих зі стабільною ішемічною хворобою серця (ІХС) та 10 пацієнтів без значимого коронарного стенозу), транскоронарне вивільнення ІЛ‑1β, ІЛ‑6, ІЛ‑18 було вищим у групі ГКС. Пацієнти були рандомізовані у співвідношенні 1:1 до групи колхіцину (введення 1 мг і через 1 год ще 0,5 мг) або групи плацебо за 6-24 год до ангіографії. Лікування колхіцином спричинило значне зниження рівнів IL‑1β, IL‑6 та IL‑18 у групі ГКС.
У дослідженні COLCHICINE-PCI [20] автори припустили, що перипроцедурне введення колхіцину зменшить як ушкодження міокарда, так і запалення, пов’язані з ЧКВ. До випробування залучили 400 пацієнтів, яким проводилося ЧКВ (198 із ГКС); їх було рандомізовано або в групу колхіцину (1,2 мг за 1-2 год до ангіографії, а потім 0,6 мг через 1 год), або в групу плацебо. Колхіцин не зменшував перипроцедурного ушкодження міокарда або виникнення MACE через 30 днів, але запобігав зростанню рівнів високочутливого СРП та IL‑6 після ЧКВ.
Морфологія коронарних бляшок є одним з вирішальних факторів, що впливають на виникнення ГКС; її можна оцінити за допомогою ангіографії коронарної комп’ютерної томографії, при цьому великий компонент низької щільності вважається маркером уразливості атеросклеротичної бляшки. В дослідженні [21] призначення 0,5 мг колхіцину щодня разом з оптимальною медикаментозною терапією (ОМТ) через 1 рік у 40 пацієнтів із ГКС спричинило значне зменшення об’єму компонента низької щільності бляшок порівняно із застосуванням тільки ОМТ. Окрім того, рівні високочутливого СРП були значно нижчими у групі колхіцину.
МікроРНК беруть участь в атеросклеротичному процесі за допомогою багатьох механізмів, включаючи запальні шляхи та метаболізм ліпопротеїнів. Нещодавно опубліковане дослідження [22], до якого було залучено 92 пацієнтів (79 осіб із ГКС і 13 хворих без відомих коронарних синдромів), виявило 30 мікроРНК, які були збільшені в пацієнтів із ГКС. Усі хворі з ГКС були рандомізовані у співвідношенні 1:1 до групи введення 1,5 мг колхіцину з ОМТ або ОМТ за 6-24 год до ангіографії. Колхіцин значно знизив експресію 12 мікроРНК, що ще раз продемонструвало його потенційну роль у зменшенні гострого запалення.
LoDoCo [23] – велике рандомізоване дослідження, до якого залучили 532 пацієнтів зі стабільною ІХС. Це було перше випробування, що продемонструвало ефективність колхіцину в дозі 0,5 мг/добу на тлі ОМТ щодо ризику небажаних подій. Спостерігалося значне зниження ризику серцево-судинних подій (ГКС, позалікарняна зупинка серця, некардіоемболічний ішемічний інсульт): 5,3 проти 16% (відносний ризик (ВР) 0,33, 95% довірчий інтервал (ДІ) 0,18-0,59). Такі результати здебільшого були обумовлені зниженням ризику ГКС (переважно нестабільної стенокардії).
Опубліковані в 2013 році обнадійливі результати стали передумовою старту дослідження LoDoCo‑2 наступного року [24] із залученням 5522 пацієнтів, з яких 2762 осіб були віднесені до групи колхіцину, а 2760 хворих – до групи плацебо. Середня тривалість спостереження склала 28,6 міс. Первинною кінцевою точкою була комбінація серцево-судинної смерті, спонтанного (непроцедурного) ІМ, ішемічного інсульту або коронарної реваскуляризації, а ключовою вторинною – комбінація серцево-судинної смерті, спонтанного ІМ чи ішемічного інсульту.
Первинної кінцевої точки досягли 187 пацієнтів (6,8%) у групі колхіцину та 264 хворих (9,6%) у групі плацебо (частота випадків – 2,5 проти 3,6 подій на 100 пацієнто-років; ВР 0,69, 95% ДІ 0,57-0,83; p<0,001). Ключова вторинна кінцева точка сталася у 115 пацієнтів (4,2%) у групі колхіцину та в 157 хворих (5,7%) у групі плацебо (частота випадків – 1,5 проти 2,1 подій на 100 пацієнто-років; ВР 0,72, 95% ДІ 0,57-0,92; p=0,007). Частота спонтанного ІМ або коронарної реваскуляризації (комбінована кінцева точка), серцево-судинної смерті чи спонтанного ІМ (комбінована кінцева точка), коронарної реваскуляризації та спонтанного ІМ також була значно нижчою при застосуванні колхіцину, ніж плацебо. Частота смертей, не пов’язана із серцево-судинними причинами, була вищою у групі колхіцину, ніж у групі плацебо (частота випадків – 0,7 проти 0,5 подій на 100 пацієнто-років; коефіцієнт ризику – 1,51; 95% ДІ 0,99-2,31), але ця різниця виявилася недостовірною. З огляду на отримані результати автори дійшли висновку, що серед пацієнтів із хронічним коронарним синдромом, більшість з яких уже отримували рекомендовану терапію для вторинної профілактики, частота серцево-судинних подій була значно нижчою при застосуванні низьких доз колхіцину, ніж плацебо.
До рандомізованого подвійного сліпого плацебо-контрольованого дослідження COLCOT було залучено 4745 пацієнтів у середньому через 13,5 дня після ГІМ [25]. Первинною кінцевою точкою ефективності була комбінація серцево-судинної смерті, зупинки серця із вдалою реанімацією, ІМ, інсульту або термінової госпіталізації щодо стенокардії, що зумовила коронарну реваскуляризацію.
Пацієнтів лікували відповідно до національних рекомендацій у 98-99% випадків, а ЧКВ щодо індексної події (ГІМ) провели у 93% осіб.
Окрім того, пацієнти були рандомізовані для одержання або 0,5 мг колхіцину щодня, або плацебо. До групи колхіцину залучили 2366 хворих, а до групи плацебо – 2379 пацієнтів. Середнє спостереження за хворими становило 22,6 міс. Первинної кінцевої точки досягли 5,5% пацієнтів у групі колхіцину порівняно із 7,1% у групі плацебо (ВР 0,77, 95% ДІ 0,61-0,96; p=0,02). ВР становив 0,84 (95% ДІ 0,46-1,52) для серцево-судинної смерті, 0,83 (95% ДІ 0,25-2,73) для реанімованої зупинки серця, 0,91 (95% ДІ 0,68-1,21) для ІМ, 0,26 (95% ДІ 0,10-0,70) для інсульту та 0,50 (95% ДІ 0,31-0,81) для термінової госпіталізації щодо стенокардії, що спричинила коронарну реваскуляризацію.
В окремому аналізі COLCOT [26] із залученням 4661 пацієнта 3 різних часових проміжки початку лікування (внутрішньолікарняне лікування до 3 днів; ранній період після виписки, дні 4-7; пізній період після виписки від 8 днів) були оцінені для визначення того, чи впливає ранній початок терапії на ефективність колхіцину. Початок лікування між 0 і 3 днями був достовірно пов’язаний зі зменшенням частоти виникнення первинної кінцевої точки ефективності, що складається з комбінації серцево-судинної смерті, реанімованої зупинки серця, інсульту, ІМ або термінової госпіталізації щодо стенокардії, яка потребує коронарної реваскуляризації. Отже, отримані дані підкреслюють важливість ранньої ініціації колхіцину після ГІМ.
З іншого боку, нещодавно опубліковане дослідження COPS [27] продемонструвало досить суперечливі результати: 795 пацієнтів із ГКС були рандомізовані для отримання або колхіцину (0,5 мг 2 р/день протягом 1-го місяця, потім 0,5 мг одноразово протягом подальших 11 міс), або плацебо разом з ОМТ для вторинної профілактики. Первинною кінцевою точкою була комбінація смерті від усіх причин, ГКС, термінової реваскуляризації, зумовленої ішемією, та некардіоемболічного ішемічного інсульту. Через 1 рік не було виявлено достовірних відмінностей між двома групами щодо серцево-судинних подій.
Метааналіз [28], який містив 5 досліджень із залученням 11 790 пацієнтів з ІХС, продемонстрував, що призначення колхіцину асоціюється зі значним зменшенням частоти виникнення основних небажаних серцево-судинних і цереброваскулярних подій, ГІМ або необхідності повторної реваскуляризації (без впливу на серцево-судинну смертність), а також аналогічні показники смертності від захворювань, не пов’язаних із серцево-судинними причинами (порівняно із плацебо).
Метааналіз [29] містив 9 рандомізованих клінічних досліджень – 4 випробування для пацієнтів із ГКС і ГІМ, 5 – для хворих із хронічним коронарним синдромом. Загальна кількість склала 12 374 учасники. Метааналіз продемонстрував, що низькі дози колхіцину в пацієнтів з ІХС асоціюються зі зменшенням ризику MACE на 35%, зменшенням ризику ГКС на 36%, зменшенням ризику інсульту на 51% та зменшенням ризику серцево-судинних втручань на 39%, однак не спостерігалося достовірного зниження ризику серцево-судинної смерті, серцевої недостатності або госпіталізації. Як і очікувалося, ризик гастроінтестинальних подій підвищувався при застосуванні колхіцину, але загальні побічні ефекти не відрізнялися між групами.
На сьогоднішній день зацікавленість у використанні колхіцину для первинної та вторинної профілактики атеросклеротичних серцево-судинних захворювань не згасає. Так, тривають дослідження СLEAR-Synergy, COVERT-MI, COACS, CONVINCE. За словами одного з апологетів вивчення ефективності колхіцину, цілком можливо, що за наявності додаткових доказів, які очікуються найближчим часом, інгібування запалення стане четвертим наріжним каменем лікування ІХС (разом зі зниженням рівня ліпопротеїнів низької щільності, пригніченням агрегації тромбоцитів і контролем додаткових факторів ризику) [30].
Фібриляція передсердь
ФП – широко розповсюджене порушення ритму в пацієнтів кардіологічного профілю, а також одне з найпоширеніших ускладнень після кардіохірургічного втручання, що є частою причиною тривалої та повторних госпіталізацій після операції. Завдяки своїй ефективності у профілактиці постперикардіотомічного синдрому, було проведено декілька досліджень застосування колхіцину для профілактики післяопераційної ФП. У випробуванні COPPS-POAF пацієнтам на 3-й день після проведеного кардіохірургічного втручання призначали колхіцин у дозі 1 мг/добу, а в подальшому – 0,5-1 мг/добу. За результатами дослідження виявилося, що колхіцин зменшував частоту післяопераційної ФП через 30 днів порівняно із плацебо (12 проти 22%; p=0,021) [31].
Ранні рецидиви ФП після проведення ізоляції легеневих вен були пов’язані з місцевим запаленням, спровокованим абляцією. Використання колхіцину для запобігання рецидивам ФП після абляції було оцінено у 2 рандомізованих дослідженнях Deftereos і співавт. [32]. У першому випробуванні призначення колхіцину 0,5 мг 2 р/день у день абляції з подальшим прийомом упродовж 3 міс знизило частоту післяопераційної ФП (16 проти 34%; p<0,01), рівень СРП на 4-й день (-1,18 мг/л проти -0,46 мг/л; p<0,01) та ІЛ‑6 на 4-й день (-0,50 пг/мл проти -0,10 пг/мл; p<0,01). У другому дослідженні, до якого залучили більшу когорту пацієнтів, колхіцин знизив частоту післяопераційної ФП (31 проти 49%; p=0,01) та покращив фізичні компоненти оцінки якості життя через 12 міс (63,6±13,8 проти 52,5±18,1; p<0,01).
Захворювання перикарда
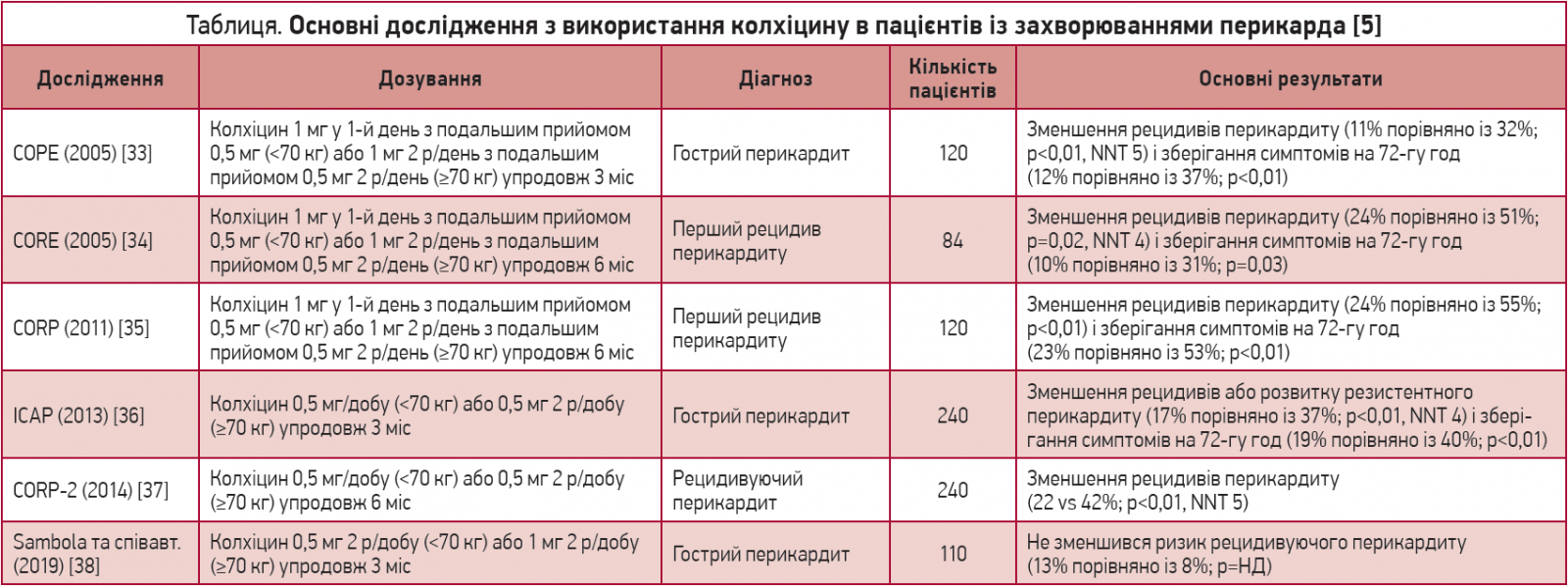
Застосування колхіцину для лікування перикардиту було вперше запропоновано в 1987 році. Це обґрунтовувалося його безпечністю та високою ефективністю в запобіганні розвитку полісерозиту в пацієнтів із сімейною середземноморською лихоманкою [2]. Майже через 20 років були опубліковані перші рандомізовані дослідження колхіцину для лікування гострого [33] та рецидивуючого перикардиту [34]. В обох випробуваннях колхіцин використовували на тлі стандартної протизапальної терапії. Учасники були рандомізовані в групу прийому колхіцину в навантажувальній дозі 1-2 мг, а потім у підтримувальній дозі 0,5-1,0 мг/день (з урахуванням маси тіла) протягом 3-6 міс, а також у групу плацебо. Ці випробування продемонстрували ефективність колхіцину; крім діареї, що з’являлася у 8-10% пацієнтів, терапія колхіцином була безпечною та добре переносилася.
Згодом ефективність терапії колхіцином була підтверджена в подальших подвійних сліпих рандомізованих контрольованих дослідженнях у пацієнтів з гострим і рецидивуючим перикардитом, включаючи дослідження CORP, ICAP та CORP‑2 (табл.). У цих дослідженнях не використовували навантажувальну дозу, а щоденне дозування коригували за масою тіла (0,5 мг 1 р/добу для пацієнтів з масою тіла <70 кг або 0,5 мг 2 р/день). Терапію продовжували протягом 3 міс у хворих з гострим перикардитом і впродовж 6 міс у пацієнтів з рецидивуючим перикардитом.
У нещодавньому дослідженні не виявлено ефективності колхіцину в пацієнтів з гострим ідіопатичним перикардитом, які не отримували кортикостероїдів [38], однак у цьому випробуванні застосування колхіцину було відтерміновано, а діагностичні критерії перикардиту відрізнялися від зазначених у настановах ESC [4].
Серцева недостатність
На сьогодні проведено 1 дослідження, метою якого було з’ясувати, чи може застосування колхіцину в пацієнтів після перенесеного ІМ зменшити ризик прогресування серцевої недостатності.
Залучення запальних шляхів до профібротичного процесу, пов’язаного з несприятливим ремоделюванням шлуночків після ІМ, стало передумовою для проведення випробувань, спрямованих на оцінку того, чи може пригнічення запалення колхіцином зменшити ризик прогресуючої серцевої недостатності. 267 пацієнтам зі стабільною хронічною серцевою недостатністю призначали колхіцин (0,5 мг 2 р/день) або плацебо протягом 6 міс. Первинною кінцевою точкою була частка хворих, які досягли поліпшення щонайменше на 1 функціональний клас за NYHA. Частота досягнення первинної кінцевої точки становила 11% у контрольній групі та 14% у групі колхіцину (відношення шансів (ВШ) 1,40, 95% ДІ від 0,67 до 2,93; p=0,365). Частота комбінованої точки смерті чи перебування в лікарні через серцеву недостатність складала 9,4% у контрольній групі порівняно з 10,1% у групі колхіцину (р=0,839). Зміни тривалості тренування на біговій доріжці на тлі лікування були незначними та схожими в 2 групах (р=0,938). СРП та IL‑6 були достовірно меншими в групі колхіцину (-5,1 мг/л і -4,8 пг/мл відповідно; усі р<0,001 порівняно з контрольною групою) [39].
Незважаючи на отримані негативні результати, слід дочекатися даних зазначених досліджень COVERT-MI, CLEAR SYNERGY, в яких, окрім іншого, вивчається вплив колхіцину на ремоделювання лівого шлуночка, а також перебіг серцевої недостатності.
Колхіцин у лікуванні пацієнтів з COVID‑19
В умовах пандемії продовжується пошук ефективних методів терапії пацієнтів з коронавірусною хворобою. Деякі з біологічних методів лікування, які були вивчені та/або використані в умовах тяжкої інфекції SARS-CoV‑2, націлені на ті самі мішені, що і колхіцин, включаючи IL‑1β (анакінра) та IL‑6 (тоцилізумаб і сарилумаб) [40]. На відміну від біологічних агентів, що використовуються під час цитокінового шторму, колхіцин не є імуносупресивним, немає даних, що він збільшує ризик зараження, а також має невелику вартість. Огляд механізмів розвитку SARS-CoV‑2 та дії колхіцину виявляє потенційну точку втручання, яка може запобігти прогресуванню від активації запальної фази (фаза 2) до гіперзапального стану (фаза 3). Таким чином пропонується максимізувати потенційну користь колхіцину при його використанні на початку процесу захворювання (в ідеалі до фази 2, але неодмінно до фази 3), однак оптимальні терміни продовжують потребувати подальших досліджень [41].
Дослідження COLCORONA проводилося в період із 23 березня 2020 до 22 грудня 2020 року, до якого було залучено 4488 амбулаторних пацієнтів (53,9% становили жінки; середній вік складав 54 роки). Первинною кінцевою точкою ефективності була комбінація смерті та госпіталізації щодо COVID‑19. 2235 хворих рандомізували до групи колхіцину, 2253 осіб – до групи плацебо. Первинної кінцевої точки досягли 104 (4,7%) із 2235 пацієнтів у групі колхіцину та 131 (5-8%) із 2253 хворих у групі плацебо (ВШ 0,79, 95% ДІ 0,61-1,03; p=0,081). Отже, різниці в досягненні кінцевої точки виявлено не було. Однак автори проаналізували досягнення кінцевої точки серед пацієнтів із ПЛР‑підтвердженим COVID‑19 і виявилося, що із 4159 пацієнтів первинної кінцевої точки досягли 96 (4,6%) із 2075 хворих у групі колхіцину та 126 (6,0%) із 2084 пацієнтів у групі плацебо (ВШ 0,75, 95% ДІ 0,57-0,99; p=0,042). Серйозні побічні реакції зареєстровані у 108 (4,9%) із 2195 осіб у групі колхіцину та у 139 (6,3%) із 2217 хворих у групі плацебо (р=0,005); пневмонія з’являлася в 63 (2,9%) із 2195 пацієнтів у групі колхіцину та в 92 (4,1%) із 2217 осіб у групі плацебо (р=0,021); про діарею повідомлялося у 300 (13,7%) із 2195 пацієнтів у групі колхіцину та в 161 (7,3%) із 2217 хворих у групі плацебо (р<0,0001) [42].
Ретроспективне одноцентрове випробування 87 пацієнтів відділення інтенсивної терапії з COVID‑19 продемонструвало менший ризик смерті в пацієнтів, котрі застосовували колхіцин (скоригований ВР 0,41, 95% ДІ 0,17-0,98) [43].
GRECCO‑19 – перше проспективне відкрите рандомізоване дослідження, яке оцінювало колхіцин порівняно зі звичайним лікуванням у хворих, котрих госпіталізували на ранніх термінах захворювання. В групі колхіцину призначали навантажувальну дозу 1,5 мг, потім 0,5 мг через 60 хв, а також підтримувальні дози 0,5 мг 2 р/день. Було виявлено значне зменшення ризику досягнення первинної кінцевої точки – двобального погіршення за шкалою тяжкості захворювання Всесвітньої організації охорони здоров’я. Автори додатково спостерігали зменшення рівнів D‑димера в пацієнтів групи колхіцину порівняно з контрольною групою [44].
В італійському дослідженні порівнювали 122 госпіталізованих хворих, які отримували колхіцин і стандартну медичну допомогу (лопінавір/ритонавір, дексаметазон або гідроксихлорохін), зі 140 госпіталізованими пацієнтами, котрі отримували лише стандартну медичну допомогу. Колхіцин мав достовірну перевагу щодо смертності (84 проти 64% виживання) порівняно з контролем. Виявлено, що менший ризик смерті був незалежно пов’язаним з лікуванням колхіцином (ВР 0,151, 95% ДІ 0,062-0,368; p<0,0001), тоді як старший вік, гірший рівень PaO2/FiO2 та більш високі рівні феритину в сироватці крові були пов’язані з більш високим ризиком [45].
На відміну від цих обнадійливих результатів у випробуванні RECOVERY не було виявлено переваг використання колхіцину. Проведено попередній аналіз даних 2178 випадків смерті серед 11 162 рандомізованих пацієнтів, 94% з яких лікувалися кортикостероїдами (дексаметазон). Не виявлено різниці в первинній кінцевій точці 28-денної смертності (20% у групі колхіцину проти 19% у групі стандартної терапії; ВР 1,02, 95% ДІ 0,94-1,11; р=0,63) [46].
В систематичному огляді та метааналізі [5], проведеному в 2021 році, проаналізували дані 17 205 пацієнтів з COVID‑19: було виявлено значне зниження смертності в хворих, які отримували колхіцин (ВР 0,57). Однак подальший аналіз підгруп з рандомізованими контрольованими випробуваннями продемонстрував недостовірне зниження показника смертності в групах лікування колхіцином. Автори наголошують, що для чіткого розуміння ефективності застосування колхіцину при COVID‑19 необхідне подальше проведення рандомізованих сліпих плацебо-контрольованих досліджень.
Безпечність застосування колхіцину
Нещодавно проведено метааналіз, в якому оцінили небажані явища у 14 983 пацієнтів. За результатами виявилося, що застосування колхіцину для лікування серцево-судинних захворювань пов’язане зі збільшенням ризику шлунково-кишкових небажаних явищ (особливо діареї) та припиненням прийому препаратів, пов’язаних із колхіцин-асоційованими небажаними явищами (переважно щодо шлунково-кишкових симптомів), порівняно із плацебо. Однак це не стосувалося інших небажаних явищ (пов’язаних з м’язами, печінкою, гематологічними, шкірними явищами, інфекціями) або смерті від усіх причин. Слід зауважити, що в пацієнтів, які отримують меншу добову дозу (0,5 мг/добу) колхіцину протягом тривалого періоду часу (>6 міс), ризик шлунково-кишкових небажаних явищ схожий до плацебо. Більша добова доза безпосередньо пов’язана зі збільшенням ризику шлунково-кишкових небажаних явищ: ризик збільшується більше ніж удвічі для доз від 0,6 до 1 мг/день (ВР 2,09), більше ніж утричі для доз >1 мг/день (ВР 3,16) [47].
Варто зазначити, що на сьогодні терапевтичний потенціал колхіцину не вичерпано. Результати поточних і майбутніх рандомізованих досліджень можуть розкрити нові показання до його застосування як у пацієнтів кардіологічного і ревматологічного профілю, так і у хворих з іншими патологіями.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 17 (510), 2021 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....