Антигістамінні препарати в дітей та підлітків: практичне оновлення
Ендогенний гістамін виробляється в цитоплазмі опасистих клітин, циркулювальних базофілів і нейронів шляхом ферментного декарбоксилювання гістидину. Це важливий медіатор запалення, що утворюється під впливом алергенних, запальних, токсичних, хімічних та ятрогенних чинників. Фізіологічна роль гістаміну багатогранна. Це основний медіатор алергічних реакцій негайного типу, регулятор шлункової секреції, нейромедіатор центральної нервової системи [1, 2]. Дія гістаміну триває до 10 хв, реалізується шляхом зв’язування зі специфічними рецепторами на мембранах найрізноманітніших клітин – лаброцитів, м’язів бронхів, ендотелію судин і чутливих нервових волокон.
На сьогодні відомо 4 типи гістамінових рецепторів (H1, H2, H3, H4) [3]. Залежно від локалізації активація рецепторів спричиняє різні біологічні ефекти: розширення і збільшення проникності судин, свербіж, скорочення гладких м’язів, спазм коронарних артерій та регулювання ритму сон-неспання [4]. Н1-гістаміновий рецептор перебуває у динамічній рівновазі між двома ізоформами (активною та пасивною), але проявляє спонтанну базальну активність через ядерний фактор транскрипції каппа В (NF‑κB).
Раніше вважалося, що Анти-Н1-антигістамінні препарати (АГП) є антагоністами Н1-рецепторів, проте цей термін не зовсім точного описує механізм дії цих препаратів. Сьогодні доведено, що АГП працюють як зворотні агоністи, які стабілізують неактивну конформацію Н1-рецепторів, зміщуючи рівновагу на користь неактивного стану.
Усі АГП розподіляють на препарати І та ІІ покоління.
Фармакологічні властивості та побічні ефекти АГП
Основний спосіб введення – оральний; лише окремі представники І покоління (хлоропірамін) доступні в парентеральних формах, для профілактики та лікування випадків алергії, включно з анафілактичними реакціями. Існують також форми місцевої дії – очні краплі та гелі, назальні спреї, шкірні креми тощо.
Фармакокінетичні характеристики АГП доволі варіабельні. Після перорального прийому найраніше пікових концентрацій у плазмі крові досягають цетиризин і левоцетиризин (30-60 хв). Період напіввиведення більшості молекул перевищує 24 год, а тривалість фармакологічного ефекту зазвичай ще довша, що пов’язано з об’ємом розподілу препарату та тривалішим впливом активних метаболітів. Зв’язування АГП з білками плазми здебільшого високе (88-98%). Пригнічення шкірної відповіді на гістамін зберігається протягом 12-24 год після одноразової дози лоратадину та цетиризину [9]; залежно від типу молекули він може тривати до 7-10 днів. Саме тому перед проведенням шкірних тестів терапію АГП слід призупинити.
Більшість АГП метаболізується в печінці за участю системи цитохрому Р450. Одночасне застосування інших інгібіторів цієї системи (макроліди, кетоконазол) або певних харчових продуктів (грейпфрут, помело, малина) посилює накопичення АГП та їхніх метаболітів, що збільшує ризик побічних реакцій. У нових молекул, зокрема в левоцетиризину, можливість міжлікарської взаємодії малоймовірна через низьку біотрансформацію в організмі та здатність пригнічувати метаболізм.
Більшість нових молекул ІІ покоління, як-от левоцетиризин, стійко та стабільно зв’язується з Н1-рецептором; це забезпечує високу ефективність і можливість призначення 1 р/добу [3]. Така характеристика є особливо цінною для клінічної практики, оскільки менша частота щоденного введення покращує переносимість і прихильність пацієнтів до лікування [11]. Слід також зазначити, що нові молекули мають незначний або відсутній ризик фармакологічної залежності (тахіфілаксії) при тривалому застосуванні [3].
Засоби ІІ покоління, зокрема левоцетиризин, мають потенційні протизапальні властивості, продемонстровані in vitro, внаслідок зменшення утворення прозапальних цитокінів.
Певні фармакологічні характеристики молекул І покоління обгрунтовують доцільність їх призначення лише у певних клінічних випадках. Завдяки високій жиророзчинності вони легко проникають крізь гематоенцефалічний бар’єр (ГЕБ), зумовлюючи седативний вплив, сонливість, зниження уваги та часу реакції – найпоширеніші побічні ефекти [14]. У препаратів ІІ покоління, що характеризуються низькою жиророзчинністю, зазначені побічні ефекти зустрічаються значно рідше та є менш вираженими.
Селективність до Н1-рецепторів у молекул І покоління також є нижчою, оскільки вони взаємодіють з негістаміновими рецепторами – серотонінергічними, холінергічними й адренергічними.
Ризик передозування АГП є вищим у дітей. Історично з епізодами отруєння (іноді летальними) найчастіше був пов’язаний дифенгідрамін (особливо тому, що відпускався без рецепта) [19].
Основні показання до призначення АГП
Основні показання до призначення АГП – алергічні прояви з переважанням ексудативного компонента. Через більшу селективність до Н1-рецепторів і менш виражені впливи на інші рецептори перевагу слід віддавати АГП ІІ покоління.
Алергічний риніт і кон’юнктивіт
Алергічний риніт є клінічним показанням до застосування АГП [22].
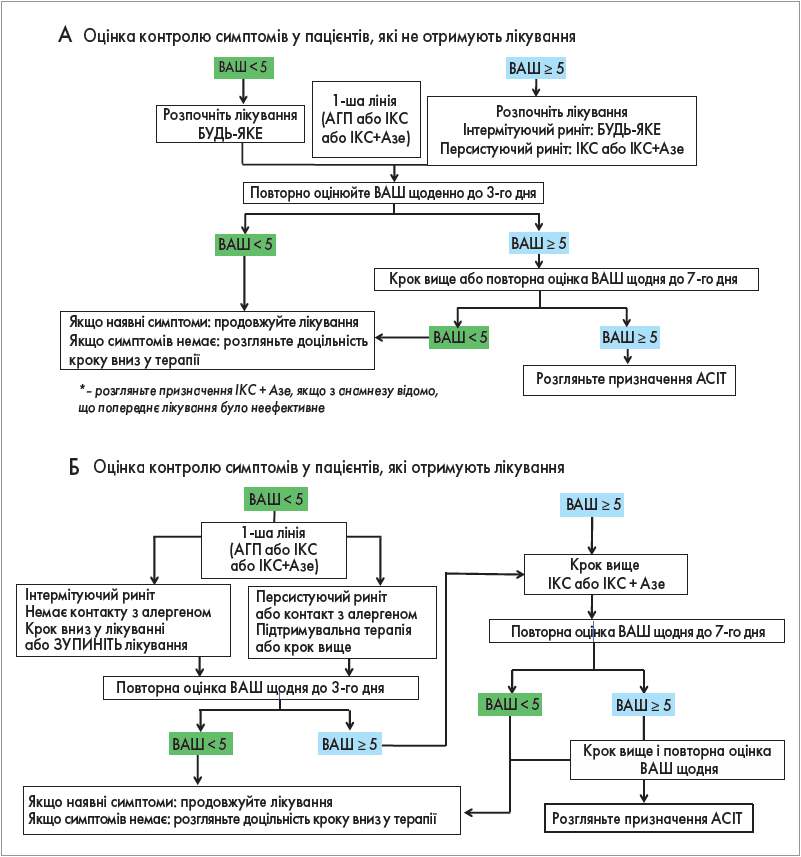
В настановах ARIA (Allergic Rhinitis and its Impact on Asthma) рекомендовано використовувати оральні молекули ІІ покоління при періодичному та персистуючому алергічному риніті (рис.). Деякі АГП, зокрема левоцетиризин, мають настільки виражену антиалергічну активність, що здатні зменшити запалення та закладеність носа [24-28]. При сезонних алергічних ринітах лікування АГП необхідно розпочинати перед потенційним впливом алергену та продовжувати впродовж усього пилкового періоду [29]. За цілорічного алергічного риніту лікування базується на клінічних симптомах і передбачає контроль стійкого запалення шляхом зменшення запального слизового інфільтрату й експресії молекул адгезії [31]. При вазомоторному та неалергічному риніті з еозинофілами (NARES) вплив АГП помірний [36, 37].
Рис. Оновлені алгоритми ведення пацієнтів з АР залежно від індексу ВАШ (підлітки й дорослі), ARIA 2019
Кропив’янка
Кропив’янка – інше важливе показання до застосування АГП. Цей клас має безперечну ефективність [39], зменшуючи свербіж, кількість, розмір і тривалість шкірних проявів як при гострій, так і при хронічній формах хвороби. В європейських настановах рекомендовано за гострої та хронічної кропив’янки використання препаратів ІІ покоління відповідно до їхньої переносимості та безпеки. Хронічна спонтанна кропив’янка має складний патогенез і часто важче піддається лікуванню; за відсутності відповіді на стандартні дози рекомендується поступово збільшувати дозу АГП ІІ покоління до чотирикратної. В разі неефективності терапії слід застосовувати інший препарат, наприклад омалізумаб або циклоспорин [40, 43].
Атопічний дерматит
Застосування АГП з метою лікування атопічного дерматиту залишається суперечливим. Раніше доцільність призначення АГП обґрунтовувалася ключовою роллю гістаміну в розвитку симптомів цього захворювання. Однак сьогодні відомо, що у виникненні свербіжу окрім гістаміну беруть участь й інші медіатори – протеази, субстанція Р та ІЛ‑31. Нещодавно продемонстровано, що основний компонент свербежу опосередкований рецепторами PAR‑2 на кератиноцитах та інших клітинах шкіри, які активуються протеазою [33]. Суттєве значення мають також нервові та психічні механізми [45]. Оскільки АГП І покоління, зокрема хлоропірамін, характеризуються седативним ефектом, їхнє призначення має клінічні переваги за цієї хвороби [47], адже мінімізація свербежу зменшує дискомфорт, покращує якість життя, запобігає розчісуванню шкіри. Місцеве застосування АГП при атопічному дерматиті не рекомендується через ризик розвитку контактної алергії [50].
Вивільнення автоалергенів кератиноцитами після подряпин обтяжує патологічний процес за принципом посилення негативного зворотнього зв’язку. Ретельний догляд за шкірою та використання кремів із протизапальною дією, наприклад стероїдів, місцевих інгібіторів кальциневрину, часто контролює свербіж. Якщо цього недостатньо, для боротьби зі свербежем доцільно призначати АГП [48]. У настановах NICE (National Institute for Health and Care Excellence) щодо лікування атопічної екземи запропоновано місячну пробну терапію неседативним АГП у дітей із сильним свербежем; у разі успіху таке лікування можна продовжувати до зникнення симптомів за умови щоквартального контролю [49].
Астма, анафілаксія та інші хвороби
Епідеміологічні, патофізіологічні та клінічні дані свідчать про тісний зв’язок верхніх і нижніх дихальних шляхів [51, 52]. При алергічному риніті й астмі верхні та нижні дихальні шляхи уражаються загальним запальним процесом, який підтримується та посилюється взаємопов’язаними механізмами [53]. Алергічний, а також неспецифічний вазомоторний риніт належать до найважливіших факторів ризику виникнення астми, а згодом до її можливих обтяжувальних факторів. Показано, що комбінація АГП з назальними стероїдами в дітей з алергічним ринітом значно покращує симптоми астми. В цьому контексті терапія АГП корисна для контролю [55].
Ін’єкційне введення системних АГП є частиною екстрених заходів на додаток до адреналіну та стероїдів, хоча в деяких настановах не рекомендовано їх вживати через зменшення пильності та судинорозширювальний ефект від внутрішньовенного болюсного введення. Пероральні АГП використовують для контролю певних симптомів (риніту, кропив’янки) після завершення гострої фази анафілаксії.
Деякі клінічні випробування підтримують призначення АГП для контролю свербежу та уражень шкіри при мастоцитозі [59], контактному дерматиті, алергічних реакціях на укуси комах або отруту перетинчастокрилих [60]. Ці засоби також використовуються для контролю свербежу при вітряній віспі [61].
Отже, АГП часто застосовуються для лікування опосередкованих гістаміном алергічних захворювань у дітей та підлітків. Ефективність АГП ІІ покоління є добре вивченою; їм слід віддавати перевагу, щоб мінімізувати побічні ефекти, однак обрання оптимального препарату має бути індивідуалізованим на підставі клінічних і фармакологічних характеристик.
Стаття друкується в скороченні.
За матеріалами: Parisi G.F., Leonardi S., Ciprandi G.et al. Antihistamines in children and adolescents: A practical update. Allergologia et Immunopathologia. 2020 Nov - Dec; 48 (6): 753-762. DOI: 10.1016/j.aller.2020.02.005. PMID: 32448753.
Переклала з англ. Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 17 (510), 2021 р.
СТАТТІ ЗА ТЕМОЮ Алергія та імунологія
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...
Організм людини – це складна жива система, функціонування якої визначається безліччю змінних і задіює величезну кількість механізмів. Зовнішні і внутрішні чинники здатні порушувати регуляцію її діяльності. Однак є механізми, які допомагають ефективно усувати «поломки» в організмі і нормалізувати його стан. Така здатність має назву біорегуляції. Основою біорегуляційної медицини є комплексні біорегуляційні препарати, серед яких одним із найвідоміших є Ехінацея Композитум С. ...
Проблема гострих запальних захворювань верхніх дихальних шляхів (ВДШ), гострого риносинуситу (ГРС) зокрема, є однією з найактуальніших у сучасній клінічній медицині. Останніми роками спостерігають зростання частоти захворювань носа і приносових пазух, що проявляється збільшенням як абсолютних (захворюваності та поширеності), так і відносних (частка в структурі оториноларингологічної патології) показників. В Україні поширеність гострих ринітів, риносинуситів та ринофарингітів сягає 489,9 випадку на 10 тис. населення, а захворюваність – 5-15 випадків на 1 тис. населення залежно від сезону. Такі хворі становлять 60-65% амбулаторних пацієнтів лікарів-отоларингологів. Уніфікований клінічний протокол первинної та спеціалізованої медичної допомоги (УКПМД) призначений забезпечити організацію надання медичної допомоги пацієнтам із ГРС на всіх етапах медичної допомоги для своєчасного виявлення, профілактики та лікування ГРС. ...