Порівняння ефективності різних пробіотиків у разі постінфекційного синдрому подразненої кишки
Синдром подразненої кишки (СПК) є одним із найчастіших гастроентерологічних захворювань. У розвинених країнах на СПК страждають 7-15% популяції, причому частіше він розвивається в жінок і осіб молодого та середнього віку. Хоча причини СПК досі до кінця не з’ясовані, в його патофізіології домінує комбінація психопатологічних факторів і гастроентерологічна дисфункція. Дослідження останніх років свідчать про те, що важливу роль у патогенезі СПК відіграють порушення кишкової мікробіоти (КМ), які спричиняють низькоінтенсивне запалення слизової оболонки кишечнику й епітеліальну дисфункцію. Зокрема, встановленим фактором ризику СПК є перенесений гострий інфекційний гастроентерит, який часто поєднується з кишковим дисбіозом.
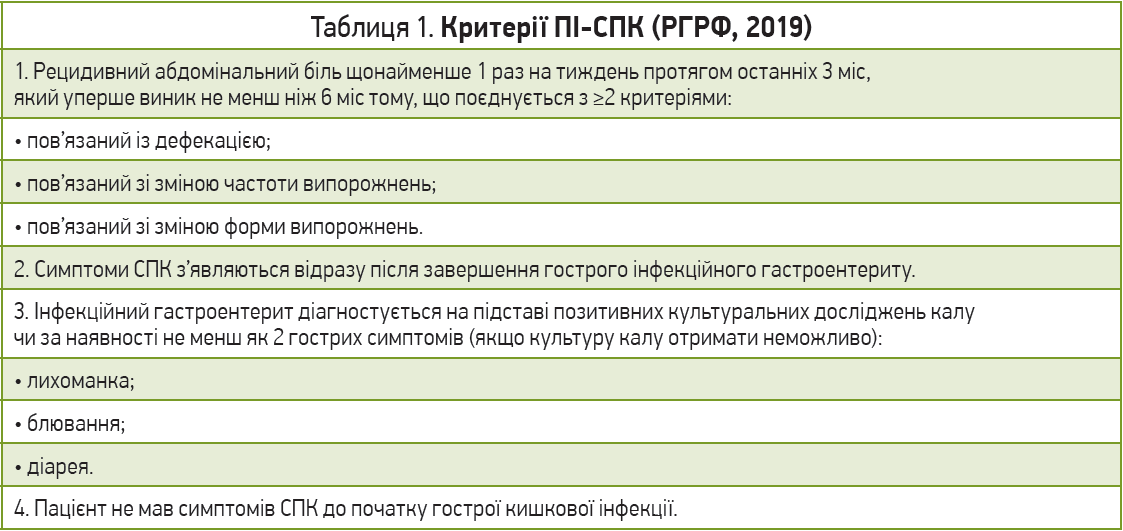
 Нині виділяють окрему форму СПК, яка дістала назву постінфекційного (ПІ-СПК). Хоча загальноприйнятого визначення ПІ-СПК немає, вважається, що ця форма характеризується першою появою симптомів СПК (згідно з Римськими критеріями IV) після перенесеного гострого гастроентериту в пацієнта, який не мав СПК до інфекції. Критерії ПІ-СПК запропоновано Робочою групою Римського фонду (РГРФ) і представлено в таблиці 1. Розподіл ПІ-СПК на субтипи ґрунтується на консистенції випорожнень (згідно з Бристольською шкалою). Найчастіше трапляється ПІ-СПК із діареєю (ПІ-СПК-Д) та змішаний субтип. ПІ-СПК із закрепами трапляється значно рідше (менш як 10% усіх випадків).
Нині виділяють окрему форму СПК, яка дістала назву постінфекційного (ПІ-СПК). Хоча загальноприйнятого визначення ПІ-СПК немає, вважається, що ця форма характеризується першою появою симптомів СПК (згідно з Римськими критеріями IV) після перенесеного гострого гастроентериту в пацієнта, який не мав СПК до інфекції. Критерії ПІ-СПК запропоновано Робочою групою Римського фонду (РГРФ) і представлено в таблиці 1. Розподіл ПІ-СПК на субтипи ґрунтується на консистенції випорожнень (згідно з Бристольською шкалою). Найчастіше трапляється ПІ-СПК із діареєю (ПІ-СПК-Д) та змішаний субтип. ПІ-СПК із закрепами трапляється значно рідше (менш як 10% усіх випадків).
Нещодавно проведений метааналіз об’єднав дані останніх досліджень, які підтвердили, що ПІ-СПК є широко розповсюдженою патологією, котра розвивається залежно від патогена в 10-45% хворих після гострих кишкових інфекцій. У середньому на частку ПІ-СПК припадає близько 10% усіх випадків СПК. Поширеність ПІ-СПК серед осіб, які перенесли інфекційний ентерит (ІЕ), коливається від 4 до 36%. Оскільки епізоди ІЕ протягом усього життя трапляються досить часто (приблизно 1,4 епізоду на рік на 1 особу), а пацієнти з СПК не завжди можуть пам’ятати про перенесені старі та легкі випадки ІЕ, то можна припустити, що реальна патогенетична роль кишкових інфекцій у разі СПК істотно більше. У недавньому систематичному огляді 45 досліджень, який охопив спостереження за 21 тис. пацієнтів з ІЕ протягом від 3 міс до 10 років, середня частота розвитку СПК після ІЕ протягом 12 міс становила 10,1%, а за період спостереження понад 12 міс – 14,5%. У 30 із 45 досліджень було показано, що відносний ризик розвитку СПК протягом 12 міс після ІЕ становив 4,2, а за період понад 12 міс зменшився до 2,3. ПІ-СПК частіше розвивається після бактеріальних гастроентеритів, аніж вірусних. Зокрема, після інфекції Clostridium difficile він розвивається приблизно у 25% хворих.
Специфічних лікувальних рекомендацій для ПІ-СПК немає, у зв’язку з чим терапію проводять як у разі СПК залежно від його субтипу. Оскільки більшість пацієнтів із ПІ-СПК мають змішаний субтип або СПК-Д, вони, якщо змога, мають обмежувати чи виключати їжу, багату на FODMAP, а також отримувати відповідне лікування, що включає протидіарейні агенти, антагоністи серотоніну, модулятори КМ, протизапальні засоби, стабілізатори опасистих клітин, секвестранти жовчних кислот, психотропні засоби, нові опіоїдні агоністи. Деякі з цих груп препаратів уже давно застосовуються в клінічній практиці, інші ще перебувають на стадії клінічних випробувань.
З огляду на те що ПІ-СПК ініціюється інфекцією, а порушення КМ можуть бути пов’язані з розвитком симптоматики, як перша лінія лікування розглядається модуляція зміненої КМ шляхом застосування рифаксиміну чи пробіотиків. Незважаючи на те що деякі дослідження вже показали потенційну користь пробіотиків у разі СПК та ПІ-СПК, однозначної думки щодо їхньої ефективності при цій патології поки що немає. Це диктує необхідність проведення подальших досліджень у цьому напрямі.
Ми порівняли ефективність трьох пробіотиків (лікарські препарати Ентерожерміна та Лінекс, дієтична добавка Неофлорум), які містять різні штами мікроорганізмів, у лікуванні хворих на ПІ-СПК-Д. До складу Лінексу входять Lactobacillus acidophilus (species L. gasseri) не менш як 4,5×106 КУО, Bifidobacterium infantis не менш як 3×106 КУО й Enterococcus faecium не менш як 4,5×106 КУО. Ентерожерміна містить спори полірезистентного штаму Bacillus clausii (2×109), а Неофлорум – суміш пробіотичних бактерій: Lactobacillus rhamnosus Rosell‑11, Lactobacillus helveticus Rosell‑52 та Bifidobacterium longum Rosell‑175 не менш як 5×109 КУО, а також дріжджі Saccharomyces boulardii 125 мг.
Мета дослідження – порівняти ефективність і безпеку пробіотиків із різним мікробіологічним складом у лікуванні ПІ-СПК-Д.
Матеріали та методи
Проведено просте порівняльне рандомізоване клінічне дослідження з вивчення ефективності монопробіотика (Ентерожерміна) та мультипробіотиків (Лінекс, Неофлорум) у хворих на ПІ-СПК-Д. Усього обстежено 90 пацієнтів (59 жінок, 31 чоловік) віком від 22 до 64 років (середній вік – 38±18 років). Діагноз ПІ-СПК встановлювали відповідно до критеріїв, запропонованих РГРФ (табл. 1). Тяжкість перебігу оцінювали за шкалою тяжкості симптомів СПК (IBS-SSS): легка, середньотяжка й тяжка форма визначалися в діапазоні 75-175, 176-300 і понад 300 балів відповідно.
Критерії включення:
- вік – 18-60 років;
- наявність ПІ-СПК-Д відповідно до критеріїв РГРФ;
- тяжкість перебігу – від помірної до тяжкої (≥175 за шкалою IBS-SSS).
Критерії виключення:
- наявність системного захворювання, імунодефіциту чи лікування із застосуванням імуномодуляторів;
- вагітність, планування вагітності чи годування груддю;
- перенесені операції на черевній порожнині, за винятком апендектомії, холецистектомії, кесаревого розтину та гістеректомії;
- тяжкі психічні розлади, зловживання алкоголем або наркотиками;
- застосування пробіотиків або антибіотиків протягом 8 тиж до початку дослідження.
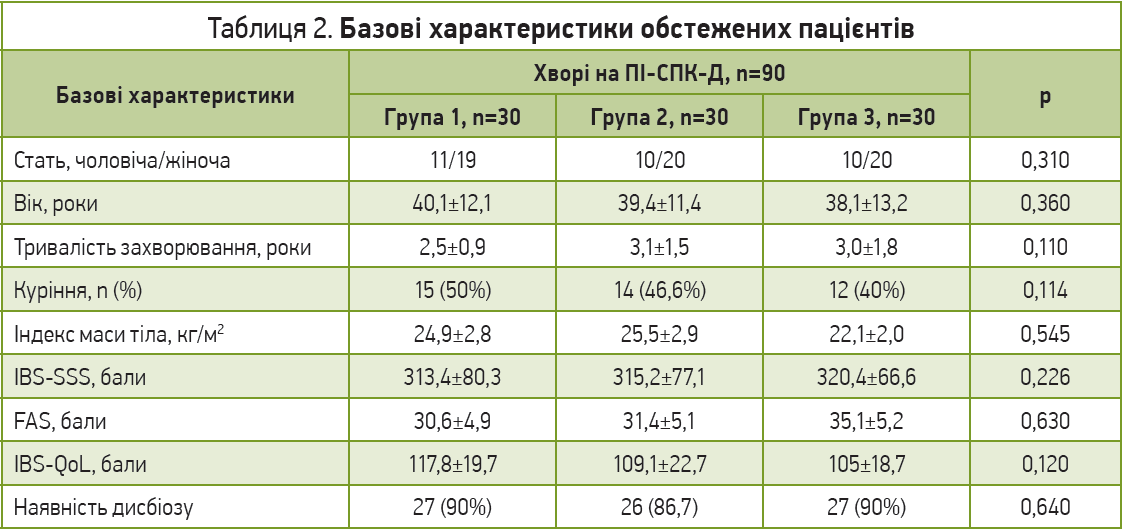
Усім хворим виконувалося комплексне лабораторне й інструментальне обстеження, що включало загальноклінічне та біохімічне дослідження крові (печінкові проби, гормони щитоподібної залози, серологічне дослідження на целіакію, електроліти), дослідження калу на кальпротектин, яйця глистів і паразити, ультрасонографію органів черевної порожнини, гастродуоденоскопію та колоноскопію із сегментарною біопсією (для виключення запальних захворювань кишечнику). У всіх хворих на підставі результатів бактеріологічного дослідження калу оцінювали кількісний і якісний склад мікробіоценозу товстої кишки за Епштейн-Литвак і Вільшанською. При цьому визначали вміст основних представників облігатної мікрофлори (біфідо- та лактобактерії, кишкові палички з незміненими біологічними властивостями, фекальні стрептококи), а також вивчали спектр умовно-патогенних мікроорганізмів і різних видів грибів Candida. Як контрольну групу було обстежено 30 умовно здорових осіб, які не мали будь-якої гастроентерологічної симптоматики. Базові характеристики хворих наведено в таблиці 2.
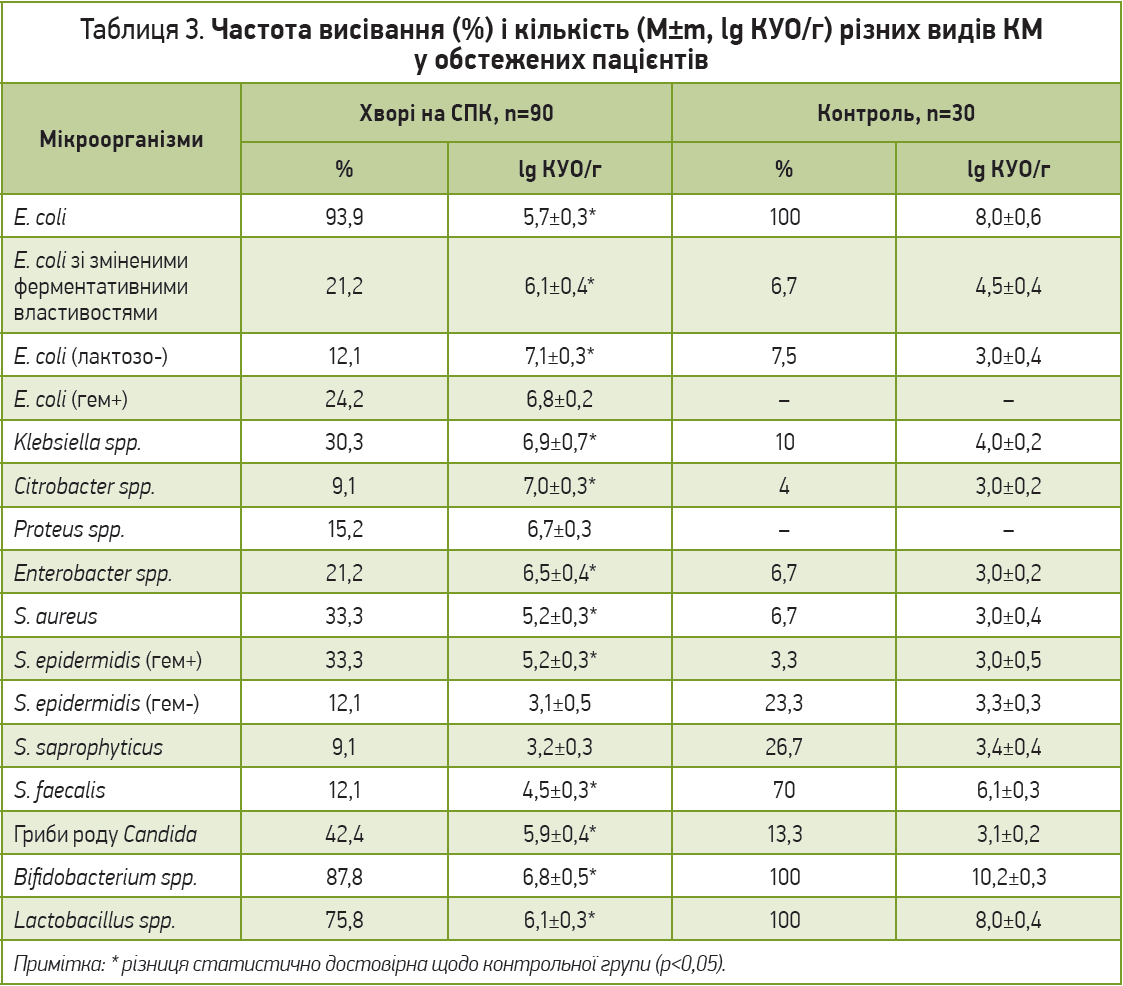
Кишковий дисбіоз різного ступеня було виявлено у 80 із 90 хворих на ПІ-СПК (88,8%), що достовірно перевищувало його частоту в контрольній групі. Якісний аналіз КМ показав вищу частоту висівання з фекалій хворих на ПІ-СПК порівняно з контролем різних видів стафілококів, які мають патогенні властивості (Staphylococcus aureus і Staphylococcus epidermidis (гем+), а також Escherichia coli (гем+), лактозонегативна E. coli, Klebsiella spp., Proteus spp. та Enterobacter spp.). Частота висівання грибів Candida з кишечнику досягала значних показників – 42,4% (табл. 3).
Залежно від проведеного лікування всі пацієнти з ПІ-СПК-Д за допомогою комп’ютерного методу випадкових чисел у співвідношенні 1:1:1 були рандомізовані на 3 групи по 30 хворих у кожній. Усі пацієнти отримували базисну терапію, що включає дієту з обмеженням клітковини, спазмолітик (отилонію бромід – по 1 таблетці 3 рази на день) і лоперамід на вимогу. Пацієнтам I групи додатково рекомендували Неофлорум (по 1 капсулі 2 рази на добу протягом 1 міс), пацієнтам II групи призначали Лінекс (по 1 капсулі 2 рази на добу протягом 1 міс), III групи – Ентерожерміну (5 мл 2 рази на добу протягом 1 міс). Ефективність лікування в кожній групі оцінювали через 1 міс за кількістю респондерів – пацієнтів, які повідомили про ≥30% зменшення середнього числа випадків найсильнішого болю в животі та ≥50% зменшення кількості днів на тиждень, у які щонайменше одні випорожнення мали консистенцію типу 6 або 7 відповідно до Бристольської шкали форми випорожнень порівняно з вихідним рівнем [14]. Також ефективність лікування в кожній групі визначали за динамікою абдомінальних симптомів, оцінених за шкалою IBS-SSS, зниження втоми (за допомогою шкали оцінки втоми FAS), а також зміни якості життя (за допомогою шкали оцінки якості життя IBS-QoL) [21, 22]. Як клінічне поліпшення розглядали зменшення числа балів після лікування за IBS-SSS ≥50, за FAS ≥4 та за IBS-QoL ≥14. Негативні результати включали збереження діареї, що потребує припинення чи зміни лікування, та побічні ефекти, що призводять до припинення терапії.
Результати
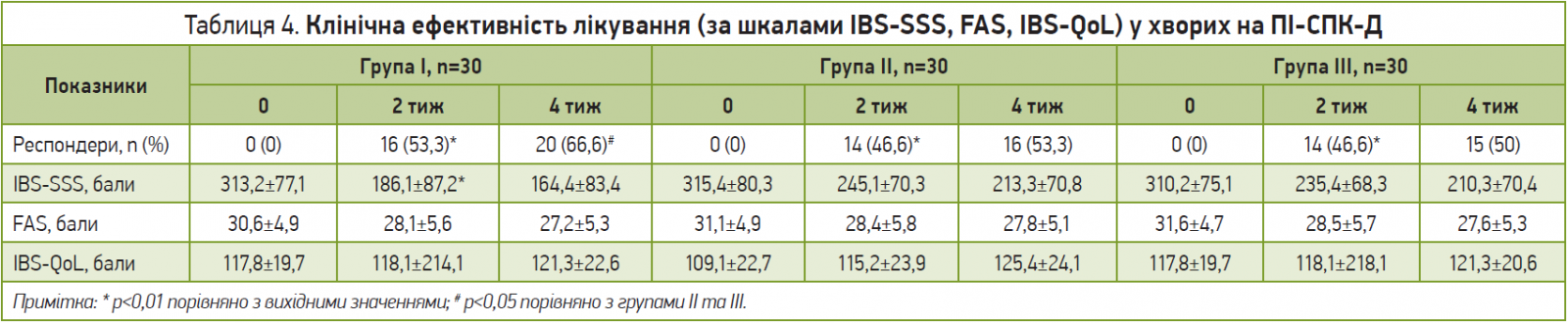
У всіх групах у більшості хворих лікування виявилося ефективним, хоча число пацієнтів із позитивною відповіддю та вираженість ефекту між групами дещо відрізнялися (табл. 4). Якщо через 2 тиж після початку лікування число респондерів між групами достовірно не відрізнялося, то через 4 тиж у групі I воно було достовірно вище, ніж у групах II та III. Зокрема, в групі I через 4 тиж число респондерів (20 із 30 хворих, 66,6%) було достовірно вищим, аніж у групі II (16 із 30 хворих, 53,3%; р<0,01) і групі III (15 із 30 хворих, 50%; р<0,01). Окрім того, в групі I поліпшення/нормалізація консистенції випорожнень відзначалася у 22 (73,3%) осіб, зменшення здуття живота – у 21 (70%), зниження чи нормалізація частоти імперативних позивів – у 21 (70%) хворих, тоді як у групі II аналогічні показники становили 66,6; 53,3 та 60%, а в групі III – 60; 53,3 та 60% відповідно (р<0,01). Ступінь тяжкості симптомів СПК за шкалою IBS-SSS у всіх групах хворих прогресивно знижувався, достовірно зменшуючись порівняно з початковими показниками як через 2 тиж, так і через 4 тиж від початку прийому пробіотиків (р<0,01). Хоча достовірних відмінностей показників IBS-SSS між групами через 2 та 4 тиж відзначено не було, все-таки зменшення абдомінального болю та здуття, а також поліпшення консистенції випорожнень було вираженішим у I групі.
Отже, в пацієнтів із ПІ-СПК-Д додаткове застосування Неофлоруму супроводжувалося підвищенням клінічної ефективності лікування порівняно з таким на тлі застосування інших пробіотиків. Ступінь вираженості втоми (фізичної та розумової), оцінений за шкалою FAS, також зменшився (р<0,05) порівняно з вихідним у всіх групах хворих, хоча відмінності не досягали достовірних значень, як і не було достовірного поліпшення якості життя за показниками IBS-QoL через 2 та 4 тиж після початку лікування.
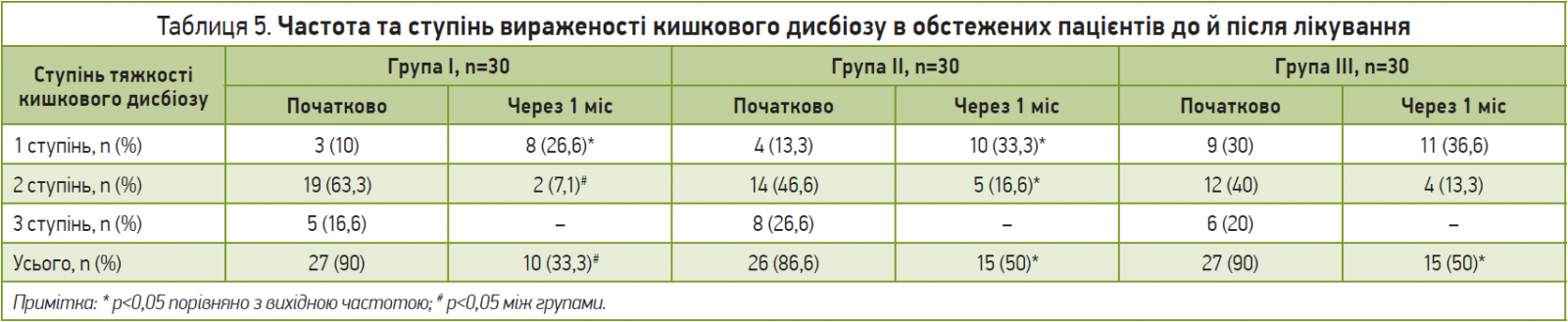
У більшості хворих на ПІ-СПК перед початком лікування було зареєстровано зміни якісного та кількісного складу мікрофлори кишечнику, які залежали від ступеня тяжкості СПК. Якісний аналіз КМ показав вищу частоту висівання з фекалій хворих на ПІ-СПК-Д порівняно з контролем різних видів стафілококів і стрептококів, які мають патогенні властивості: S. aureus і S. epidermidis (гем+), а також E. coli (гем+), лактозонегативна E. coli, Klebsiella spp., Proteus spp. та Enterobacter spp. Окрім того, виявлено істотне зниження кількісного рівня Bifidobacterium spp. (87,8% хворих) і Lactobacillus spp. (75,8%). Через 4 тиж після початку лікування в усіх групах хворих було виявлено достовірне зменшення частоти кишкового дисбіозу та ступеня його тяжкості порівняно з вихідними показниками (р<0,05), що достовірно частіше відзначалося в групі хворих, яким рекомендували Неофлорум (табл. 5). Слід зазначити, що в пацієнтів I групи також достовірно знизилася частота висівання умовно-патогенної флори. У хворих, які вживали Неофлорум, достовірно рідше, ніж у пацієнтів груп II та III, висівали Clostridium, Staphylococcus, Proteus та E. coli зі зміненими ферментативними властивостями (лактозонегативну), а гемолітичну кишкову паличку після вживання Неофлоруму не було виявлено в жодного пацієнта.
Відповідно, в пацієнтів із ПІ-СПК-Д застосування пробіотика Неофлорум супроводжувалося достовірним як клінічним, так і мікробіологічним ефектом, який був вищим, аніж у інших порівнюваних пробіотиків, як-от Лінекс і Ентерожерміна. Усі хворі повністю завершили лікування, в жодному випадку не було зафіксовано істотних побічних ефектів, які потребували скасування пробіотиків. Проведене дослідження показало, що Неофлорум, який містить пробіотичні штами біфідобактерій (B. longum) і лактобактерій (L. rhamnosus, L. helveticus) у дозі не менш як 5×109 КУО, а також дріжджі S. boulardii в дозі 125 мг, варто розглядати як безпечну, добре переносиму та високоефективну дієтичну добавку до раціону харчування в пацієнтів із СПК-Д.
Обговорення
Дослідження останніх років показали, що ПІ-СПК є досить поширеною патологією, що трапляється приблизно в 1 з 10 осіб, які перенесли гострий інфекційний гастроентерит [6, 8]. Оскільки гострий ІЕ є одним з основних факторів ризику СПК, а останній може бути об’єктивно ідентифікований після перенесеної інфекції, це дає змогу спростувати твердження, що СПК є криптогенним станом. Основні фактори ризику ПІ-СПК включають також жіночу стать, молодий вік, певні психологічні чинники до чи під час гострого ІЕ (занепокоєння, депресія, соматизація тощо), а також тяжкість і тривалість перебігу ІЕ. Природний перебіг ПІ-СПК передбачає, що з часом його прояви стихають, а загальний прогноз може бути кращим, аніж за СПК загалом [7]. Патофізіологія ПІ-СПК є багатофакторною та передбачає порушення моторики, вісцеральну гіперчутливість, кишковий дисбіоз, імунну активацію, зміни з боку ентероендокринних клітин, генетичні чинники. Оскільки специфічні лікувальні рекомендації для ПІ-СПК поки що не розроблено, його терапія аналогічна такій за різних субтипів СПК [8].
Як відомо, в більшості пацієнтів із СПК є зниженою різноманітність КМ зі збільшенням числа ентеробактерій і відносно низькими рівнями біфідобактерій і лактобацил, а також порушенням співвідношення основних філотипів КМ [21]. Кишковий дисбіоз наразі розглядають як важливий патогенетичний фактор СПК та ПІ-СПК, отож останнім часом інтенсивно вивчаються різні терапевтичні стратегії, пов’язані з модифікацією КМ, у тому числі застосування пробіотиків і рифаксиміну.
Оскільки в доступній літературі ми не знайшли досліджень, присвячених застосуванню трансплантації фекальної мікробіоти (ТФМ) у разі ПІ-СПК, то провели відповідне випробування її ефективності та безпеки при цій патології порівняно з традиційною фармакотерапією. За своїм дизайном дослідження було сліпим рандомізованим і порівняльним, проведене в паралельних групах хворих на ПІ-СПК. Недоліками випробування були відсутність подвійного сліпого контролю, порівняно невелике число хворих тільки з одним фенотипом (СПК-Д), проведення тільки одноразової процедури. Проте було встановлено, що одноразове виконання ТФМ хворим на ПІ-СПК виявилося ефективним у більшості пацієнтів (понад 60%), причому її ефективність і безпека були зіставні з результатами традиційної 4-тижневої фармакотерапії. Отримані дані узгоджуються з результатами інших досліджень [13-15]. Ефективність ТФМ клінічно виявлялася вже через 2 тиж, поступово збільшуючись до 3 міс спостереження. Перевагою цього методу також є мікробіологічна ефективність, що проявляється вже через 4 тиж у вигляді зменшення частоти та ступеня тяжкості кишкового дисбіозу, збільшення різноманітності КМ, а також у тенденції до нормалізації співвідношення основних її філотипів. Легкі побічні ефекти ТФМ виникали порівняно нечасто, були короткочасними й минущими, у зв’язку з чим не мали будь-якого істотного клінічного значення.
Останніми роками широко проводяться рандомізовані клінічні дослідження численних пробіотиків, які є похідними традиційної ферментованої їжі, коменсальних бактерій, що мають вигідні для організму людини властивості чи отримуються з навколишнього середовища. Застосування пробіотиків показало обнадійливі результати при цілій низці як кишкових, так і позакишкових захворювань, за яких спостерігаються порушення мікробіоти [6, 21, 28].
Сучасні пробіотики повинні відповідати таким вимогам: 1) чинити позитивну дію на організм господаря; 2) не спричиняти побічних ефектів у разі тривалого застосування; 3) мати колонізаційний потенціал, тобто зберігатися в травному тракті до досягнення максимального позитивного ефекту (бути стійкими до низької кислотності, жовчних кислот, протимікробних токсинів і ферментів, які продукуються патогенною мікрофлорою); 4) характеризуватися стабільною клінічною ефективністю, простою технологією отримання [22, 23].
Механізм дії пробіотиків зумовлений наявністю в мікроорганізмів, які входять до їхнього складу, низки функціональних властивостей: здатності виживати в кислому середовищі, ефективно прикріплюватися до епітеліоцитів слизової стінки кишки та колонізувати її, продукувати протимікробні речовини, стимулювати імунну систему, запобігати надлишковому росту та розмноженню патогенних мікробів і відновлювати нормальну мікрофлору кишечнику [4, 26]. Просуваючись травним трактом, мікроорганізми зберігають свою життєздатність і забезпечують тимчасову корисну дію на мікрофлору кишечнику, модифікуючи її склад і метаболічну активність. Ефективність пробіотиків залежить від багатьох чинників: їхнього складу, стану мікрофлори організму людини, способу життя тощо. Найчастіше призначаються й найкраще вивченими є пробіотики, виготовлені на основі біфідобактерій, лактобактерій та ентерококів [21, 22].
Нині постійно зростає кількість робіт із вивчення ефективності різних пробіотичних штамів у разі запальних захворювань кишечнику, СПК, діареї, закрепів, вагінітів, атопічного дерматиту, харчової алергії та хвороб печінки [3, 5, 6, 9-12, 17, 20].
Із лікувальною метою можуть застосовуватися пробіотики, що містять такі мікроорганізми, які є звичайними жителями кишечнику, найперше біфідо- та лактобактерії, а також мікроорганізми, які в нормі в кишечнику людини не живуть (наприклад, Bacillus cereus IP 5832 або S. boulardii). Ці препарати можуть бути монокомпонентними, тобто включати тільки один вид мікроорганізмів, або багатокомпонентними. Вважається, що для корекції дисбіозу кишечнику найдоцільніше використовувати багатокомпонентні лікарські засоби, що містять мікроорганізми з доведеним пробіотичним ефектом. Вони зазвичай призначаються курсами тривалістю не менш як 1 міс [13, 15, 27].
Одним із нових ефективних сучасних комбінованих мультиштамних пробіотиків, які застосовуються в Україні, є Неофлорум (компанія «УА «Про-Фарма»), що містить вдало підібрану комбінацію пробіотичних бактерій: L. rhamnosus Rosell‑11, L. helveticus Rosell‑52 та B. longum Rosell‑175 у дозі не менш як 5×109 КУО, а також дріжджі S. boulardii в дозі 125 мг. Ці бактерії мають виражену антагоністичну дію стосовно C. difficile й інших патогенів, а також сприяють нормалізації КМ.
Висновки
Застосування пробіотиків продемонструвало обнадійливі результати при лікуванні багатьох станів, пов’язаних із порушеннями мікробіоти. Зокрема, результати проведеного нами дослідження показали ефективність і безпеку нового комбінованого мультиштамного пробіотика Неофлорум у веденні пацієнтів із СПК-Д. Порівняно з іншими пробіотиками (Лінекс, Ентерожерміна) застосування Неофлоруму супроводжувалося вираженішим клініко-мікробіологічними ефектом, а саме достовірно частішим зникненням/поліпшенням основних клінічних симптомів, а також зниженням частоти виявлення кишкового дисбіозу після 1-місячного курсового лікування.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 18 (511), 2021 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...