Вплив систем нагріву тютюну на здоров’я ротової порожнини: огляд наукових даних
Тютюнокуріння є однією з актуальних соціальних та медичних проблем сучасності, а також причиною багатьох тяжких захворювань (онкологічних, серцево-судинних, респіраторних тощо). Поширеність куріння в Україні залишається на досить високому рівні: в середньому курять 40,1% чоловіків і 8,9% жінок (це майже ¼ усього дорослого населення) [1]. Згубний вплив тютюнокуріння добре відомий лікарям різних спеціальностей, однак мало хто зважає на те, що куріння спричиняє негативні наслідки і для ротової порожнини, адже першими під удар шкідливого чинника потрапляють слизова оболонка порожнини рота та тканини пародонту [2].
Органи та тканини порожнини рота, ротова рідина — це місця первинного контакту організму курця з токсичними і канцерогенними речовинами, які входять до складу тютюнового диму. В огляді наявних публікацій щодо зв’язку куріння із захворюваннями ротової порожнини, який підготувала Американська колегія лікарів, доведено значний вплив куріння на виникнення карієсу зубів, захворювань пародонту та слизової оболонки порожнини рота, випадки відторгнення зубних імплантатів [3]. Курці частіше мають справу із проблемою галітозу (неприємного запаху з рота), утворенням специфічного щільного нальоту на зубах («нальоту курця»), сухістю в порожнині рота та смаковими інверсіями.
За допомогою численних епідеміологічних досліджень доведено, що серед курців поширеність захворювань пародонту є набагато вищою, ніж серед некурців, а вираженість клінічних проявів, прогноз наслідків безпосередньо залежать від кількості сигарет, викурених щодня, і тривалості шкідливої звички (очевидніші після 10 років куріння) [4].
Встановлено, що куріння негативно впливає на гігієнічний стан порожнини рота, про що свідчать більш високі значення гігієнічних індексів у курців (порівняно з некурцями) [4, 5]. В курців інтенсивніше утворюються тверді зубні відкладення [5, 6], які травмують ясенний край і є ретенційним пунктом для формування зрілої біоплівки, найбільш патогенної для твердих тканин зуба та тканин пародонту.
Саме тому стоматологи повинні щодня інформувати пацієнтів про негативний вплив куріння на тканини порожнини рота, спонукаючи їх до повного припинення куріння. З огляду на щораз вищу популярність альтернативних методів доставки нікотину, зокрема систем для нагрівання тютюну (СНТ) виробництва Philip Morris Products S.A., комерціалізованих під ТМ IQOS, у цьому огляді зібрано дані наукових публікацій щодо впливу СНТ на здоров’я ротової порожнини для оцінки зменшення шкоди порівняно із продовженням куріння. Хоча вони не цілком безпечні, дані токсикологічних і клінічних досліджень свідчать про значне зниження виділення [7] та впливу [8] на організм шкідливих речовин, характерних для сигаретного диму (СД). Однак варто ще раз наголосити: незважаючи на нижченаведену інформацію, єдиний спосіб мінімізувати всі ризики — відмова від споживання тютюну та нікотину в будь-якому вигляді.
Вплив на тканини ротової порожнини
Функція слизової оболонки ротової порожнини полягає у захисті тканин та органів, що знаходяться під нею, від фізичних, механічних, хімічних ушкоджень, а також ушкоджень, спричинених впливом мікроорганізмів. Експозиція токсинів, що потрапляють до ротової порожнини, може зумовити зміну структури епітелію, а це спричиняє адаптаційні/реакційні чи патологічні зміни.
Оскільки СД потрапляє до організму через ротову порожнину, велике значення має належний стан її епітелію, який виконує функцію первинного захисту, тому має зберігатися баланс між розмноженням, диференціюванням і злущуванням або загибеллю його клітин. Хоча СД не впливає на цикл кератиноцитів у ротовій порожнині, він змінює кількість клітин, що піддаються ранньому чи пізньому апоптозу, а це впливає на біологію епітелію ротової порожнини. За 3 год експозиції СД у базальних і надбазальних шарах експлантованого до пробірки епітелію ротової порожнини були виявлені зміни клітинного диференціювання, хоча не спостерігалося жодного впливу на міжклітинну адгезію та захисні функції. У курців в епітелії ротової порожнини також спостерігалися зміни експресії генів, які інколи значною мірою впливають на тканини та фенотип. Утім, у багатьох випадках цитологічні, геномні та транскриптомні зміни слизової оболонки ротової порожнини були зумовлені запальними захворюваннями в ротовій порожнині (наприклад, пародонтит) або пренеоплазією чи раком шлунково-кишкового тракту.
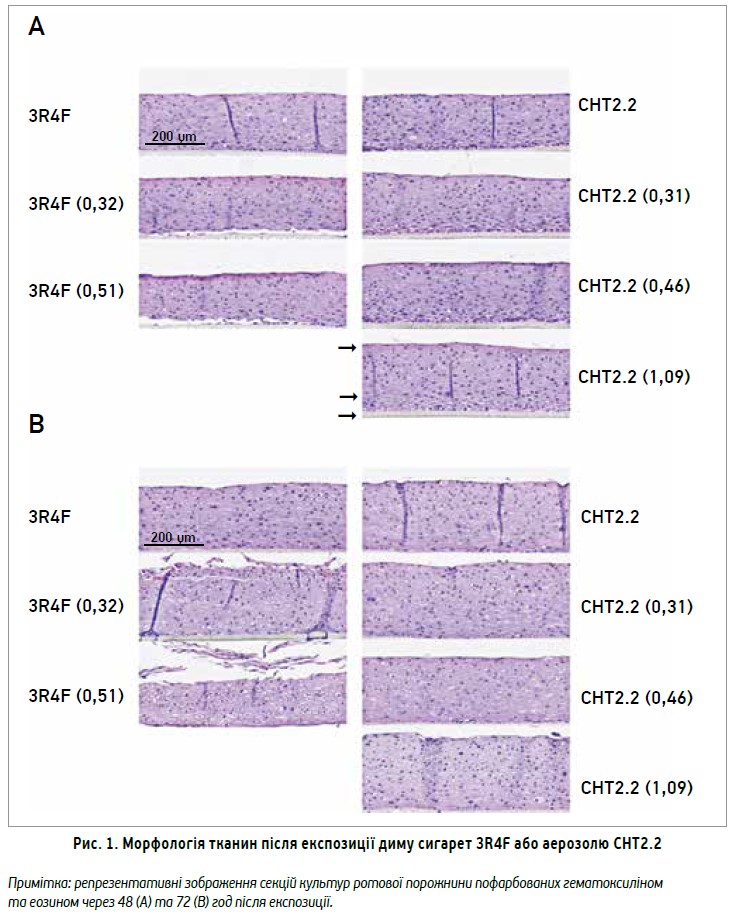
У своєму дослідженні «Системна токсикологічна оцінка біологічного впливу тютюнових продуктів модифікованого ризику на органотипові культури епітеліальних тканин у ротовій порожнині людини» Філіппо Занетті та співавт. порівняли ефект від експозиції аерозолю, отриманого з тютюнових продуктів модифікованого ризику (СНТ2.2), із СД від сигарети формату 3R4F. Органотипові культури епітеліальних тканин у ротовій порожнині людини (EpiOral, MatTek Corporation) упродовж 28 хв піддавалися впливу СД від сигарет 3R4F або аерозолю СНТ2.2; обидві речовини розбавили повітрям, щоб отримати відповідну концентрацію (0,32 або 0,51 мг нікотину/л аерозоль/дим від сигарети 3R4F та 0,31 і 0,46 мг/л для СНТ2.2). Також перевірили вплив аерозолю СНТ2.2 з більш високою концентрацією (1,09 мг/л). Застосовувався системний токсикологічний підхід, що поєднував клітинний аналіз (аналізи цитотоксичності й активності цитохрому Р450), комплексне молекулярне дослідження транскриптому букального епітелію (іРНК та мікроРНК), які проводилися за допомогою біологічних підрахунків, вимірювання прозапальних маркерів, що з’явилися, та гістопатологічний аналіз. Спостерігалося, що вплив диму від сигарет 3R4F був більш цитотоксичним, спричинив значніші морфологічні зміни в тканинах, а також інтенсивніше виділення медіаторів запалення, ніж аерозоль СНТ2.2 (рис. 1). Аналіз транскриптомних змін культур ротової порожнини, які піддавалися впливу, продемонстрував наявність значних порушень у різних моделях мережі, як-от апоптоз, некроптоз, старіння, метаболізм ксенобіотиків, оксидативний стрес та ядерний фактор 2, що пов’язаний з еритроїдним фактором 2 (NFE2L2). Реакція на стрес, спричинений експозицією аерозолю СНТ2.2, була значно слабшою, а культури, на які здійснювався вплив, відновилися більше (ніж після впливу диму сигарет 3R4F) [9].
Естетична складова: наліт курця та фарбування зубів
Хоча конкретний механізм пов’язаної з курінням зміни кольору детально не досліджено, вважається, що бурі пігменти з певної фази СД є основним чинником утворення темних плям на зубах і полімерних композитних матеріалах. При запалюванні та затяжці сигаретою тютюн згорає при температурі від 600 до 900 °C з утворенням дисперсної фази, яка містить тверді частинки та крапельки рідини, що зависли в газовій фазі. Коли дисперсна фаза затримується на фільтрі та віднімається кількість наявних води і нікотину, залишок класифікується як сухі тверді частинки, які не містять нікотину (NFDPM), котрі ще називають смолами. В смолах наявні пігментовані сполуки й іони таких металів, як свинець та кадмій; вони можуть осідати на поверхні чи потрапляти до матричної структури твердих тканин зуба та полімерних композитних матеріалів, що спричиняє зміну їхнього кольору. Отже, серйозність пов’язаної з курінням зміни кольору зубів і полімерного композиту значною мірою залежить від кількості бурого нальоту, утвореного під час згорання тютюну при дуже високих температурах. Іншими словами, зменшення або видалення смол із СД має потенціал до мінімізації впливу куріння на стійкість кольору полімерних композитних матеріалів. З огляду на цю передумову тютюновмісний продукт, який зумовлює чіткий зсув у складі аерозолю (порівняно із СД), може спричиняти зміну кольорів композитних полімерів з меншою імовірністю.
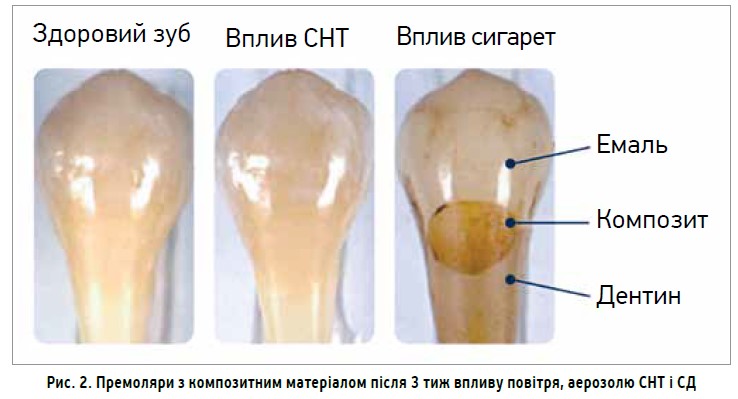
Результати дослідження «Вплив куріння сигарет на стабільність кольору зубопротезних полімерних композитів» Сяоі Чжао та співавт. довели, що куріння сигарет зумовлює значну зміну кольору широко застосовуваних зубних полімерних композитів і може спричинити погіршення естетичного вигляду пломбувальних матеріалів. Хоча мікронаповнений полімерний композит DVS продемонстрував меншу зміну кольору порівняно з універсальними полімерними композитами TEC і FSU, які використовувалися в цьому дослідженні, стійкість його кольору залишається проблематичною, оскільки бурувате забарвлення було легко помітним неозброєним оком після 3 тиж впливу куріння сигарет in vitro. Найімовірніше, зміна кольору полімерного композиту пов’язана з пігментами в дисперсній фазі (смолі), яка утворюється через згорання тютюну при високих температурах під час куріння сигарет, оскільки значно менша зміна кольору відбувалася при використанні тютюновмісних стіків за технологією «нагрівання замість горіння», СНТ2.2. Аерозоль з СНТ2.2 зумовлював лише незначне збільшення жовтизни полімерних композитів, тоді як СД значною мірою збільшував жовтизну, почервоніння та потемніння полімерних композитів і спричиняв 68-разове збільшення ΔE в кольоровому просторі CIE Lab (рис. 2) [10].
Чи впливає на зміну кольору зубів нікотин?
Аналіз А. Гайдук хімічних відкладень на емалі під дією СД та аерозолю СНТ за допомогою газової хроматографії, а також мас-спектрометрії визначив 11 компонентів тютюнового диму, які сприяють зміні кольору емалі (більшість з них складали терпеноїди). Нікотин не можна було ідентифікувати як значне джерело знебарвлення, якщо порівнювати зразки експонованих продуктів, що містять нікотин (СД або аерозоль СНТ), з контрольними зразками. Зразки — емалеві блоки великої рогатої худоби, які підлягали впливу СД та аерозолю СНТ протягом 14 днів (із чищенням зубною пастою) [11].
Контроверсійні дані – клінічний випадок
Пацієнтка Л., 1956 р. н., звернулася до дерматовенеролога КУ «Запорізький обласний шкірно-венерологічний клінічний диспансер» зі скаргою на появу ділянки ураження на нижній губі, що супроводжується пекучим болем і незначним свербінням. Історія хвороби не виявила схожих випадків. В особистому анамнезі хвора повідомила, що курить 26 років і не може кинути. Через традиційне куріння в жінки спостерігалися напади бронхіальної астми. За порадою лікаря з 01.12.2018 р. почала використовувати стіки HEETS і систему для нагрівання тютюну IQOS, щоб змінити традиційний спосіб куріння тютюну, що спричинило стабілізацію стану дихальної системи, але, на її думку, стало пусковим механізмом для зміни червоної облямівки шкіри. Через 4-5 міс щоденного використання IQOS уражена ділянка з’явилася на нижній губі. Ділянка ураження поступово збільшувалася і почала турбувати пацієнтку. На початку травня 2019 р. на відстані ≈1,0-1,5 см від лівого кута рота на нижній губі в зоні звичайного куріння з’явився висип, сформувалася огрубіла шкіра (за словами пацієнтки) діаметром 4-5 мм, що супроводжувалося печінням і свербінням. Хвора пов’язувала появу висипу зі стіками HEETS і розігрітим тютюновим виробом IQOS, оскільки ця зона була в контакті. Згодом жінка почала перекладати стік від ураженого лівого кута рота до правого, де через декілька тижнів з’явився такий самий висип. Через 3-4 тиж патологічний процес почав поширюватися майже на всю червону облямівку (нижня губа). Протягом подальших 3-4 міс уражена ділянка почала твердіти. За цей час пацієнтка не зверталася по професійну медичну допомогу та не займалася самолікуванням. При огляді на нижній губі виявлено наліт неправильної форми молочного кольору, що підноситься над незміненою поверхнею на 1-2 мм. Наліт був ущільнений (з чіткими рифленими межами та шорсткою поверхнею).
Оскільки пацієнтка категорично відмовилася від біопсії з подальшим гістологічним дослідженням (а також від хірургічного лікування), було встановлено діагноз: верукозна лейкоплакія червоної облямівки (нижня губа), бляшковий тип. З огляду на можливу травматизацію та ризик переродження зазначеного новоутворення хворій призначено місцеву терапію комбінованим препаратом, що містить глюкокортикоїдні, антибактеріальні й антимікотичні компоненти; водночас складено схему лікування тривалістю 1 міс: 2 р/добу протягом 7 днів, ще 3 тиж — 1 р/добу (перед сном).
У зв’язку з тим, що запропонована терапія покращувала суб’єктивний стан пацієнтки, зменшувала уражену ділянку та її інфільтрацію, на уражену ділянку призначали крем для місцевого застосування з 1% пімекролімусом 2 р/добу протягом 3 міс з метою поступової відміни глюкокортикоїдного препарату. Продовження — під постійним спостереженням. Уражена ділянка практично не турбувала жінку та стала більш пласкою. Дерматоскопічні прояви формування онкопатології були відсутні. Оскільки хвора продовжувала використовувати СНТ і відмовлялася від інших методів терапії, клінічне поліпшення було пом’якшено. Планувалося продовження призначеної терапії з застосуванням 1% крему пімекролімусу, а також подальше тривале клінічне та дерматоскопічне спостереження з метою дослідження стану шкіри [12].
Висновки
Отже, найкращий спосіб позбавитися всіх ризиків – повна відмова від споживання тютюну та нікотину в будь-якому вигляді. Клінічний випадок продемонстрував, що спеціалісти в разі відмови пацієнта кинути курити можуть рекомендувати перехід на альтернативні методи споживання тютюну, в т. ч. СНТ. Для спеціаліста в сфері стоматології важливо розуміти різницю впливу нових продуктів і традиційного куріння, водночас спонукаючи пацієнта до повної відмови від куріння.
Література
1. WHO: The Global Adult Tobacco Survey (GATS) Ukraine. – 2017.
2. Стоматологические проблемы курильщиков и пути их решения / А. Б. Чухловин, А. А. Тотолян, Ю. Г. Трофимова [и др.] // Клиническая стоматология. – 2007. – № 2. – С. 52-56.
3. The health consequences of smoking – 50 years of progress: a report of the Surgeon General. – Atlanta, GA.: U. S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, Office on Smoking and Health. – 2014. – Р. 944.
4. Rivera-Hidalgo F. Smoking and periodontal disease / F. Rivera-Hidalgo // Periodontology 2000. – 2003. – Vol. 32. – P. 50-58.
5. Müller H-P. Longitudinal association between plaque and gingival bleeding in smokers and non-smokers / H-P. Müller, S. Stadermann, A. Heinecke // J. Clin. Periodontol. – 2002. – Vol. 29, N. 4. – P. 287-294.
6. Comparison of the validity of periodontal probing measurements in smokers and non-smokers / A. J. Biddle, R. M. Palmer, R. F. Wilson, T.L.P. Watts // J. Clin. Periodontol. – 2001. – Vol. 28, N. 8. – P. 806-812.
7. Filippo Zanetti et al., Assessment of the impact of aerosol from a potential modified risk tobacco product compared with cigarette smoke on human organotypic oral epithelial cultures under different exposure regimens, Food and Chemical Toxicology, Volume 115, 2018, Pages 148-169, ISSN0278-6915, https://doi.org/10.1016/j.fct.2018.02.062.
8. Zhao, Xiaoyi & Zanetti, Filippo & Majeed, Shoaib & Pan, Jie & Malmström, Hans & Peitsch, Manuel & Hoeng, Julia & Ren, Yanfang (2017). Effects of cigarette smoking on color stability of dental resin composites. American journal of dentistry. 30. 316-322.
9. Adrian Haiduc et al. Analysis of chemical deposits on tooth enamel exposed to total particulate matter from cigarette smoke and tobacco heating system 2.2 aerosol by novel GC-MS deconvolution procedures, Journal of Chromatography B, Volume 1152, 2020, 122228, ISSN1570-0232, https://doi.org/10.1016/j.jchromb.2020.122228.
10. H.I. Makurina et al. Verrucous leukoplakia of the red border caused by the use of IQOS heated tobacco product (a case report), Zaporozhye medical journal. Volume 22. No. 6, November – December 2020ISSN2306-4145. 885-890.
Підготувала Іванна Листопад
Медична газета «Здоров’я України 21 сторіччя» № 19 (512), 2021 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Однією із найвагоміших знахідок із часу відкриття дигіталісу Нобелівський комітет назвав синтез і дослідження β-блокаторів, які зараз мають провідні стабільні позиції у лікуванні більшості серцево-судинних хвороб (ішемічна хвороба серця – стенокардія, гострий коронарний синдром, інфаркт міокарда, артеріальна гіпертензія, серцева недостатність, тахіаритмії) (Радченко О.М., 2010). Це епохальне відкриття зроблено під керівництвом британського фармаколога Джеймса Блека (James Whyte Black), який отримав за нього Нобелівську премію в 1988 році. ...