Новітні рекомендації Європейського товариства кардіологів щодо діагностики, лікування та профілактики серцево-судинних захворювань в онкологічних пацієнтів
Сучасна стратегія лікування онкологічних пацієнтів спрямована на забезпечення їх тривалої виживаності та мінімізацію токсичного впливу протипухлинних лікарських засобів на інші органи та системи, зокрема на серцево-судинну систему (ССС), що в цілому дозволить підвищити якість життя. За ініціативи Європейського товариства кардіологів (European Society of Cardiology, ESC) у співпраці з Європейською асоціацією гематологів, Європейським товариством терапевтичних радіологів та онкологів і Міжнародним кардіоонкологічним товариством було розроблено рекомендації, у яких міститься новітня інформація щодо діагностики, лікування та профілактики серцево-судинної токсичності, зумовленої терапією раку, а також дані про особливості ведення онкологічних пацієнтів з серцево-судинними захворюваннями (ССЗ).
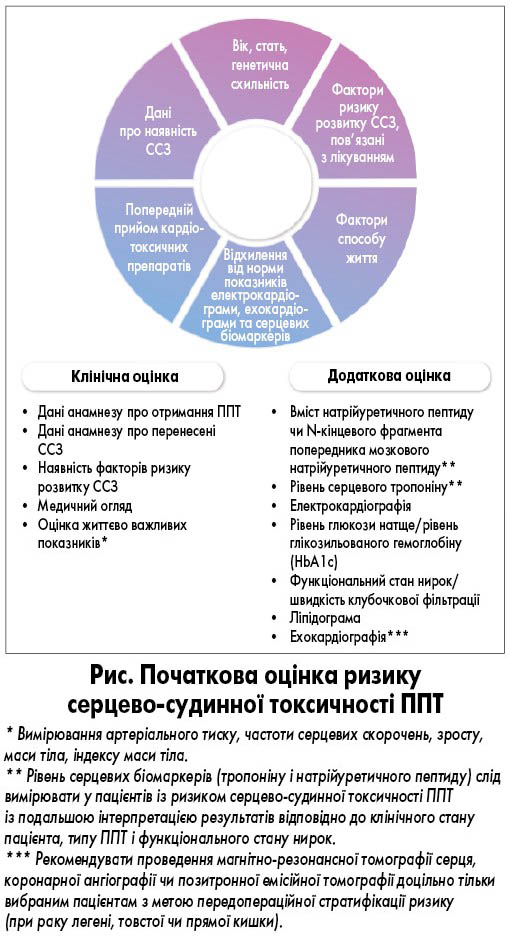 Перед призначенням протипухлинної терапії (ППТ) насамперед необхідно встановити можливий ризик її токсичного впливу на ССС, який залежить від первинного стану ССС до лікування та може змінюватися під час терапії (рис.). Ризик токсичного впливу ППТ на ССС варто оцінювати за допомогою загальновизнаного методу стратифікації ризику. Однак було опубліковано тільки обмежену кількість ретроспективних даних, більшість із яких стосувалися конкретних груп онкологічних пацієнтів [24-29]. Тому з метою оцінювання ризику токсичного впливу ППТ на ССС варто розглянути базову стратифікацію ризику серцево-судинної токсичності, розроблену Асоціацією серцевої недостатності та Міжнародним кардіоонкологічним товариством (Heart Failure Association – International Cardio-Oncology Society baseline cardiovascular toxicity risk stratification, HFA-ICOS) [12, 13]. При високому ризику серцево-судинної токсичності ППТ хворого слід направити до кардіолога [33], при помірному – забезпечити пацієнту ретельний моніторинг стану ССС та пояснити негативний вплив серцево-судинних факторів ризику на стан ССС під час отримання ППТ, а при низькому – розглянути направлення пацієнта до кардіоонколога тільки у разі розвитку нових або неконтрольованих побічних явищ (ПЯ), спричинених ППТ.
Перед призначенням протипухлинної терапії (ППТ) насамперед необхідно встановити можливий ризик її токсичного впливу на ССС, який залежить від первинного стану ССС до лікування та може змінюватися під час терапії (рис.). Ризик токсичного впливу ППТ на ССС варто оцінювати за допомогою загальновизнаного методу стратифікації ризику. Однак було опубліковано тільки обмежену кількість ретроспективних даних, більшість із яких стосувалися конкретних груп онкологічних пацієнтів [24-29]. Тому з метою оцінювання ризику токсичного впливу ППТ на ССС варто розглянути базову стратифікацію ризику серцево-судинної токсичності, розроблену Асоціацією серцевої недостатності та Міжнародним кардіоонкологічним товариством (Heart Failure Association – International Cardio-Oncology Society baseline cardiovascular toxicity risk stratification, HFA-ICOS) [12, 13]. При високому ризику серцево-судинної токсичності ППТ хворого слід направити до кардіолога [33], при помірному – забезпечити пацієнту ретельний моніторинг стану ССС та пояснити негативний вплив серцево-судинних факторів ризику на стан ССС під час отримання ППТ, а при низькому – розглянути направлення пацієнта до кардіоонколога тільки у разі розвитку нових або неконтрольованих побічних явищ (ПЯ), спричинених ППТ.
Стратегія профілактики та моніторингу серцево-судинних ускладнень у хворих, які отримують ППТ
Ризик токсичного впливу ППТ на ССС залежить від типу та стадії онкологічного захворювання, дози протипухлинних препаратів і наявності супутніх захворювань. Сьогодні відомі спільні модифіковані та немодифіковані фактори ризику розвитку ССЗ та раку [4, 131, 132]. Тому важливо рекомендувати хворим кинути курити, обмежити споживання алкоголю та включити повсякденну фізичну активність у розпорядок дня [30]. Ведення здорового способу життя знижує ризик виникнення раку, ССЗ і ймовірність розвитку ССЗ в онкологічних хворих [134, 135]. Кардіореспіраторні тренування справляють позитивний вплив на зменшення серцево-судинної токсичності ППТ, однак дані є неоднозначними [136, 137]. У профілактиці розвитку ССЗ у хворих, які отримують ППТ, важливе значення варто надавати корекції електролітного дисбалансу (гіпокаліємії та гіпомагніємії) і лікуванню супутніх захворювань (артеріальної гіпертензії [138], цукрового діабету [139], дисліпідемії [140]). У поліморбідних пацієнтів також необхідно уникати поліпрагмазії, яка може утруднювати лікування онкологічних захворювань [141].
Стратегії первинної профілактики токсичного впливу протипухлинних препаратів на ССС
Тактика профілактики ССЗ має бути індивідуальною та базуватися на систематичному комплексному підході. Головною метою первинної профілактики серцево-судинної токсичності ППТ є уникнення чи мінімізація уражень ССС [142].
Первинна профілактика токсичного впливу хіміотерапії на ССС. У кількох рандомізованих контрольованих дослідженнях встановлено, що застосування гормональної терапії під час хіміотерапії антрациклінами (з подальшим використанням трастузумабу або без нього) знижує ризик значного зниження фракції викиду (ФВ) лівого шлуночка (ЛШ) [145-154]. Дані останніх метааналізів за участю онкологічних пацієнтів, які отримували хіміотерапію антрациклінами та HER2-таргетну терапію, показали, що застосування блокаторів ренін-ангіотензин-альдостеронової системи, бета-адренорецепторів та антагоністів мінералокортикоїдних рецепторів має значну користь у запобіганні зниженню ФВ ЛШ, проте не було встановлено статистичних відмінностей щодо частоти розвитку серцевої недостатності (СН) у цієї групи пацієнтів [155-160]. Інші автори зазначають, що можна зменшити токсичний вплив антрациклінів на організм людини шляхом коригування тривалості інфузії та дози препаратів [161]. Сьогодні застосування дексразоксану і ліпосомальних антрациклінів схвалено у пацієнтів із високим і дуже високим ризиком токсичного впливу хіміотерапії на ССС, а також у пацієнтів, які попередньо отримали високі кумулятивні дози антрациклінів [158, 162-167]. У нещодавньому метааналізі 19 досліджень встановлено, що ліпосомальний доксорубіцин є менш кардіотоксичним, ніж звичайний доксорубіцин [165], та може бути розглянутий у пацієнтів із гострим лейкозом замість даунорубіцину при наявності діастолічної СН [164, 165].
Первинна профілактика токсичного впливу опромінення на ССС
Первинна профілактика уражень ССС, спричинених променевою терапією (ПТ), залежить від сучасних технологічних досягнень, які дозволяють забезпечити цільову доставку дози опромінення, зберігаючи або підвищуючи ефективність лікування при одночасному зниженні токсичного впливу на ССС [169, 170]. Зокрема, застосування ПТ модуляцією інтенсивності дози може дозволити зменшити негативний вплив опромінення на серце [171, 172]. Однак не завжди можна уникнути уражень серця при опроміненні, особливо при локалізації пухлини у середостінні (наприклад, у пацієнтів з центральною пухлиною легень, лімфомою середостіння).
Вторинна профілактика токсичного впливу ПТ у пацієнтів із ССЗ
У разі наявності ССЗ чи інших супутніх захворювань варто розглядати проведення оптимальної терапії до і під час ПТ. При призначенні пацієнтам кардіопротекторної терапії під час ПТ рекомендовано регулярно обстежувати пацієнтів і досліджувати стан ССС за допомогою електрокардіографії (ЕКГ), ехокардіографії та визначення рівня серцевих біомаркерів (натрійуретичного пептиду, серцевих тропонінів). ЕКГ-моніторинг слід виконувати пацієнтам із високим ризиком розвитку серцевих аритмій. При трактуванні визначених рівнів серцевих біомаркерів варто інтерпретувати їх, враховуючи вік, стать хворих, функціональний стан нирок, наявність ожиріння, а також тривалість ПТ і дані анамнезу щодо супутніх захворювань (фібриляції передсердь чи тромбоемболії легеневої артерії) [53, 63, 195-197]. З метою ранньої діагностики токсичного впливу ПТ на ССС рекомендовано також проводити ехокардіографію чи магнітно-резонансну томографію серця [22, 54, 94], що згодом дозволяє клініцистам вчасно призначити кардіопротекторну терапію та запобігти значному зниженню ФВ ЛШ, а також зменшити ризик переривання ПТ, що могло б вплинути на виживаність пацієнтів [22, 43, 72, 94].
Діагностика та лікування ССЗ у пацієнтів, які отримують ППТ
У разі появи гострого серцево-судинного ускладнення під час чи після ППТ хворих рекомендовано направляти у спеціалізований кардіоонкологічний центр [12]. Перед початком лікування ССЗ у цієї групи пацієнтів слід враховувати прогноз перебігу онкологічного захворювання, поточні витрати на лікування, можливий розвиток ПЯ, взаємодію між препаратами та прихильність пацієнта до терапії.
Дисфункція серця, виникнення якої пов’язане з хіміотерапією антрациклінами
Токсичний вплив хіміотерапії на ССС може проявлятися клінічно або бути безсимптомним і виявлятися у пацієнтів під час моніторингу. Доцільність продовження терапії антрациклінами слід розглядати мультидисциплінарній команді фахівців, враховуючи співвідношення користі/ризику. Рекомендовано припинити хіміотерапію в онкологічних пацієнтів, у яких розвинулася тяжка симптомна дисфункція серця [22]. Тимчасове припинення лікування антрациклінами також рекомендовано пацієнтам з помірною симптомною чи помірною або тяжкою безсимптомною дисфункцією серця.
Варто використовувати інгібітори ангіотензинперетворювального ферменту (іАПФ)/блокатори рецепторів до ангіотензину II (БРА) або інгібітори рецепторів ангіотензину-неприлізину, блокатори бета-адренорецепторів, інгібітори натрійзалежного котранспортера глюкози 2 типу й антагоністи мінералокортикоїдних рецепторів у пацієнтів, у яких під час хіміотерапії антрациклінами виникла симптомна дисфункція серця або безсимптомна помірна чи тяжка дисфункція серця. Лікування цими препаратами необхідно проводити за відсутності протипоказань до їх застосування та з титруванням до цільових доз, як зазначено у рекомендаціях ESC (2021) щодо діагностики й лікування гострої та хронічної СН [14]. Варто розглянути призначення іАПФ, БРА та/або блокаторів бета-адренорецепторів при легкій безсимптомній дисфункції серця, яка розвинулася під час хіміотерапії антрациклінами [1, 14, 102, 424].
При потребі продовження хіміотерапії антрациклінами можна обрати одну із стратегій додатково до прийому іАПФ/БРА та блокаторів бета-адренорецепторів у цільових дозах [14]. У першому випадку можна знизити дозу антрациклінів, у другому – перейти на прийом ліпосомальних антрациклінових препаратів і у третьому – провести попереднє лікування дексразоксаном перед кожним наступним циклом хіміотерапії антрациклінами. Хворим, у яких було відновлено хіміотерапію антрациклінами після попереднього епізоду дисфункції серця, а також пацієнтам із легкою безсимптомною дисфункцією серця, котрі продовжують хіміотерапію, рекомендовано здійснювати моніторинг стану ССС через кожні 1-2 цикли терапії.
Дисфункція серця, яка розвивається при застосуванні HER2-таргетної терапії
Згідно з настановами ESC (2021) щодо діагностики та лікування гострої та хронічної СН [14], рекомендовано призначати ранню кардіопротекторну терапію хворим із симптомною та тяжкою безсимптомною СН з ФВ ЛШ <40% для уникнення прогресування захворювання [425], особливо при продовженні таргетної терапії [427]. Тимчасове переривання HER2-таргетної терапії рекомендовано пацієнтам, у яких під час такого лікування розвинулася помірна або тяжка симптомна чи тяжка безсимптомна дисфункція серця з ФВ ЛШ <40%. У пацієнтів із легкою симптомною дисфункцією серця рекомендовано обговорити прийняття рішення щодо продовження або переривання HER2-цільової терапії мультидисциплінарною командою. Пацієнтам із помірною безсимптомною дисфункцією серця та ФВ ЛШ 40-49% чи легкою симптомною дисфункцією серця з ФВ ЛШ ≥50% слід продовжувати HER2-таргетну терапію та додатково призначити кардіопротекторні препарати (іАПФ/БРА та блокатори бета-адренорецепторів) і забезпечити належний моніторинг показників стану ССС [22, 33, 189, 211, 428, 429]. Хворим, які отримують HER2-таргетну терапію, рекомендовано проводити ехокардіографію та визначати рівень серцевих маркерів через кожні два цикли протягом перших чотирьох циклів після повторного початку ППТ, що дозволить контролювати частоту розвитку дисфункції серця.
Міокардит та СН, які можуть виникати при застосуванні інгібіторів імунних контрольних точок
Застосування інгібіторів контрольних точок (ІКТ) може супроводжуватися розвитком міокардиту, найчастіше – протягом перших 12 тижнів лікування, однак може виникати і пізніше – після 20-го тижня [386]. Крім того, отримання ІКТ може супроводжуватися розвитком дисліпідемії, гострого коронарного синдрому, васкуліту, атріовентрикулярних блокад, суправентрикулярних і шлуночкових аритмій, раптової смерті, перикардиту та ішемічного інсульту [323, 325]. У пацієнтів із нестабільною гемодинамікою рекомендовано розпочати лікування метилпреднізолоном у високих дозах [436].
Переривання лікування ІКТ рекомендовано у всіх випадках підозри на наявність міокардиту, а саме – появи у пацієнта нових симптомів з боку ССС протягом останніх 12 тижнів таргетної терапії. Після усунення симптомів з боку ССС рекомендовано обговорити подальшу тактику ведення пацієнта мультидисциплінарною командою. Лікування як нефульмінантного, так і фульмінантного міокардиту, асоційованого з прийомом ІКТ, слід розпочати якнайшвидше шляхом введення метилпреднізолону у дозі 500-1000 мг внутрішньовенно болюсно 1 раз на день протягом перших 3-5 днів, що дозволить знизити ризик розвитку ПЯ з боку ССС [386, 436]. У разі клінічного покращення стану пацієнта на фоні терапії (зниження рівня тропонінів більше ніж на 50% від максимального протягом 24-72 години, усунення дисфункції ЛШ, атріовентрикулярної блокади або аритмії) рекомендовано перехід із внутрішньовенного застосування кортикостероїдів на пероральний прийом преднізолону, починаючи з дози 1 мг/кг маси тіла і до 80 мг/добу. Якщо рівень тропоніну не знижується більше ніж на 50% від максимального і/або атріовентрикулярна блокада, шлуночкова аритмія чи дисфункція ЛШ зберігаються, незважаючи внутрішньовенне введення метилпреднізолону протягом 3 днів у поєднанні з кардіопротекторною терапією, слід розглянути можливість призначення імуносупресивних препаратів другої лінії, однак дані щодо їх застосування обмежені [22, 445, 446].
Розвиток дисфункції серця на фоні імунотерапії Т-клітинним рецептором химерного антигену
Найпоширенішими серцево-судинними ускладненнями у пацієнтів, які отримують терапію Т-клітинним рецептором химерного антигену (CAR-T), є аритмії (у 77,6% випадків), включаючи подовження інтервалу QT, шлуночкові аритмії та фібриляцію передсердь, СН (у 14,3% випадків), інфаркт міокарда та венозну тромбоемболію (у 0,5% випадків) [455]. Госпіталізація до відділення інтенсивної терапії рекомендована у тяжких випадках через ризик розвитку злоякісних серцевих аритмій і поліорганної недостатності.
Розвиток СН під час трансплантації гемопоетичних стовбурових клітин
Серцево-судинні ускладнення під час трансплантації гемопоетичних стовбурових клітин (ТГСК), включаючи застійну СН [456], тампонаду серця та порушення ритму (фібриляція передсердь, тріпотіння передсердь і надшлуночкова тахікардія) [457] є нечастими, однак їх слід лікувати згідно з рекомендаціями ESC [14, 273, 441, 444, 458].
Кардіоміопатія Такоцубо і рак
При розвитку кардіоміопатії Такоцубо пацієнтам рекомендовано припинити ППТ. У хворих на міокардит Такоцубо уникають призначення препаратів, які подовжують інтервал QT [467]. Роль імуносупресії у лікуванні кардіоміопатії Такоцубо невідома, тому у таких пацієнтів слід розглянути можливість внутрішньовенного введення метилпреднізолону з подальшим обговоренням плану лікування у рамках мультидисциплінарної команди.
Оцінка серцево-судинного ризику після завершення ППТ
Оцінка стану ССС протягом першого року після кардіотоксичної ППТ
Ризик розвитку серцево-судинних подій оцінюють протягом перших 12 місяців після успішного завершення ППТ. Однак цю рекомендацію не слід розглядати у пацієнтів, які припинили ППТ у зв’язку з прогресуванням раку чи поганим прогнозом.
З метою виділення груп онкологічних пацієнтів, які потребують спостереження за ССС протягом першого року після лікування раку, прийнято оцінювати ризик розвитку ССЗ за шкалою HFA-ICOS12, на підставі даних про отримання специфічної ППТ, помірний або тяжкий токсичний вплив ППТ і наявність нових порушень функції ССС за даними ехокардіографії, рівнем серцевих біомаркерів чи про появу нових серцево-судинних симптомів наприкінці терапії (через 3 або 12 місяців після лікування) [68, 208]. У пацієнтів без симптомів із високим кардіоваскулярним ризиком проведення ехокардіографії та визначення серцевих сироваткових біомаркерів рекомендовано через 3 і 12 місяців, а з помірним і низьким ризиком – через 12 місяців після завершення ППТ [53, 54, 59, 61, 68, 148, 208, 425, 634].
Усім пацієнтам, які отримували кардіопротекторну терапію з приводу ППТ, рекомендовано проводити ЕКГ, ехокардіографію та визначати рівень серцевих біомаркерів (якщо систолічна дисфункція ЛШ/СН є потенційним ризиком) через 3, 6 та 12 місяців після завершення лікування онкологічного захворювання.
Наприкінці ППТ варто також оцінити необхідність продовження кардіопротекторної терапії. У пацієнтів із безсимптомною легкою або помірною дисфункцією серця, яка розвинулася внаслідок токсичного впливу протипухлинних лікарських засобів, у яких відмічається нормалізація показників ехокардіографії та серцевих біомаркерів, рекомендовано обговорити рішення щодо відміни кардіопротекторної терапії мультидисциплінарною командою. Тривале лікування ССЗ рекомендовано пацієнтам із помірною та тяжкою симптомною або тяжкою безсимптомною дисфункцією серця, яка виникла у результаті токсичного впливу протипухлинних лікарських засобів, через високу частоту рецидивів СН, а також хворим, у яких розвинулася легка чи помірна дисфункція серця внаслідок ППТ та у яких не вдалося відновити нормальну функцію ЛШ після її оцінки наприкінці терапії.
Довгострокове спостереження пацієнтів із ССЗ, які вижили після раку
У пацієнтів, які пережили рак, неодноразово відмічаються віддалені наслідки лікування, пов’язані з впливом на фізичне та психосоціальне здоров’я, що можуть скоротити тривалість і знизити якість їхнього життя. Ризик смерті від ССЗ зростає більш ніж удвічі у пацієнтів, які пережили кілька солідних ракових захворювань і лімфому, порівняно із загальною популяцією [660-662]. Оцінювання кардіоваскулярного ризику наприкінці терапії дає змогу визначити групи пацієнтів, які потребують тривалого кардіологічного спостереження протягом перших 12 місяців після ППТ. Пацієнти, які пережили рак і в яких спостерігалася поява нових ССЗ після ППТ, належать до групи високого ризику майбутніх серцево-судинних подій, тому вони потребують тривалого спостереження.
Прогресуюча серцево-судинна токсичність, пов’язана з опроміненням, зазвичай розвивається через 5-10 років після початкового лікування й може спричинити виникнення ішемічної хвороби серця та СН у 6 разів частіше, ніж у загальній популяції. Вища серцево-судинна смертність порівняно із такою у загальній популяції пояснюється радіаційно-асоційованим захворюванням серця при лімфомі Ходжкіна, неходжкінській лімфомі, раку молочної залози та легені [663-665]. Частота і прогресування пов’язаних із ПТ серцево-судинних ускладнень залежить від дози опромінення, супутньої терапії раку, наявності ССЗ, факторів серцево-судинного ризику та віку [389, 400].
Пізні серцево-судинні ускладнення також спостерігаються у хворих, які пережили рак та яким потрібна ТГСК. Частота СН зростає до 14,5% у жінок через 15 років після ТГСК. Фактори ризику серцево-судинних захворювань після ТГСК включають вік, дозу антрацикліну, опромінення грудної клітки, гіпертензію, цукровий діабет і куріння [666]. Пацієнтам, які пережили рак, рекомендована щорічна клінічна оцінка серцево-судинного ризику, яку можна здійснювати у співпраці з фахівцями первинної ланки надання медичної допомоги. Хворих, які пережили рак і мають високий або дуже високий ризик виникнення ССЗ у майбутньому, можна розділити на групи високого раннього (протягом 5 років після ППТ) та високого пізнього (30 років після ППТ) ризику. Пацієнтів з високим або дуже високим базовим ризиком розвитку ССЗ і дисфункцією серця на момент оцінки наприкінці терапії включають у групу високого або дуже високого раннього ризику, особливо в перші 2 роки після ППТ. У цієї групи пацієнтів рекомендовано визначати рівень натрійуретичного пептиду та виконувати ехокардіографію через 1, 3 та 5 років після ППТ та надалі через кожні 5 років.
Хворим, які пережили рак, із пізнім високим ризиком дисфункції серця, пов’язаної з токсичністю ППТ (наприклад, у молодих пацієнтів із лімфомою Ходжкіна або саркомою, які отримали високу загальну кумулятивну дозу антрацикліну, або пацієнтів, котрі отримували високі дози опромінення в ділянці серця) [661, 669], рекомендовано щорічно оцінювати кардіоваскулярний ризик з об’єктивним оглядом пацієнта, реєстрацією ЕКГ і вимірюванням натрійуретичного пептиду, починаючи з 5 років після лікування за умови, що ці показники стану ССС через 12 місяців є нормальними.
Обізнаність хворих щодо токсичного впливу ППТ
Робота з пацієнтами щодо підвищення їх обізнаності про можливість розвитку ССЗ при захворюванні на рак чи після ППТ має важливе значення у профілактиці серцево-судинних подій. Варто інформувати онкологічних пацієнтів про потенційно підвищений ризик виникнення ССЗ через ППТ і рекомендувати їм повідомляти медичні бригади про появу ранніх ознак і симптомів ССЗ. Надання рекомендацій щодо здорового способу життя хворим на рак дозволяє знизити негативний вплив факторів ризику розвитку серцево-судинних подій, що дає змогу знизити ймовірність виникнення ускладнень під час і після ППТ.
Таким чином, вперше розроблені настанови з кардіоонкології містять надзвичайно цінну інформацію для фахівців онкологічної галузі, оскільки визначають тактику ведення пацієнтів з ССЗ, яким планується призначення ППТ, а також особливості профілактики, діагностики та лікування проявів серцево-судинної токсичності ППТ в онкологічних хворих.
Реферативний огляд Lyon A.R. et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS) Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC). European Heart Journal. 2022; 00: 1-133. https://doi.org/10.1093/eurheartj/ehac244.
Підготувала Ірина Неміш
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (77) 2022 р
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




