13 грудня, 2022
Досвід застосування синдромно-патогенетичної терапії у пацієнтів із постковідним синдромом
 На початку 20-х років ХХІ століття людство стало свідком безпрецедентної пандемії коронавірусної хвороби (COVID-19), спричиненої SARS-CoV-2. COVID-19 упевнено й агресивно крокує планетою, зокрема, станом на 5 серпня 2022 року в світі налічувалося 579 092 623 підтверджені випадки COVID-19 зі 6 407 556 летальними випадками [1].
На початку 20-х років ХХІ століття людство стало свідком безпрецедентної пандемії коронавірусної хвороби (COVID-19), спричиненої SARS-CoV-2. COVID-19 упевнено й агресивно крокує планетою, зокрема, станом на 5 серпня 2022 року в світі налічувалося 579 092 623 підтверджені випадки COVID-19 зі 6 407 556 летальними випадками [1].
Вірус SARS-CoV-2 здатен уражати різноманітні види клітин організму, що визначає тип і тяжкість наслідків COVID‑19, а завершення гострої фази хвороби не завжди означає повне одужання пацієнта [2]. Термін «хронічний» або «тривалий» перебіг інфекційного процесу передбачає персистенцію збудника. Згідно з термінологією Американського товариства фахівців з інфекційних захворювань (IDSA), такий феномен описано як тривалий COVID, пост-COVID‑синдром і пост-гострий COVID‑19-синдром, а Гарвардською медичною школою вживається термін «постковідні далекобійники» [3].
Згідно з даними Всесвітньої організації охорони здоров’я, час від початку до клінічного одужання при легких випадках COVID-19 становить ≈2 тиж, у разі тяжких або критичних випадків – від 3 до 6 тиж. Проте в багатьох пацієнтів певні симптоми тривають упродовж місяців. Підтверджені стійкі ушкодження багатьох органів і систем (легень, серця, мозку, нирок і судинної системи) в пацієнтів, які перенесли COVID-19. Такі ушкодження спричинені тяжкими запальними реакціями, тромботичною мікроангіопатією, венозною тромбоемболією і кисневою недостатністю, які виявлялися навіть у безсимптомних пацієнтів із пневмонією, зумовленою COVID‑19 [2].
При гострому COVID‑19 ознаки та симптоми захворювання зберігаються до 4 тиж, за тривалого симптоматичного COVID‑19 – від 4 до 12 тиж, у разі пост-COVID‑19-синдрому – >12 тиж і не пояснюються альтернативним діагнозом, тобто термін «пост-COVID‑19-синдром» застосовують у випадку збереження патологічного стану після перенесеного COVID‑19 за відсутності в організмі пацієнта збудника цього захворювання [3].
Post-COVID long-hauler («далекобійник») – особа, в якої діагностовано COVID‑19, спричинений SARS-CoV-2, і яка не повернулася до вихідного рівня стану здоров’я та функціонування організму через 6 міс після перенесеного захворювання [3, 4]. «Далекобійниками» стають, за різними оцінками, від 10 до 50% пацієнтів, які перенесли COVID-19: в однієї частини таких хворих наявні незворотні ушкодження легень, серця, нирок або мозку, які порушують функціонування зазначених органів; у іншої – незважаючи на відсутність помітних ушкоджень органів, все ж спостерігаються виснажливі симптоми [4].
Попри надзвичайну поширеність синдрому пост-COVID‑19 й досі немає чітких рекомендацій щодо лікування таких хворих. У світі досліджується ефективність багатьох лікарських засобів для лікування постковідного синдрому – від протизапальних засобів до спазмолітиків [5]. З огляду на це вирішено провести аналіз наявної літератури щодо такої проблеми та представити власний досвід лікування цієї складної категорії пацієнтів.
Матеріали та методи
Для вирішення поставленого завдання було проведено аналіз літературних джерел в електронних базах даних: The Cochrane Collaboration The Cochrane Library (http://www.cochrane.org); The National Center for Biotechnology Information (https://www.ncbi.nlm.nih.gov); Medscape from WebMD (http://www.medscape.com); https://www.uptodate.com; Centers for Disease Control and Prevention (https://www.cdc.gov) за ключовими словами long COVID, post-COVID syndrome, post-COVID conditions, post-COVID long-haulers, post-acute sequelae of SARS-CoV‑2 infection, post-COVID-19 rehabilitation, xylitol, arginine, carnitine, edaravone. За українськими відповідниками зазначених ключових слів виконано пошук на сайті Національної бібліотеки України ім. В. І. Вернадського (http://www.nbuv.gov.ua) і спеціалізованого медичного порталу health-ua.com. Також проаналізовано всі релевантні посилання в отриманих джерелах.
Клінічне дослідження проведене за участю у ролі пацієнтів 50 лікарів із 20 областей України, які перехворіли на COVID‑19 різного ступеня тяжкості. Від усіх учасників цього постмаркетингового обсерваційного клінічного випробування, проведеного з дотриманням спеціальних міжнародних правил Належної клінічної практики (Good Clinical Practice, GCP) і вимог наказу МОЗ України № 690 від 23.09.2009 року «Про затвердження Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісії з питань етики», отримано інформовану згоду на участь у дослідженні. Отримані результати середніх величин наведені у вигляді середнього арифметичного та його середньої похибки (M±m); порівняння поміж показниками різних термінів проведено за допомогою парного t-критерію Стьюдента.
Результати й обговорення
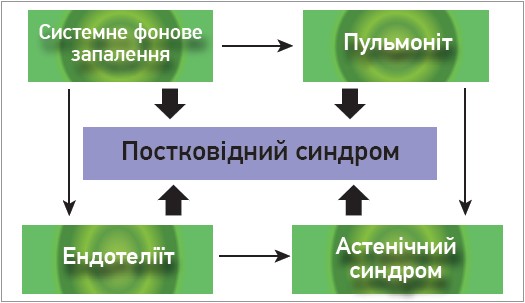
В результаті наукового пошуку було встановлено, що пусковими в розвитку постковідних ускладнень є три патофізіологічні синдроми: ендотеліїт, системне фонове запалення, пульмоніт і виражений клінічний синдром – астенія (рис.).
Рис. Основні механізми формування постковідного синдрому
Ендотеліїт – один із провідних синдромів при COVID-19 та пускових механізмів лонгковідного синдрому. Вірус SARS-CoV 2 може безпосередньо інфікувати ендотеліальні клітини шляхом потрапляння через рецептори ангіотензинперетворювального ферменту‑2, внаслідок чого спричинити дифузне запалення ендотелію. Вірус також здатний інфікувати епітеліоцити кровоносних судин людини. Пряме ураження ендотеліоцитів вірусом або їх опосередковане ушкодження імунними клітинами, цитокінами та вільними радикалами може бути причиною вираженої дисфункції ендотелію, що в подальшому зумовлює порушення мікроциркуляції, вазоконстрикцію, розвиток ішемії органів, запалення та набряк тканин, прокоагуляцію [3, 5]. В поєднанні з хронічним запаленням (як наслідок ендотеліальної дисфункції) спостерігаються гіперкоагуляція, підвищення рівня фібриногену, сповільнення процесів фібринолізу й антикоагуляції, що може спричинити формування тромбів [6].
Установлено, що після перенесеного COVID-19 у пацієнтів як наслідок ушкодження ендотелію судин ризик тромбоемболії зростає на 25%, з’являється вазоконстрикція. Внаслідок ураження міокарда в постковідних пацієнтів спостерігаються аритмії, на 22% зростає ризик інфарктів, у міокарді розвиваються порушення перфузії та ішемічні зміни [7].
Системне фонове «тліюче» запалення в постковідному періоді виникає унаслідок ушкодження цитокінами та вільними радикалами ендотелію судин при гіперімунній реакції [8]; у пацієнтів навіть через 2 тиж після одужання концентрація цитокінів у сироватці крові (інтерлейкіни (IL) 2, 4, 6, 17) була вищою порівняно з контрольною групою, що свідчить про продовження запального процесу після одужання [9]. Цитокіни збільшують проникність гематоенцефалічного бар’єра, внаслідок чого SARS-CoV-2 може інфікувати астроцити та мікроглію, активувати каскад нейрозапалення і нейродегенерації [10].
SARS-CoV-2 спричиняє ускладнення в центральній нервовій системі (ЦНС) унаслідок системного гіперзапалення, пов’язаного з вродженим імунітетом (провокується зв’язуванням білка S1 з експресуючими ACE2-клітинами), нейросудинною ендотеліальною дисфункцією [10]. Окрім цього, не виключається і пряме ураження вірусом SARS-CoV‑2 клітин ЦНС [2].
Серед непрямих механізмів залучення мозку варто відзначити порушення регуляції цитокінів, трансміграцію периферичних імунних клітин, автоімунну агресію, гіпоксичну травму, тромботичну мікроангіопатію [10].
Вірус SARS-CoV 2 може порушувати рівновагу між ядерним фактором транскрипції NF κB (експресія цитокінів) і активацією Nrf2 (експресія антиоксидантних ферментів). Оксидативний стрес є важливим чинником у патогенезі COVID-19, погіршуючи наслідки цитокінового шторму, згортання крові та гіпоксії, що зумовлює ушкодження тканин, пульмоніт (пневмонію), ураження дихальної системи та поліорганну недостатність [11].
Дисрегуляторна активація моноцитарних фагоцитів, розвиток генералізованого тромбозу мікроциркуляторного русла, прогресуючий внутрішньоальвеолярний та інтерстиціальний фіброз – серед важливих ланок патоморфогенезу інтерстиціальної пневмонії при COVID-19. В ексудативній та проліферативній стадіях переважають реакції Т-клітинного імунітету як відповідь на проникнення вірусу SARS-CoV-2, проте у фібротичній фазі загальна кількість Т‑лімфоцитів суттєво зменшується. Домінування CD8+ Т-лімфоцитів-супресорів над CD4+ Т‑лімфоцитами-хелперами пов’язують з механізмами можливого автоімунного ураження [12].
Ушкодження легень унаслідок проникнення коронавірусу та впливу цитокінів на ендотелій судин й альвеолярний комплекс (із розвитком рентгенологічного симптому матового скла) спричиняє інтерстиційну пневмонію, активацію процесу фіброзоутворення і порушення функціонування легень [12].
Цитокіновий шторм зумовлює активацію коагуляційних шляхів під час імунної відповіді на інфекцію, що спричиняє дисбаланс між про- й антикоагулянтними факторами та в подальшому мікротромбоз, поширену внутрішньосудинну коагуляцію, поліорганну недостатність [13, 14]. IL‑6, фактор некрозу пухлини (TNF) та інтерферон-гамма (IFN‑γ) – цитокіни, які відіграють важливу роль у патогенезі запального ушкодження легень, що спостерігається при COVID‑19 [14].
Частими неврологічними симптомами, які супроводжують COVID-19, є запаморочення, головний біль, порушення свідомості. Хвороба може викликати і складніші неврологічні дисфункції: енцефалопатії, енцефаліт, менінгіт, гострий дисемінований енцефаломієліт, судомні напади, інсульт, нейром’язові розлади [3].
Виражений астенічний синдром, який суттєво погіршує якість життя і знижує працездатність лонгковідних пацієнтів, розвивається доволі часто; можуть тривало реєструватися запалення низької інтенсивності в головному мозку, автоімунне ушкодження чи зменшення припливу крові до головного мозку (або їх поєднання). Накопичення у ЦНС прозапальних цитокінів може спричиняти дисрегуляцію центральних структур і вегетативну дисфункцію (підвищену температуру тіла, порушення циклу сну / неспання, когнітивні порушення, швидку втомлюваність) [4].
Проявами лонгковідного астенічного синдрому є психічні проблеми та загальне виснаження хворого, які характеризуються швидкою втомлюваністю, дратівливою слабкістю, афективною лабільністю, сльозливістю, розладами пам’яті. Масивне медикаментозне навантаження при лікуванні COVID-19, тривалий і виснажливий перебіг захворювання з дихальною недостатністю та водно-електролітним дисбалансом, тяжкі супутні чи некомпенсовані системні захворювання розглядаються як можливі причини виникнення астенії при лонгковідному синдромі [3].
Наслідками масштабної вірусної реплікації та цитокінового шторму є масивне ураження органів і тканин організму: ендотелію судин (системне запалення, порушення коагуляційного гомеостазу, тромбоемболії); легень (пневмонія і гострий респіраторний дистрес-синдром, ГРДС); серцево-судинної системи (інфаркти, міокардит); нервової системи (цереброваскулярні, нейродегенеративні порушення) тощо [15].
Важливими підходами в лікуванні «тліючого» системного запалення є зменшення рівня цитокінів та інших медіаторів, зниження проникності гематоенцефалічного бар’єра; корекція порушення ендотеліальної функції; підвищення ефективності внутрішніх антиоксидантних систем організму [3].
З‑поміж стратегічних напрямків терапії постковідного синдрому слід відзначити усунення водно-електролітних та метаболічних порушень; моніторинг і корекцію порушень при супутніх патологіях; профілактику розвитку метаболічних розладів (кетоацидозу); усунення внутрішньоклітинного енергодефіциту, «тліючого» системного запалення [3].
Проведений аналіз літературних джерел показав, що одним з ефективних речовин для профілактики та лікування цитокінового шторму на тлі тяжкого перебігу COVID‑19 і розвитку ГРДС може бути едаравон.
Едаравон (3-метил‑1-феніл‑2-піразолін‑5-он) – низькомолекулярний антиоксидант широкого спектра дії, який є акцептором як водо-, так і жиророзчинних активних форм кисню (АФК) та виявляє численні плейотропні властивості (протизапальні, імуномодулювальні, антицитокінові, антиапоптичні, антинекротичні, антифіброзні, мембраностабілізувальні, протекторні щодо легень) [16, 17].
Призначення едаравону покращувало індукований фіброз легень, послаблювало оксидативний стрес та активацію цитокінового сигнального шляху TGF‑β1/Smad3, що свідчить про його перспективність як препарату-кандидата для лікування початкової стадії фіброзу легень, асоційованого із ГРДС [18]. Едаравон забезпечував послаблення гіперпроникності, індукованої цитокінами, в мікроваскулярних ендотеліальних клітинах легень людини [17, 19].
Терапія едаравоном, розпочата в ранній та/або другій перехідній фазі, може попередити прогресування цитокінового шторму в пацієнтів із групи високого ризику, а також усувати його прояви при ГРДС на третій стадії захворювання. Призначення препарату може знижувати потребу у вентиляції та/або її тривалість, а також летальність і застосовуватися в ролі допоміжної терапії при лікуванні тяжкого інфікування COVID‑19 [17].
Ще одним перспективним напрямом лікування хворих із COVID‑19 є покращення мікроциркуляції та відновлення функції ендотелію легеневих капілярів шляхом збільшення вмісту NO. Із цією метою в багатьох дослідженнях пропонується використовувати L‑аргінін [7].
L‑аргінін (2-аміно‑5-гуанідиновалеріанова кислота) є умовно незамінною амінокислотою, активним клітинним регулятором фізіологічних процесів організму людини [20, 21].
Амінокислота L‑аргінін – субстрат для синтезу NO; відновлюючи його вміст у легеневій тканині, внаслідок чого покращує мікроциркуляцію, сприяє вазодилатації непосмугованої мускулатури бронхів і зниженню артеріального тиску в гіпертензивних хворих, запобігає активації та адгезії лімфоцитів і тромбоцитів, відновлює ендотелій легеневих артерій та активізує його вазомоторну функцію [7, 21, 22]. L‑аргінін забезпечує протекторний вплив, важливий для пацієнтів у критичному стані, завдяки антигіпоксантній, мембраностабілізувальній, цитопротекторній, антиоксидантній та дезінтоксикаційній активності. Екзогенне надходження L‑аргініну як субстрату для синтезу NO патогенетично обґрунтовано для зменшення проявів ендотеліальної дисфункції та в лонгковідних пацієнтів [6].
Аналіз можливих засобів для лікування постковідного синдрому показав, що одним із компонентів програми лікування цих станів може бути левокарнітин (L‑карнітин) – природна сполука, яка бере участь в енергетичному обміні та метаболізмі кетонових тіл, а також є необхідною для транспортування в мітохондрії довголанцюгових жирних кислот (енергетичного субстрату для всіх тканин, окрім мозку) і їхнього подальшого β-окиснення з утворенням енергії [7, 22, 23].
L‑карнітин може бути корисним для лонгковідних пацієнтів завдяки імуномодулювальному впливу, пригніченню оксидативного стресу, біомедіаторів запалення, зокрема С‑реактивного білка (СРБ), TNF та IL‑6, що може сприяти подоланню цитокінового шторму [7, 23].
При огляді можливостей проведення патогенетичного лікування доцільно також згадати, що як ефективне джерело енергії у постковідних пацієнтів може бути використаний ксилітол [24]. Завдяки своїм ефектам ксилітол сприяє регідратації та зменшенню кетогенезу і кетоацидозу при некомпенсованому цукровому діабеті [25, 26]; його рекомендується призначати для зменшення інтоксикації та покращення мікроциркуляції у періопераційному періоді, а також для лікування станів кетоацидозу різної етіології [27, 28].
Результати клінічного дослідження
З огляду на важливість розробки й апробації методів терапії COVID‑19, проти якої немає специфічних етіотропних ліків, а також для усунення наслідків цього захворювання на особливу увагу в сучасних реаліях заслуговує комплексний синдромно-патогенетичний підхід, який полягає у практичному клінічному використанні лікарями медичних засобів, не зареєстрованих для терапії саме COVID‑19 [7].
У цьому клінічному випробуванні використано синдромно-патогенетичний підхід, спрямований на полегшення загального стану та підвищення якості життя пацієнта із синдромом «далекобійника», що виник унаслідок COVID‑19; зазначений підхід забезпечено застосуванням додатково до базисного лікування інфузійної терапії препаратами Ксаврон® (едаравон), Тіворель® (L‑аргінін, L‑карнітин) і Ксилат® (ксилітол + електроліти) в реконвалесцентів COVID‑19, які продовжували скаржитися на характерні для постковідного періоду підвищену втомлюваність з крайньою нестійкістю настрою, ослаблення самоконтролю, нетерплячість, непосидючість, порушення сну, втрату здатності до тривалого розумового та фізичного напруження, непереносимість гучних звуків, яскраве світло, різкі запахи. Важливим є те, що всі пацієнти, що виявили бажання лікуватися за зазначеною схемою, не мали ознак дихальної недостатності та не потребували лікування в умовах відділень інтенсивної терапії.
У хворих досліджуваної групи комбінацію зазначених препаратів вводили за такою схемою: Ксаврон® (по 20-30 мл 2 р/добу внутрішньовенно), Тіворель® (1 флакон 1 р/добу внутрішньовенно) та Ксилат® (внутрішньовенно краплинно 400-600 мл (6-10 мл/кг) 1 р/добу); 10-14-денну терапію розпочинали якнайраніше після госпіталізації.
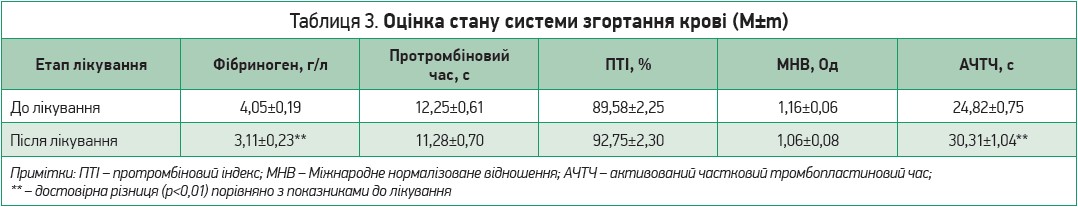
Під час надходження та виписки зі стаціонару в пацієнтів оцінювали стан психоемоційної сфери (госпітальна шкала тривожності й депресії HADS, індекс Бартела, модифікована шкала Ренкіна, опитувальний лист EQ-5D для оцінки якості життя, виразність астенії за суб’єктивною шкалою оцінки МFI‑20). У цих самих контрольних точках проводилися загальний клінічний аналіз крові та визначення лейкоцитарної формули (еритроцити, гемоглобін, гематокрит, тромбоцити, ШОЕ, лейкоцити, базофіли, еозинофіли, нейтрофіли, лімфоцити, моноцити), вимірювався рівень глюкози крові, оцінювалися показники гомеостазу за коагулограмою (фібриноген, протромбіновий час, протромбіновий індекс, міжнародне нормалізоване відношення, активований частковий тромбопластиновий час), уміст у крові СРБ й IL‑6. Здійснювався моніторинг температури тіла, артеріального тиску, частоти серцевих скорочень, сатурації киснем крові пацієнтів (1-й день, 7-й день та при виписці). Реєстрували кількість ліжко-днів, проведених у стаціонарі лонгковідними пацієнтами. Основні результати дослідження представлені в таблицях 1-3.
Наведені результати температурного скринінгу, вимірювання артеріального тиску та частоти серцевих скорочень, проведених під час надходження до стаціонару, на 7-й день перебування і під час виписки, свідчать про достовірне зниження (p<0,01) температури тіла, достовірну (p<0,05) нормалізацію артеріального тиску та частоти серцевих скорочень.
Середній термін перебування пацієнтів у стаціонарі, яким призначалася синдромно-патогенетична інфузійна терапія, становив 10,06±0,23 доби. Результати терапії лонгковідних пацієнтів до і після синдромно-патогенетичного лікування за клінічним аналізом крові та лейкоцитарною формулою представлено в таблиці 2, стан системи гемостазу згідно з даними коагулограми наведено в таблиці 3.
Позитивна динаміка лікування простежувалася і за змінами рівня сатурації крові. Так, під час надходження до стаціонару рівень SpO2 становив 93,40±0,56%, на 7-й день лікування – 95,81±0,44% (p<0,05), під час виписки він зростав до 97,46±0,18% (p<0,01). З 19 пацієнтів під час надходження на стаціонарне лікування спостерігалися патологічні зміни на ЕКГ ішемічного чи метаболічного характеру. Після проведення синдромно-патогенетичної терапії у 15 з них (78,9%) відзначено покращення самопочуття і значну позитивну динаміку кривої електрокардіограми. В постковідних пацієнтів серед важливих результатів спостерігалася стабілізація рівня глюкози крові натще: від початкового рівня 8,75±0,87 ммоль/л до 6,30±0,33 ммоль/л (p<0,05).
Вміст СРБ – маркера запального процесу в легеневій тканині й індикатора цитокінового шторму і ГРДС – у крові пацієнтів підпорядковувався негаусівському розподілу та помітно знижувався: до лікування медіана концентрації становила 2,0 мг/л (Q1: 0,51; Q3: 3,0), після лікування – 0 мг/л (Q1: 0; Q3: 0,08) (р<0,05), що може свідчити про протизапальну активність комбінованої інфузійної терапії.
За госпітальною шкалою тривоги та депресії (Hospital Anxiety and Depression Scale, HADS) стан пацієнтів на початку терапії оцінено в 6,11±0,95 бала, тобто як дуже близький до субклінічно вираженої тривоги/депресії, під час виписки відзначено помітне покращення емоційного стану (4,11±0,77 бала). Відповідно до шкали повсякденної життєдіяльності Бартела (індекс Бартела), яку використовують як скринінг для оцінки рівня побутової активності, стан пацієнтів у балах оцінено як легку залежність у повсякденному житті: 97,44±0,84 бала під час надходження до стаціонару та 100,00 бала – під час виписки (р<0,05).
Дані опитувального листа EQ-5D як кількісного показника стану здоров’я вказують на значне покращення фізичних і психоемоційних показників якості життя: 58,33±1,67 та 80,00±2,89 бала до та після лікування відповідно (p<0,05). За суб’єктивною шкалою оцінки астенії MFI‑20 у 46 лонгковідних пацієнтів під час надходження на стаціонарне лікування відзначено виражену астенію, а в 4 – помірну; слід зауважити, що в жодного з пацієнтів, що пройшли пропоновану нами синдромно-патогенетичну терапію, під час виписки не виявлено вираженої астенії; хворі відзначили перехід до помірних проявів або повної їх відсутності. Вищезазначені дані можуть свідчити про комплексну нейропротекторну активність досліджуваної комбінації лікарських засобів.
Слід зазначити, що покращення стану (зникнення або зменшення вираженості характерних скарг) після проведеного комплексу лікування відзначило 43 пацієнти (86,0%), часткове покращення – 4 хворих (8,0%), а 3 пацієнтів (6,0%) почували себе так само, як і до лікування.
Отже, результати клінічного випробування продемонстрували потенційну ефективність запропонованої схеми лікування в комплексній терапії пацієнтів, госпіталізованих через наслідки COVID‑19. На нашу думку, використання цієї схеми може ефективно запобігати розвитку можливих ускладнень (пневмонія, дихальна недостатність, зміни реологічних і фібринолітичних властивостей крові, фіброзів, підвищеного тромбоутворення, ураження серцево-судинної та нервової систем), знижувати частоту і тяжкість інвалідизації та покращувати якість життя пацієнтів після перенесеного COVID‑19.
Висновки
При обґрунтуванні обрання засобів терапії ураховано механізми патофізіологічних синдромів, які є пусковими в розвитку лонгковідних ускладнень: системне фонове запалення, ендотеліїт, пульмоніт і виражений клінічний синдром – астенія.
Обраний синдромно-патогенетичний підхід до лікування лонгковідних пацієнтів полягає у комбінованому призначенні інфузійних лікарських препаратів: Ксаврону – для усунення системного запалення внаслідок оксидативного стресу та цитокінового шторму, Тіворелю – для захисту серцево-судинної системи, Ксилату – як джерела енергії для подолання астенічного синдрому.
Результати цього клінічного випробування за участю пацієнтів, які працюють лікарями в різних регіонах України, демонструють, що після включення додатково до основної терапії лонгковідним пацієнтам засобів запропонованої схеми лікування достовірно покращувався стан більшості хворих (86,0%), спостерігалась клінічна стабілізацію стану здоров’я: нормалізація температури, артеріального тиску, серцевого ритму, показників крові й ЕКГ, сатурації, глюкози крові, сну, загального самопочуття і настрою; також відзначені значна регресія неврологічної симптоматики, покращення пам’яті та уваги, працездатності, толерантності до фізичних навантажень; зникнення астенічних та тривожних станів, головного болю, болю в м’язах, апатії, запаморочення, задишки, тахікардії, синдрому хронічної втоми, явищ інтоксикації. Отже, хоча дані в цьому огляді вказують на ефективність запропонованого синдромно-патогенетичного підходу в пацієнтів із постковідним синдромом, для підтвердження цієї тенденції необхідне подальше проведення великих якісних випробувань.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 13 (530), 2022 р.