21 березня, 2023
Судомні напади та епілепсія у пацієнтів з ішемічним інсультом
Удосконалення методів лікування і реабілітації пацієнтів з інсультом допомогло знизити пов’язану з інсультами смертність, але водночас призвело до збільшення поширеності постінсультних судомних нападів (ПІСН) та постінсультної епілепсії (ПІЕ). На окрему увагу заслуговує проблема потенційного впливу негайної реваскуляризації (тромболізису або тромбектомії) на ризик виникнення ПІСН. Пропонуємо до вашої уваги огляд статті J. P. Zöllner et al. «Seizures and epilepsy in patients with ischaemic stroke», опублікованої у виданні Neurol Res Pract (2021 Dec 6; 3: 63), яка присвячена аналізу сучасних даних щодо протисудомної терапії у пацієнтів з інсультом, а також профілактиці ПІСН і ПІЕ.
Щорічно ПІСН виникають приблизно у 5‑7% осіб, які перенесли інсульт, і можуть погіршувати їхній прогноз (Wang et al., 2017; Zou et al., 2015). Ризик виникнення ПІСН на 10‑16% вищий в осіб, які перенесли первинний внутрішньомозковий, субарахноїдальний або субдуральний крововилив (Holtkamp et al., 2017; Won et al., 2017; 2019). Судомний напад, що виник впродовж семи днів після гострого пошкодження мозку, спричиненого інсультом, травмою або хірургічним втручанням на мозку, називають «раннім», або гострим симптоматичним, нападом, тоді як судомний напад, що виник після семи днів – «пізнім», або неспровокованим (Beghi et al., 2010). Такий поділ ґрунтується на патофізіологічних даних і клінічних спостереженнях.
Ранні судомні напади розглядають як наслідок порушень гомеостазу, що супроводжують гостре пошкодження мозку, та, власне, не є ознакою епілепсії. Вважається, що схильність до спонтанної генерації судом зумовлена структурними особливостями мозку. Пізні напади у пацієнтів, які перенесли інсульт, пов’язані з високим (>70%) ризиком повторних нападів, і цей ризик є вищим, ніж за ранніх нападів (Kim et al., 2016). Отже, згідно з визначенням Міжнародної протиепілептичної ліги (ILAE), один пізній судомний напад є підставою для встановлення діагнозу ПІЕ, при цьому ризик повторних нападів впродовж 10 років сягає >60% (Hesdorffer et al., 2009; Fisher et al., 2014).
Показання для призначення ПЕП пацієнтам з інсультом
У настанові Американської асоціації серця / Американської асоціації інсульту (AHA/ASA, 2019) з реабілітації пацієнтів після інсульту призначення ПЕП для первинної профілактики ПІЕ після інсульту не рекомендовано (навіть після геморагічного інсульту, асоційованого з вищим, ніж за інших типів інсульту, ризиком судомних нападів) (Qian et al., 2014; Winstein et al., 2016; Zöllner et al., 2020). Загалом ПЕП не рекомендовано і після раннього судомного нападу (Winstein et al., 2016). Проте ПЕП показані як засоби вторинної профілактики у пацієнтів із підтвердженою ПІЕ та в усіх випадках встановлення епілептичного статусу (Fisher et al., 2014). До того ж деякі пограничні випадки можуть потребувати призначення ПЕП, що має визначатися індивідуально. Йдеться, зокрема, про ранній судомний напад після перенесеного інфаркту мозку з геморагічною трансформацією, а також про розвиток множинних ранніх нападів упродовж 24 годин. У такому разі може бути рекомендовано призначення короткострокової (впродовж місяця) терапії ПЕП для зменшення ризику пізніх нападів і ПІЕ (Lahti et al., 2017).
Якщо ранні судомні напади пов’язані з первинним мозковим крововиливом або тромбозом венозного синусу головного мозку з руховим дефіцитом, слід розглянути застосування ПЕП протягом декількох тижнів, хоча наразі бракує відповідної доказової бази (Lopponen et al., 2014; Price et al., 2016).
У настанові Європейської організації боротьби з інсультом (ESO) рекомендовано припинити застосування ПЕП після раннього нападу, коли у пацієнта минула гостра фаза і його переводять із інсультного відділення (Holtkamp et al., 2017). Проте автори попереджають, що нині рівень доказовості майже для всіх рекомендацій щодо ПІСН є дуже низьким. Отже, призначаючи лікування ПІСН, слід брати до уваги характеристики інсульту та судомних нападів, наявність супутніх захворювань, прихильність пацієнта до лікування ПЕП, їх переносимість та взаємодію з іншими препаратами, які він отримує, тощо. Як зазначають J. P. Zöllner et al., чинниками ризику виникнення як ранніх, так і пізніх судомних нападів після ішемічного інсульту є тяжкий інсульт, кортикальна локалізація інсульту, молодший вік, геморагічна трансформація (Guo et al., 2015).
Аналіз даних 135 тис. 117 пацієнтів з ішемічним інсультом підтвердив, що ризик раннього судомного нападу пов’язаний із вищим показником за шкалою тяжкості інсульту Національного інституту охорони здоров’я Великої Британії (NIHSS) на момент виписки зі стаціонару. Так, якщо відносно нетяжкий інсульт (NIHSS<3) був пов’язаний із ризиком розвитку ранніх судомних нападів 0,6%, то найтяжчий інсульт (NIHSS>31) – із ризиком 9% (збільшенням відносного ризику на 9,2% для кожного додаткового бала за шкалою NIHSS). Ризик ранніх нападів підвищують також інфекції, що не вражають нервову систему, та низький доклінічний рівень функціонування (Zöllner et al., 2020).
Під час прийняття рішень можуть бути застосовані інструменти оцінювання ризику, наприклад Шкала ризику ПІЕ (Post-Stroke Epilepsy Risk Scale – PoSERS; чутливість 70%; специфічність 99,6%) або шкала SeLECT (для оцінювання тяжкості інсульту, атеросклеротичної етіології великих артерій, ранніх нападів, уражень кори головного мозку та зони пошкодження середньої мозкової артерії; чутливість 18,2%; специфічність 96,7%) (Galovic et al., 2018; Strzelczyk et al., 2010; Feyissa et al., 2019).
Якщо у пацієнта виник пізній судомний напад, його слід поінформувати про підвищений ризик повторних нападів і призначити терапію ПЕП. Індивідуальний вибір терапії потребує обговорення з пацієнтом та врахування останніх даних клінічних досліджень і персональних особливостей (зокрема, професії, ризику падінь через напади, можливості керування автомобілем тощо) (Holtkamp et al., 2017).
Пацієнти з виключно нетяжкими нападами (без фокальних нападів із порушенням свідомості, фокально-білатеральних тоніко-клонічних нападів, із низьким ризиком травмування під час нападів) можуть не потребувати призначення ПЕП. Ризик неврологічних порушень внаслідок постінсультного епілептичного статусу (ЕС) у 2‑3 рази вищий, ніж у пацієнтів без нападів. За даними L. Rumbach et al. (2000), із 31 пацієнта з ЕС 15 померли впродовж 10 років, зокрема п’ятеро – під час ЕС події. Тому після постінсультного ЕС необхідно призначати довготривалу терапію.
J. P. Zöllner et al. (2020) зауважують, що на догоспітальному етапі та у відділенні невідкладної допомоги диференціальна діагностика гострого церебрального інфаркту та постіктального парезу Тодда може бути складною, якщо до цього в пацієнта не спостерігалися симптоми моторних судом.
В одному з досліджень в 11 із 539 пацієнтів, які отримали тромболітичну терапію, ретроспективно діагностовано парез Тодда, а не інсульт (Tsivgoulis et al., 2011). Серед пацієнтів, які отримували тромболізис через хвороби, що імітують інсульт, 85% становили пацієнти із судомами (Winkler et al., 2009).
Така діагностична невизначеність може мати наслідки для терапії: хибне діагностування інсульту як судомного нападу може призвести до затримки проведення реваскуляризації. Протилежний ризик, пов’язаний із тромболізисом у пацієнтів із нападами, що імітують інсульт, імовірно, значно нижчий (наявних даних щодо серйозних побічних ефектів тромболізису немає).
Вибір ПЕП для лікування постінсультних судомних нападів
Існує припущення, що у більшості пацієнтів із ПІЕ монотерапія ПЕП може бути успішною (Silverman et al., 2002). Хоча нещодавно це було поставлено під сумнів (Redfors et al., 2020). Зокрема, це свідчить про важливість ретельного вибору ПЕП для призначення пацієнтам з інсультом, особливо з огляду на потенційні лікарські взаємодії. Для лікування пацієнтів з ПІЕ доцільним є застосування ПЕП нового покоління – завдяки кращій переносимості та меншій взаємодії з іншими препаратами, ніж у ПЕП попередніх поколінь (Trinka et al., 2012). Також продемонстровано хорошу переносимість і низький потенціал взаємодії під час лікування ПІЕ таких нових ПЕП, як ламотриджин (LTG), леветирацетам (LEV) і лакосамід (LCM).
LTG демонструє помірну протисудомну ефективність, добре переноситься, зазвичай стабілізує настрій, має низький потенціал взаємодії та зручний у застосуванні (можливо раз на добу), проте необхідно повільно підвищувати дозування. Пацієнти з ПІСН краще переносять LTG, ніж карбамазепін (CBZ) – інший ПЕП, що метаболізується в печінці. Результати нещодавніх досліджень in vitro продемонстрували, що LTG як блокатор натрієвих каналів при терапевтичній концентрації у сироватці працює як антиаритмічний агент класу Іb. Потенційні проаритмогенні властивості LTG спонукали Управління з контролю за якістю харчових продуктів і лікарських засобів США (FDA) додати до інструкції з медичного застосування відповідне попередження. Через брак клінічних даних ILAE рекомендує перед початком застосування LTG виконувати електрокардіографію (ЕКГ) пацієнтам, які мають встановлені серцево-судинні захворювання (ССЗ), чинники ризику ССЗ та вік >60 років – для виключення порушень провідності серця (French et al., 2021).
Ретельне кардіологічне обстеження, зокрема ЕКГ, є частиною стандарту надання допомоги пацієнтам з інсультом і підвищує ймовірність вчасного виявлення серцевої патології. Пацієнтам, які отримують цільову дозу LTG, слід регулярно виконувати ЕКГ.
LEV має високу протисудомну активність, низький потенціал медикаментозної взаємодії та може бути введений внутрішньовенно (в/в) для швидкого досягнення ефективної концентрації у сироватці та застосування у пацієнтів з порушенням ковтання. Побічні ефекти під час приймання LEV (дратівливість та раптові зміни настрою) виникають у <10% пацієнтів. У проспективному відкритому дослідженні застосування LEV сприяло тому, що напади не виникали протягом року в 77,1% учасників із пізніми ПІСН. Чотири пацієнти (11,4%) припинили приймати LEV через побічні ефекти (в одного – відчуття втоми та у трьох пацієнтів – агресивна поведінка) (Belcastro et al., 2008; 2011). В іншому рандомізованому відкритому дослідженні продемонстровано подібну ефективність LEV і CBZ із контрольованим вивільненням, втім, переносимість LEV була кращою (Consoli et al., 2012).
LCM загалом добре переноситься та ефективний у пацієнтів з епілепсією цереброваскулярної етіології (Rosenow et al., 2020). За безсудомного ЕС, що розвинувся після інсульту у пацієнтів віком від 70 років, в/в введення LCM є ефективним та добре переноситься (Belcastro et al., 2013).
Габапентин (GBP), імовірно, має нижчу протисудомну ефективність, ніж описані вище ПЕП. Його слід застосовувати кілька разів на добу, проте він має низький потенціал медикаментозних взаємодій. Водночас GBP асоційований із ризиком запаморочення та зміни психічного стану в пацієнтів похилого віку, особливо в разі застосування високих добових доз (Fleet et al., 2018).
J. P. Zöllner et al. зазначають, що не проводили рандомізованих контрольованих досліджень із попарним порівнянням ефективності різних ПЕП для лікування ПІЕ. Проте у випробуванні STEP-ONE порівнювали LEV, LTG і CBZ із контрольованим вивільненням як засоби монотерапії фокальної епілепсії у літніх осіб. Завдяки кращій переносимості приймання пацієнтом ПЕП впродовж року є вищим для LEV, ніж для CBZ, тоді як для LTG ця ймовірність є середньою та суттєво не відрізняється від препаратів порівняння (Werhahn et al., 2015). За нещодавно оприлюдненими результатами дослідження SANAD II, для LTG як засобу стартової монотерапії фокальної форми епілепсії продемонстровано кращий показник 12-місячної ремісії, ніж для LEV або зонісаміду (Marson et al., 2021).
Наразі бракує даних щодо застосування еслікарбазепіну (ESL), LCM, окскарбазепіну (OXC), перампанелу (PER) і зонісаміду для лікування ПІЕ (Alvarez-Sabín et al., 2002; Sales et al., 2020; Mazzocchetti et al., 2020). У пілотному дослідженні зазначено, що LCM є відносно ефективним у пацієнтів з епілепсією цереброваскулярної етіології та має гарну переносимість, якщо призначений з урахуванням протипоказань (передусім, певних розладів провідності серця). Результати щодо монотерапії свідчать про кращу протисудомну ефективність та сприятливий фармакокінетичний профіль LCM порівняно із CBZ (тобто меншу кількість взаємодій і менший негативний вплив на концентрацію ліпідів) (Rosenow et al., 2020).
Через гіршу переносимість та значну кількість медикаментозних взаємодій CBZ, фенітоїн (PHT) і вальпроат (VPA) не є ПЕП першої лінії для пацієнтів похилого віку. Особливо треба брати до уваги значне зниження концентрації в сироватці пероральних антикоагулянтів, що не є антагоністами вітаміну К (НОАК), після застосування CBZ і PHT, а також можливість інгібування CBZ і ESL дії симвастатину (Ucar et al., 2004; Bialer and Soares-da-Silva, 2012; Mintzer et al., 2018; Galgani et al., 2018). CBZ, OXC і ESL також можуть спричинити гіпонатріємію, особливо у літніх пацієнтів (Berghuis et al., 2017; Intravooth et al., 2018).
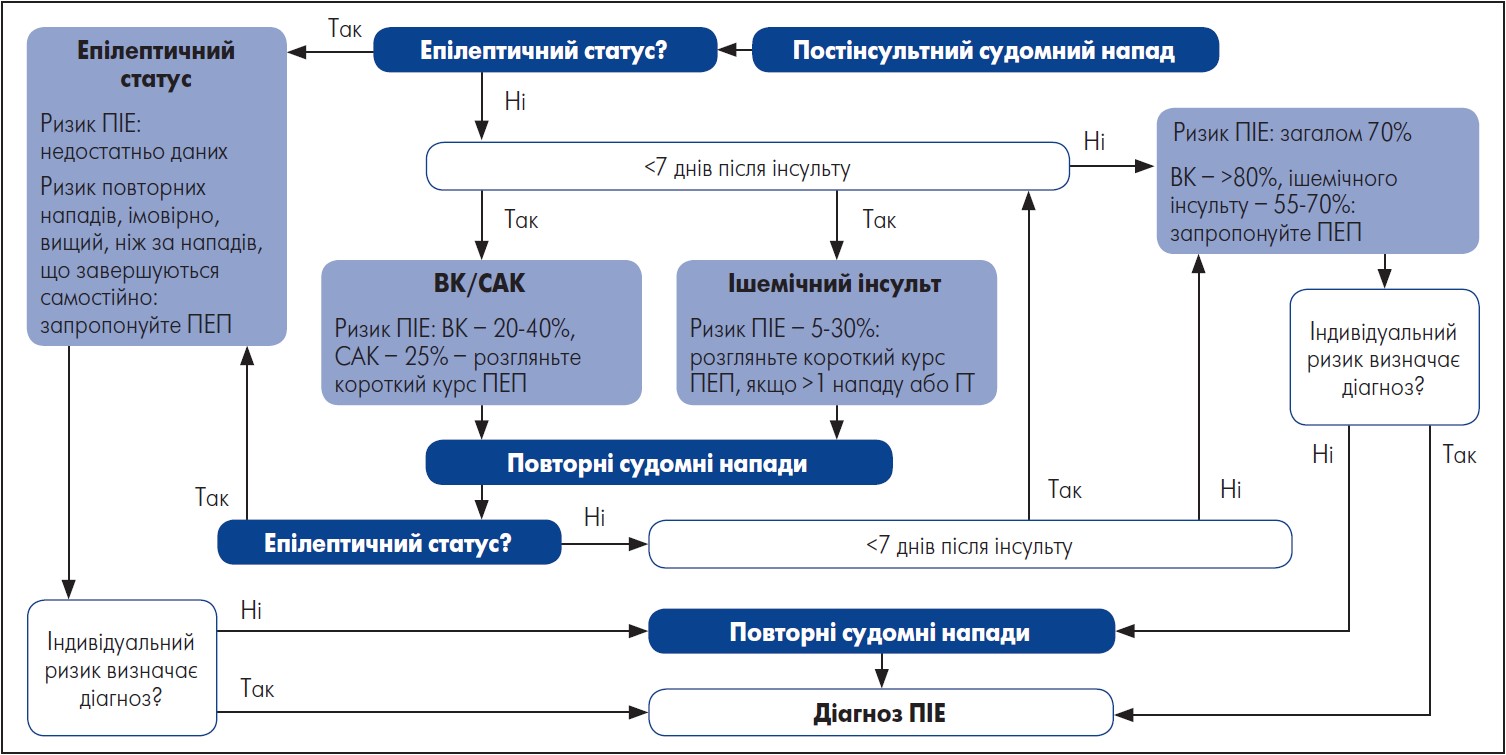
Стратегію медикаментозного лікування ранніх і пізніх судомних нападів схематично представлено на рисунку.
Примітки: ПІЕ – постінсультна епілепсія; ПЕП – протиепілептичний препарат; ВК – внутрішньомозковий крововилив; ГТ – геморагічна трансформація; САК – субарахноїдальний крововилив.
Рисунок. Стратегія лікування пацієнтів із постінсультними судомними нападами
Адаптовано за J. Zelano, 2016.
У настанові щодо застосування нових оральних антикоагулянтів (НОАК) у пацієнтів із фібриляцією передсердь Європейської асоціації серцевого ритму (EHRA, 2018) зазначено, що комбінація LEV і НОАК може бути проблематичною. T. J. Von Oertzen et al. (2019) заперечили це припущення, оскільки не отримано жодних клінічних доказів взаємодії LEV і НОАК, а підвищений ризик смертні, пов’язаний із ПІЕ після інсульту, є вагомішим чинником під час прийняття рішення. Подальші фармакогенетичні дослідження також не виявили такої взаємодії (Mathy et al., 2019; Kurt et al., 2019). Натомість фермент-індукувальні ПЕП, як-от CBZ, PHT, фенобарбітал і примідон, можуть взаємодіяти з препаратами, які часто призначають після інсульту, зокрема антикоагулянтами, антигіпертензивними засобами і статинами, що становить потенційно серйозний ризик для пацієнтів, які перенесли інсульт.
Терапія інсульту і судомні напади
Чи підвищує тромболітична терапія ризик виникнення ПІСН? Тромболізис розглядався як можливий чинник ризику ПІСН, оскільки тромболітичний агент, рекомбінантний тканинний активатор плазміногену (rt-PA), може чинити нейротоксичну дію на мозок, уражений інфарктом (Alvarez et al., 2013; Bentes et al., 2017). Тож успішна реперфузія може виступати механізмом генерації ПІСН.
Як зазначають J. P. Zöllner et al., розглядаючи клінічні випадки клініцисти раніше припускали, що виникнення ранніх судомних нападів під час реканалізації призводить до неврологічного поліпшення (Rodan et al., 2006). Проте подальші дослідження свідчили на підтримку концепції реперфузії як генератора судом (Alemany et al., 2021). Зокрема, F. Brigo et al. (2020) продемонстрували, що в/в введення rt-PA незалежно підвищує ризик гострих симптоматичних, тобто ранніх, судом (відношення ризиків [ВР]: 2,26).
V. Alvarez et al. (2013) виявили збільшення частоти ранніх судом у пацієнтів з інсультом після виконання тромболізису та їх кореляцію з гіршим прогнозом. Тромболізис виявився також незалежним чинником ризику пізніх судомних нападів у популяційному ретроспективному когортному дослідженні (Burneo et al., 2019).
J. Naylor et al. (2018) теж спостерігали збільшення ризику виникнення пізніх судомних нападів навіть через 24 міс. після тромболізису. За даними аналізу груп, що отримували різні варіанти реперфузійної терапії (в/в rt-PA, внутрішньоартеріальний тромболізис [ВАТ] або обидва), усі варіанти пов’язані з подібним збільшенням частоти судомних нападів порівняно з консервативними методами лікування інсульту (скориговане ВР [сВР] для в/в rt-PA: 3,7; 95% довірчий інтервал [ДІ] 1,8‑7,4; p<0,001; сВР для ВАТ 5,5; 95% ДІ 2,1‑14,3; p<0,001; сВР для ВАТ + rt-PA в/в: 3,4; 95% ДІ 0,98‑11,8; p=0,05) (Naylor et al., 2018). R. Castro-Apolo et al. (2018) виявили подібний вплив на прогноз у пацієнтів, які отримали в/в rt-PA і мали пізні судомні напади. R. Brondani et al. (2020) також підтвердили, що ПІСН є незалежним чинником ризику гіршого прогнозу після застосування тромболізису в пацієнтів з інсультом. У дослідженні неврологічний дефіцит, що розвивався після тромболізису і геморагічної трансформації, був незалежним чинником ризику ПІСН.
Попри те, що успішна реперфузія та потенційна нейротоксичність є механізмами виникнення ПІСН, новіші та масштабніші дослідження одностайно продемонстрували, що реканалізація загалом не пов’язана з підвищеним ризиком розвитку ані ранніх, ані пізніх судомних нападів.
Так, нещодавній метааналіз засвідчив, що частота судомних нападів (ранніх – 3,14%; пізніх – 6,7%) після лікування в/в rt-PA, механічної тромбектомії (МТ) або обох методів була подібною до частоти у великих неселективних базах даних пацієнтів, а об’єднаний аналіз не виявив достовірного підвищення шансів розвитку ПІСН у пацієнтів з rt-PA або МТ (Lekoubou et al., 2020; Fridman et аl., 2021).
За результатами метааналізу понад 30 досліджень за участю сумарно 26 тис. 45 пацієнтів, які перенесли інсульт, поширеність ПІСН серед них становила 7%. Кортикальні ураження (ВР: 3,58; 95% ДІ 2,35‑5,46; р<0,001), геморагічні компоненти (ВР: 2,47; 95% ДІ 1,68‑3,64; р<0,001), ранні судомні напади (ВР: 4,88; 95% ДІ 3,08‑7,72; р<0,001) і молодий вік (різниця в середніх значеннях із/без ПІЕ: 2,97 року; 95% ДІ 0,78‑5,16; р=0,008) частіше були пов’язані з ПІЕ. Терапія rt-PA знову не була визначена як незалежний чинник ризику ПІСН (Gasparini et al., 2020).
L. Keller et al. (2015) не змогли встановити вплив в/в rt-PA на частоту ПІСН. Новіші дані, отримані J. P. Zöllner et al. (2020) щодо 13 тис. 356 пацієнтів, яким виконували тромболізис (з приводу ішемічного інсульту), не підтвердили більшої частоти ранніх нападів порівняно з пацієнтами, яким тромболізис не проводили (1,5 проти 1,8%; р=0,07). Крім того, серед 1 тис. 13 пацієнтів, яким виконували тромболізис і МТ, частота ранніх судомних нападів не була вищою, ніж при застосуванні лише тромболізису (в обох випадках 1,7%; р=1) (Zöllner et al., 2020).
Висновок щодо того, що МТ не збільшує ризик ПІСН, було підтверджено даними нещодавнього проспективного дослідженням за участю 344 пацієнтів з ішемічним інсультом (Alemany et al., 2021). Зокрема, J. De Reuck et al. (2010) і D. Nesselroth et al. (2018) повідомили, що тромболізис навіть частково запобігав ПІСН, і пояснили це збереженням тканин у пацієнтів, яким його виконували. Y. Kim et al. (1999) припустили, що rt-PA чинить захисну дію на тканини мозку. Згодом у дослідженні порівнювали дані 177 пацієнтів, що отримували в/в rt-PA, і 158 осіб, які не мали спеціального лікування, де не виявлено збільшення частоти ПІСН, пов’язаного з rt-PA (Tan et al., 2012).
Отже, дані щодо розвитку судомних нападів після реканалізації досі є суперечливими. Проте результати наймасштабніших досліджень та метааналізів свідчать, що ані в/в введення rt-PA, ані МТ не є незалежними чинниками ризику розвитку ранніх або пізніх судомних нападів за умови врахування інших відомих чинників ризику, як-от тяжкість інсульту, його локалізація в корі головного мозку та наявність геморагічної трансформації (Lekoubou et al., 2020; Gasparini et al., 2020; Zöllner et al., 2020).
На їхню думку, неузгодженість попередніх результатів можна пояснити відмінностями щодо методів дослідження і клінічних змінних, а також невеликою кількістю пацієнтів, які брали участь в одноцентрових дослідженнях.
Профілактика судомних нападів після інсульту
Як зазначено в дослідженнях із застосуванням дифузійно-зваженої магнітно-резонансної томографії (МРТ), епілептичні напади після інсульту можуть поглибити пошкодження головного мозку, тому важливим є визначення можливих профілактичних заходів (Kumral et al., 2013). Первинна профілактика передбачає негайне запобігання судомним нападам після інсульту. Тоді як вторинна профілактика стосується запобігання подальшим судомним нападам після першого ПІСН, а третинна – охоплює профілактику рецидивів нападів для полегшення медикаментозного реабілітаційного лікування та зниження епілептогенної активності мозку після інсульту.
Третинна профілактика. Підходи до третинної профілактики охоплюють індивідуально оптимізовану реабілітацію та протисудомну терапію. Окрім показань, вибору та дозування ПЕП, слід зважати на потенційні довгострокові наслідки. Зазвичай пацієнти з ПІЕ мають кілька чинників ризику ССЗ, що потребує уникання застосування препаратів, які негативно діють на біомаркери судинних захворювань, а саме на рівень загального холестерину, ліпопротеїнів, С-реактивного білка і загального гомоцистеїну. Тому, як зазначають дослідники, слід виключити застосування CBZ, PHT, фенобарбіталу і примідону (Mintzer et al., 2009). Y. C. Chuang et al. (2011) повідомили про значне збільшення товщини інтими-медії загальної сонної артерії під час тривалого (>2 років) застосування ПЕП попередніх поколінь (CBZ, PHT та VPA), що корелювало з тривалістю застосування. Приймання індукторів ферментів, як-от CBZ або PHT, було пов’язане з несприятливими змінами рівня холестерину, метаболізму фолієвої кислоти та підвищенням рівня С-реактивного білка. Крім того, у пацієнтів спостерігався вищий вміст сечової кислоти і загального гомоцистеїну в крові, а також маркерів окиснення, як-от активні продукти тіобарбітурової кислоти (побічні продукти окиснення ліпідів). Під час монотерапії LTG не спостерігалося значних змін цих маркерів або товщини інтими-медії загальної сонної артерії. Однак середня тривалість застосування LTG у цьому дослідженні була коротшою (5,5±3,1 року), ніж інших препаратів (CBZ – 13,4 року, PHT – 10,7 року, VPA – 8,7 року). Порівняння дії CBZ, PHT і VPA засвідчило особливо сильний зв’язок приймання CBZ і PHT із підвищенням рівня холестерину ліпопротеїдів високої щільності (Vyas et al., 2015). Це може вказувати на асоціацію терапії статинами зі зниженням ризику рецидиву ПІСН, незалежно від вторинного профілактичного ефекту статинів щодо власне інсультів (Guo et al., 2015).
Вторинна профілактика. Показання щодо вторинної профілактики після одного випадку ПІСН обговорювалися вище. Зокрема, припущення щодо того, що контролю нападів легше досягти за ПІЕ, ніж за фокальної епілепсії загалом, були поставлені під сумнів (Silverman e al., 2002; Redfors et al., 2020).
Первинна профілактика. Сучасні настанови не рекомендують первинне профілактичне протисудомне лікування пацієнтів з ішемічним інсультом (Holtkamp et al., 2017; Winstein et al., 2016). Хоча первинна профілактика ПІСН та ПІЕ є предметом активних досліджень, переконливих даних досі бракує. На практиці первинна профілактика охоплює залучення додаткових антиепілептогенних ефектів лікарських препаратів різних груп. P. Klein et al. (2020) надали вичерпний огляд досліджень на тваринних моделях та клінічних даних щодо антиепілептогенних ефектів різних препаратів, де йдеться про потенційні антиепілептогенні властивості у LEV та GBP (Löscher et al., 1998; Pitkänen et al., 2016; Takahashi et al., 2018).
Цікаво, що припущення про наявність антиепілептогенного ефекту для антигіпертензивних препаратів, антагоністів рецепторів ангіотензину І, лозартану і телмісартану базувалось на підставі досліджень із вивчення ролі гематоенцефалічного бар’єра (ГЕБ) в епілептогенезі (Klein et al., 2020).
Порушення ГЕБ дає змогу альбуміну проникати в мозок, де він зв’язується з рецепторами трансформувального фактора росту β (TGFβ) на астроцитах, спричиняючи вивільнення прозапальних цитокінів, які є рушійною силою епілептогенезу (Cacheaux et al., 2009; Frigerio et al., 2012). Антагоністи рецепторів ангіотензину І можуть пригнічувати активацію TGFβ і запобігати епілептогенезу через блокування фосфорилювання протеїну Smad 2/3 після порушення ГЕБ або прямого впливу альбуміну на кору головного мозку (Bar-Klein et al., 2014).
Діуретики тіазид і фуросемід у дослідженнях на тваринних моделях і клінічних дослідженнях знижували частоту судомних нападів (Hesdorffer et al., 2001). Статини знижували ризик госпіталізації через епілепсією у пацієнтів із ССЗ, тоді як деякі ПЕП не мали такого ефекту (Etminan et al., 2010). У дослідженні J. Guo et al. (2015) зазначили, що статини пов’язані зі зниженням ризику ПІЕ. Це підтвердили Y. Li et al. (2015), продемонструвавши, що приймання статинів достовірно знижує ризик як ранніх, так і пізніх судомних нападів (p=0,003). Зниження ризику було значущішим під час лікування статинами у високих дозах (для ранніх нападів p=0,003; для ПІСН p=0,006) і ставало ефективнішим за тривалішого лікування порівняно з короткостроковим (p=0,015), можливо, завдяки протизапальним властивостям статинів.
У систематичному огляді ефективності застосування статинів для первинної профілактики ПІСН і ПІЕ B. Nucera et al. (2020) проаналізували одне дослідження, що підтвердило зниження ризику ПІС, і три дослідження – зниження ризику ПІЕ під час застосування статинів після геморагічного інфаркту головного мозку.
Висновки
Підсумовуючи, J. P. Zöllner et al. зазначають, що кожен випадок ПІСН потребує індивідуального оцінювання ризику пацієнта з урахуванням потенційної дії та побічних ефектів ПЕП. Зокрема, перевагу слід віддавати ПЕП із низьким потенціалом фармаковзаємодії. Під час лікування пацієнтів із ПІЕ продемонстровано хорошу переносимість і низький потенціал взаємодії ламотриджину, леветирацетаму і лакосаміду. Оптимізацію профілактики та лікування ПІСН і ПІЕ може забезпечити виявлення візуальних біомаркерів. На це спрямовані МРТ-дослідження патофізіологічних механізмів виникнення судом після інсульту та принципів епілептогенезу загалом.
UA-LEVI-PUB-022023-085
Підготувала Тетяна Ткаченко