Aллергический ринит и эозинофильный эзофагит как возможные коморбидные заболевания

Аллергическим заболеваниям (АЗ) присущ характер системной патологии, что способствует частому сочетанию (коморбидности) у пациентов нескольких форм аллергопатологии. При этом коморбидностью называется сочетание у пациента двух или нескольких самостоятельных заболеваний или синдромов, ни один из которых не является осложнением другого, а частота этого сочетания превышает вероятность случайного совпадения.
Например, такое распространенное (10-40% случаев в популяции) АЗ, как аллергический ринит (АР), часто сочетается с аллергическим конъюнктивитом, синуситом, отитом, бронхиальной астмой и другими АЗ. В доступной медицинской литературе по этому поводу имеется достаточно большое количество публикаций. Значительно меньшее их количество посвящено возможному сочетанию АР с желудочно-кишечными проявлениями пищевой аллергии, в частности с эозинофильным эзофагитом (ЭоЭ), чему и будет посвящена данная публикация.
В традиционно обновляемых документах Программы ВОЗ «Аллергический ринит и его влияние на астму» (ARIA) в сотрудничестве с GA2LEN (Global Allergy and Asthma European Network) и AllerGen (The Allergy, Genes and Environment Network) ринитом называется воспаление слизистой оболочки носа, которое характеризуется ринореей, чиханием, блокадой носа и/или зудом в носу. При этом указанные симптомы возникают в течение не менее 2 дней подряд и сохраняются более 1 часа большую часть дней. Также подчеркивается, что актуальность проблемы АР во многом обусловлена системным характером этого заболевания. АР представляет собой интермиттирующее или персистирующее воспаление слизистой оболочки носа и его пазух, обусловленное действием аллергенов и характеризуется заложенностью, выделениями, зудом носа, чиханием и нередко аносмией (хотя возможно наличие только нескольких из указанных симптомов).
Этиология и патогенез АР в последние годы подробно освещены в многочисленных публикациях. Традиционно развитие АР ассоциируется с гиперчувствительностью к пыльцевым аллергенам, аллергенам домашней и библиотечной пыли, клещей домашней пыли, эпидермиса и экскрементов животных или птиц, аэроаллергенам насекомых (тараканы, комары, муравьи, моль, мотыль и др.), плесневых и дрожжевых грибов, несколько реже – к профессиональным (в том числе химическим), пищевым и медикаментозным аллергенам и пр. АР относится к группе атопических заболеваний, в основе которых лежит IgE-зависимый (немедленный) тип аллергической реакции по классификации П. Джелла и Р. Кумбса (1969), что непосредственно отражается на особенностях клинической картины заболевания, подходах к его диагностике и лечению. Так, при контакте с причинно-значимым аллергеном у предрасположенных к развитию АЗ пациентов сенсибилизация сопровождается гиперпродукцией В-лимфоцитами специфических IgE-антител (реагинов) при участии различных цитокинов и Т-хелперов. При повторном контакте с «виновным» аллергеном в организме происходит его связывание с IgE, которые фиксированы на рецепторах тучных клеток и базофилов. В дальнейшем это приводит к деградации клеток-мишеней, высвобождению гистамина, лейкотриенов, простагландинов, брадикинина, тромбоцит-активирующего фактора и развития аллергического воспаления, которое сопровождается гиперсекрецией слизи и отеком слизистой оболочки полости носа, а также соответствующих симптомов со стороны органов зрения и слуха.
Кроме эозинофильного воспаления в слизистой оболочке носа, а часто и в области его придаточных пазух, слуховой трубы и глаз, повышенной экспрессии эндотелиальных и эпителиальных молекул адгезии, продукции соответствующих цитокинов и хемокинов, к особенностям патогенеза АР следует отнести активацию и повышенную продолжительность жизни эозинофилов, которая обусловлена дополнительной наработкой этими клетками крови таких цитокинов, как ИЛ‑5, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Это, в свою очередь, приводит к повышенной инфильтрации слизистой оболочки тучными клетками, базофилами, эозинофилами. Ранняя фаза аллергической реакции развивается в течение нескольких минут после воздействия аллергена, однако через 4-6 часов у половины больных наблюдается поздняя фаза аллергического воспаления. Именно Т-лимфоциты (преимущественно Th2-типа) и участвуют в поздней фазе патогенеза АР, аллергического конъюнктивита и аллергического отита. На этом измененном фоне дальнейшее попадание аллергена в организм вызывает все более выраженную клиническую симптоматику. Такое воспаление даже после однократного действия аллергена может продолжаться несколько дней. При этом возникает также гипер- и метаплазия эпителия, утолщение базальной мембраны, инфильтрация лимфоцитами, эозинофилами, моноцитами, гистиоцитами, фибробластами, повышается количество тучных клеток. При прогрессировании АР может развиться полипоз носа, который еще больше отягощает состояние соответствующей категории больных.
Как упоминалось выше, основными симптомами, которые в любом сочетании характерны для клинических проявлений АР, являются: зуд в полости носа, приступообразное чихание, обильные водянистые выделения из носа (ринорея), заложенность носа. Данные симптомы АР могут или появляться эпизодически только в условиях тесного контакта с причинно-значимыми аллергенами, в определенный сезон года, или сохраняться в течение всего года с периодическим ухудшением состояния пациента при воздействии большой концентрации аллергена, различных пусковых (триггерных) факторов, обострении респираторных заболеваний. При длительном течении АР у больных могут появляться и другие симптомы, к которым относятся снижение обоняния, носовые кровотечения, першение в горле, кашель, головная боль, проявления конъюнктивита, ощущение распирания и боли в околоносовых пазухах, ушах, снижение слуха, изменения тембра голоса, явления дерматита в области крыльев носа, частые фаринголарингиты, снижение внимания и работоспособности, слабость, раздражительность, бессонница и пр.
При физикальном обследовании пациента могут быть выявлены классические симптомы АР, в частности затрудненное носовое дыхание, открытый рот, отечность в области лица, «темные круги» вокруг глаз, чихание, дерматит в области крыльев носа, ринорея. В случае присоединения вторичной инфекции насморк может приобретать слизисто-гнойный характер, пациенты могут потирать ладонью кончик носа, что получило название «аллергический салют». При АР с сопутствующим конъюнктивитом отмечаются признаки «аллергических очков», отечность и гиперемия конъюнктив, слезотечение, гиперемия кожи вокруг глаз, а при тяжелом течении заболевания – отек век, лица, темные круги под глазами.
Диагностика АР основана на сборе аллергологического анамнеза, данных физикального обследования пациента, проведении специфических кожных, провокационных и лабораторных тестов с аллергенами, а также других лабораторных и инструментальных методов исследования. Правильно собранный аллергологический анамнез позволяет не только выявить АР, но и достаточно точно определить виновные в его развитии аллергены. Кроме того, в анамнезе у больных АР можно найти указания на дебют заболевания в молодом возрасте (детский или взрослый до 30-40 лет), отягощенный личный и семейный аллергологический анамнез, эффективность применения противоаллергической терапии и пр.
Проведение специфической аллергологической диагностики при АР возможно с помощью различных тестов in vivo и in vitro с аллергенами. К диагностическим тестам in vivo прежде всего относится кожное тестирование с различными, как правило, ингаляционными аллергенами. Основным методом кожного тестирования в аллергологии традиционно является тест уколом или прик-тест (prick-test). Для диагностики АР применяют также провокационный назальный тест с аллергенами, который считается положительным при обострении симптомов ринита (чихание, зуд в носу, насморк). Проявления ринита можно зафиксировать при проведении передней риноскопии. Лабораторные методы исследования играют важную роль в специфической диагностике АР. Поскольку в основе развития АР лежит IgE-зависимый (немедленный) тип аллергической реакции, то для выявления причинно-значимых аллергенов традиционно применяют иммуноферментный и хемилюминесцентный анализ, радиоаллергосорбентный и иммунофлюоресцентные тесты. Дополнительные инструментальные и лабораторные методы обследования больных АР могут включать проведение рентгенографии и компьютерной томографии носа и околоносовых пазух, эндоскопическое исследование полости носа, риноскопии и риноманометрии, цитологического и бактериологического исследования выделений из носа, биоптата слизистой оболочки, гемограммы и др. Однако, несмотря на важность этих методов обследования пациентов, следует отметить, что ни один из указанных методов без сопоставления их результатов с данными анамнеза, клинической картины, результатами тестирования с аллергенами не может быть основанием для постановки окончательного диагноза АР.
Поскольку АЗ носят преимущественно системный характер, то вполне логично ожидать, что АР у части пациентов может сочетаться с пищевой аллергией и АЗ пищеварительного тракта. Подобный перечень заболеваний с учетом патогенетических механизмов их развития и локализации, по мнению Д.Ш. Мачарадзе (2016), может включать различные нозологии, что и представлено в таблице 1.
В рамках данной статьи, как указывалось выше, мы остановимся на ЭоЭ и его вероятной связи с АР. ЭоЭ – это Th2-воспалительное заболевание с ИЛ‑5, ИЛ‑13 и эутоксином как ключевым медиатором, а также эозинофилами, Т-хелперами, базофилами как ключевыми клетками. Таким образом, ЭоЭ представляет собой хроническое иммунное заболевание пищевода, проявляющееся клинически симптомами эзофагеальной дисфункции, сходными с гастроэзофагеальным рефлюксом, но, как правило, рефрактерными к стандартной антирефлюксной терапии, а гистологически – преимущественно эозинофильным воспалением пищевода.
В качестве основных маркеров такого воспаления выступают уровень общего IgE, ИЛ‑5, ИЛ‑13, данные биопсии слизистой пищевода с наличием эозинофилии. Заболевание имеет генетическую предрасположенность, а его провоцирующими факторами выступают чаще пищевые, но нередко и ингаляционные аллергены. В связи с этим вполне логично ожидать, что у части пациентов АР и ЭоЭ могут выступать в качестве коморбидных заболеваний, поскольку аэро-, а в ряде случаев и пищевые аллергены являются этиологическими факторами для АР. Еще одним аргументом в пользу того, что АР и ЭоЭ являются коморбидными заболеваниями, свидетельствует тот факт, что у 50-80% детей с ЭоЭ отмечается наличие таких АЗ, как бронхиальная астма, АР, атопический дерматит, экзема и пр.
Распространенность ЭоЭ точно не определена и колеблется в пределах от 1 до 9 на 100 тыс. населения, однако в странах с западным образом жизни частота ЭоЭ значительно выросла и практически сравнялась с распространенностью болезни Крона – 40-55 на 100 тыс. населения. По данным детского госпиталя в Питсбурге (США), обслуживающего примерно 1 млн детей, ежегодно диагностируется около 100 новых случаев ЭоЭ. Мальчики болеют чаще девочек. Заболевание чаще встречается среди школьников и молодых взрослых, хотя оно может отмечаться в любом возрасте и осложняться стриктурами пищевода, образованием колец Шацки (Schatzki) и ахалазией в результате того, что эозинофильное воспаление способно индуцировать развитие фиброза и ремоделирования пищевода.
Как указывалось выше, ЭоЭ характеризуется проявлениями, сходными с симптомами гастроэзофагеального рефлюкса. Так, у детей младшего возраста клиническая картина ЭоЭ напоминает клинику пилоспазма, при которой доминируют рефлюкс-подобные симптомы и трудности при кормлении (отказ от еды, срыгивание и рвота в течение одного часа после кормления, выраженный болевой синдром во время приема пищи, затруднение при глотании твердой или сухой пищи, дефицит массы тела, нарушение развития). У подростков и взрослых ЭоЭ чаще всего проявляется симптомами дисфагии и/или эпизодами застревания пищи в пищеводе, что сопровождается ощущениями онемения, жжения по ходу пищевода, болью в горле и за грудиной, затруднением глотания, что может быть вызвано преходящим спазмом гладкой мускулатуры пищевода и ее отеком, а также ремоделированием пищевода (стриктуры, кольца) в результате хронического эозинофильного воспаления. Данные физикального осмотра и стандартных лабораторных показателей у пациентов с ЭоЭ, как правило, в пределах нормы, за исключением периферической эозинофилии, которая имеет место у 50% обследованных с этим заболеванием. Повышение уровня общего IgE крови выше 114 кЕд/л регистрируется в 50-60% случаев. Однако следует отметить, что эти показатели не всегда диагностически значимы. С одной стороны, нормальные их значения не исключают наличия ЭоЭ, а с другой – положительные результаты этих тестов требуют проведения дифференциальной диагностики с другими причинами эозинофилии и повышения уровня общего IgE.
Важное значение в диагностике ЭоЭ, как и АР, имеют данные аллергологического обследования пациентов. Так, по данным различных исследователей, IgE-опосредованная сенсибилизация диагностируется при помощи кожных (прик-, патч-тесты), провокационных и лабораторных тестов с аллергенами у 15-43% пациентов с ЭоЭ, хотя на самом деле ее удельный вес может быть и выше с учетом возможного прохождения IgE-трансформации В-клеток и синтеза аллерген-специфических реагиновых антител непосредственно в слизистой пищевода, в результате чего IgE не попадают в системный кровоток. Имеются также данные о том, что сенсибилизация к ингаляционным аллергенам (клещи домашней пыли, пыльца деревьев и трав) у детей с ЭоЭ отмечается так же часто, как и к пищевым аллергенам. В дополнение к этому данные нескольких ретроспективных исследований продемонстрировали снижение частоты ЭоЭ в зимний и увеличение в весенне-летний период, что свидетельствует о значимости в его развитии и пыльцевой сенсибилизации.
Диагноз «ЭоЭ» базируется на основании выявления у пациента симптомов эзофагеальной дисфункции и характерной картины исследования биоптатов слизистой пищевода, взятых во время фиброгастродуоденоскопии, а также исключения других причин гастроэзофагеального рефлюкса. ЭоЭ может быть заподозрен при обнаружении следующих эндоскопических признаков (рис. 1):
• воспалительных изменений, одинаково выраженных как в дистальной, так и в средней части пищевода (в отличие от рефлюкс-эзофагита, при котором наиболее значительные изменения выявляют в дистальном отделе);
• линейных вертикальных борозд;
• циркулярных складок (кольца Шацки);
• налета на слизистой оболочке в виде белых «крупинок» (примерно 1 мм в диаметре);
• контактной кровоточивости.
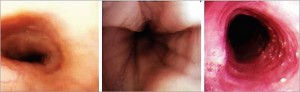 Рис. 1. Эндоскопическая картин аэозинофильного эзофагита
Рис. 1. Эндоскопическая картин аэозинофильного эзофагитаа – норма, б – продольные борозды , в - кольца, белый эскудат (Новик Г. А., Ткаченко М. А., 2012)
Биоптаты во время эндоскопии следует брать как из дистальной, так и из средней трети пищевода, где при ЭоЭ обнаруживают наибольшее число эозинофилов. В связи с тем, что патологические изменения могут иметь «пятнистый» характер, следует брать не менее 5 биоптатов. Необходимо подчеркнуть, что диагноз «ЭоЭ» не может быть поставлен без проведения гистологического исследования. В норме слизистая оболочка пищевода у детей не содержит эозинофилов. При гастроэзофагеальном рефлюксе обнаруживают в среднем 1-5 интраэпителиальных эозинофилов в поле зрения (при увеличении ×400). В случае тяжелого рефлюкс-эзофагита число интраэпителиальных эозинофилов может достигать 10-15 в поле зрения (при увеличении ×400) (рис. 2).
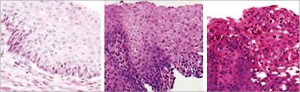
Рис. 2. Гистологическая картина эозинофильного эзофагита
а – норма: эозинофилы отсутствуют, б – рефлюкс - эозофагит: единичные эозинофилы ; в – эозинофильный эозофагит: большое число эозинофилов в поверхностных слоях эпителия, эозинофильные микроабсцессы ( Новик Г. А., Ткаченко М. А., 2012)
Общие принципы лечения пациентов с АЗ включают: комплексность, этапность (устранение симптомов, базисная терапия, профилактика обострений, контроль над заболеванием), элиминацию аллергенов (по мере возможности), рациональную фармакотерапию, аллерген-специфическую иммунотерапию (АСИТ), осуществляемую аллергологом, проведение образовательных программ с пациентами и членами их семей.
Рациональная фармакотерапия АР должна основываться на проведении противовоспалительной терапии, и, в первую очередь, с использованием топических форм глюкокортикоидов (ТГК) и антигистаминных препаратов (АГП). Согласно рекомендациям American Academy of Otolaryngology-Head and Neck Surgery Foundation (2014) к препаратaм 1-й линии при лечении больных АР (сильные рекомендации) относятся: ТГК и неседативные АГП (особенно при чихании и зуде). При этом преимущество в плане эффективности и безопасности отдается цетиризину и левоцетиризину. Интраназальные формы АГП также могут применяться. Антагонисты лейкотриеновых рецепторов не относятся к терапии 1-й линии и чаще назначаются при сочетании АР с бронхиальной астмой. Комбинированная фармакотерапия назначается при неадекватном ответе на монотерапию. Подкожная и сублингвальная АСИТ имеют преимущества. Хирургическое лечение, акупунктура показаны только части пациентов, а фитотерапия не рекомендуется вообще.
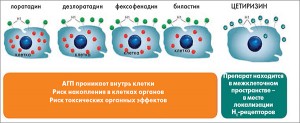
Среди АГП особое внимание привлекает к себе цетиризин. В последние годы было проведено значительное количество сравнительных исследований эффективности и безопасности цетиризина в сравнении с лоратадином, дезлоратадином, фексофенадином, левоцетиризином, в которых именно цетиризин продемонстрировал или преимущества, или по крайней мере подобную эффективность и безопасность при лечении пациентов с АР. Этому есть логичное объяснение (рис. 3). Так, в результате исследований последних лет было установлено, что для эффективного антигистаминного действия препарат должен обеспечивать высокую терапевтическую концентрацию в местах расположения H1-рецепторов. При этом для обеспечения отсутствия токсического действия на организм АГП не должен проникать внутрь клетки. Такими свойствами обладает именно цетиризин, который в отличие от других АГП концентрируется в межклеточном пространстве, непосредственно в месте локализации H1-рецепторов. Цетиризин демонстрирует уникальные структурные характеристики в сравнении с другими H1-антагонистами II поколения. Среди них следует выделить минимальный риск дозозависимого воздействия на клетки и органы, минимальную вариабельность достижения терапевтического эффекта у различных категорий пациентов, низкий уровень нежелательного лекарственного взаимодействия с другими лекарственными средствами, отсутствие кумуляции в жизненно важных органах.
На украинском рынке цетиризин представлен препаратом Цетрин производства фармацевтической компании «Др. Редди’с», который имеет доказанную клиническую эквивалентность оригинальному препарату. Кроме того, Цетрин имеет собственную доказательную базу и длительный опыт широкого применения в медицинской практике. Цетиризин производства компании «Др. Редди’с» получил одобрение контролирующих медицинских служб по качеству и безопасности препаратов ведущих стран мира и поставляется во многие страны, в том числе США, Германию, Великобританию. Поэтому логично, что среди аллергологов Украины и врачей другого профиля наиболее популярным препаратом цетиризина является Цетрин производства фармацевтической компании «Др. Редди’с». Так, по данным исследовательской компании Фармстандарт в 2011-2013 гг., именно Цетрин был тем таблетированным АГП, который наиболее часто назначается в нашей стране.
Традиционно в терапии больных АР применяются ТГК, вводимые интраназально, поскольку их эффективность и достаточная безопасность доказаны во многих рандомизированных двойных слепых плацебо-контролируемых исследованиях. Использование ТГК обеспечивает выраженные противовоспалительные эффекты непосредственно на слизистых оболочках носа, глаз и бронхов при минимальных системных проявлениях. ТГК при назначении больным АР оказывают выраженный терапевтический эффект, уменьшая как заложенность носа, так и зуд, чихание, ринорею.
Современные ТГК высокоэффективны и обладают минимальными побочными эффектами, однако их с осторожностью следует назначать больным с иммуносупрессией, тяжелыми бактериальными, грибковыми и вирусными (герпетическими) инфекциями. Системные глюкокортикоиды, но коротким курсом и только перорально, могут вынужденно назначаться больным лишь при тяжелом течении АР. Необходимо отметить, что, по результатам одного из исследований последних лет, цетиризин оказался одинаково эффективным в лечении сезонного АР в сравнении с флутиказона пропионатом при 2-недельном наблюдении за больными.
Лечение пациентов с ЭоЭ включает элиминационную диету и фармакотерапию, направленную на подавление эозинофильного воспаления. В нетяжелых случаях элиминационная диета может быть использована в качестве монотерапии. При этом «виновные» пищевые продукты из рациона пациентов исключаются как на основании данных аллергологического обследования, так и эмпирическим путем. Поскольку ЭоЭ не является «чистым» IgE-зависимым заболеванием, то, к сожалению, полностью полагаться на результаты аллергологических тестов не представляется возможным. В последние годы большинство рекомендаций включают использование эмпирической элиминационной диеты с исключением 6 пищевых продуктов: молока, сои, яиц, пшеницы, арахиса и морепродуктов, что позволяет такому подходу быть в 80% случаев эффективным. Альтернативой является использование смесей на основе аминокислот. В ряде случаев с учетом вкусовых пристрастий больных в смеси добавляют фруктовые соки. Клинически улучшение состояния пациентов с ЭоЭ наступает в среднем через 8 дней, а нормализация гистологической картины при данном патологическом процессе отмечается через 4 недели. Однако феномен «перерастания» пищевой аллергии для этого заболевания не характерен, поэтому необходимость диеты сохраняется обычно пожизненно.
Имеются данные об эффективности использования в комплексной терапии пациентов с пищевой аллергией, в том числе и с ЭоЭ, АГП системного действия. В тяжелых случаях наряду с элиминационной диетой используются системные глюкокортикоиды (преднизолон, метилпреднизолон), которые эффективно подавляют воспаление и купируют симптомы ЭоЭ, но их применение ограничено побочными эффектами и 90% вероятностью рецидива заболевания после их отмены. Местное применение глюкокортикоидов (флутиказон и будесонид) в лекарственной форме аэрозолей для лиц с бронхиальной астмой возможно осуществлять путем распыления аэрозоля во рту и последующего проглатывания его пациентами, что эффективно в 80% случаев и не сопряжено с системными побочными эффектами. При этом флутиказон вводится через рот (не вдыхается) с помощью дозированного ингалятора (без спейсера), после чего действующее вещество попадает в пищевод со слюной, оказывая местный противовоспалительный эффект. Вязкую суспензию будесонида готовят, используя содержимое небул. Однако все же частым (у 10-15% пациентов) побочным эффектом такой местной терапии является кандидоз пищевода.
Монтелукаст у пациентов с ЭоЭ показал симптоматический эффект, но при этом не уменьшал эозинофильную инфильтрацию в пищеводе, что может способствовать его ремоделированию. В настоящее время идут II и III фазы клинических испытаний препаратов на основе моноклональных антител к IgE (омализумаб) и ИЛ‑5 (реслизумаб, меполизумаб). Несмотря на обнадеживающие предварительные результаты, омализумаб при хорошем симптоматическом эффекте не снижал эозинофильную инфильтрацию, а реслизумаб и меполизумаб хотя и снижали тканевую эозинофилию, но не устраняли симптомы ЭоЭ. При развитии стриктуры пищевода может потребоваться оперативное лечение. Подходы к терапии пациентов с ЭоЭ представлены в таблице 2 (Д.Ш. Мачарадзе, 2016).
Лечение больных с одновременным наличием АР и ЭоЭ базируется на общих принципах терапии АЗ и должно включать в себя применение разнообразных элиминационных мероприятий, фармакотерапии и АСИТ.
Таким образом, АР относится к числу наиболее распространенных АЗ, часто сочетающихся с другими проявлениями аллергопатологии, в том числе и с ЭоЭ. И если подходы к диагностике и лечению АР достаточно хорошо изложены в большинстве международных и отечественных протоколов, то проблема диагностики и лечения ЭоЭ, особенно при его сочетании с АР, требует проведения дальнейших исследований.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ Алергія та імунологія
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...
Організм людини – це складна жива система, функціонування якої визначається безліччю змінних і задіює величезну кількість механізмів. Зовнішні і внутрішні чинники здатні порушувати регуляцію її діяльності. Однак є механізми, які допомагають ефективно усувати «поломки» в організмі і нормалізувати його стан. Така здатність має назву біорегуляції. Основою біорегуляційної медицини є комплексні біорегуляційні препарати, серед яких одним із найвідоміших є Ехінацея Композитум С. ...
Проблема гострих запальних захворювань верхніх дихальних шляхів (ВДШ), гострого риносинуситу (ГРС) зокрема, є однією з найактуальніших у сучасній клінічній медицині. Останніми роками спостерігають зростання частоти захворювань носа і приносових пазух, що проявляється збільшенням як абсолютних (захворюваності та поширеності), так і відносних (частка в структурі оториноларингологічної патології) показників. В Україні поширеність гострих ринітів, риносинуситів та ринофарингітів сягає 489,9 випадку на 10 тис. населення, а захворюваність – 5-15 випадків на 1 тис. населення залежно від сезону. Такі хворі становлять 60-65% амбулаторних пацієнтів лікарів-отоларингологів. Уніфікований клінічний протокол первинної та спеціалізованої медичної допомоги (УКПМД) призначений забезпечити організацію надання медичної допомоги пацієнтам із ГРС на всіх етапах медичної допомоги для своєчасного виявлення, профілактики та лікування ГРС. ...